青藏高原3个地方春小麦品种旗叶PSⅡ光化学效率的光响应分析
2016-01-12李妙,师瑞,陈文杰等
*通信作者:师生波,研究员,博士生导师,主要从事植物生理生态学研究。E-mail:sbshi@nwipb.cas.cn
青藏高原3个地方春小麦品种旗叶PSⅡ光化学效率的光响应分析
李妙1,3,师瑞2,陈文杰1,师生波1*,张怀刚1
(1 中国科学院西北高原生物研究所 高原生物适应与进化重点实验室,西宁 810001;2 中山大学 生命科学学院,广州 510275;3 中国科学院大学,北京 100049)
摘要:采用叶绿素荧光分析方法,以高原春小麦(‘互助红’、‘互麦12’和‘互麦13’)为材料,研究了孕穗期旗叶的PSⅡ光化学效率以及光化学和非光化学猝灭的光响应特性。结果显示:(1)3个春小麦品种旗叶的光合色素有差异,最大光化学效率(Fv/Fm)无显著差异。(2)随着光强增加,3个品种旗叶有效光化学效率(Fv′/Fm′)、实际光化学效率(ΦPSⅡ)、光化学猝灭系数(qP)、PSⅡ反应中心开放比率(qL)均呈降低趋势;低光强范围内,叶片Fv′/Fm′、ΦPSⅡ、qP、qL值均依次按‘互麦12’>‘互助红’>‘互麦13’的顺序降低;中高光强范围内,3个品种的Fv′/Fm′趋于一致,而‘互助红’的ΦPSⅡ、qP、qL较其他两个品种略高。(3)随着光强增加,各品种非光化学猝灭系数(NPQ)、表观电子传递速率(ETR)、调节性能量耗散量子产量(ΦNPQ)、非调节性能量耗散量子产量(ΦNO)均呈升高趋势;中低光强范围内,NPQ、ΦNPQ值均依‘互麦13’ >‘互助红’>‘互麦12’的顺序降低,而‘互助红’和‘互麦12’的ETR变化较为一致且‘互麦13’的最低;中高光强范围内,NPQ、ΦNPQ值均依次按‘互助红’>‘互麦13’ >‘互麦12’的顺序降低,而ETR值按‘互助红’>‘互麦12’ >‘互麦13’的顺序降低;在整个光强变化过程中,ΦNO表现为按‘互麦13’ >‘互麦12’ >‘互助红’的顺序依次降低。研究认为,3个高原春小麦品种中‘互助红’最适应高光强环境;‘互麦12’光能利用能力强于‘互麦13’,但略弱于‘互助红’;‘互麦13’对光强变化较为敏感,热耗散能力略强于‘互麦12’,在低光环境下有较高的热耗散能力。
关键词:春小麦;叶绿素荧光;光响应曲线;PSⅡ光化学效率;青藏高原
收稿日期:2014-08-21;修改稿收到日期:2014-12-10
基金项目:国家自然科学
作者简介:李妙(1989-),女,在读硕士研究生,主要从事植物生理生态学研究。E-mail:limiao_2014@126.com
中图分类号:Q945.79 文献标志码:A
Analysis of Photosynthetic Responses of PSⅡ Photochemistry
Efficiency in Flag Leaf of Three Native Spring Wheat
Varieties on the Qinghai-Tibetan Plateau
LI Miao1,3,SHI Rui2,CHEN Wenjie1,SHI Shengbo1*,ZHANG Huaigang1
(1 Key Laboratory of Adaptation and Evolution of Plateau Biology,Northwest Institute of Plateau Biology,Chinese Academy of Sciences,Xining 810001,China;2 School of Life Sciences,Sun-Yat-Sen University,Guangzhou 510275,China;3 University of Chinese Academy of Sciences,Beijing 100049,China)
Abstract:Based on the analysis of chlorophyll fluorescence parameters,we investigated the light responses of PSⅡ photochemical efficiency,photochemical and non-photochemical quenching processes in flag leaves of booting stage with three local varieties of spring wheat (Triticum aestivum L.).The results showed that:(1)There was adifference of chlorophyll (Chl) content among three local wheat varieties,but the maximum quantum photochemistry efficiency of PSⅡ (Fv/Fm) had no significantdifference among them.(2)As the increase of light intensity,the PSⅡ maximal photochemical efficiency (Fv′/Fm′),PSⅡ actual photochemical efficiency (ΦPSⅡ),PSⅡ photochemical quenching coefficient (qP) and the fraction of PSⅡ reaction centers that are opened (qL) all exhibited adecreased tendency.Under low light intensity,Fv′/Fm′,ΦPSⅡ,qP and qL of wheat flag leavesdecreased from ‘Humai 12’ through ‘Huzhuhong’ to ‘Humai 13’.Under the middle and high light intensity,changes of Fv′/Fm′ values in three varieties tended consistent,but the values of ΦPSⅡ,qP and qL in ‘Huzhuhong’ were slightly higher than that of other two.(3)The values of PSⅡ non-photochemical quenching coefficient (NPQ),apparent electron transfer efficiency (ETR),the quantum yield of quenchingdue to light-induced processes and non-light-induced processes (ΦNPQ and ΦNO) tended to increase with the increasing of light intensity.Under low light intensity,the NPQ and ΦNPQdecreased from ‘Humai 13’ through ‘Huzhuhong’ to ‘Humai 12’,changes of ETR in ‘Huzhuhong’ and ‘Humai 12’ tended consistent,value of ETR in ‘Humai 13’ was the lowest among three varieties.Under the middle and high light intensity,NPQ and ΦNPQdecreased from ‘Huzhuhong’ through ‘Humai 13’ to ‘Humai 12’,the ETR showed adecreased tendency from ‘Huzhuhong’ through ‘Humai 12’ to ‘Humai 13’.During the whole changes in light intensity,ΦNOdecreased from ‘Humai 13’ through ‘Humai 12’ to ‘Huzhuhong’.The study suggested that ‘Huzhuhong’ showed strong adaption to high light intensity environment among three varieties.Moreover,‘Humai 12’ had more higher capacity of solar energy usage than ‘Humai 13’ but weaker than ‘Huzhuhong’.‘Humai 13’ was more sensitive to the changes in light intensity than the other two,and it had weaker excitation energydissipation capacity than ‘Huzhuhong’ but better than ‘Humai 12’.‘Humai 13’had more higher ability of thermaldissipation at low light intensity.
Key words:spring wheat;chlorophyll fluorescence;photosynthetic response curve;PSⅡ photochemical efficiency;Qinghai-Tibetan Plateau
光合作用是植物将太阳光能转化为化学能并合成有机物的重要生理过程。太阳光作为植物光合作用的能量基础,适宜的强度有助于诱导光合酶的活性,促进叶片气孔的开张,激发光合作用;然而,自然条件下植物经常会遭受强太阳辐射的胁迫,尤其是生长在具有高强光辐射的高原地区植物。当植物光合机构吸收过量的光能时,过量的激发能将会累积在两个光合反应中心(光系统Ⅱ和光系统Ⅰ),抑制光合作用活性并产生光抑制甚至光破坏[1]。
青海省位于青藏高原东北部,太阳辐射强,光能资源丰富[2]。青藏高原地区太阳光强于同纬度低海拔地区[3],高原植物经过长期的进化适应,已经形成了多种防御和减弱强太阳光辐射的机制。春小麦是青海省农业区的主要农作物之一,本研究中选用的春小麦品种‘互助红’、‘互麦12’和‘互麦13’是青海省互助县育成的旱地耐旱品种,它们在青海省的浅山和半脑山地区有较大的种植面积,经济效益显著[4-5]。在生产实践中,独特生态环境中春小麦品种较稳定产量的形成机制一直备受关注[6]。作物产量的高低取决于光合作用中有机物质的积累,光合生理过程对波动环境的驯化适应能力是保障植物完成生长发育和产量形成的关键。光合作用对外界环境变化较为敏感[7],特别是光系统Ⅱ(PSⅡ),在环境胁迫时常表现为PSⅡ光化学效率的降低。叶绿素荧光能快速反应光合生理的变化,被誉为植物光合作用的快速、无损伤探针[8]。利用叶绿素荧光技术得到的光合作用的光响应曲线能很好地反映植物光合作用随光照强度的变化特征,对了解植物光合机构对高光强的适应机制,判断植物对环境的适应能力差异非常重要,是植物生理生态学研究的一个重要内容[9-10]。
目前关于春小麦的研究多集中于新品种的培育和引进[5,11]、栽培技术的改良[12]、抗性[13]和农艺性状的筛选[14-15]、环境胁迫对小麦产量的影响[16-17]等方面。近期师生波等[16]对高原系列春小麦研究发现,在仅以强光胁迫的自然条件下,高原春小麦的光合机构存在可逆失活现象。植物在长期进化中形成了多种防御机制,避免光伤害的一个重要的光化学调节机制是提高光化学反应和光合能力;有氧参与的电子传递在CO2同化受到限制的情况下也可作为维持光合电子传递的一种应急机制,对于缓解光合膜上的还原态压力、减少PSⅡ中活性氧的产生、防御光破坏也是非常重要的[1]。热耗散增加可以减少PSⅡ反应中心和电子传递链的过分还原,与叶黄素循环的运行状况及叶黄素库的大小相关,是植物防止强光导致光合机构光破坏的保护性机制[18]。本试验通过对3个品种春小麦PSⅡ光化学效率等荧光参数的光响应分析,旨在了解青海省典型耐旱品种的内在光合属性,为优良品种的选育提供理论支撑。
1材料和方法
1.1 试验样地及植物材料
试验设置在青海省都兰县香日德镇东盛村农灌区,位于36°02′ N,97°48′ E,海拔2 905.4 m。受南部布尔汗布达山地形与孟加拉湾湿气流的影响,香日德镇夏季湿润凉爽,日照充足,昼夜温差大。发源于布尔汗布达山东南麓的香日德河年均流量12.54 m3·s-1,灌溉条件稳定,是典型的绿洲农业区。耕作土壤主要是棕漠土,耕作层土壤肥厚,有机质含量为6.6~18.49 g·kg-1,属冬灌旱作农耕地。
试验材料选用青海省当地春小麦(TriticumaestivumL.)品种‘互助红’、‘互麦12’和‘互麦13’。‘互助红’是经久不衰的耐旱小麦品种,具有高产、稳产、适应性广、抗逆性强、强中抗倒伏的特点[4]。‘互麦12’是水地与旱地品种杂交而来的丰产品种,具有抗倒伏、抗病、高产的特性[4]。‘互麦13’耐旱、穗大粒多、丰产稳产,一般比‘互助红’增产2.3%~13.8%,但植株偏高,高水肥条件下容易倒伏[5]。3个春小麦品种均为青海省互助土族自治县脑山及半脑山地区主要的种植品种,具有适应高原强太阳辐射和土壤干旱的特性。孕穗期后‘互助红’旗叶多呈直立型,而‘互麦12’和‘互麦13’的旗叶多呈直立转披型,即旗叶从基部顺时针缓慢旋转后在其远轴叶面的近1/2处多呈现水平受光状态。
1.2 小区设置和田间管理
试验采取随机区组设计,设3个重复小区,小区试验面积为5 m2。以行距20 cm间隔条播3个品种,每个品种播种4行作为小区内重复,共12行,行长为2 m。
2013年3月18日以每公顷150 kg尿素和75 kg磷酸二铵水平施入底肥,并辅以农家肥若干;地表喷洒除草剂后翻耕,次日播种。出苗后人工间苗至每行200株。春小麦生长期间适时除草和浇水,拔节期以每公顷75 kg的量追施尿素1次。
不同春小麦品种旗叶的叶绿素荧光参数测定试验始于2013年6月22日后的孕穗期。此前6月20日给予了田间灌溉。试验期间多为全晴天或晴天多薄云天气,为避免逐渐加强的土壤干旱胁迫,自6月25日起,每晚在各春小麦品种行间于根部浇灌少量水,以确保第2天试验期间土壤维持潮湿状态。
1.3 叶绿素荧光参数的测定
叶绿素荧光参数采用英国产FMS-2便携式脉冲调制荧光仪测定。选旗叶远轴面中部向光面为测定部位,以仪器内置卤素灯为光源,设21、58、125、232、380、580、820、1 120、1 480、1 880 μmol·m-2·s-1系列作用光强,每个光强经3 min平衡适应后测定稳态荧光产率(Fs)和最大荧光产率(Fm′)。PSⅡ反应中心关闭状态的最小叶绿素荧光产量(F0)和开放状态的最大叶绿素荧光产量(Fm),测自太阳落山前用暗适应夹经120 min暗适应恢复后的旗叶。测定Fm和Fm′的饱和脉冲光强为6 500 μmol·m-2·s-1,0.7 s脉冲。PSⅡ最大光化学量子效率(内亶光化学效率)表示为Fv/Fm,其中,Fv=Fm-F0。F0′以Oxborough等[19]经验公式估算:F0′=F0/(Fv/Fm-F0/Fm′)。Fs、Fm′、Fm、F0和F0′用于以下叶绿素荧光参数的计算:
PSⅡ有效光化学量子效率(Fv′/Fm′)=(Fm′-F0′)/Fm′[20]
PSⅡ实际光化学量子效率(ΦPSⅡ)=(Fm′-Fs)/Fm′[20]
PSⅡ反应中心表观电子传递速率(ETR)=ΦPSⅡ×PAR×0.5×0.84[1]
PSⅡ反应中心的开放比率(qL)=qP×(F0′/Fs)[21]
光化学猝灭系数(qP)=(Fm′-Fs)/(Fm′-F0′)[22]
非光化学猝灭系数(NPQ)=Fm/Fm′-1[22]
PSⅡ反应中心非调节性能量耗散的量子产量(ΦNO)=1/[NPQ+1+qL×(Fm/F0-1)][23]
PSⅡ反应中心调节性能量耗散的量子产量(ΦNPQ)=1-ΦPSⅡ-1/[NPQ+1+qL×(Fm/F0-1)][23]
1.4 叶绿素和类胡萝卜素含量的测定
早晨9:00以前在田间每一小区每行各选取春小麦品种旗叶1枚,用去离子水洗净其表面灰尘后于叶片中部依固定膜片剪取1 cm2的叶圆片4个。同一小区来源的16个叶圆片混合后分两组,经精度0.001 g电子天平称重后采用师生波等[24]方法浸提。叶绿素和类胡萝卜素的测定与计算见朱广廉等[25]的方法,含量以单位叶片鲜重表示。
1.5 数据分析
数据用SPSS 16.0软件进行统计分析,各春小麦品种间的差异采用单因素方差分析(one-way ANOVA),多重比较采用最小显著差异法(LSD),显著性水平设定为α=0.05。用Microsoft Excel软件制图,数据选自2013年7月1日和2日上午8:30~11:30间的测定结果,连续2d的天气状况均为晴天有薄云。旗叶PSⅡ最大光化学量子效率的测定样本数为12,PSⅡ有效光化学量子效率等的光响应曲线为5次测定的平均。图中垂直条表示标准差(SD)。
2结果与分析
2.1 高原春小麦旗叶的光合色素含量和内禀光化学效率的比较
在小麦孕穗期,春小麦品种旗叶的总叶绿素含量(Chl)表现为‘互助红’>‘互麦13’>‘互麦12’的趋势,且‘互助红’的Chl显著高于‘互麦12’(P<0.05)(图1,A);而3个春小麦品种间类胡萝卜素含量(Car)的表现与Chl相反(图1,B),说明两类光合色素Chl和Car之间存在着一定的互补性。另外,Car在光合色素中的含量较低,‘互助红’、‘互麦12’和‘互麦13’旗叶中Car/Chl比值依次为0.053、0.078、0.060,它们光合色素含量(Car+Chl)依次为2.94、2.85、2.90 mg·g-1,且3个品种间无显著差异。同时,‘互麦13’的PSⅡ最大光化学量子效率(Fv/Fm)略低,但统计学上3个春小麦品种旗叶Fv/Fm无显著差异,平均为0.85(图1,C)。适宜生态环境中的Fv/Fm反映了PSⅡ反应中心内禀光能转化效率,多次测定具有相似的相对变化趋势,意味着3个春小麦品种的内禀光能转化效率基本相同。
2.2 高原春小麦品种旗叶PSⅡ光化学效率对不同光强的响应特征
图2,A显示,PSⅡ有效光化学量子效率(Fv′/Fm′)随光强增加而降低,3个春小麦品种间Fv′/Fm′在光强低于820 μmol·m-2·s-1时具有较小差异,并按‘互麦12’、‘互助红’和‘互麦13’顺序依次略有降低趋势;在高于820 μmol·m-2·s-1光强下3个品种间基本无差异。同时,PSⅡ实际光化学量子效率(ΦPSⅡ)也随光强增加而降低(图2,B);3个春小麦品种间ΦPSⅡ仅在低于1 120 μmol·m-2·s-1的中低光强范围具有较小的差异;‘互麦13’在整个光强变化范围内均最低,在580 μmol·m-2·s-1光强下‘互麦12’略高于‘互助红’,之后‘互助红’则略高于‘互麦12’。从两荧光参数的比较可以看出,随着光强增加春小麦旗叶ΦPSⅡ比Fv′/Fm′降低程度大,说明ΦPSⅡ对光强变化较为敏感。
2.3 高原春小麦品种旗叶表观电子传递速率和开放比率随光强的变化规律
图3,A表明,3个春小麦品种间PSⅡ反应中心相对表观电子传递速率(ETR)随光强增加而增大,并在高于380 μmol·m-2·s-1光强下差异较为明显,且按照‘互助红’、‘互麦12’和‘互麦13’依次有降低趋势。同时,PSⅡ反应中心开放比率(qL)则随光强增加而降低,3个春小麦品种间有较小的差异,同一光强下3个品种间的变化趋势与ETR相同(图3,B)。

图1 孕穗期3个春小麦品种旗叶光合色素
2.4 高原春小麦旗叶叶绿素荧光猝灭系数随光强的变化特征
3个春小麦品种的光化学猝灭系数(qP)随光强增加而降低,不同品种间差异较小,低于380 μmol·m-2·s-1光强下,‘互助红’和‘互麦12’基本无差异;在高光强下,qP有随‘互助红’、‘互麦12’和‘互麦13’顺序依次降低的趋势(图4,A)。3个春小麦品种的非光化学猝灭系数(NPQ)随光强增加而升高且不同品种间差异显著;在光强小于820 μmol·m-2·s-1时,‘互麦13’略大于‘互助红’和‘互麦12’,而在光强大于820 μmol·m-2·s-1之后,NPQ在‘互助红’中明显升高,且按照‘互助红’、‘互麦13’和‘互麦12’的顺序依次有降低趋势(图4,B)。可见,随着光强的增加,各高原春小麦品种叶绿素荧光猝灭系数变化趋势相似,品种间差异逐渐加大,且始终以‘互助红’较高;叶片qP和NPQ变化趋势相反,NPQ在品种间的差异大于qP。
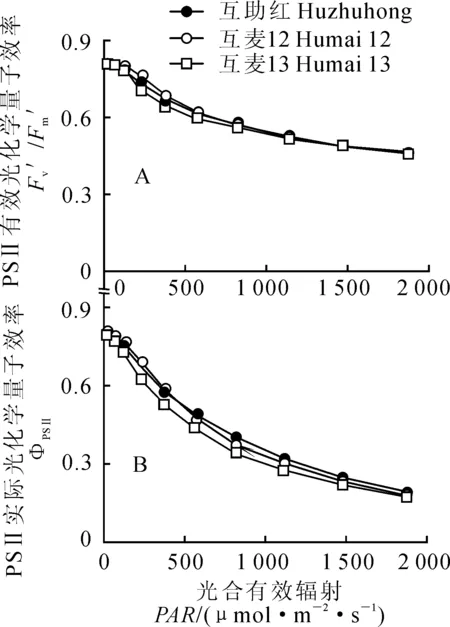
图2 孕穗期3个春小麦品种旗叶PSⅡ有效光化学效率
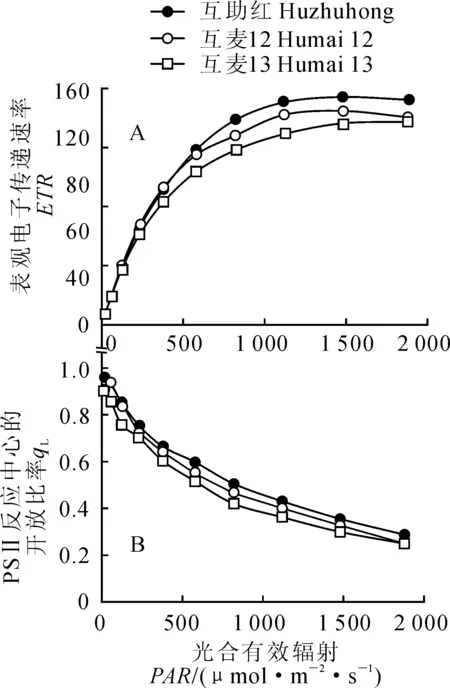
图3 孕穗期3个春小麦品种旗叶PSⅡ反应中心的
2.5 高原春小麦旗叶PSⅡ反应中心调节性和非调节性能量耗散随光强增加的动态特征
3个高原春小麦品种的调节性能量耗散量子产量(ΦNPQ)随光强增加而增大(图5,A);它们之间在光强小于820 μmol·m-2·s-1时略显差异,且依照‘互麦13’、‘互助红’和‘互麦12’的顺序有逐渐降低趋势;而在光强大于1 480 μmol·m-2·s-1之后,品种间差异很小,‘互助红’仅略大于‘互麦12’和‘互麦13’。同时,3个春小麦品种非调节性能量耗散量子产量(ΦNO)也随光强增加有增大趋势,但品种间的差异较为明显,且随‘互麦13’、‘互麦12’和‘互助红’顺序有依次降低趋势;在光强大于1 880 μmol·m-2·s-1时,‘互麦13’和‘互麦12’的非调节性能量耗散趋于相同(图5,B)。以上研究结果表明,随光强的增加,高原春小麦ΦNPQ增大的程度远大于ΦNO,是非辐射能量耗散响应光强的主要途径。
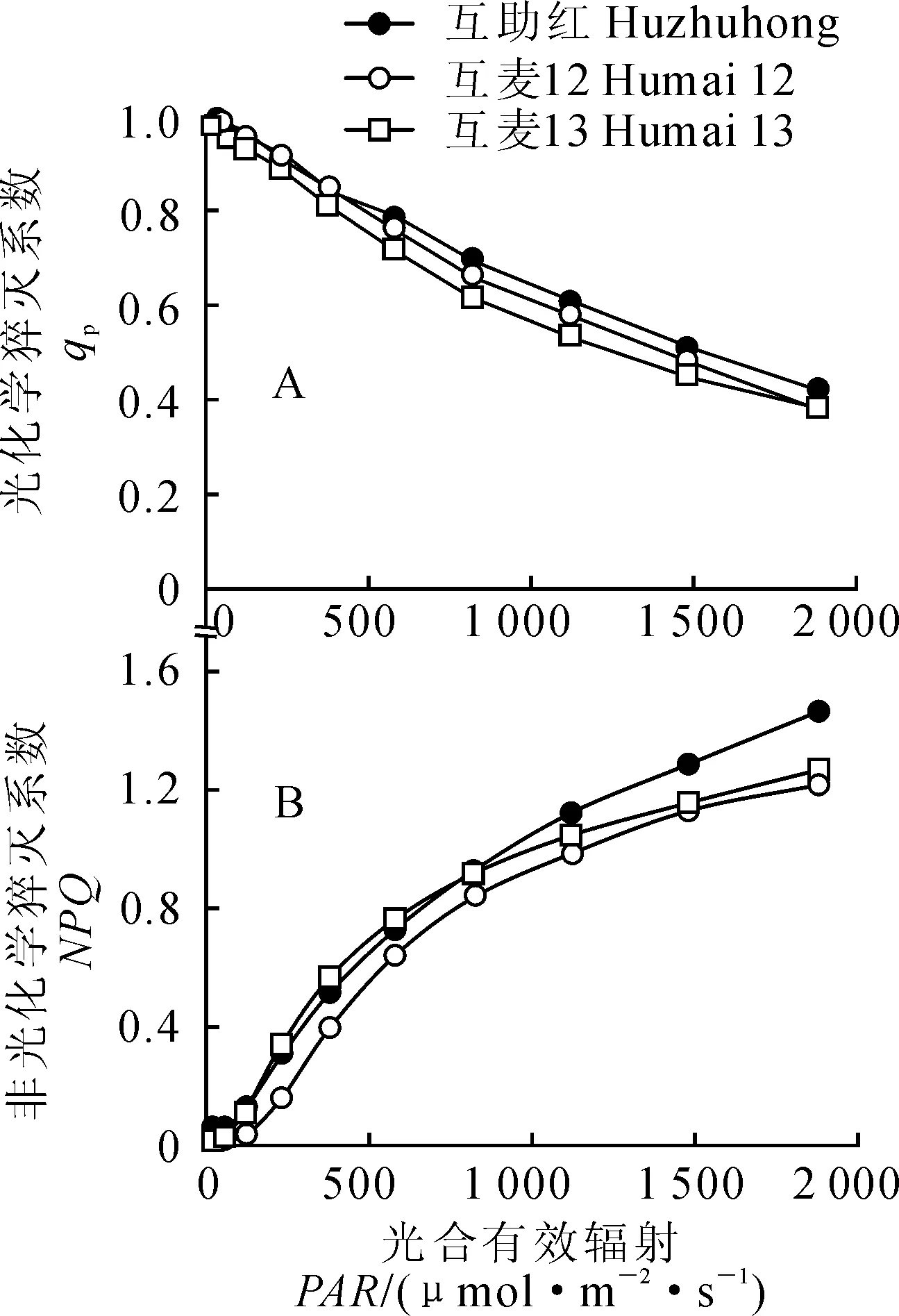
图4 孕穗期3个春小麦品种旗叶PSⅡ反应中心
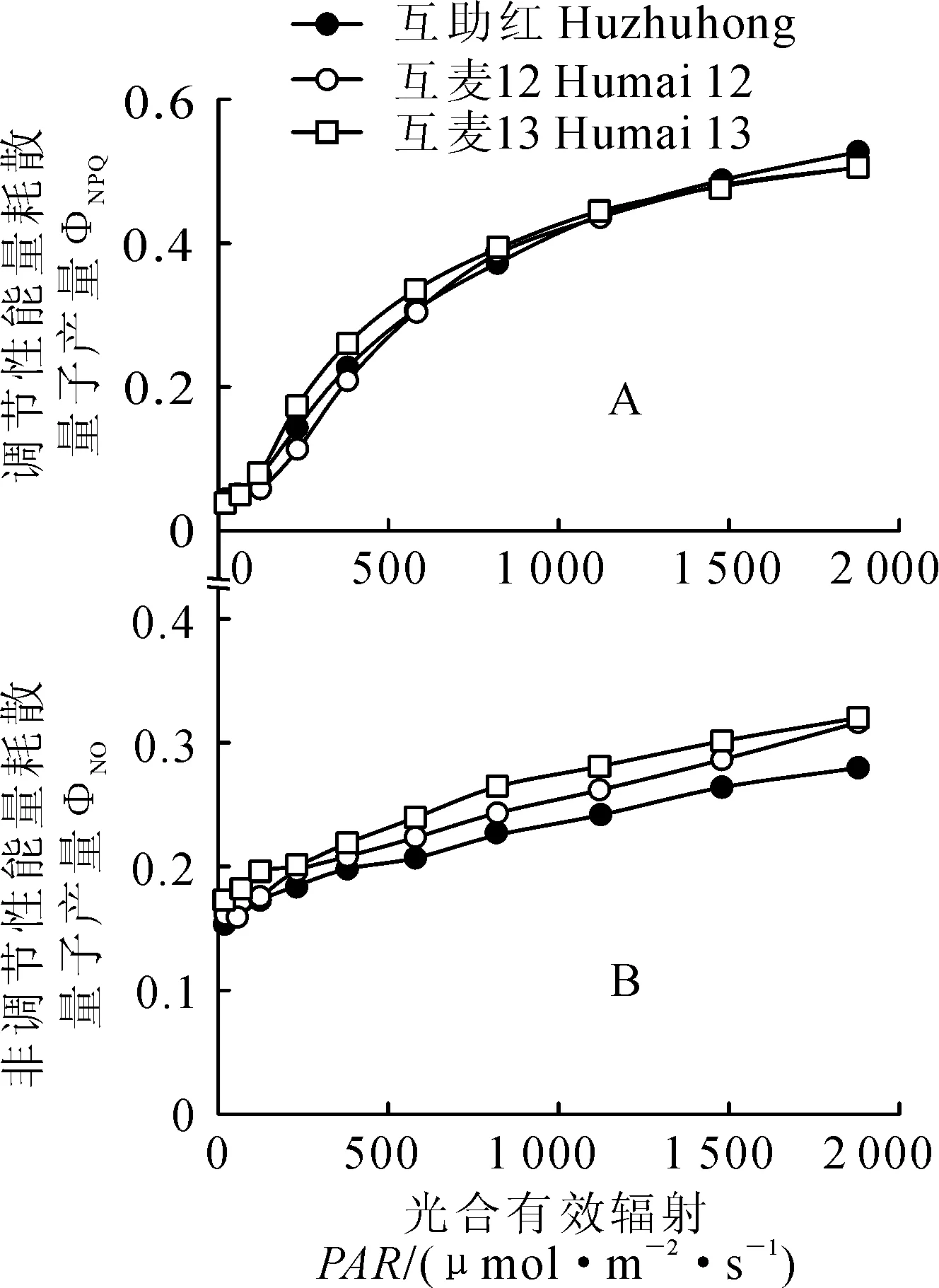
图5 孕穗期3个春小麦品种旗叶PSⅡ反应中心调节性
3讨论
地处青藏高原东北部的青海省都兰县香日德镇,地理和气候条件优厚,是典型的绿洲农业区。该区土壤有机质丰富、结构良好、养分充足、保水力强、通气良好,适宜高原春小麦的生长[26]。本试验以青藏高原地方春小麦品种‘互助红’、‘互麦12’、‘互麦13’为研究材料,通过对比旗叶光合机构各荧光参数的光响应特性,探讨了青海省典型耐旱品种的抗高光强辐射的能力,为后期高原春小麦优势品种的选育提供理论依据。
光合色素中叶绿素(Chl)负责捕获和传递光能并将光能转变为化学能,类胡萝卜素(Car)可进行光能捕获和光破坏防御[27]。本研究发现,3个春小麦品种旗叶的Chl和Car存在着互补关系,这与我们以前对高原系列春小麦光合色素含量的观测结果相一致[16]。两类光合色素的互补可以弥补天线色素在吸收自然太阳光能时的总量差异,但也存在对不同波段光谱的吸收差异。Car占光合色素总含量比例较低,相对较高的Car可以耗散过剩激发能以防止强光对叶绿素的伤害[28],品种‘互麦12’相对较高的Car显然有利于保护叶绿素免受强光伤害,但保护作用有限。Fv/Fm表示PSⅡ反应中心天线色素捕获的光能可转化成化学能的潜在效率,可反映PSⅡ反应中心固有的光能转化效率[29]。本实验中不同品种间Fv/Fm几乎无差异,同光合色素含量之间似乎没有规律可循。有研究认为,植物体叶绿素含量少未必会导致Fv/Fm值的降低[30],Fv/Fm与Car组分玉米黄质之间并无确切的关系[31]。但也有研究认为Fv/Fm和Chl含量之间存在着正相关的关系[6,32],很可能Fv/Fm和光合色素之间的关系变化具有种的差异性,这还有待进一步研究证实。
叶绿素荧光参数Fv′/Fm′易受持续强光胁迫的影响,较高的Fv′/Fm′意味着PSⅡ反应中心的能量捕获陷阱较大[6]。ΦPSⅡ反映吸收的光能用于原初醌电子受体QA还原的实际运行效率[6]。大量研究表明,植物的ΦPSⅡ随着光强增加也呈现相应的胁迫现象[33]。3个高原春小麦品种中‘互麦12’在低光强下捕光能力和光能利用能力稍高,表明在低光强下‘互麦12’对光能的捕获和利用呈正相关;中高光强之后‘互助红’对光能的利用和转化能力最强,‘互麦13’对吸收的光能利用效率最低。这从光能捕获和利用方面体现了‘互助红’在3个品种中的优势地位,‘互麦12’则较适应低光强环境,‘互麦13’对光能的捕获和利用能力在3个品种中最差。
光合机构反应中心的开闭程度和过剩激发能的耗散状况是判断光合作用高效率运行的可靠依据[16]。通常情况下,qP可衡量PSⅡ反应中心的开放比例,NPQ可表征植物对过剩激发能的耗散程度[17]。稳态作用光下,qP和NPQ两个参数既具有内禀性又呈现互补性,即随着光强增加qP呈降低趋势而NPQ呈升高趋势[34]。荧光参数qL与qP类似,可以衡量反应中心的开放程度,但qL在高光强下对氧化态QA的估计往往比qP准确[23]。本研究中qL和qP两参数的变化趋势一致,且不同光强下qL的值似乎均小于qP,准确地体现了3个春小麦品种反应中心开放程度受光强的胁迫情况。同时,3个品种旗叶反应中心的开放比率qL同ΦPSⅡ变化趋势基本吻合,体现了开放比率与实际运行效率的一致性。有研究表明,植物在同一光强下NPQ越高说明叶片受伤害越小[35]。‘互麦13’在中低光强时对光较为敏感,而‘互助红’对高光强环境较为适应,叶片最不易受伤害。3个品种中‘互助红’的ETR较大,表现出其在高光强下仍有较高的光合效率,相比而言‘互麦13’的光合效率是3个品种中最低的。
ΦNPQ高代表叶片可以通过调节性热耗散机制消除过剩激发能;而ΦNO高则说明植物不能完全消除过剩激发能,植物可能已经受到损伤或即将受到不可逆的损伤[6]。虽然本研究中3个高原春小麦品种都有潜在被伤害的趋势,但是热耗散能力依然起主导作用,在高光强下3个品种都可以维持较高ETR。‘互助红’在高光强下强的调节性热耗散能力和较弱的非调节性能量耗散能力体现了‘互助红’强抗逆性的本性。虽然3个品种中‘互麦13’具有高产的特点,但是在高光强环境下叶片却最易受到伤害。
综上所述,3个高原春小麦品种中,‘互助红’在光能捕获、PSⅡ实际光能转化效率、反应中心开闭程度和电子传递速率以及热耗散等方面都具有较大优势;‘互麦12’较适应中低光强的环境,但其热耗散能力却在3个品种中最弱;虽然‘互麦13’的热耗散能力稍强于‘互麦12’,但它的光能捕获、光能利用能力以及反应中心开放比率较低,表现出对光强变化比较敏感,叶片极易受伤害的特点。小麦育种过程不但需要育种者明确育种目标,还需要育种者对亲本材料有足够了解。本研究比较了青海省3个典型耐旱地方品种的内禀光化学效率及激发光能的光化学和非光化学光响应分配特性,可为育种工作者提供理论帮助,为今后扩大亲本来源提供借鉴。
参考文献:
[1]许大全.光合作用效率[M].上海:上海科学技术出版社,2002:123-135.
[2]SUN C H(孙翠花),CHEN ZH G(陈志国).Qinghai-Tibetan Plateau climate conditions and crop yield analysis[J].AnhuiAgriculturalScienceBulletin(安徽农学通报),2006,12(6):84-86(in Chinese).
[3]MO SH G(莫申国),ZHANG B P(张百平),CHENG W M(程维明),etal.The main environmental effect of the Qinghai-Tibetan Plateau[J].ProgressinGeography(地理科学进展),2004,23(2):88-96(in Chinese).
[4]YANG Y L(杨有来),CAO CH H(曹成海),GAO SH G(高世恭).Humai seriesdrought tolerance varieties breeding technology and application of spring wheat[J].QinghaiAgricultureandForestryScienceandTechnology(青海农林科技),2000,(1):24-27(in Chinese).
[5]WANG X L(王秀兰),WANG F ZH(王发忠),LEI F L(雷发林).Variety characteristics and high yield cultivation techniques of spring wheat “Humai 13”[J].Crops(作物杂志),2007,(5):77-78(in Chinese).
[6]SHI SH B(师生波),CHEN W J(陈文杰),SHI R(师瑞),etal.PSⅡ photochemical efficiency in flag leaf of wheat varieties and its adaptation to strong sun-light intensity on farmland of Xiangride in Qinghai Province,Northwest China[J].ChineseJournalofAppliedEcology(应用生态学报),2014,25(9):2 613-2 622(in Chinese).
[7]LARCHER W.Physiological Plant Ecology(2nd Ed)[M].New York:Springer-Verlag,1980:5-60.
[9]JIANG G M(蒋高明),HE W M(何维明).A quick new method f ordetermining light response curves of photosynthesis under field light conditions[J].ChineseBulletinofBotany(植物学通报),1999,16(6):712-718(in Chinese).
[10]YAN X H(闫小红),YIN J H(尹建华),DUAN SH H(段世华),etal.Photosynthesis light response curves of four rice varieties and model fitting[J].ChineseJournalofEcology(生态学杂志),2013,32(3):604-610(in Chinese).
[11]MA X G(马晓岗).Canadian spring wheat gluten quality ‘Ge Laini’ successful introduction in Qinghai Province[J].QinghaiAgricultureandForestryScienceandTechnology(青海农林科技),2001,(2):48(in Chinese).
[12]CHEN ZH G(陈志国),BU H CH(部和臣),ZHANG H G(张怀刚),etal.Water-saving new varieties of spring wheat ‘plateau 584’ and its cultivation techniques[J].JournalofTriticeaeCrops(麦类作物学报),2003,23(3):149(in Chinese).
[13]ZHANG CH Q(张长青),YANG W M(杨文美),ZHAO Y J(赵燕驹).Identification ondisease resistance of Qinghai spring wheat varieties (lines) to wheat scab[J].XinjiangAgriculturalSciences(新疆农业科学),2005,42(3):175-177(in Chinese).
[14]CHEN L H(陈丽华),XIANG J SH(相吉山),LI G Y(李高原),etal.Analysis of breeding evolution and main agronomic characters of spring wheat cultivars in Qinghai[J].JournalofQinghaiUniversity(青海大学学报),2008,26(6):1-10(in Chinese).
[15]GAO Y T(高亚婷),LIUd C(刘登才),ZHANG H G(张怀刚),etal.Thedifferences of major phenotypic traits of wheat caused bydifferent environments in Sichuan and Qinghai[J].ActaAgriculturaeBoreali-OccidentalisSinica(西北农业学报),2013,22(2):18-23(in Chinese).
[16]SHI SH B(师生波),ZHANG H G(张怀刚),SHI R(师瑞),etal.Assessment of photosynthetic photo-inhibition and recovery of PSⅡ photochemical efficiency in leaves of wheat varieties in Qinghai-Tibetan Plateau[J].ChineseJournalofPlantEcology(植物生态学报),2014,38(4):375-386(in Chinese).
[17]YU X F(于显枫),GUO T W(郭天文),ZHANG R ZH(张仁陟),etal.Effects of water and nitrogen interacting on gas exchange and chlorophyll fluorescence parameters of spring wheat[J].ActaAgriculturaeBoreali-OccidentalisSinica(西北农业学报),2008,17(3):117-123(in Chinese).
[18]DEMMIG-ADAMS B,WILLIAM W,ADAMS Ⅲ.Xanthophyll cycle and light stress in nature:uniform response to excessdirect sunlight among higher plant species[J].Planta,1996,198:460-470.
[19]OXBOROUGH K,BAKER N R.Resolving chlorophyll a fluorescence images of photosynthetic efficiency into photo-chemical and non-photochemical components:calculation ofqPandFv′/Fm′ without measuringF0′[J].PhotosynthesisResearch,1997,54(2):135-142.
[20]GENTY B,BRIANTAIS J M,BAKER N R.The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence[J].BiochimicaetBiophysicaActa,1989,900(1):87-92.
[21]BAKER N R.Chlorophyll fluorescence:a probe of photosynthesisinvivo[J].Annu.Rev.PlantBiol.,2008,59:89-113.
[22]BILGER W,BJÖRKMAN O.Role of the xanthophyll cycle in photoprotection elucidated by measurements of light-induced absorbance changes,fluorescence and photosynthesis in leaves ofHederacanariensis[J].PhotosynthesisResearch,1990,25(3):173-185.
[23]KRAMERd M,JOHNSON G,KIIRATS O,etal.New fluorescence parameters for thedetermination of QAredox state and excitation energy fluxes[J].PhotosynthesisResearch,2004,79(2):209-218.
[24]SHI SH B,ZHU W Y,LI H M,etal.Photosynthesis ofSaussureasuperbaandGentianastramineais not reduced after long-term enhancement of UV-B radiation[J].EnvironmentalandExperimentalBotany,2004,51(1):75-83.
[25]朱广廉,钟诲文,张爱琴.植物生理实验室[M].北京:北京大学出版社,1990:51-54.
[26]都兰县县志编委会.都兰县志[M].西安:陕西人民出版社,2001:201-209.
[27]SUN X L(孙小玲),XU Y F(许岳飞),MA L Y(马鲁沂),etal.A review of acclimation of photosynthetic pigment composition in plant leaves to shade environment[J].ChineseJournalofPlantEcology(植物生态学报),2010,34(8):989-999(in Chinese).
[28]MIDDLETON E M,TERAMURA A H.The role of flavonol glycoside and carotenoids in protecting soybean from ultraviolet-Bdamage[J].PlantPhysiology,1993,103:475-480.
[29]MAXWELL K,JOHNSON G N.Chlorophyll fluorescence-a practical guide[J].JournalofExperimentalBotany,2000,51:659-668.
[30]CAO L(曹莉),WANG H(王辉),SUNd J(孙道杰),etal.Photosynthesis and chlorophyll fluorescence characters of xantha wheat mutants[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2006,26(10):2 083-2 087(in Chinese).
[31]CHRISTIANE S,HARTMUT K L.Photosynthetic CO2-assimilation,chlorophyll fluorescence and zeaxanthin accumulation in field grown maple trees in the course of a sunny and a cloudyday[J].JournalofPlantPhysiology,1996,148:399-412.
[32]CHEN J F(程建峰),CHEN G Y(陈根云),SHEN Y G(沈允钢).Relational analysis of leaf characteristics and photosynthetic capacities of plants[J].ChineseJournalofEco-Agriculture(中国生态农业学报),2012,20(4):466-473(in Chinese).
[33]LINDA A.FRANKLIN,MURRAY R B.A comparison of photosynthetic electron transport rates in macroalgae measured by pulse amplitude modulated chlorophyll fluorometry and mass spectrometry[J].JournalofPhycology,2001,37:756-767.
[34]SHI SH B(师生波),SHANG Y X(尚艳霞),SHI R(师瑞),etal.Responses of PSⅡ photochemistry efficiency and photosynthetic pigments ofSaussureasuperbato short-term UV-B-supplementation[J].ChineseJournalofPlantEcology(植物生态学报),2012,36(5):420-430(in Chinese).
[35]YAN N,XU X F,WANG Zd,etal.Interactive effects of temperature and light intensity on photosynthesis and antioxidant enzyme activity inZizanialatifoliaTurcz.plants[J].Photosynthetica,2013,51(1):127-138.
(编辑:裴阿卫)
