秦皮乙素及其衍生物的合成与药理学研究进展
2016-01-11梁承远张诗韵毛跟年宋慧慧丁顺军陈雪峰
梁承远, 张诗韵, 毛跟年, 宋慧慧, 丁顺军, 王 兰, 陈雪峰
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
秦皮乙素及其衍生物的合成与药理学研究进展
梁承远, 张诗韵, 毛跟年, 宋慧慧, 丁顺军, 王兰, 陈雪峰
(陕西科技大学 食品与生物工程学院, 陕西 西安710021)
摘要:秦皮乙素是陕西道地药材秦皮的主要有效成分,化学名为6,7-二羟基香豆素,俗称七叶亭.秦皮乙素因其独特的结构及理化性质正日益引起科研人员的浓厚兴趣.科学家已研究发现秦皮乙素具有良好的抗肿瘤、抗炎及抗菌活性,显示了其广阔的应用前景.本文综述了近年来国内外学者对秦皮乙素及其合成与药理研究成果,以及近十年来秦皮乙素衍生物的合成与生物活性研究成果,包括抗溶组织梭菌胶原酶(ChC),灭杀白蚁,以及显著的抗大肠杆菌与抗念珠菌活性等.随着各种结构新颖的秦皮乙素衍生物不断地被合成报道,其生物活性与作用机制逐步被阐明,陕西道地药材秦皮及其主要成分秦皮乙素的开发与临床应用前景将会变得更加广阔.
关键词:秦皮乙素; 香豆素; 合成; 衍生物; 药理活性
0引言
秦皮为常用中药,始载于《神农本草经》,中国药典(2010年版) 规定秦皮为木犀科植物苦枥白蜡树(FraxinusrhynchophyllaHance)、白蜡树(F.chinensisRoxb.)、尖叶白蜡树(F.szaboanaLingelsh.)或宿柱白蜡树(F.stylosaLingelsh.)等的干燥枝皮或干皮[1].主产于陕西、河北、河南、山西、辽宁、吉林等地.
秦皮乙素是秦皮的主要有效成分,化学名称为6,7-二羟基香豆素(Esculetin,如图1所示),俗称七叶亭.其结构为香豆素类七叶内脂,亦为含6,7-二酚羟基的邻羟基桂皮酸内酯,是合成药物东喘宁的中间体.其形状为白色至浅黄色针状结晶,溶于热乙醇和稀碱溶液,微溶于水、乙醇和醋酸乙酯,不溶于乙醚和氯仿.
研究证实秦皮乙素除平喘、祛痰、镇咳外,还具有多种药理活性:抗炎[2]、抗氧化[3]、治疗肠道疾病[4]、抗菌[5]、保肝[6]、抗肿瘤[7]等.由于多重药理作用,秦皮乙素具有广阔的药用开发前景.其结构中的6,7-二酚羟基与3,4-双键是重要的反应活性位点,可在该位置引入取代基团或官能团对其进行化学修饰,可以通过化学反应衍生化获得结构新颖的秦皮乙素衍生物.
近年来,随着对秦皮乙素研究的不断深入和需求的不断增长,开发出秦皮乙素的工业合成方法以取代日益枯竭的药用植物资源具有重要的现实意义.在本文中,笔者综述了近年来国内外学者对秦皮乙素及其衍生物合成,以及国内外近十年来秦皮乙素的药理活性研究进展.

图1 秦皮乙素(Esculetin)
1秦皮乙素药理学研究进展
1.1抗炎作用
段慧琴等[8]采用体外培养的肠黏膜微血管内皮细胞,研究了秦皮乙素的抗炎机制,结果显示秦皮乙素可以通过两种途径来发挥其抗炎机制.一是,降低NO的分泌,从而调节血管收缩,增加血流量,促进毒素排出,减轻炎症中组织器官的损伤;二是,抑制可溶性细胞间黏附分子sICAM-1的分泌,减轻白细胞与内皮细胞的粘附反应,控制白细胞穿出血管壁,减少炎症组织中白细胞数,从而减轻炎症反应,通过调控微血管功能实现其抗炎的药效.
Choia等[9]观察了秦皮乙素对实验性骨关节炎关节液中一氧化氮(NO)、前列腺素2(PGE2) 和软骨中基质金属蛋白酶-1(MMP-1) 水平的影响,结果显示秦皮乙素能明显降低关节炎关节软骨中的MMP-1及关节液中的NO、PGE2水平,减缓骨关节炎的发生.
王志强等[10]通过秦皮乙素预处理大鼠来研究其对急性心肌缺血再灌注损伤(MIRI)的保护作用,结果显示秦皮乙素通过抑制炎症反应发挥对缺血再灌注心肌的保护作用.
1.2抑制血管平滑肌细胞增殖
动脉粥样硬化性疾病是人类健康的严重威胁,泡沫细胞的形成是动脉粥样硬化发生的核心环节.贺超等[11]以平滑肌源性泡沫细胞为研究对象,用不同浓度的秦皮乙素在体外干预平滑肌源性泡沫细胞,结果显示50μg/mL秦皮乙素能通过激活PPARγ,促进胆固醇外转运蛋白ABCA1和ABCG1表达来抑制平滑肌源性泡沫细胞的形成.
戴榕等[12]通过体外培养大鼠血管平滑肌细胞(rVSMCs),观察不同浓度秦皮乙素作用不同时间对rVSMCs增殖的影响,结果显示在一定范围内,秦皮乙素可呈剂量和时间依赖性抑制rVSMCs的增殖,其主要机制是抑制了Ras-Raf-MEK-ERK/MAPK和Ras-PI3K-Akt信号转导通路.
1.3抗氧化作用
自由基可与生物体内的许多物质,如脂肪酸、蛋白质等作用,夺取它们的氢原子,造成相关细胞结构与功能的破坏.在香豆素类化合物中,秦皮乙素具有较强的抑制黄嘌呤氧化酶、清除氧自由基、保护光损伤的活性[13].秦皮乙素对脂质过氧化物引起的细胞DNA氧化损伤具有保护作用[14].
梁敏等[15]研究发现秦皮乙素具有较强的抗氧化活性.将提取并分离得到的秦皮乙素采用DPPH分析法,通过测吸光度等手段,计算清除率.结果表明,秦皮乙素对DPPH自由基清除效果佳,对DPPH自由基的清除能力远远强于BHT(2,6-二叔丁基对甲酚).对DPPH自由基的清除能力,可间接反映其抗氧化能力的大小,清除率越大,表明该物质清除自由基的能力越强,抗氧化能力越强.
1.4参与血清蛋白和金属离子相互作用
生命体系中金属离子、药物等与生物大分子的相互作用已有广泛报道.刘保生等[16]采用荧光光谱法研究了秦皮乙素与牛血清白蛋白(BSA)、人血清白蛋白(HSA)的相互作用.结果表明,秦皮乙素对血清白蛋白的荧光有较强的猝灭作用,其荧光猝灭为单一的静态猝灭过程,属能量转移的作用机制.
刘雪峰等[17,18]采用荧光光谱、紫外光谱技术研究了秦皮乙素与BSA在金属离子Cu2+、Ni2+、Zn2+和Co2+分别共存时的相互作用.结果显示,Me2+共存时,秦皮乙素-BSA的表观结合常数KA、秦皮乙素对BSA内源荧光的碎灭常数KP等参数等均有明显改变,表明Me2+参与了秦皮乙素-BSA的结合过程.紫外光谱表明Cu2+、Ni2+、Zn2+和Co2+分别与秦皮乙素存在相互结合.采用荧光光谱、圆二色光谱(CD)和紫外光谱研究6种典型共存物分别对中药有效成分秦皮乙素-BSA结合的扰动,CD结果表明,共存物与BSA 结合导致BSA分子构象变化是共存物扰动秦皮乙素-BSA 结合的共通方式,是Glucose和VC的主要扰动方式.
1.5治疗肠道疾病
王新等[19]通过体外培养大鼠肠黏膜微血管内皮细胞,采用硝酸还原酶法研究了秦皮乙素对正常肠黏膜微血管内皮细胞以及LPS致伤的肠黏膜微血管内皮细胞分泌NO的影响.结果显示,秦皮乙素不但能降低正常肠黏膜微血管内皮细胞NO的分泌水平,尤其能抑制内毒素引起的肠黏膜微血管内皮细胞分泌NO水平的升高.这表明秦皮乙素对LPS引起的肠黏膜微血管内皮细胞损伤有拮抗作用.
1.6抗菌作用
秦皮中的秦皮乙素为抑制病原微生物的有效成分.秦皮乙素能有效抑制大肠杆菌、变形杆菌、绿脓杆菌、金黄色葡萄球菌等病原微生物的生长.
Duncan等[20]研究了食用植物中秦皮乙素、秦皮甲素等香豆素类化合物对动物内脏细菌的抑制作用,结果表明秦皮乙素对内脏器官中的大肠杆菌O157繁殖具有明显的抑制作用.
Watanabe K.等[21]研究表明秦皮乙素对小鼠中实验性大肠杆菌病O111∶B4有较好的防治作用,并通过体内试验揭示了秦皮乙素具有较强的抗体内毒素的作用.
1.7保肝作用
秦皮乙素具有一定的保肝作用.预防给药6 mg·kg- 1剂量的秦皮乙素,对扑热息痛和四氯化碳引起的大鼠肝损伤具有明显的保护作用[22].秦皮乙素对叔丁基过氧化氢诱导的大鼠肝损伤具有明显的保护作用.根据大鼠肝脏组织病理学评估显示,秦皮乙素能够降低t-BHP诱导的肝脏病变的发生率,包括肝细胞肿胀,白细胞浸润和坏死的发生率.推测秦皮乙素可能通过减少生命系统的氧化应激起到化学预防的作用[23].
1.8抗肿瘤作用
秦皮乙素在体外对人体白血病细胞、人胃癌细胞、肝癌细胞等几种肿瘤细胞株显示抑制细胞生长的作用.
Park等[24]研究表明,秦皮乙素与 HA14-1(小分子Bcl-2蛋白抑制剂)合用时,能够有效抑制人白血病U937细胞中的肿瘤活性.
Wang等[25]利用免疫印迹分析研究了秦皮乙素对白血病细胞HL-60 G1期调控因子的影响,结果表明秦皮乙素通过诱导G1期细胞周期阻滞从而抑制白血病细胞HL-60的增殖.
贾绍华等[26]通过MTT法考察了秦皮乙素对胃癌SGC-7901细胞的体外抑瘤作用,随着给药浓度的增加,SGC-7901细胞的生长率也随之降低,且有明显的凋亡形态学特征.
张舜尧[27]的研究也显示,秦皮乙素在体外可以通过促进凋亡受体途径相关蛋白Fas、FasL、FADD的表达,并形成聚合体促进Caspase-8、Caspase-3的表达,从而诱导SGC-7901细胞凋亡.
秦皮乙素还可以增强紫杉醇对ERK通路介导的HepG2人肝癌细胞的凋亡作用[28],抑制人肝癌细胞株SMMC-7721的增殖,诱导肝癌细胞凋亡[29,30].
1.9其它药理作用
Leung等[31]研究表明,秦皮乙素在体内外对鼠类的巨噬细胞和淋巴细胞具有免疫调节作用;张月等[32]采用光谱研究表明,秦皮乙素可与铁离子形成络合物,这种络合物的形成在一定程度上可降低由铁离子所引起的细胞毒性;Masamoto等[33]研究表明,秦皮乙素在体外具有对蛋白酪氨酸激酶活性的抑制作用,浓度为5μmol/L的秦皮乙素可抑制B16小鼠黑色素瘤细胞中黑色素的生物合成;Yang等[34]研究表明,秦皮乙素可通过启动由线粒体介导的3T3-L1脂肪细胞的凋亡通路,诱导脂肪细胞的凋亡来起到减少脂肪细胞生成抑制脂肪细胞蓄积的作用.
2秦皮乙素的合成
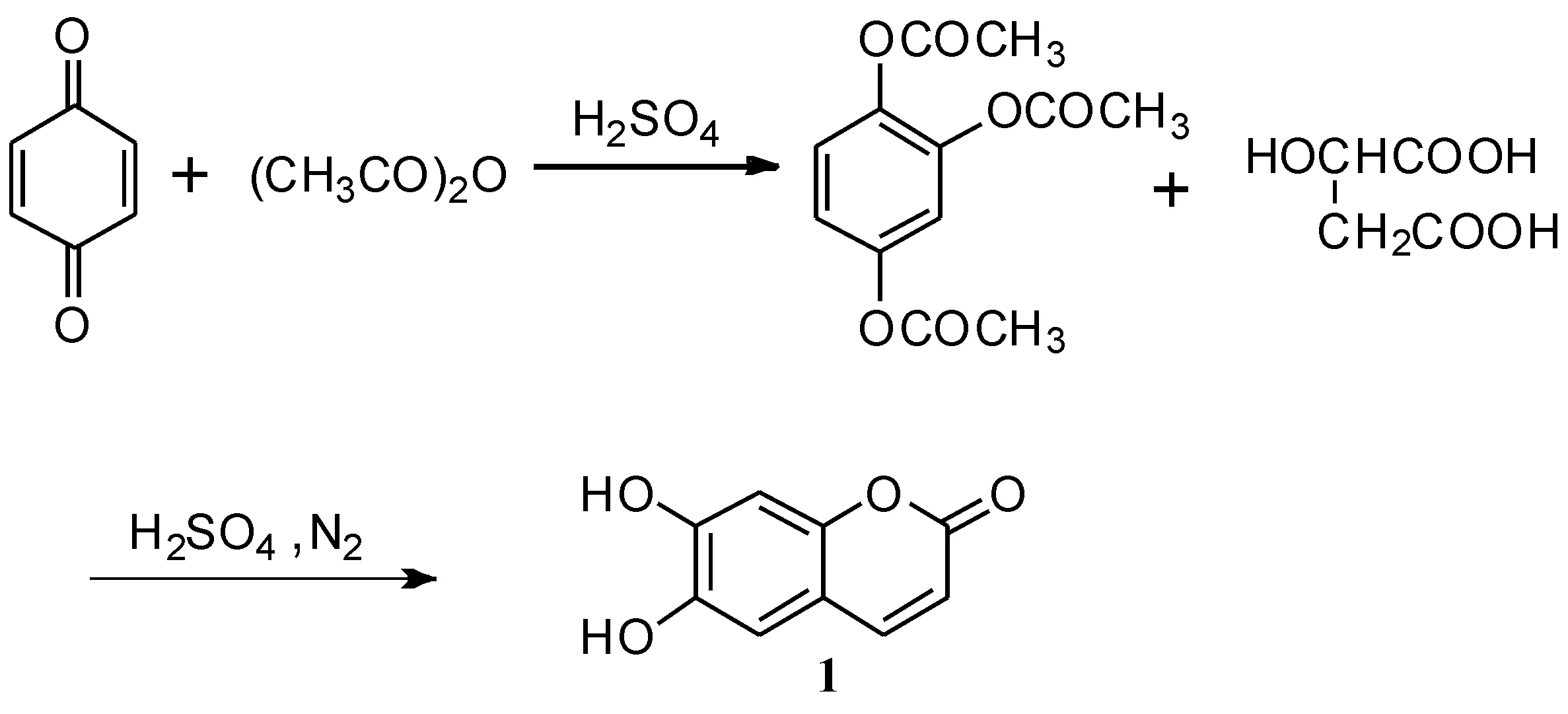
曹卫权等[35]以廉价易得的对苯醌为原料(如路线1所示),与乙酸酐经酰化反应生成1,2,4-苯三酚三乙酸酯,再与苹果酸在浓硫酸催化、氮气保护下发生环合反应制得秦皮乙素粗品,经40%乙醇重结晶得纯品,总收率为80.3 %.该方法使用40%乙醇重结晶代替碱溶酸析法对秦皮乙素粗品进行分离纯化,得到产品的颜色较浅,且纯度理想.该工艺路线步骤简洁,操作方便,适于工业化生产.
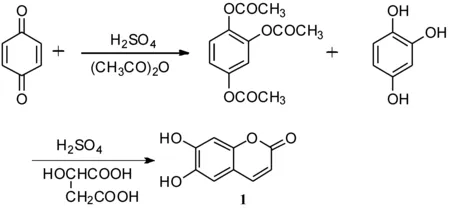
张婷等[36]同样以对苯醌为初始原料,对秦皮乙素全合成的路线进行了研究(如路线 2所示).以1,4-对苯醌为原料,经乙酰化、水解、酯化,脱水等反应生成秦皮乙素.实验表明,投料比为对苯醌∶醋酐∶浓硫酸=1∶3∶0.15、反应时间为3 h、反应温度为45 ℃ 时,收率达到89.2%.
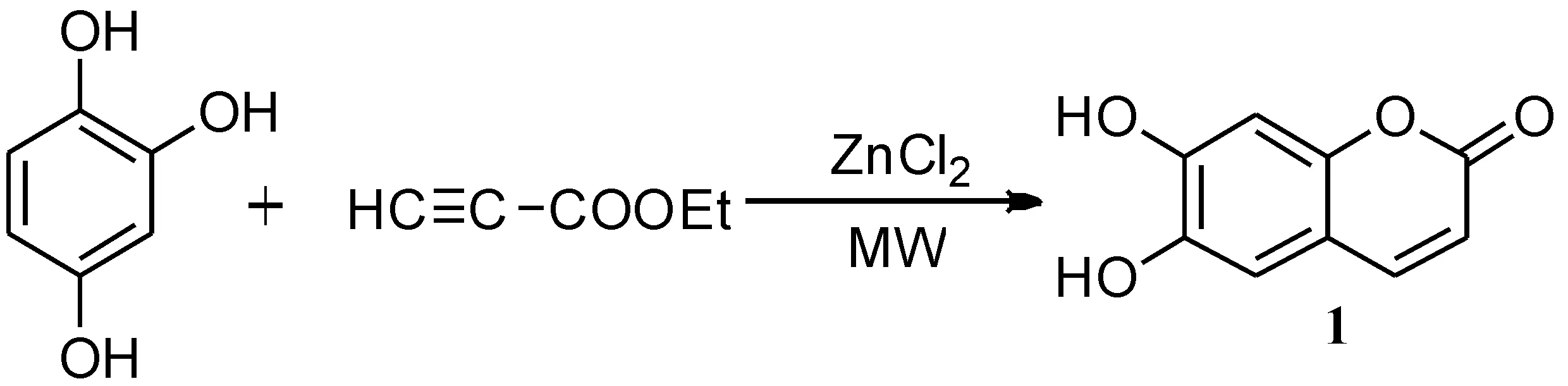
杨晓军等[37]以无水氯化锌为催化剂,采用微波辐射,由1,2,4-苯三酚与丙炔酸乙酯发生缩合环化反应制得秦皮乙素(如路线3所示).结果表明,微波辐射合成秦皮乙素的最佳反应条件为:投料比为1,2,4-苯三酚:丙炔酸乙酯= 1∶1、反应时间为10 min、温度为105 ℃、微波功率为400 W时,产率可达87. 4%.微波辐射法合成秦皮乙素操作简单,反应时间短,产率高.
路线1
路线2
路线3
3秦皮乙素衍生物的合成与药理活性研究进展
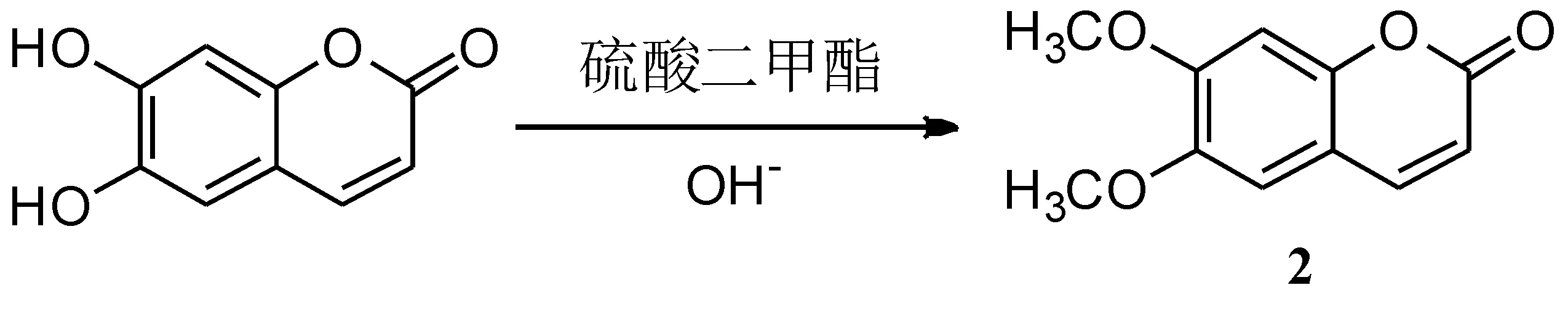
张树芬等[38]报道了6,7-二甲氧基香豆素2的合成方法(如路线 4所示).以6, 7-二羟基香豆素经甲基化得到6,7-二甲氧基香豆素,总收率为74. 4%.整个过程反应条件温和,操作方便,适合工业生产.
赵丽娟[39]在离子液体的条件下,同样以6,7-
二羟基香豆素经甲基化得到6,7-二甲氧基香豆素,对比相转移催化剂与[BMIm]Cl、[BMIm]Br、[BMIm][BF4]、[BMIm][PF6]的催化效果,发现咪唑类离子液体的催化效果较好.同时,咪唑类离子液体作为甲基化反应过程中可重复利用的催化剂,还可以提高反应产率和反应选择性,使得反应在较低温度下可以进行.
Naohiro等[40]等的研究显示,6,7-甲氧基香豆素与东莨菪亭3均有显著的抗溶组织梭菌胶原酶(ChC)的活性.
路线 4
方专等[41]借助微波加热手段(如路线 5所示),合成了东莨菪亭3(6-甲氧基-7-羟基香豆素).通过尝试不同的溶剂体系,优化反应条件得出:微波辐射合成东莨菪亭和传统加热路线[42,43]相比,操作更容易,反应时间短,收率高.其中,微波辅助脱除7位甲基形成东莨菪亭时,使用LiCl和DMF体系,收率从传统的46%提高到了73%.
Adfa等[44]合成了一批秦皮乙素衍生物(如路线 6所示),并研究了它们的杀白蚁活性及抗拒食活性,结果显示衍生物2-8均显示出抗拒食活性,而东莨菪亭2表现出了最强的杀白蚁活性,衍生物4,5和7也表现出了一定的杀白蚁活性.

路线5
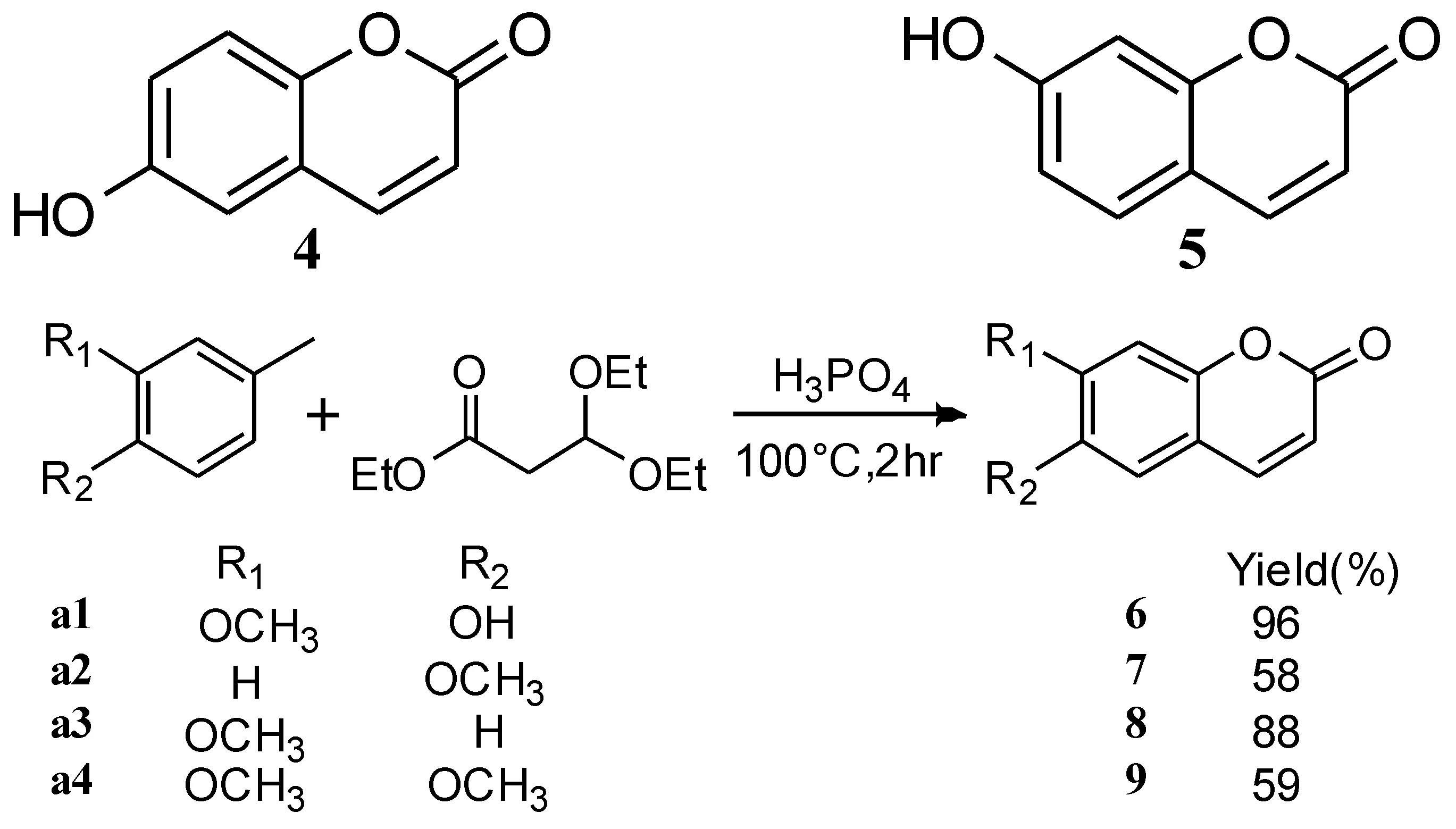
路线6
Bull等[45]运用BHQ反应合成了6H-苯并[d]萘[1,2-b]吡喃-6-酮环体系香豆素衍生物(如路线7所示),代表性的化合物10收率达84%.
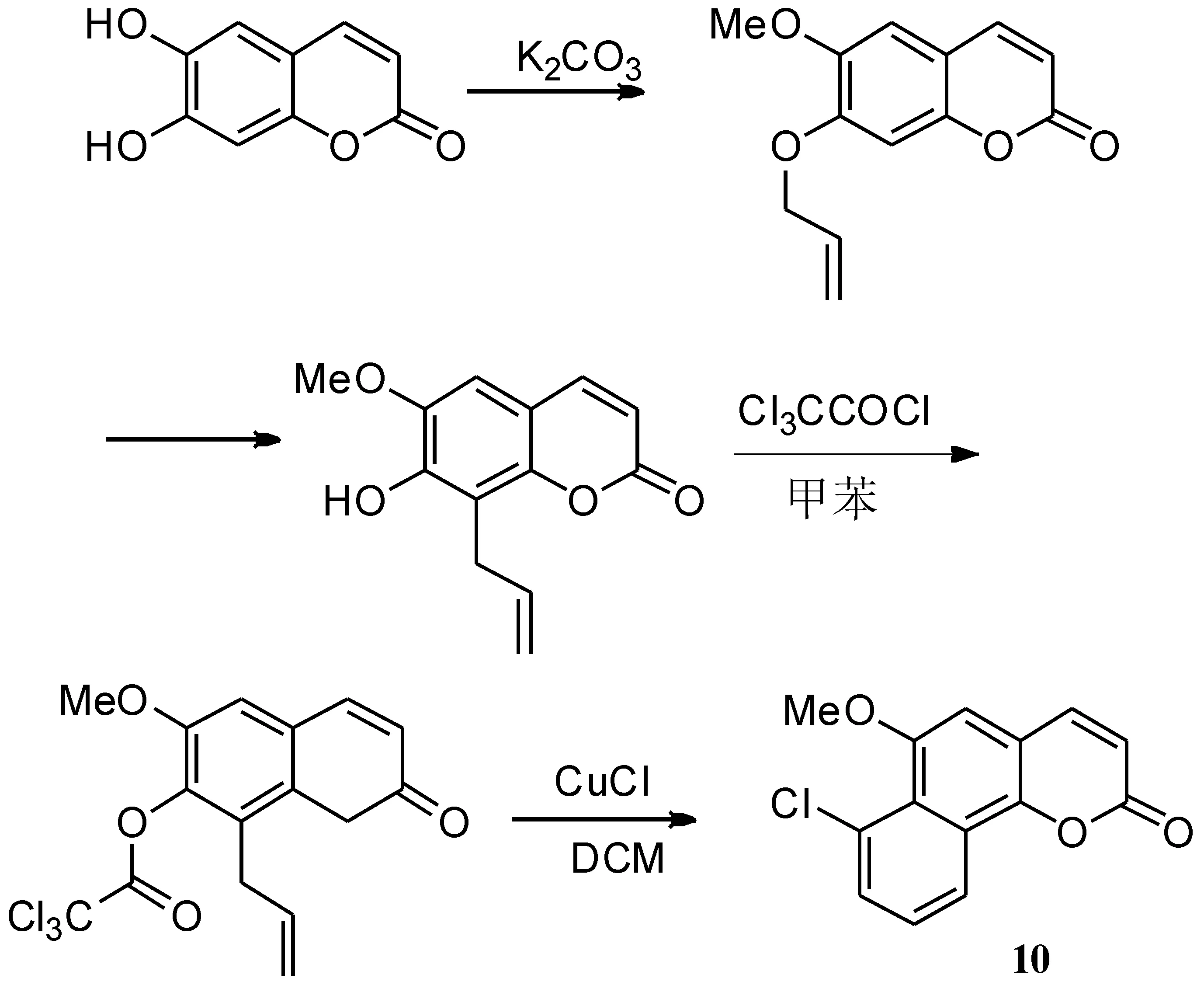
路线7
Nemoto等[46]首次使用烯酮的不对称催化环氧化反应作为关键步骤,进行不对称全合成(+)-前胡素11以及相关的天然吡喃二氢香豆素衍生物13-15.反应中使用新型的多功能不对称催化剂La(O-i-Pr)3∶BINOL∶Ph1As=O以1∶1∶1当量加入时,能够有效地促进烯酮的不对称催化环氧化(如路线8所示).
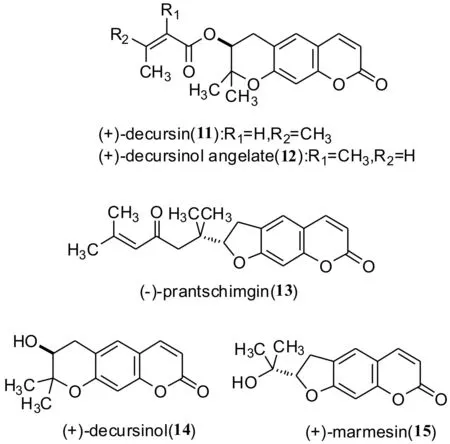
路线8
2002年,Chimichi等[47]合成醛基香豆素时,以秦皮乙素为初始原料,经过不同的反应,得到了6-氧基-7-(2-氧代乙氧基)乙醛香豆素21(如路线9所示).反应中首先由秦皮乙素1得到了单酯的产物16、二酯产物19,以及比例为25∶1的单羟基酸17和18.化合物16和17在硫酸二甲酯和6-甲酯的水解下得到了20,20经过Rosenmund还原反应得到衍生物21,总收率达50%.而乙醛香豆素21还可以通过原料东莨菪亭3,以类似的方法制得.
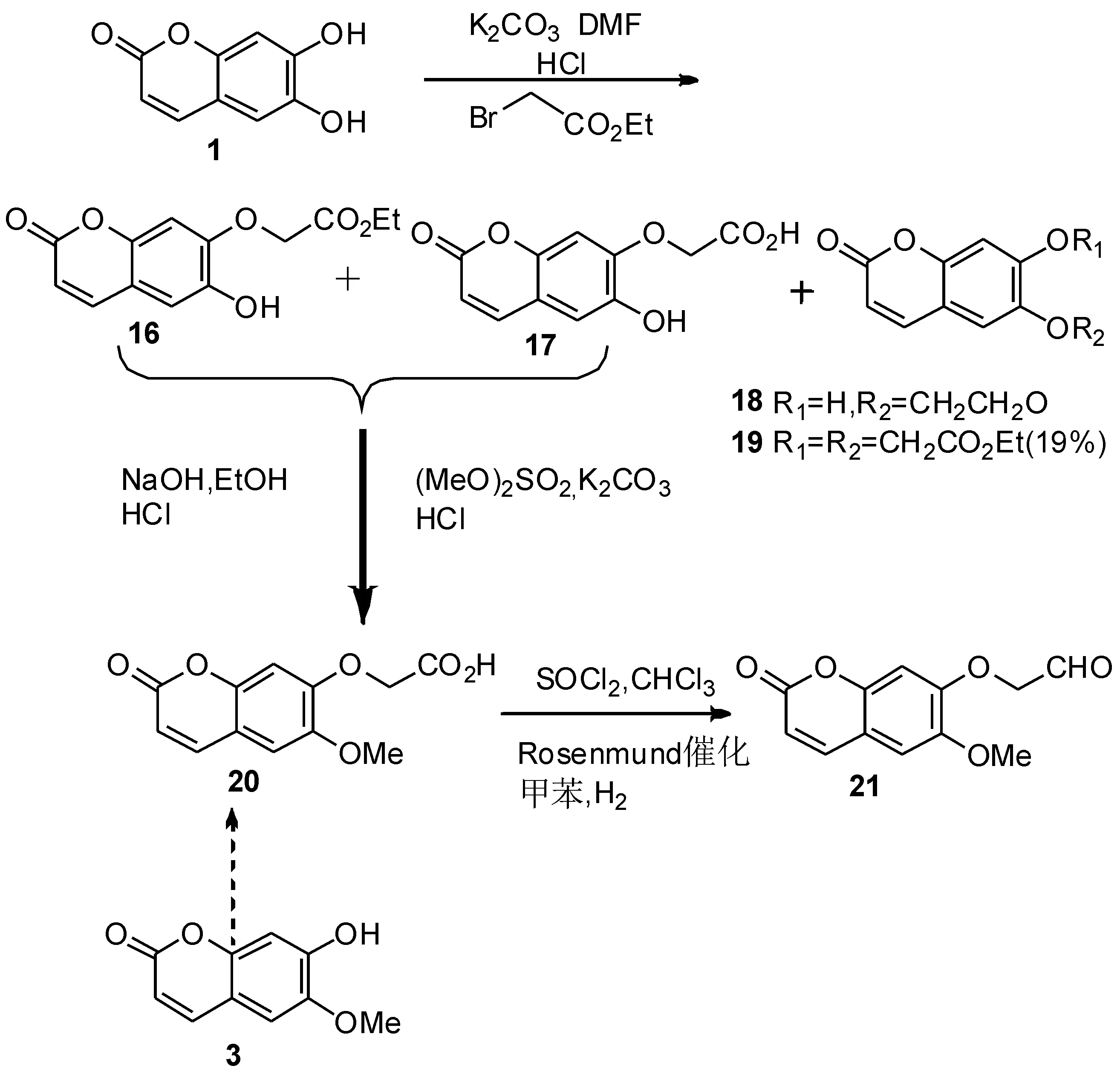
路线9
Cravotto等[48]发现了天然羟基香豆素在超声化学条件下,能够进行Mitsunobu脱氢烷基化反应,并首次合成了植物雌激素Ferujol.其中,秦皮乙素的7位羟基能够选择性烷基化并取得了良好的收率(如路线10所示),秦皮乙素在不同的反应条件下得到了秦皮乙素衍生物22-28.

路线10
2007年,Creaven等[49]由秦皮乙素为初始原料,合成得到了新型香豆素配位体(如路线11所示),并对其抗菌活性(包括耐甲氧西林金黄色葡萄球菌(MRSA)、大肠杆菌和白色念珠菌)进行了研究.6,7-二氧乙酸香豆素29与铜(II)和锰(II)盐进行反应,得到秦皮乙素铜和锰的金属配合物30和31.与市售抗真菌剂酮康唑相比,化合物29能有效对抗所有微生物,配合物30和31未表现出显著的抗菌活性,化合物32对MRSA和大肠杆菌表现出显著活性,并有一定的抗念珠菌活性.
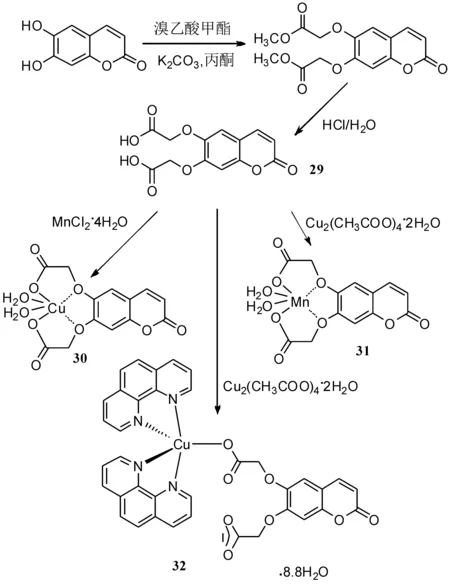
路线11
胡立宏等[50]以秦皮乙素1为原料,合成了(+)-Marmesin 33(如路线 12所示).(+)-Marmesin 33是GLUT4膜转移激动剂和GLUT4蛋白表达激动剂,可用于治疗糖尿病及其并发症.
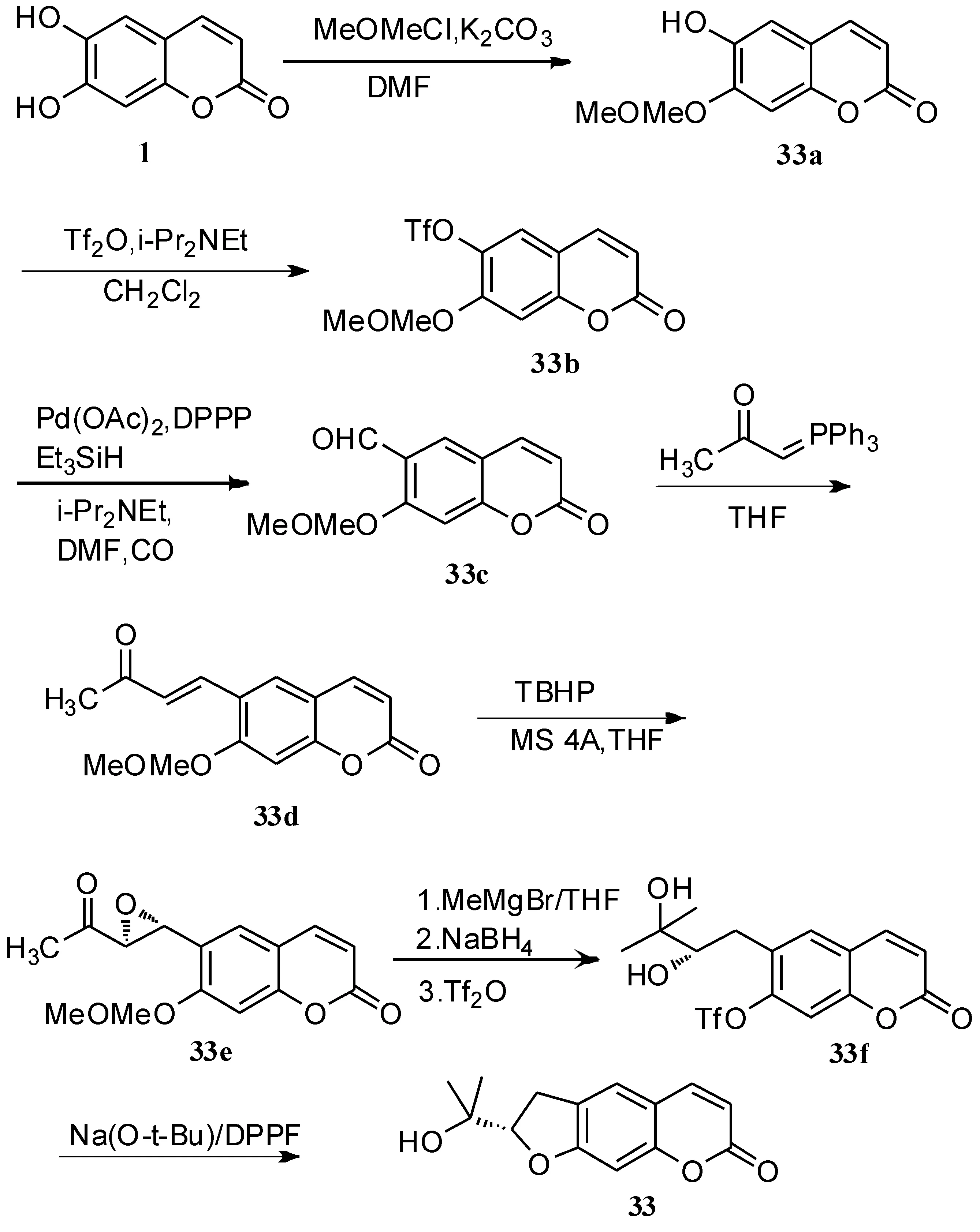
路线12
Bhardwaj等[51]以秦皮乙素为初始原料,将H2O2作为催化剂,通过氧化偶联合成了新的香豆素衍生物34-37(如路线 13所示).
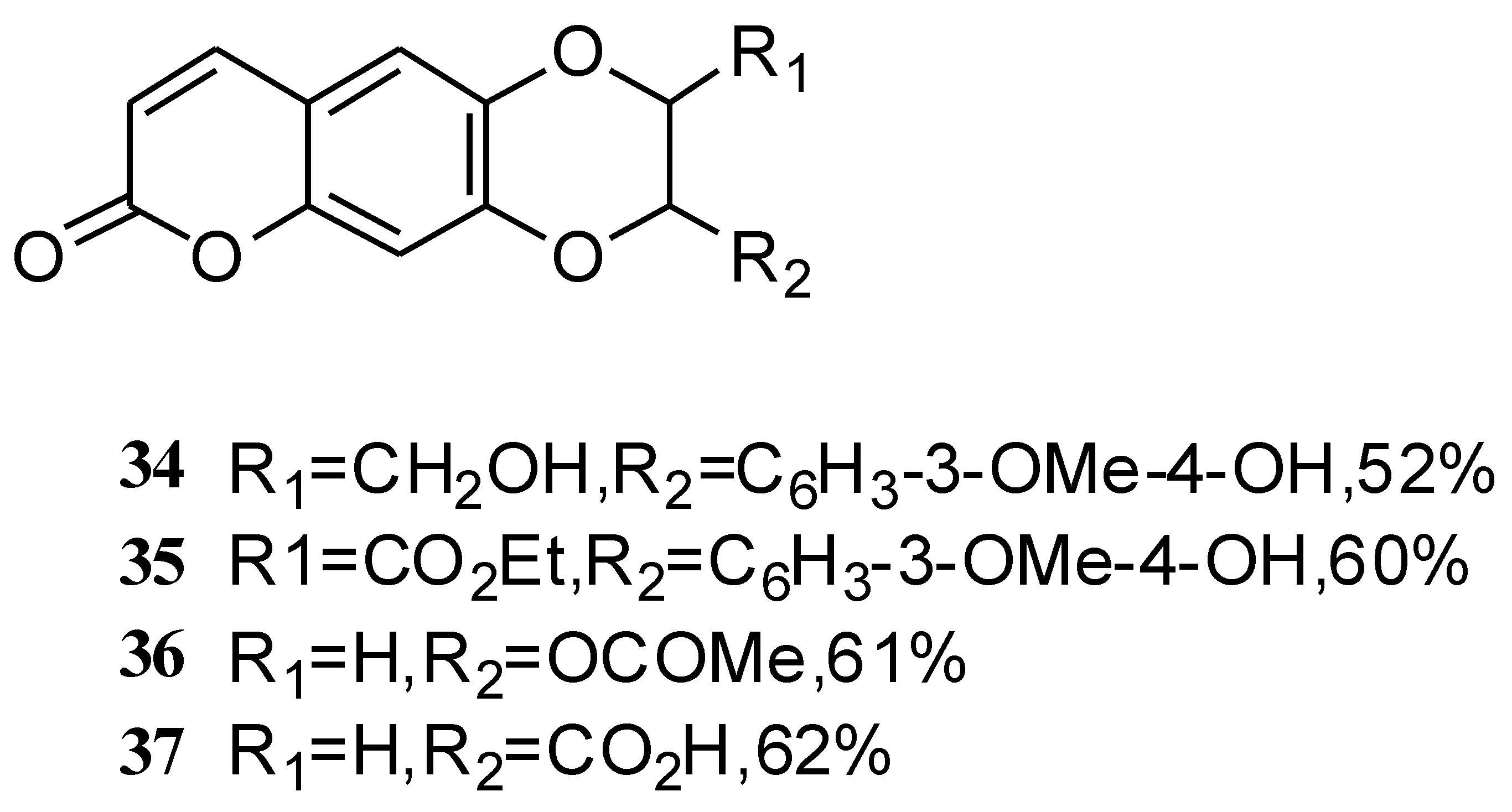
路线13
Castaldi等[52]报道了由Cu(II)离子氧化秦皮乙素得到的生物大分子ESC 39,40 (如路线 14所示).在形成氧化产物ESC时, Cu(II)还原为Cu(I).比较水相中苹果酸和ESC在钙-聚半乳糖醛酸盐(CA-PGA)中的活动得出,在pH 5.0和6.0时,苹果酸促成了22%~34%的Cu(II)积累,而ESC促成了约12%~25%.Cu(II)-ESC的研究还表明,形成二聚体时,一分子的ESC会消除一个Cu(II)离子,且速率比苹果酸更快.
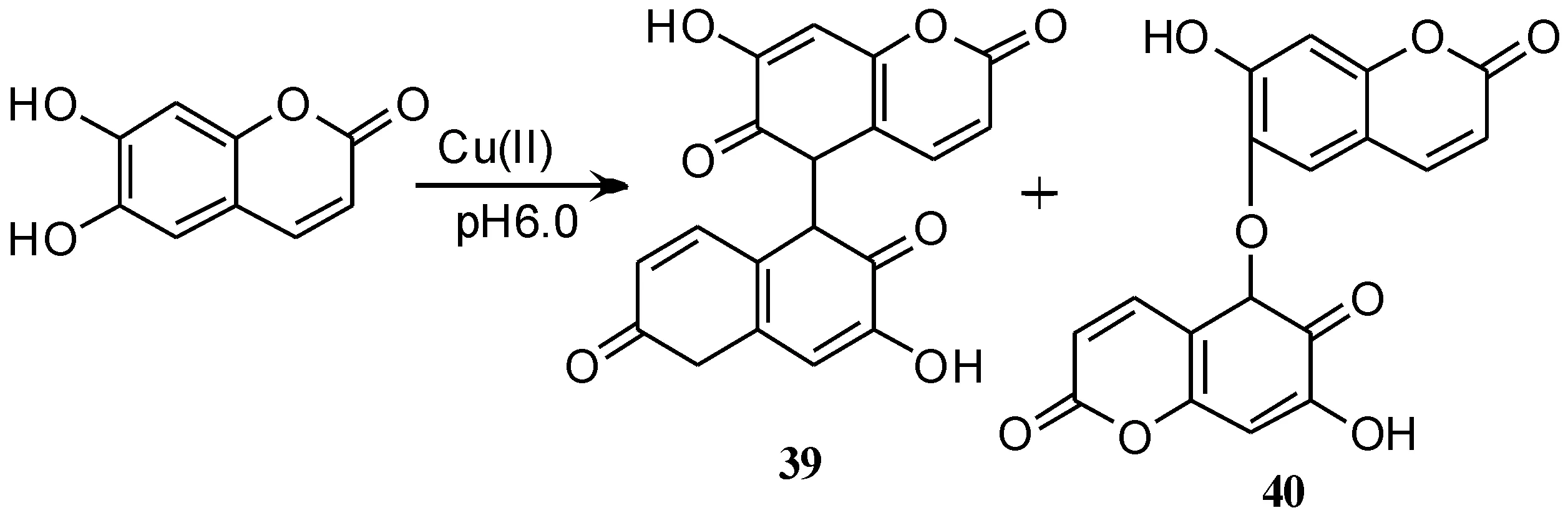
路线14
2010年,Aurioll等[53]由秦皮乙素合成了6-OH取代的葡萄糖苷衍生物41,如图2所示.该衍生物与秦皮甲素结构类似,应用在化妆品、营养品和药物等领域.例如,治疗或预防氧化应激,癌症,心血管疾病,细菌感染、病毒感染、真菌感染,紫外线诱导的红斑、过敏、新陈代谢症,糖尿病,肥胖,荷尔蒙失调,骨性疾病,疼痛,脑疾病,口腔或牙齿疾病,炎性或免疫疾病等.

图2 秦皮乙素葡萄糖苷衍生物
Pisani等[54]由秦皮乙素合成了一类香豆素衍生物42,如图3所示.研究发现这类香豆素衍生物对乙酰胆碱酯酶(AChE)和丁酰胆碱酯(BChE)表现出优异的选择性,并可作为高效的乙酰胆碱酯酶抑制剂.
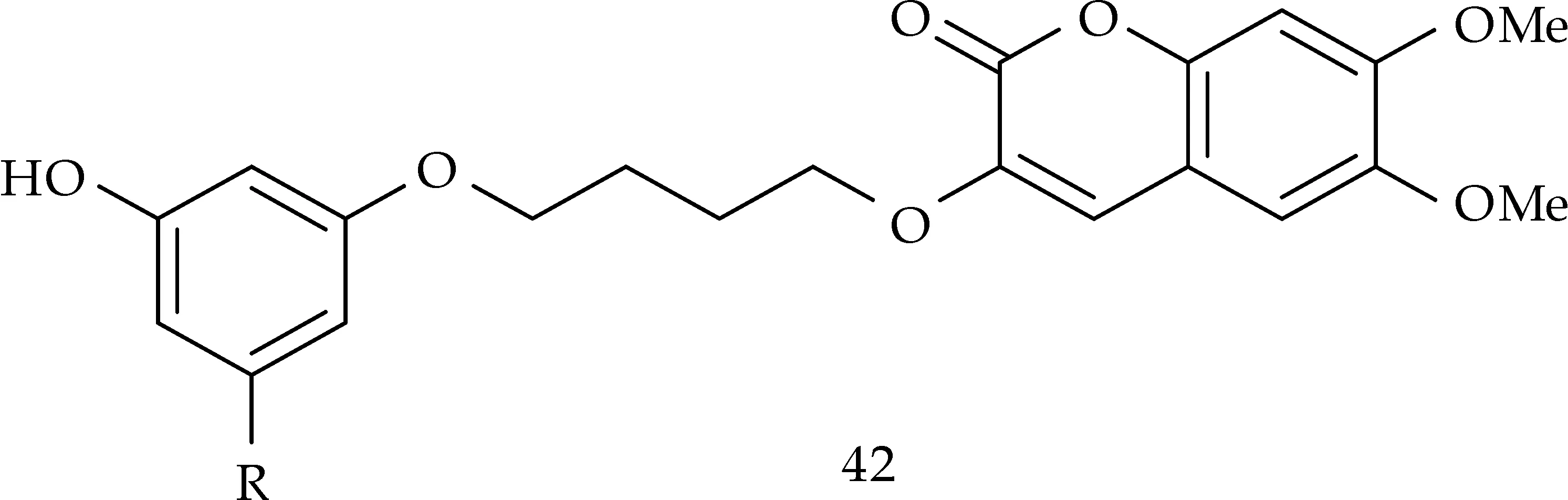
图3 香豆素衍生物
4结论
秦皮乙素因其独特的结构及理化性质正日益引起科研人员的浓厚兴趣,特别是近年来秦皮乙素被发现具有良好的抗肿瘤、抗炎、抗菌等药理活性,其衍生物的合成与生物活性研究已显示了独特的新药开发价值.基于此,本文首次综述了秦皮乙素及其衍生物合成与药理学研究进展,这将有益于后续药学研究的不断深入.
天然产物的开发和应用研究是无止境的,相信随着秦皮乙素衍生物合成方法的进一步丰富和发展,各种结构新颖的秦皮乙素衍生物将不断涌现.目前,对于秦皮乙素各方面药理活性与作用机制的研究正方兴未艾.随着药效作用的分子机制逐步明确,陕西道地药材秦皮的开发及其主要成分秦皮乙素运用于临床治疗的前景将会变得更加广阔.
参考文献
[1] 国家药典委员会.中华人民共和国药典一部[M].北京:化学工业出版社,2010:255.
[2] Yamada H.,Watanabe K.,Saito T,et al.Esculetin (dihydroxycoumarin) inhibits the production of matrix metalloproteinases in cartilage explants,and oral administration of its prodrug,CPA-926,suppresses cartilage destruction in rabbit experimental osteoarthritis[J].J.Rheumatol,1999,26(3):654-662.
[3] Martin Aragón S,Benedi J M,Villar A M.Effects of the antioxidant (6,7-dihydroxycoumarin) esculetin on the glutathione system and lipid peroxidation in mice[J].Gerontology.,1998,44(1):21-25.
[4] Hu Y,Chen X,Duan H.Chinese herbal medicinal ingredients inhibit secretion of IL-6, IL-8, E-selectin and TXB2 in LPS-induced rat intestinal microvascular endothelial cells[J].Immunopharmacol Immunotoxicol,2009,31(4):550-555.
[5] Duncan S H,Leitch E C,Stanley K N,et al.Effects of esculin and esculetin on the survival of escherichia coli O157 in human faecal slurries,continuous-flow simulations of the rumen and colon and in calves[J].British Journal of Nutrition,2004,91(5):749-755.
[6] So-hyung Kim,Kyoung-ah Kang,Rui Zhang,et al.Protective effect of esculetin against oxidative stress-induced cell damage via scavenging reactive oxygen species[J].Acta Pharmacologica Sinica,2008,29,1 319-1 326.
[7] Kawaii S,Tomono Y,Ogawa K,et al.The antiproliferative effect of coumarins on several cancer cell lines[J].Anticancer Research,2001,21(2A):917-923.
[8] 段慧琴,张永东,范开,等.七叶亭抗炎机理研究[J].中国兽医杂志,2007,43(9):45-46.
[9] Choia J H,Kima D Y,Yoon J H,et al.Effects of SKI 306X,a new herbal agent,on proteoglycan degradation in cartilage explant culture and collagenase-induced rabbit osteoarthritis model[J].Osteoarthritis and Cartilage,2002,10(6):471-478.
[10] 王志强,夏勇.七叶亭预处理对大鼠急性心肌缺血再灌注损伤的保护作用[J].成都医学院学报,2011,6(1):49-51.
[11] 贺超,黄烨,李柏生,等.七叶内酯对平滑肌源性泡沫细胞胆固醇外转运蛋白ABCA1和ABCG1表达的影响[J].广东医学,2012,33(22):3 368-3 371.
[12] 戴榕,郑琼莉, 徐全胜,等.七叶内酯对大鼠血管平滑肌细胞增殖的抑制及其机制[J].华中科技大学学报(医学版),2009,38(2):239-242.
[13] Lin H C,Tsai S H,Chen C S,et al. Structure-activity relationship of coumarin derivatives on xanthine oxidase-inhibiting and free radical-scavenging activities[J].Biochem Pharmacol,2008,75(6):1 416-1 425.
[14] Kaneko T,Tahara S,Takabayasi F.Suppression of lipid hydroperoxide-induced oxidative damage to cellular DNA by esculetin[J].Biol Pharm Bull,2003,26(6):840-844.
[15] 梁敏.秦皮抗氧化成分的分离及其活性研究[J].食品工业科技.2006,27(3):64-66.
[16] 刘保生,赵长容,张红医.秦皮甲素、秦皮乙素与血清白蛋白的相互作用[J].分析科学学报,2005,21(1):17-19.
[17] 李磊,刘雪锋,方云,等.共存物对中药有效成分七叶内酯-BSA结合的扰动方式[J].应用化学,2008,25(1):106-110.
[18] 刘雪锋,李磊,方云,等.中药成分七叶内酯-BSA-金属离子的相互作用[J].化学研究与应用,2002,19(2):45-50.
[19] 王新,索占伟,穆祥,等.七叶亭抗LPS致肠黏膜微血管内皮细胞分泌NO升高的研究[J].莱阳农学院学报,2005,22(4):256-258.
[20] Duncan S H,Leitch E C,Stanley K N,et al.Effects of esculin and esculetin on the survival of escherichia coli O157 in human faecal slurries,continuous-flow simulations of the rumen and colon and in calves[J].Br J Nutr,2004,91(5):749-755.
[21] Watanabe K,Ito A,Sato T,et al.Esculetin suppresses proteoglycan metabolism by inhibiting the production of matrix metalloproteinases in rabbit chondrocytes[J].Eur. J. Pharmacol,1999,370(3):297-305.
[22] Gilani A H,Janbaz K H,Shah B H.Esculetin prevents liver damage induced by paracetamol and CCL4[J].Pharmacol Res,1998,37(1):31-35.
[23] Lin W L,Wang C J,Tsai Y Y,et al.Inhibitory effect of esculetin on oxidative damage induced byt-butyl hydroperoxide in rat liver[J].Arch Toxicol,2000,74(8):467-472.
[24] Park C,Jin C Y,Kwon H J,et al.Induction of apoptosis by esculetin in human leukemia U937 cells: roles of Bcl-2 and extracellular-regulated kinase signaling[J].Toxicol In Vitro,2010,24(2):486-494.
[25] Wang C J,Hsieh Y J,Chu C Y,et al.Inhibition of cell cycle progression in human leukemia HL-60 cells by esculetin[J].Cancer Lett,2002,183(2):163-168.
[26] 贾绍华,刘冰洁,张道勇,等.秦皮乙素诱导人胃癌SGC-7901 细胞凋亡机制的研究[J].黑龙江医药,2012,25(3):365-368.
[27] 张舜尧.秦皮乙素诱导SGC-7901肿瘤细胞凋亡的实验研究[D].哈尔滨:哈尔滨商业大学,2011.
[28] Kuo H C,Lee H J,Hu C C,et al.Enhancement of esculetin on taxol-induced apoptosis in human hepatoma HepG2 cells[J].Toxicol Appl Pharmacol,2006,210(1/2):55-62.
[29] 王晶,伟忠民.秦皮乙素诱导人肝癌细胞SMMC-7721凋亡的机制研究[J].中成药,2013,34(11):2 059-2 063.
[30] 王晶,王洪新,李红玉,等.秦皮乙素的制备及对人肝癌细胞SMMC-7721体外增殖的影响[J].中国现代应用药学杂志,2009,26(6):439-442.
[31] Leung K N,Leung P Y,Kong L P,et al.Immunomodulatory effects of esculetin (6,7-dihydroxycoumarin)on murine lymphocytes and peritoneal macrophages[J].Cell Mol Immunol,2005,2(3):181-188.
[32] 张丹.两种天然抗氧化剂对铁离子诱导的羟自由基形成以及细胞毒性的影响[D].武汉:华中农业大学,2009.
[33] Masamoto Y,Murata Y,Baba K,et al.Inhibitory effects of esculetin on melanin biosynthesis[J].Biol.Pharm.Bull.,2004,27(3):422-425.
[34] Yang J Y,Della Fera M A,Baile C A,et al.Esculetin induces mitochondria-mediated apoptosis in 3T3-L1 adipocytes[J].Apoptosis,2006,11(8):1 371-1 378.
[35] 曹卫权,薛建锋,石春明,等.6,7-二羟基香豆素的研制[J].精细化工中间体,2013,43(3):39-41.
[36] 张婷.6,7-二羟基香豆素的合成与研究[D].南京:南京理工大学,2007.
[37] 杨晓军, 高焕焕.微波辐射合成秦皮乙素的研究[J].应用化工,2011,40(4):627-629.
[38] 张树芬,马吉海,陈韶蕊,等.6,7-二甲氧基香豆素的合成工艺改进[J].河北科技大学学报,2007,28(1):24-25.
[39] 赵丽娟.6,7-二甲氧基香豆素的合成与研究[D].兰州:兰州交通大学,2012.
[40] Oshima N,Narukawa Y,Takeda T,et al.Collagenase inhibitors from viola yedoensis[J].Journal of Natural Medicines,2013,67(1):240-245.
[41] 方专,何光力,何菱.微波辅助合成东莨菪素[J].华西药学杂志,2007,22(3):302-303.
[42] 孙文基, 杨旭民.天然药物成分提取分离与制备[M].北京:中国医药科技出版社,1999:367-369.
[43] Demyttenaere J,Vervisch S,Debenedetti S,et al.Synthesis of virgatol and virgatenol,two naturally occurring coumarins from pterocaulon virgatum (L.)DC,and7-(2,3-epoxy-3-methylbutoxy)-6 -methoxycoumarin,isolated from conyza obscura DC[J].Synthesis,2004,11:1 844-1 848.
[44] Adfa M,Yoshimura T,Komura K,et al.Antitermite activities of coumarin derivatives and scopoletin from protium javanicum burm.F.[J].Journal of Chemical Ecology,2010,36(7):720-726.
[45] Bull J A,Lujan C,Hutchings M G,et al.Application of the BHQ benzannulation reaction to the synthesis of benzo-fused coumarins[J].Tetrahedron Letters,2009,50(26):3 617-3 620.
[46] Nemoto T,Ohshima T,Shibasaki M.Enantioselective total syntheses of (+)-decursin and related natural compounds using catalytic asymmetric epoxidation of an enone[J].ChemInform,2003,59(35):6 889-6 897.
[47] Chimichi S,Boccalini M,Cosimelli B.A new convenient route to 2-oxoethoxycoumarins:Key intermediates in the synthesis of natural products[J].Tetrahedron,2002,58(24):4 851-4 858.
[48] Cravotto G,Chimichi S,Robaldoa B,et al.Monoalkylation of dihydroxycoumarins via mitsunobu dehydroalkylation under high intensity ultrasound:The synthesis of ferujol[J].Tetrahedron Letters,2003,44(46):8 383-8 386.
[49] Creaven B S,Egan D A,Karcz D,et al.Synthesis, characterisation and antimicrobial activity of copper(II)and manganese(II) complexes of coumarin-6,7-dioxyacetic acid (cdoaH2) and 4-methylcoumarin-6,7-dioxyacetic acid(4-MecdoaH2):X-ray crystal structures of[Cu(cdoa)(phen)2].8.8H2O and [Cu(4-Mecdoa)(phen)2].13H2O (phen=1,10-phenanthroline)[J].Journal of Inorganic Biochemistry,2007,101(8):1 108-1 119.
[50] 胡立宏,沈旭,蒋华良,等.线型呋喃香豆素衍生物、其制备方法和用途、以及包含该衍生物的药物组合物[P],中国专利:200710040733.8,2007-05-16.
[51] Bhardwaj S,Mishra A K,Kaushik NK.Synthesis of some novel coumarinolignans newer catalyst for phenolic oxidative coupling[J].Trends in Applied Sciences Research,2006,1(2):115-122.
[52] Castaldi P,Garau G,Palma A,et al.Formation of biopolymers owing to the oxidation of esculetine by Cu(II) ions in a Ca-polygalacturonate network[J].Journal of Inorganic Biochemistry,2012,108(1):30-35.
[53] Auriol D,Aurelie G,Fabrice L,et al.Hydrosoluble [6)-O-a-D-Glcp-(1]n-6-O-b-D-Glcp-(1-phenolic derivatives with dermocosmetic, nutritional and therapeutic applications, and compositions containing said water soluble compounds[P].PCT:2009067736,2011-10-20.
[54] Pisani L,Catto M,Giangreco I,et al.Design, synthesis, and biological evaluation of coumarin derivatives tethered to an edrophonium-like fragment as highly potent and selective dual binding site acetylcholinesterase inhibitors[J].Chem Med Chem,2010,5(9):1 616-1 630.
Advances in the synthesis and pharmacological
activities of esculetin and its derivatives
LIANG Cheng-yuan, ZHANG Shi-yun, MAO Gen-nian,
SONG Hui-hui, DING Shun-jun, WANG Lan, CHEN Xue-feng
(School of Food and Biological Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China)
Abstract:Esculetin is the main active ingredient of Cortex Fraxini,its chemical name is 6,7-dihydroxycoumarin.In recent years,scientists have found that esculetin possessed good anti-tumor,anti-inflammatory and antibacterial activities,which showed a broad pharmaceutical application prospects.This review covered recent studies on the synthesis,pharmacological activities and mechanism of esculetin and its derivatives over the past decade,including anti-clostridium histolyticum collagenase (ChC),eradicating termites,as well as significant activity against Escherichia coli and Candida.With a variety of novel esculetin derivatives being continuously synthesized,the development and clinical application of Shaanxi Cortex Fraxini and its main ingredient esculetin will be more prospective.
Key words:esculetin; coumarin; synthesis; derivatives; biological activity
中图分类号:R285.5
文献标志码:A
文章编号:1000-5811(2015)02-0126-08
作者简介:梁承远(1985-),男,陕西宝鸡人,讲师,博士,研究方向:新药研究与开发
基金项目:陕西省科技厅自然科学基金项目(2014JQ4154,2012JZ3002); 陕西科技大学博士科研启动基金项目(BJ13-20)
收稿日期:*2014-12-20
