阿魏酸对小胶质细胞炎性反应的抑制作用
2016-01-11吴建良,沈敏敏,杨水新等
网络出版时间:2014-12-4 13:45网络出版地址:http://www.cnki.net/kcms/doi/10.3969/j.issn.1001-1978.2015.01.021.html
阿魏酸对小胶质细胞炎性反应的抑制作用
吴建良1, 沈敏敏1,杨水新1,王翔2,马增春3
(1.湖州市中心医院,浙江 湖州313000;2.湖州市第一人民医院,浙江 湖州313000; 3.军事医学科学院放射与辐射医学研究所,北京100850)
中国图书分类号:R-332;R322.81;R345.57;R364.5;R392.12;R745.7
摘要:目的考察阿魏酸对脂多糖诱导的小鼠小胶质细胞炎性反应的抑制作用及其机制。方法采用脂多糖(LPS)刺激小胶质细胞(BV-2)活化,研究阿魏酸对炎症反应的抑制作用。采用硝酸还原酶法检测阿魏酸对一氧化氮(nitric oxide, NO) 的影响,定量PCR和蛋白印迹分析阿魏酸对诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)和环氧合酶-2(COX-2)的影响,定量PCR技术和ELISA分析阿魏酸对炎性因子白细胞介素-1β(interleukin-1β, IL-1β)、白细胞介素-6(interleukin-6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)的影响,进而检测阿魏酸对促分裂原活化蛋白激酶(mitogen-activated protein kinases, MAPK)信号通路的影响。结果1.25~20 μmol·L`(-1)的阿魏酸对细胞活性无明显影响。阿魏酸浓度依赖性降低NO的浓度,可以明显抑制iNOS、COX-2的基因和蛋白表达,明显抑制IL-1β、IL-6、TNF-α的表达,提前给予阿魏酸共同孵育对LPS引起的ERK信号通路的磷酸化有抑制作用。结论阿魏酸具有抑制小胶质细胞活化,抑制神经性炎症的作用,其机制可能是阿魏酸通过ERK信号通路发挥对炎性分子的抑制作用。
关键词:阿魏酸;小胶质细胞;神经性炎症;一氧化氮合酶;环氧合酶-2;炎性因子
doi:10.3969/j.issn.1001-1978.2015.01.021
文章编号:
文献标志码:A1001-1978(2015)01-0097-06
收稿日期:2014-09-04,修回日期:2014-11-28
基金项目:国家自然科学基金青年基金项目(No 81202936);湖州市科技计划项目(No 2013GY14)
作者简介:吴建良(1963-),男,硕士,副主任药师,研究方向:中药药理学,Tel:0572-2023301-3401,E-mail: wjl6592@163.com
Abstract:AimTo evaluate the effects of ferulic acid (FA) on lipopolysaccharide (LPS)-induced neuroinflammation in microglia cells and its potential mechanisms. MethodsMicroglial activation was induced by stimulation with LPS, and the effects of FA pretreatment on microglial activation and production of proinflammatory mediators, nitric oxide/iNOS were investigated. The role of the mitogen-activated protein kinases in the antiinflammatory actions of FA in LPS-stimulated microglia was further elucidated. ResultsCell viability experiments revealed that FA did not produce cytotoxicity in microglia. FA significantly inhibited LPS-induced production of tumour necrosis factor-alpha (TNF-α), interleukin-6 (IL-6), interleukin-1beta (IL-1β), and nitric oxide(NO). Protein and mRNA levels of COX-2 and inducible nitric oxide synthase (iNOS) were also attenuated by FA. Further experiments on intracellular signalling mechanisms showed that inhibition of extracellular regulated kinase (ERK) contributed to the anti-neuroinflammatory actions of FA. ConclusionThe results suggest that FA inhibits LPS-induced microglial inflammation by partial targeting of ERK signalling and attenuation of ERK.
马增春(1970-),男,博士,研究员,研究方向:中药药理学,Tel:010-66932201,E-mail:13681121635@163.com
小胶质细胞为脑内的单核吞噬细胞,是中枢神经系统内的免疫效应细胞,发挥内源性免疫防御作用[1]。小胶质细胞在特定病理条件下长期持续活化,会分泌神经毒性物质和炎性介质,如白细胞介素-1β(interleukin-1β, IL-1β),白细胞介素-6(interleukin-6, IL-6),肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、一氧化氮(nitric oxide, NO)等,这些物质与小胶质细胞相互作用,造成中枢神经系统炎症反应放大和毒性产物增多,从而引起阿尔茨海默病(Alzheimer’s disease, AD)等神经退行性病变[2]。AD 的主要致病因素可能与细胞外积聚的不溶性β淀粉样肽(β-amyloid peptide, Aβ),激活小胶质细胞引起的神经元退行性病变[3]。因此抑制小胶质细胞的激活,减少致炎介质的释放成为了筛选治疗AD的重要药物靶点[4]。
阿魏酸(ferulic acid, FA)是当归、川芎、升麻等中药的有效成分之一,具有抑制Aβ沉积,减轻神经细胞炎症反应,改善AD的行为症状[5-7],但对小胶质细胞的具体分子机制尚不明确。利用脂多糖( lipopolysaccharide, LPS) 激活小胶质细胞建立AD 等神经退行性疾病的炎症模型是国际上公认的造模手段[8-9],本文采用LPS 处理小胶质细胞BV-2 细胞株建立炎症模型,旨在研究阿魏酸对神经细胞炎症反应的抑制作用及分子机制。
1材料与方法
1.1材料
1.1.1细胞BV-2细胞株购自北京协和医科大学细胞中心,细胞培养于10%胎牛血清的DMEM培养液中,在37℃,5%二氧化碳的细胞培养箱中,细胞呈单层生长,达80%左右时传代。
1.1.2试剂与仪器阿魏酸购自中国食品药品检定研究院,DMEM和胎牛血清购于Gibco BRL (Grand Island, NY, USA)。NO试剂盒购自南京建成生物工程研究所,CCK-8 (Wako, Osaka, Japan)。RNApure 超纯总RNA快速提取试剂盒(博迈德生物),TransScriptTM One-Step RT-PCR SuperMix(北京全式金生物技术有限公司),Fast SYBR@Green Master Mix (Applied Biosystems)。IL-1β、IL-6、TNF-α细胞因子酶联免疫吸附测定(enzyme linked immunosorbent assay, ELISA)试剂盒购自美国R&D 公司。兔抗鼠的环氧合酶-2(COX-2)抗体,β-actin 多克隆抗体购自美国Cell Signaling Technology,兔抗鼠的诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)多克隆抗体购自美国BD 公司,p38促分裂原活化蛋白激酶(p38 mitogen-activated protein kinase, p38)、c-Jun 氨基末端激酶(c-Jun N-terminal kinases, JNK) 胞外信号调节激酶(extracellular regulated kinase, ERK)、phospho-ERK, phospho-p38, phospho-JNK 等抗体购自Santa Cruz Biotechnology公司。ECL(enhanced chemoluminescence)发光液购自Pierce公司。硝酸纤维膜及蛋白分子量marker购自普利莱公司的分装产品。转膜用滤纸为Bio-Rad 公司产品。
细胞培养箱(NAPCO 5410),超净工作台(北京长城空气净化设备公司),倒置显微镜(Nikon 120型),Victor X5酶标仪(PerkinElmer Waltham, MA, USA))PCR仪 (GeneAmp 2400),核酸蛋白分析仪(Beckman DU640),StepOne PlusTM Real Time PCR (Applied Biosystems)。
1.2方法
1.2.1CCK-8检测细胞培养在96孔板(1×104细胞/孔)中,培养至细胞80%汇合,加入系列浓度的阿魏酸的0.1 mL培养液,培养1 h后,加入LPS (终浓度10 μg·L-1),继续培养24 h,各孔加入10 μL CCK-8,孵育4 h,使用酶标仪在450 nm处测定吸光度。
1.2.2NO检测细胞培养在48孔板(2×104细胞/孔)中,培养至细胞80%汇合,加入含有指定浓度的阿魏酸的0.2 mL培养液,继续培养1 h后,加入LPS (终浓度10 μg·L-1),继续培养24 h后,收集每孔培养液,按NO检测试剂盒操作方法进行检测。
1.2.3定量PCR检测细胞培养在6孔板(1×105细胞/孔)中,培养至细胞80 %汇合,加入含有指定浓度的阿魏酸的培养液,培养液中培养1 h后,加入LPS (终浓度10 μg·L-1),继续培养6 h,按试剂盒说明提取细胞总RNA,电泳分析表明 18 S和28 S条带清晰可见,A260/A280比值在 1.7-2.0,总RNA片段完整未降解可用。取 2 μg RNA按照TransScriptTMOne-Step RT-PCR SuperMix 说明进行逆转录反应,42 ℃ 30 min;85 ℃ 5 min。用ABI StepOne PlusTM Real Time PCR进行PCR反应,取 2.0 μL逆转录反应产物作为PCR反应模板,加入上下游引物 20 μmol·L-1各 0.5 μL,Fast SYBR@Green Master Mix 10 μL,补充Rase-free water至 20 μL。反应参数:95 ℃ 20 S预变性,95 ℃ 3 S变性,60 ℃ 30 S退火,共 40个循环。每次扩增设置β-actin 内参照,进行PCR扩增产物的实时定量分析,用2-(△△Ct) 方法分析。

Tab 1 Primers sequence used in Real Time PCR
1.2.4ELISA检测细胞培养在24孔板(4×104细胞/孔)中,培养至细胞80%汇合,加入含有指定浓度阿魏酸的培养液,培养1 h后,加入LPS (终浓度10 μg·L-1),继续培养6 h后,收集每孔培养液,按照ELISA 试剂盒说明书操作。
1.2.5蛋白印迹分析取指数生长期的BV-2 细胞接种于6 孔板中,1×108·L-1,待细胞贴壁后,加入各浓度药物预孵育1 h后,加入LPS (终浓度10 μg·L-1),继续培养6 h后,用预冷的PBS洗涤3次, 加100 μL的RIPA 裂解液,冰上作用30 min 后,用细胞刮把细胞刮下,按试剂盒方法提取蛋白,蛋白样品进行定量分装后,蛋白样品进行SDS-PAGE电泳分离,电转移至PVDF膜上,将膜用5%脱脂奶粉室温封闭1 h,5%脱脂奶粉稀释的一抗轻摇孵育4℃过夜,TBST洗膜3次,每次15 min,加入用5%脱脂奶粉稀释的二抗(辣根过氧化物酶偶联的羊抗兔IgG),室温轻摇1 h,TBST洗膜3次,每次15 min,ECL发光、压片显影。
1.2.6统计学分析数据采用SPSS 13.0统计软件进行分析。实验结果符合正态性分布,组间和组内比较采用单因素方差分析。
2结果
2.1阿魏酸对细胞活性的影响为检测对BV-2细胞活性的影响,指数培养期细胞与1.25~20 μmol·L-1的阿魏酸1 h后,加入LPS (终浓度10 μg·L-1),继续培养24 h,各孔加入10 μL CCK-8,孵育4 h后检测细胞活性,如Fig 1所示,LPS减轻细胞活性,但差异无统计学意义。 1.25~20 μmol·L-1的阿魏酸对细胞活性无明显影响。以下实验采用2.5~10 μmol·L-1的浓度范围。
2.2阿魏酸对NO的影响NO是由神经胶质细胞活化所产生的炎症因子之一,是神经性炎症的一个重要检测指标。本实验采用硝酸还原酶法检测阿魏酸对LPS 诱导BV-2细胞生成NO 的影响。结果如Fig 2所示,LPS 组的NO生成量明显高于正常组,与LPS组相比,阿魏酸呈剂量依赖性降低NO的浓度。

Fig 1Cytotoxicity effects of FA on BV-2 cells
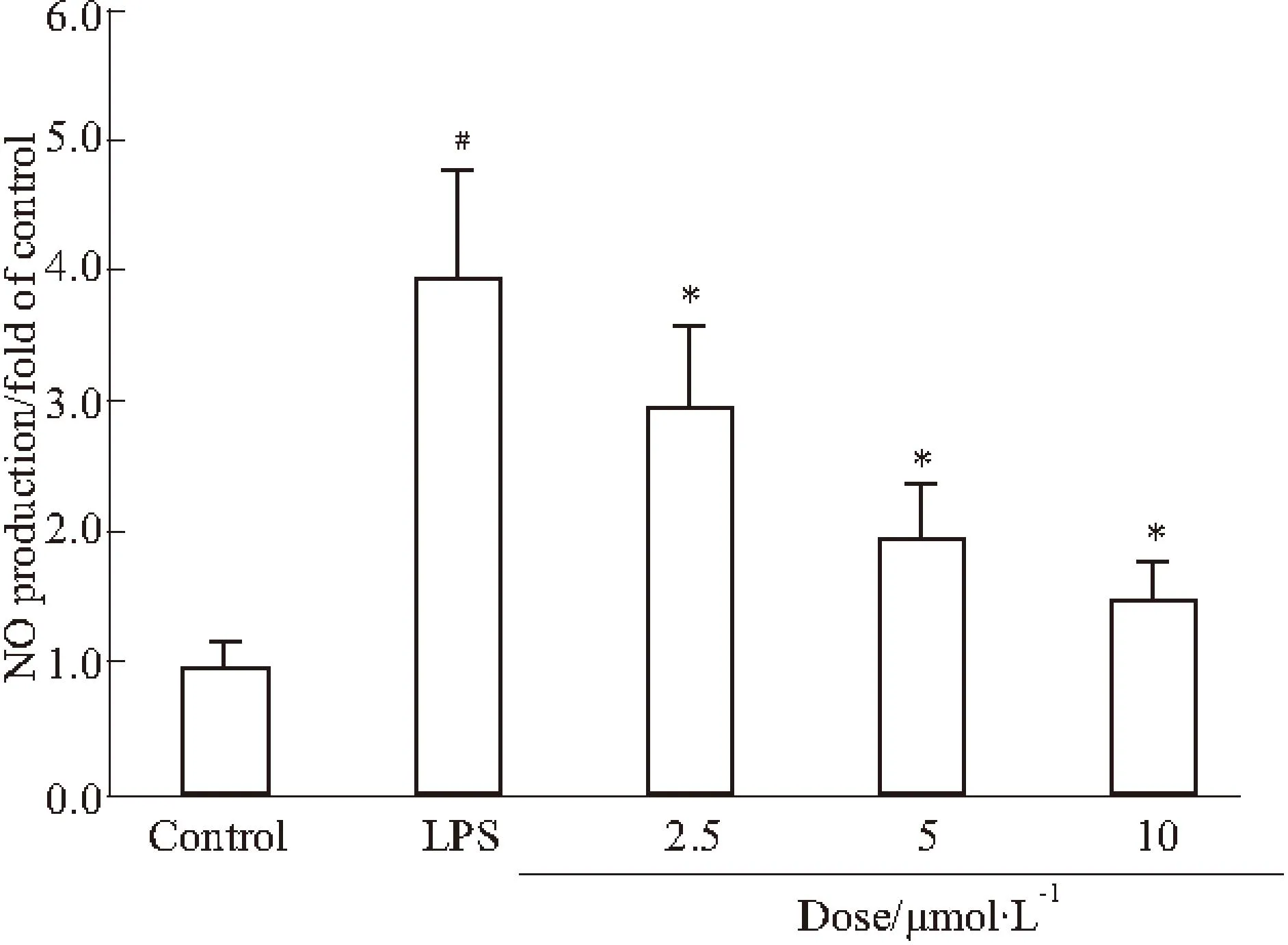
Fig 2Effect of FA on LPS-induced NO production in BV-2 cells
#P<0.05vscontrol group;*P<0.05vsLPS treatment group.
2.3阿魏酸对iNOS和COX-2的影响iNOS 和COX-2 分别是NO和PGE2生成的限速酶,正常时无表达或表达量低,在LPS刺激下表达量增加,并促使NO和PGE2的生成。采用定量PCR技术检测阿魏酸对iNOS和COX-2 基因表达的影响,如Fig 3所示,正常组iNOS 和COX-2在基因水平表达量极少,经LPS刺激后,iNOS、COX-2 基因表达量明显上调,阿魏酸可以明显抑制iNOS、COX-2的基因表达,并呈剂量依赖性。采用Western blot检测阿魏酸对iNOS和COX-2蛋白表达的影响,结果如Fig 4所示,正常组iNOS 和COX-2在蛋白水平表达量极少,经LPS刺激后,iNOS、COX-2 蛋白表达量明显上调,阿魏酸可以明显抑制iNOS、COX-2的蛋白表达,并呈剂量依赖性。

Fig 3Effect of FA on LPS-induced iNOS and COX-2
mRNA production in BV-2 cells
#P<0.05vscontrol group;*P<0.05vsLPS treatment group.
2.4阿魏酸对炎性因子的影响小胶质细胞参与AD的炎症反应,小胶质细胞一方面转化为吞噬细胞,通过吞噬死亡神经细胞残骸和变性的突触,有利于神经元再生和死亡周边区神经元的存活,另一方面通过释放和分泌一系列的神经毒性物质和炎症因子,如IL-1β、IL-6、TNF-α等,导致继发性脑组织损伤。采用定量PCR技术检测阿魏酸对炎性因子基因表达的影响,结果如Fig 5所示,LPS刺激后,IL-1β、IL-6、TNF-α基因表达量明显上调,阿魏酸可以明显抑制IL-1β、IL-6、TNF-α的基因表达,并呈剂量依赖性。采用ELISA检测阿魏酸对炎性因子表达的影响,如Fig 6所示,LPS刺激后,IL-1β、IL-6、TNF-α表达量明显上调,阿魏酸可以明显抑制IL-1β、IL-6、TNF-α的表达,并呈剂量依赖性。 2.5Western blot检测阿魏酸对促分裂原活化蛋白激酶(mitogen-activated protein kinases, MAPK)信号通路的影响通过Western blot检测,发现提前给予阿魏酸共同孵育对LPS引起的ERK信号通路的磷酸化有抑制作用,推断阿魏酸可能是通过ERK信号通路发挥对炎性分子的抑制作用,见Fig 7。

Fig 4Effect of FA on LPS-induced iNOS and COX-2 protein
production in BV-2 cells
#P<0.05vscontrol group;*P<0.05vsLPS treatment group.

Fig 5Effect of FA on LPS-induced cytokine release in gene level
#P<0.05vscontrol group;*P<0.05vsLPS treatment group.

Fig 6Effect of FA on LPS-induced cytokine
release detected by ELISA
#P<0.05vscontrol group;*P<0.05vsLPS treatment group.
3讨论
由小胶质细胞过度激活导致的神经炎症是造成神经元突触功能异常和认知能力下降的最直接的原因[10]。无论AD的致病机制如何,过度的神经炎症是疾病发生和发展的中心环节[11]。因此,以神经炎症为靶点,通过抑制小胶质细胞的过度激活和促炎症细胞因子的释放能够有效阻止疾病的恶化[12]。由于阿魏酸具有较强的神经保护和抗炎活性[13-14],因此,我们通过体外培养小胶质细胞建立神经性炎症模型,研究阿魏酸对LPS诱导小胶质细胞活化所产生的炎症反应的抑制作用, 并重点探讨阿魏酸抑制小胶质细胞活化的分子机制。
iNOS催化产生一氧化氮是引起AD的主要发病机制,致炎细胞因子刺激胶质细胞,诱导iNOS的表达。目前认为AD病人脑中反应性胶质细胞过度表达iNOS是造成神经元损伤的重要原因。因此,直接抑制iNOS和NO的产生,是炎症治疗的有效手段之一[15]。阿魏酸能明显抑制LPS诱导的BV-2细胞的NO的生成和iNOS蛋白的表达。COX-2是一些炎症因子的诱导酶,LPS可诱导产生COX-2,阿魏酸能明显抑制LPS诱导的BV-2细胞的COX-2蛋白的表达。这可能是阿魏酸通过抑制小胶质细胞活化,从而抑制神经性炎症的功能之一。

Fig 7 Effect of FA on LPS-induced MAPK kinases
Cells were preincubated with various concentrations of FA for 1h, and then stimulated with LPS. Total cells lysates were subjected to Western blot for phospho-ERK, phospho-p38, phospho-JNK. Similar results were obtained from at least three independent experiments. Relative phosphorylation levels of MAP kinases were normalized by each total protein.#P<0.05vscontrol group;*P<0.05vsLPS treatment group.
在AD的急性炎症反应(包括胶质细胞的激活等) 可发挥保护作用,从而将损伤局限化并增强神经元的修复。如果急性炎症未能充分消退,将会自然转为在AD中常见的相对难以控制的慢性炎症,此时胶质细胞的活动往往是增加神经元的氧化应激,导致神经元功能障碍进而产生神经元的退行性病变。因此,尽管神经炎症并不一定是神经退行性疾病的始发因素,但是持续的炎症反应会导致疾病的进行性加重,使神经炎症与神经元病变之间构成恶性循环,最终导致更多的神经元死亡[15]。小胶质细胞长期持续活化,会分泌神经毒性物质和炎性介质,如IL-1β、IL-6、TNF-α 、NO等[16]。IL-1β、IL-6、TNF-α是神经炎症中主要的促炎症细胞因子,白介素介导了一个恶性循环的神经炎症反应过程,其中Aβ是核心的始动因素,引起胶质细胞活化及神经退行性病变。IL-1β、IL-6是起主导作用的前炎症因素,当异常过度激活时,就会产生损害及损伤。TNF-α在外周是一种炎性细胞因子前体,在AD 患者血清、脑脊液、脑皮层以及Aβ激活的胶质细胞中TNF-α浓度都明显升高[16]。本文研究结果表明LPS刺激后,IL-1β、IL-6、TNF-α表达量明显上调,阿魏酸浓度依赖性抑制IL-1β、IL-6、TNF-α的表达。
MAPK 级联信号转导通路能被多种炎症因子所激活,并对小胶质细胞内的iNOS 和致炎因子的表达进行调节。LPS 激活的神经胶质细胞可通过细胞外信号调节激酶ERK和p38 MAPK级联增加iNOS 和炎性因子的表达[17]。因此,通过抑制MAPK 级联信号转导通路可能成为治疗神经炎症的一个新的靶点,本文研究结果表明阿魏酸可能是通过ERK信号通路发挥对炎性分子的抑制作用。
本文实验证实,阿魏酸具有抑制小胶质细胞活化,抑制神经性炎症的作用,其机制可能是阿魏酸通过ERK信号通路发挥对炎性分子的抑制作用。AD是一个复杂多机制的参与过程, 阿魏酸的保护作用是否涉及到其他机制,还有待继续研究。
参考文献:
[1]Sugama S, Takenouchi T, Cho B P, et al. Possible roles of microglial cells for neurotoxicity in clinical neurodegenerative diseases and experimental animal models[J].InflammAllergyDrugTargets, 2009,8(4):277-84.
[2]Nam K N, Kim K P, Cho K H, et al. Prevention of inflammation-mediated neurotoxicity by butylidenephthalide and its role in microglial activation[J].CellBiochemFunct, 2013,31(8):707-12.
[3]Kim B W, Koppula S, Kim J W, et al.Modulation of LPS-stimulated neuro inflammation in BV-2 microglia by Gastrodia elata: 4-hydroxybenzyl alcohol is the bioactive candidate[J].JEthnopharmacol, 2012,139(2):549-57.
[4]Choi D K, Koppula S, Suk K. Inhibitors of microglial neurotoxicity: focus on natural products[J].Molecules, 2011,16(2):1021-43.
[5]Yan J J, Jung J S, Kim T K, et al. Protective effects of ferulic acid in amyloid precursor protein plus presenilin-1 transgenic mouse model of Alzheimer disease[J].BiolPharmBull, 2013,36(1):140-3.
[6]Bramanti E, Fulgentini L, Bizzarri R, et al.β-amyloid amorphous aggregates induced by the small natural molecule ferulic acid[J].JPhysChemB,2013,117(44):13816-21.
[7]Mori T, Koyama N, Guillot-Sestier M V, et al. Ferulic acid is a nutraceutical β-secretase modulator that improves behavioral impairment and alzheimer-like pathology in transgenic mice[J].PLoSOne, 2013,8(2):e55774.
[8]Espinosa-Oliva A M, de Pablos R M, Herrera A J. Intracranial injection of LPS in rat as animal model of neuroinflammation[J].MethodsMolBiol, 2013,1041:295-305.
[9]Huang F, Deng H M, Zhu M M, et al. Inhibitory effect of ferulic acid on inflammatory response in microglia induced by lipopolysaccharides[J].DongwuxueYanjiu, 2011,32(3):311-6.
[10]Kwon O W, Moon E, Chari M A, et al. A substituted 3,4-dihydropyrimidinone derivative (compound D22) prevents inflammation mediated neurotoxicity; role in microglial activation in BV-2 cells[J].BioorgMedChemLett, 2012,22(16):5199-203.
[11]Jung H Y, Nam K N, Woo B C, et al. Hirsutine, an indole alkaloid of Uncaria rhynchophylla, inhibits inflammation-mediated neurotoxicity and microglial activation[J].MolMedRep, 2013,7(1):154-8.
[12]Han L, Yin K, Zhang S, et al. Dalesconols B inhibits lipopolysaccharide induced inflammation and suppresses NF-κB and p38/JNK activation in microglial cells[J].NeurochemInt, 2013,62(7):913-21.
[13]闫恩志,范莹,隋海娟,等.阿魏酸钠通过JNK信号传导通路对抗Aβ1-42引起的海马神经元凋亡[J].中国药理学通报,2013,29(7):990-4.
[13]Yan E Z,Fan Y, Sui H J, et al. Sodium ferulate inhibits Aβ1-42-induced hippocampal neuronal apoptosis through inhibition of c-jun N-terminal kinases signaling pathways[J].ChinPharmacolBull,2013,29(7):990-4.
[14]闫恩志,范莹,隋海娟, 等.阿魏酸钠对淀粉样β蛋白片段1-42引起的培养海马神经元损伤的保护作用及机制[J].中国药理学通报,2013,29(8):1155-8.
[14]Yan E Z,Fan Y, Sui H J, et al. Protective effect of sodium ferulate on Aβ1-42-induced neurotoxicity in cultured hippocampal neurons[J].ChinPharmacolBull,2013,29(8):1155-8.
[15]Zhang Q, Yuan L, Liu D, et al. Hydrogen sulfide attenuates hypoxia-induced neurotoxicity through inhibiting microglial activation[J].PharmacolRes, 2014, 84:32-44.
[16]Dragone T, Cianciulli A, Calvello R, et al. Resveratrol counteracts lipopolysaccharide-mediated microglial inflammation by modulating a SOCS-1 dependent signaling pathway[J].ToxicolInVitro, 2014,28(6):1126-35.
[17]Lim J Y, Hwang B Y, Hwang K W, et al. Methylalpinumisoflavone inhibits lipopolysaccharide-induced inflammation in microglial cells by the NF-kappaB and MAPK signaling pathway[J].PhytotherRes, 2012,26(12):1948-56.
Inhibitory effect of ferulic acid on neuroinflammation in LPS-activated microglia
WU Jian-liang1, SHEN Min-min1, YANG Shui-xin1, WANG Xiang2, MA Zeng-chun3
(1.HuzhouCentralHospital,HuzhouZhejiang313000,China; 2.TheFirstPeople’sHospitalofHuzhou,Huzhou
Zhejiang313000,China; 3.BeijingInstituteofRadiationMedicine,AcademyofMilitaryMedicalSciences,Beijing100850,China)
Key words: ferulic acid; microglia; neuroinflammation;nitric oxide synthase;cyclo-oxygenase-2; inflammatory factor
