磷酸化蛋白EBP50通过降低ERK1/2活性抑制乳腺癌细胞MCF-7增殖能力
2016-01-11刘虹,马艳,邵荣光
网络出版时间:2014-12-4 13:45网络出版地址:http://www.cnki.net/kcms/doi/10.3969/j.issn.1001-1978.2015.01.013.html
磷酸化蛋白EBP50通过降低ERK1/2活性抑制乳腺癌细胞MCF-7增殖能力
刘虹,马艳,邵荣光
(中国医学科学院北京协和医学院医药生物技术研究所,北京100050)
中国图书分类号:R329.24;R341;R394.2;R737.9;R977.6
摘要:目的探讨磷酸化蛋白EBP50对乳腺癌细胞MCF-7细胞增殖的影响及其潜在机制研究。方法使用pGPU6/Neo载体构建稳定敲除EBP50表达的MCF-7细胞株,使用Western blot检测乳腺癌细胞中EBP50、c-myc、p-ERK1/2以及ERK1/2的表达,使用磺酰罗丹明B染色方法检测乳腺癌细胞增殖。结果使用pGPU6/Neo载体可以稳定地降低MCF-7细胞中EBP50的表达,敲除EBP50可以促进乳腺癌细胞增殖,同时促进c-myc的表达,上调ERK1/2的磷酸化水平,但不影响ERK1/2的表达。结论EBP50可以通过抑制ERK1/2活性,抑制MCF-7乳腺癌细胞增殖能力。
关键词:EBP50; ERK1/2;MCF-7;乳腺癌;增殖;pGPU6/Neo
doi:10.3969/j.issn.1001-1978.2015.01.013
文章编号:
文献标志码:A1001-1978(2015)01-0055-05
收稿日期:2014-09-23,修回日期:2014-11-04
基金项目:国家科技部“重大新药创制”科技重大专项(No 2012ZX09301002-01);国家自然科学基金资助项目(No 31401186);中央级公益性科研院所基本科研业务专项(No IMBF201407)
作者简介:刘虹(1985-),女,博士,助理研究员,研究方向:分子生物学与肿瘤药理学,Tel:010-83166673,E-mail:liuhong_1006@live.com;
通讯作者邵荣光(1957-),男,博士,研究员,研究方向:抗肿瘤药理学,,Tel:010-83166673, E-mail:shaor@imb.pumc.edu.cn
Abstract:Aim To investigate the relationship between phosphoprotein EBP50 and the proliferation of breast cancer in MCF-7 cells. MethodsThe qualified recombinant plasmid sh-EBP50-pGPU6/Neo was transfected into MCF-7 cells with EBP50 knocking down. The expression of EBP50, c-myc, p-ERK1/2, and ERK1/2 was detected by Western blot. The proliferation ability of cells was detected by sulforhodamine B assay. ResultsThe EBP50 knocking down plasmid was constructed successfully. MCF-7 cells with EBP50 knocking down had been established successfully. Knocking down of EBP50 increased the proliferation of MCF-7 significantly, and partially augmented the expression of c-myc and phosphorylation of ERK1/2. However, knocking down of EBP50 did not impact the expression of ERK1/2. ConclusionEBP50 suppresses the proliferation of breast cancer cell through inhibiting the activity of ERK1/2 in MCF-7 cell line.
磷酸化蛋白50[ezrin/radixin/moesin (ERM)-binding phosphoprotein 50,EBP50]是一个多功能连接蛋白,可以通过PDZ-1结构域、PDZ-2结构域及EB结构域与其他蛋白相互结合,参与细胞的多种生物活动。近年来的研究表明,EBP50的表达与乳腺癌的增殖和转移密切相关。EBP50在乳腺癌细胞MDA-MB-231中含量较低,而在乳腺癌细胞MCF-7中表达较高[1];上调EBP50的表达可以降低乳腺癌细胞的增殖及侵袭能力[2]。而一项针对222例乳腺癌患者的研究表明,EBP50的低表达可导致患者存活率降低[3]。以上的文献说明,在乳腺癌中,EBP50具有潜在的抗肿瘤能力,但抗肿瘤能力并未在上皮样乳腺癌细胞MCF-7细胞中得到验证。
有丝分裂原激活激酶(mitogen-activated kinase,MAPK)信号通路在多个物种中高度保守,是重要的细胞增殖与分化的调节信号通路。细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)是MAPK信号通路中的主要作用分子,参与并调控多种肿瘤的发生发展进程[4]。ERK持续活化可以促进信号传导与转录活化因子(signal transducers and activators of transcription,STAT1)降解,从而抑制其促凋亡、抗肿瘤能力[5]。
在本研究中,我们构建了稳定干扰EBP50表达的乳腺癌MCF-7细胞株,并对其增殖能力及潜在作用机制进行探讨。我们发现,EBP50可以抑制上皮样乳腺癌细胞MCF-7的增殖,这种抑制增殖的能力可能是通过抑制ERK1/2的活性实现的。本研究补充了EBP50抑制乳腺癌细胞增殖的分子机制研究,为研究乳腺癌发生机制提供了一定的理论依据。
1材料
1.1实验细胞乳腺癌MCF-7细胞购于中国医学科学基础医学研究所细胞培养中心。MCF-7细胞使用 DMEM培养基,10% FBS培养。每隔2 d传代1次,细胞培养条件为 37 ℃,5% CO2。
1.2主要试剂DMEM细胞培养基、进口血清FBS和胰酶购于美国Gibco公司;Lipofectamine 2000转染试剂购自美国Invitrogen公司;真核表达载体pGPU6/Neo为本实验室保存载体;磺酰罗丹明B试剂盒购于美国Sigma公司;抗人β-actin、EBP50、p-ERK1/2及ERK1/2抗体购自美国Cell Signaling Technology公司;RIPA裂解液、BCA蛋白浓度定量试剂盒购于碧云天生物科技研究所。
2方法
参考文献2.1稳定干扰EBP50表达载体构建实验方法所示`([6]),在线设计针对 EBP50的siRNA序列,逆转录合成有效靶序列的DNA,合成序列为:5′-CACCGACCAGAAACGCAGCAGCAAACTTCAAGAGA GTTTGCTGTGGTTTTTTTG-3′。将合成的小片段DNA经酶切后与载体pGPU6/Neo相连接,用于构建稳定干扰EBP50的稳转细胞系。 2.2稳定干扰EBP50细胞系的建立实验方法`([6]),具体步骤如下:预先在培养皿中培养细胞,使细胞在贴壁24 h后处于指数生长期。将构建好的载体经大提质粒试剂盒提纯后,使用Lipofectamine 2000转染试剂转染进入细胞中,待转染后24 h更换为含有真核筛选抗性的培养基。培养约2周后,将细胞消化、重悬,经梯度稀释后接种于96孔板中,继续培养。当细胞在培养孔中形成单克隆集落时,转移至48孔板中扩大培养。2.3Western blot取适量培养细胞,加入RIPA裂解液后振荡混匀,冰上放置30 min,间或振荡;4 ℃、4 560×g,离心15 min。取上清,使用蛋白定量试剂盒测定蛋白浓度,其具体步骤参照说明书进行。调节蛋白至相同浓度,分装,加入5倍上样缓冲液,96 ℃变性10 min,用于SDS电泳;使用Amersham显色系统显色,经Western blot分析软件测出各条带的光密度值并分析`([6])。 2.4磺酰罗丹明B(sulforhodamine B,SRB)法检测细胞增殖实验参考文献方法`([7]),具体步骤如下:在每孔加入50 μL 4℃预冷的TCA溶液固定细胞,TCA溶液的终浓度为10%。静置5 min移入4℃冰箱中固定1 h,取出,用去离子水冲洗5遍,室温晾干。待96孔板室温下晾干后,每孔加入0.4%的SRB染液70 μL,染色30 min后倒掉染液,用1%乙酸冲洗4次,去除未结合的染料,室温晾干。用100 μL非缓冲Tris-base碱液溶解与细胞蛋白结合的染料,水平摇床上振荡20 min,采用酶标仪540 nm处测定光吸收值。2.5统计学处理实验结果以±s表示,两样本均数间比较采用t检验。
3结果
3.1稳定干扰EBP50的载体建立将合成的小片段DNA经酶切后与载体pGPU6/Neo相连接,转化进大肠杆菌DH5α中进行扩增。然后分别提纯空载体Mock以及sh-EBP50质粒,进行测序,结果如下图所示(Fig 1A),经DNA-MAN软件比对后证明测序结果正确(Fig 1B),说明载体构建成功。

Fig 1Construction of sh-EBP50 plasmid
A: The sequencing results of sh-EBP50 plasmid; B: The comparison results of sh-EBP50 plasmid with application of DNA-MAN.
3.2稳定干扰EBP50的乳腺癌细胞株筛选鉴定在稳定干扰EBP50细胞株形成的单克隆细胞中,挑选6个克隆细胞检测其EBP50的蛋白表达水平,以确定其干扰效果。使用空载体Mock组作为空白对照,实验结果显示,与Mock组相比,单克隆A1、A2、A3、B1、B2以及B3细胞株中的EBP50表达有所降低,其中A3以及B3中EBP50表达的降低差异具有显著性(P<0.01),而A1及 B1中EBP50的降低差异具有显著性(P<0.01),上述结果说明单克隆A1、A3、B1以及B3细胞株是可以稳定干扰EBP50表达的乳腺癌细胞株(Fig 2)。在后续的研究中,我们选择A1细胞株作为研究对象(简称为sh-EBP50)。


A and B: The MCF-7 cells were stably transfected with sh-EBP50 plasmid. The expression of EBP50 was detected by Western blot.**P<0.01vsMock.

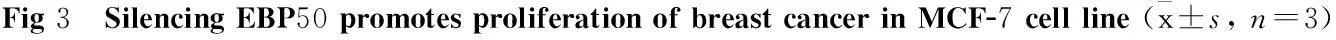
A: The expression of EBP50 was reduced through stably transfecting the sh-EBP50 plasmid. The MCF-7 cells were stably transfected with sh-EBP50 plasmid. The expression of EBP50 was detected by Western blot; B: Silencing EBP50 promotes the proliferation of breast cancer in MCF-7 cell line. The proliferation of sh-EBP50 cells was detected by SRB assay; C: Silencing EBP50 increases the expression of c-myc. The MCF-7 cells were stably transfected with sh-EBP50 plasmid. The expression of c-myc was detected by Western blot.**P<0.01vsMock.
3.3干扰EBP50的表达促进乳腺癌MCF-7细胞增殖 研究表明,EBP50与乳腺癌的增殖密切相关,上调EBP50的表达可以降低乳腺癌细胞MDA-MB-231的增殖能力[1]。因此,我们检测了敲除EBP50后对MCF-7乳腺癌细胞增殖的影响。使用SRB实验结果显示,敲除EBP50(Fig 3A)可以明显地促进乳腺癌细胞的增殖能力(Fig 3B);而Western blot实验显示,敲除EBP50可以促进增殖信号标志分子c-myc的表达(Fig 3C)。以上的实验结果显示,在乳腺癌MCF-7细胞中敲除EBP50可以促进其增殖能力。
3.4干扰EBP50的表达增加乳腺癌细胞中ERK1/2激酶活性ERK包括ERK1与ERK2两种亚型,均可参与并调控多种肿瘤的发生发展进程[4]。在本研究中,干扰EBP50表达后可以上调ERK1和ERK2激酶的磷酸化水平,同时不影响ERK1和ERK2激酶原型的蛋白表达量(Fig 4),上述实验结果说明,敲除EBP50可以激活乳腺癌中ERK1/2的活性。

Fig 4Silencing EBP50 stimulates phosphorylation of

The MCF-7 cells were stably transfected with sh-EBP50 plasmid. The expression of phosphorylation of ERK1/2 and ERK1/2 was detected by Western blot.**P<0.01vsMock.
4讨论
大量研究表明,EBP50参与了乳腺癌的增殖和转移。上调EBP50的表达可以降低乳腺癌细胞的侵袭能力,敲除EBP50可以促进T47D细胞的增殖[2]。此外,EBP50缺失还可以诱导上皮细胞发生上皮间质转化(epithelial-mesenchymal transition,EMT)[8]。而在原发性乳腺癌以及乳腺癌细胞系MDA-MD-231中,EBP50基因发生错义突变[2]。本研究中,我们发现了敲除EBP50可以促进MCF-7细胞增殖,本文的研究结果与上述文献报道相符,本研究补充了EBP50抑制乳腺癌增殖的研究。此外,也有文献表明,EBP50具有一定的促进肿瘤细胞生长与转移的能力。在胃癌细胞中,EBP50在胞质和胞核中均高表达,其表达量与肿瘤的大小呈正相关[9]。在肝细胞癌中,EBP50主要分布于细胞核中,并且可以促进肝细胞癌的生长[10]。在肾细胞癌中,EBP50可以与Ezrin结合形成蛋白质复合物,通过激活Rac1-ARHGEF7信号通路,促进肾细胞癌转移过程[11]。上述文献表明,EBP50对于肿瘤的调控作用具有组织差异性,在乳腺癌中,EBP50主要发挥抑制肿瘤生长和转移的作用,提示EBP50可以作为研究治疗乳腺癌发生发展机制的特异性靶点。
myc基因家族是较早发现的一组癌基因,包括c-myc、n-myc、l-myc。myc基因家族及其产物可促进细胞增殖、永生化、去分化和转化,因而在多种肿瘤形成过程中处于重要地位;而c-myc参与了多种乳腺癌的发生发展进程。肿瘤抑制因子(breast cancer susceptibility gene 1,BRCA1)可以抑制c-myc的转录活性以及其转化活性,当BRCA1缺失可以导致c-myc的过量表达,从而诱导乳腺癌的发生[12]。此外,c-myc还是雌激素受体(estrogen receptor,ER)以及表皮生长因子受体(epidermal growth factor receptor,EGFR)信号通路的下游效应分子,因而c-myc的高表达还是导致乳腺癌对辅助治疗发生耐受的重要原因[13]。上述文献表明,c-myc是乳腺癌细胞增殖过程中重要的生物学标志物,直接反映了乳腺癌细胞的增殖能力,因此在本研究中,我们除了使用SRB染色方式评价乳腺癌细胞的细胞活力以外,还检测了c-myc的蛋白表达量,共同评价EBP50缺失后对乳腺癌细胞增殖能力的影响。
EBP50还参与了其他多种分子介导的肿瘤增殖过程,例如EGFR[14]、Ⅱ型神经纤维瘤分子(neurofibromatosisⅡ,NF2)[15]、血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)[16]等。当EGF刺激激活EGFR诱导MDA-MD-231细胞增殖,过量表达EBP50可以抑制ERK的激酶活性从而抑制MDA-MD-231细胞的增殖[4],说明EBP50的抑制肿瘤作用可能是通过抑制ERK信号通路实现。此外,抑制ERK还可以降低肿瘤细胞的集落形成[17],然而上调EBP50的表达可以通过抑制ERK的激酶活性,降低肿瘤细胞的集落形成[4]。上述研究表明,上调EBP50的表达可以通过降低ERK的活性,从而抑制肿瘤细胞的增殖与集落形成。在本研究中,我们发现EBP50缺失后可以促进乳腺癌的增殖,同时上调ERK1/2的磷酸化水平,我们的实验结果从EBP50缺失的角度证明了EBP50可以通过抑制ERK的活性,继而影响乳腺癌细胞的增殖,补充了EBP50对ERK活性调节的关系,及其对乳腺癌细胞增殖的影响。
综上所述,本研究通过构建稳定干扰EBP50表达的MCF-7乳腺癌细胞株,探讨EBP50对乳腺癌增殖的影响及潜在的机制。本研究的结果说明,EBP50可以抑制乳腺癌细胞MCF-7的增殖能力,这可能是通过抑制ERK1/2的活性实现的。本研究补充了EBP50抑制乳腺癌增殖的研究,为阐明乳腺癌的发生发展机制提供了一定的指导意义。
[1]Yao W, Feng D, Bian W, et al. EBP50 inhibits EGF-induced breast cancer cell proliferation by blocking EGFR phosphorylation [J].AminoAcids, 2012, 43(5): 2027-35.
[2]Pan Y, Wang L, Dai J L. Suppression of breast cancer cell growth by Na+/H+exchanger regulatory factor 1 (NHERF1) [J].BreastCancerRes, 2006, 8(6): R63.
[3]Paradiso A, Scarpi E, Malfettone A, et al. Nuclear NHERF1 expression as a prognostic marker in breast cancer [J].CellDeathDis, 2013, 4: e904.
[4]Zheng J F, Sun L C, Liu H, et al. EBP50 exerts tumor suppressor activity by promoting cell apoptosis and retarding extracellular signal-regulated kinase activity [J].AminoAcids, 2010, 38(4): 1261-8.
[5]Soond S M, Townsend P A, Barry S P, et al. ERK and the F-box protein betaTRCP target STAT1 for degradation[J].JBiolChem, 2008, 283(23): 16077-83.
[6]花芳,余娇娇,孙巍,等. TGF-β/ Smad3信号参与介导TRB3的促肿瘤作用[J]. 中国药理学通报, 2013, 29(3):323-7.
[6]Hua F, Yu J J, Sun W, et al. TGF-β/ Smad3 signaling participates in and mediates tumor progression of TRB3 [J].ChinPharmacolBull, 2013, 29(3): 323-7.
[7]张彩霞, 刘虹, 宫玉艳, 等. SphK1抑制剂SKI II抑制肝癌HepG2细胞周期及细胞侵袭[J]. 药学学报, 2014, 49(2): 204-8.
[7]Zhang C X, Liu H, Gong Y Y, et al. Inhibitions of SphK1 inhibitor SKI II on cell cycle progression and cell invasion of hepatoma HepG2 cells [J].ActaPharmSin, 2014, 49(2): 204-8.
[8]Clapéron A, Guedj N, Mergey M, et al. Loss of EBP50 stimulates EGFR activity to induce EMT phenotypic features in biliary cancer cells [J].Oncogene, 2012, 31(11): 1376-88.
[9]Lv XG1, Lei X F, Ji M Y, et al. Clinical significance of EBP50 overexpression assessed by quantum dot analysis in gastric cancer [J].OncolLett, 2013, 5(6): 1844-8.
[10]Shibata T, Chuma M, Kokubu A, et al. EBP50, a beta-catenin-associating protein, enhances Wnt signaling and is over-expressed in hepatocellular carcinoma [J].Hepatology, 2003, 38(1): 178-86.
[11]Hsu Y H, Lin W L, Hou Y T,et al. Podocalyxin EBP50 ezrin molecular complex enhances the metastatic potential of renal cell carcinoma through recruiting Rac1 guanine nucleotide exchange factor ARHGEF7 [J].AmJPathol, 2010, 176(6): 3050-61.
[12]Wang Q, Zhang H, Kajino K, et al. BRCA1 binds c-Myc and inhibits its transcriptional and transforming activity in cells [J].Oncogene, 1998, 17(15): 1939-48.
[13]Butt A J, McNeil C M, Musgrove E A, et al. Downstream targets of growth factor and oestrogen signalling and endocrine resistance: the potential roles of c-Myc, cyclin D1 and cyclin E [J].EndocrRelatCancer, 2005, 12 Suppl 1: S47-59.
[14]Goel A, Prasad A K, Parmar V S, et al. 7,8-Dihydroxy-4-methylcoumarin induces apoptosis of human lung adenocarcinoma cells by ROS-independent mitochondrial pathway through partial inhibition of ERK/MAPK signaling [J].FEBSLett, 2007, 581(13): 2447-54.
[15]James M F, Beauchamp R L, Manchanda N, et al. A NHERF binding site links the betaPDGFR to the cytoskeleton and regulates cell spreading and migration [J].JCellSci, 2004, 117(Pt 14): 2951-61.
[16]Maudsley S, Zamah A M, Rahman N, et al. Platelet-derived growth factor receptor association with Na(+)/H(+) exchanger regulatory factor potentiates receptor activity [J].MolCellBiol, 2000, 20(22): 8352-63.
[17]Bessard A, Frémin C, Ezan F, et al. RNAi-mediated ERK2 knockdown inhibits growth of tumor cellsinvitroandinvivo[J].Oncogene, 2008, 27(40): 5315-25.
Phosphoprotein EBP50 suppresses proliferation of breast cancer
by inhibiting activity of ERK1/2 in MCF-7 cell line
LIU Hong, MA Yan, SHAO Rong-guang
(DeptofOncology,InstituteofMedicinalBiotechnology,ChineseAcademyofMedicalSciences&
PekingUnionMedicalCollege,Beijing100050,China)
Key words: EBP50; ERK1/2; MCF-7; breast cancer; proliferation; pGPU6/Neo
