脑室给予不同剂量的Capsazepine对LPS致大鼠发热过程的影响
2016-01-11BibekKhanal,施蓓,PujaPaudel等
网络出版时间:2014-12-4 13:45网络出版地址:http://www.cnki.net/kcms/doi/10.3969/j.issn.1001-1978.2015.01.009.html
脑室给予不同剂量的Capsazepine对LPS致大鼠发热过程的影响
Bibek Khanal,施蓓,Puja Paudel, 张璠, 秦鑫,曹宇
(中国医科大学基础医学院生理学教研室,辽宁 沈阳110001)
中国图书分类号:R-332;R322.81;R392.11;R441.3;R977.6
摘要:目的在大鼠侧脑室内给予不同剂量的瞬时受体电位香草酸受体1(transient receptor potential vanilloid 1,TRPV1)拮抗剂Capsazepine,观察对LPS致热过程的影响。方法在侧脑室内预先给与3种剂量Capsazepine,随之腹腔给与LPS致热。在腹腔内埋植发射子遥测体温变化过程,同时应用荧光测定法检测下丘脑细胞内钙离子浓度的变化,Western blot方法检测TRPV1表达水平。结果随着Capsazepine剂量增大,LPS致大鼠发热水平升高,下丘脑细胞内钙离子浓度减少,TRPV1表达水平降低。结论Capsazepine作用于大鼠下丘脑,可使LPS诱导的发热水平提高,此效应可能与TRPV1的作用有关。
关键词:发热;瞬时受体电位香草酸受体1;Capsazepine; LPS; 下丘脑;Ca`(2+)
doi:10.3969/j.issn.1001-1978.2015.01.009
文章编号:
文献标志码:A1001-1978(2015)01-0035-04
收稿日期:2014-09-21,修回日期:2014-10-11
基金项目:国家自然科学基金主任基金(No 31340074);辽宁省自然科学基金(No 201202277)
作者简介:Bibek Khanal(1986-),男,硕士,助教,研究方向:体温生理,E-mail:bibekcmu@163.com
通讯作者曹宇(1963-),女,博士,教授,研究方向:体温生理,,E-mail:caoycmu@163.com
Abstract:AimTo observe the effects of the transient receptor potential vanilloid receptor 1(TRPV1) antagonist Capsazepine on the LPS-induced fever process. MethodsThree doses of Capsazepine were respectively injected into rats’ lateral ventricles before the intraperitoneal injection of LPS caused fever. An emitter was implanted inside the rat’s abdominal cavity to monitor the body temperature changes during the fever process. Then the changes of calcium ion in the hypothalamus were detected by fluorescence and the expressions of TRPV1 protein were detected by Western blot. ResultsThe higher dosage of Capsazepine was injected, the higher the level of LPS-induced fever was, and the lower the concentration of calcium ion in the hypothalamus as well as the TRPV1 expressions were. ConclusionCapsazepine could increase the level of fever induced by LPS via acting on the rats’ hypothalamus. This effect might be related to the functions of TRPV1.
发热是临床上常见的体征。一般认为病原体引起的机体发热是由于外源性致热原进入体内,促进单核巨噬细胞释放内生致热原,内生致热原直接或间接作用于体温调节中枢,进而使体温调节中枢的调定点上移,引起机体出现调节性体温升高。临床和实验研究表明,哺乳类动物和人在发热时体温很少超过一定水平,例如,人体的体温升高极少超过41℃,说明体内存在着调控体温的自限机制,然而,目前其详细的分子生物学机制还不清楚。机体实现对体温的调控关键的一环是对温度的感受性,近年来人们发现了在多种感受器中存在的一组被称为瞬时受体电位(transient receptor potential,TRP)的通道蛋白具有传递感觉信息的功能,其中,有的成员具有温度感受特性,在组织细胞中可能起“温度换能器”的功能[1],这一发现极大地推动了对机体温度感知生物学机制的研究。
瞬时受体电位香草酸受体1 (transient receptor potential vanilloid 1, TRPV1)是TRP家族成员之一,是一种对Ca2+有高渗透性的非选择性阳离子通道[2],可被温热等多种理化因素激活,例如,大于43℃的热刺激、辣椒素和质子等[3],在整体水平发热条件下,炎性介质等会降低激活该通道的温度阈值[4]。TRPV1在哺乳动物组织中表达部位广泛,现已证明,在下丘脑体温调解中枢也有TRPV1的表达[5],然而,关于TRPV1在体温调节机制中的作用目前还不清楚,根据其对高温刺激的敏感性推测可能与机体发热时的限热机制有关。
Capsazepine是TRPV1通道特异性颉抗剂,被广泛应用于痛觉传入机制的研究[6]。本实验通过采用脂多糖(lipopolysaccharide,LPS)复制大鼠发热模型,在侧脑室内给予不同剂量的capsazepine,观察发热时相的变化、下丘脑TRPV1表达量及细胞内钙离子浓度变化,为进一步深入探讨TRPV1通道在机体发热过程中的作用提供实验依据。
1材料与方法
1.1实验动物及分组选用清洁级♂SD大鼠,体质量250~280 g,基础体温(38.1±0.2)℃,由中国医科大学实验动物中心提供。饲育室室温(20±2)℃,相对湿度40%~60%,昼夜光照节律12 h ∶12 h,单笼饲养,自由进食水。
将实验动物随机分成6组,每组6只:① 正常对照组(Control):侧脑室(intracerebroventricular, icv)注射溶剂10μL(溶剂为10%无水乙醇+10% Tween80 + 80%生理盐水),30min后腹腔注射(intraperitoneal injection,i.p.)生理盐水4 mL·kg-1;② Capsazepine组(CPZ):icv CPZ10 μL(Sigma, USA),含量为0.02 mg·kg-1,30 min后i.p.生理盐水4 mL·kg-1;③ LPS致热组(LPS):icv溶剂10 μL,30 min后i.p.LPS 80 μg·kg-1(20 mg·L-1,用生理盐水配制)(Sigma, USA);④、⑤及⑥组分别icv CPZ 0.01、0.02和0.03 mg·kg-1,均调至为10 μL。30 min后i.p.LPS 4 mL·kg-1。
1.2脑室插管给药将大鼠用10%水合氯醛(3 mL·kg-1)腹腔麻醉,然后将其头部固定于立体定位仪上,暴露前囟。参照大鼠脑图谱,用探针在颅骨表面冠状缝下0.8 mm,矢状缝旁开1.5 mm处钻孔,将外径为1 mm的引导管垂直插入一侧侧脑室内,深度4.0 mm,用牙科水泥固定导管,按照上述实验步骤给药。
1.3记录体温大鼠麻醉后在腹正中线行剖腹术,将无线遥测发射子固定于腹壁上。术后动物单笼饲养,恢复1周后进行实验。使用无线BW-200数据采集系统记录体温变化。实验均在早8时开始,首先每隔5 min测量体温1次,共测量3次,取其平均值记为基础体温。然后各组在相应处理后开始监测体温变化,每隔5 min自动记录体温一次,直到实验结束。
体温反应指数(therm1 response index,TRI)的测算按照Milton法[7],计算发热曲线与体温基线之间的面积,其中,体温值为纵坐标,1.5 cm代表0.5℃,以时间值为横坐标,1.5 cm代表1 h。TRI可以反映发热效应的强度。
1.4下丘脑细胞内钙离子浓度([Ca2+]i)测定实验结束后迅速分离出下丘脑组织,制备成单细胞悬液,保持细胞存活率在95%以上。然后用Fura-2/AM避光孵育负载,采用日立F-4500型荧光双波长分光光度计,激发波长340 nm,发射波长510 nm,测定荧光值,根据公式计算[Ca2+]i。[Ca2+]i=Kd×(R-Rmin)/(Rmax-R)×F2min /F2max( nmol·L-1)。Kd值为224 nmol·L-1,R为荧光值,F2 min为加入EGTA 后测得的荧光值,F2max为加入Triton X-100后测得的荧光值,[Ca2+]i 为nmol·L-1。

2结果
2.1各实验组大鼠体温的变化Fig 1显示各组在经过不同实验因素处理后,体温变化值(ΔT, ℃)随时间的变化曲线。给予大鼠腹腔注射LPS可引起体温升高,在4 h左右大鼠体温达到高峰,之后体温开始下降;在发热期间LPS组在各观察时间点与Control组比较体温变化差异均有显著性(P<0.05)。当预先经侧脑室注入capsazepine,30 min后腹腔注射LPS后,大鼠体温也明显升高,在4h左右体温达到高峰,与Control组和CPZ组各采样时间点比较体温变化值差异有显著性(P<0.05);与LPS组相比,0.02 mg·kg-1剂量组和 0.03 mg·kg-1剂量组自2 h以后,发热过程中的各时间点ΔT值均升高(P<0.05),且在4~5.5 h期间,体温持续保持在高峰水平。0.01 mg·kg-1剂量在发热起始阶段略高于LPS组,但各时间点ΔT与LPS组比较无显著性差异(P>0.05)。在CPZ 3个剂量组中随着CPZ给药剂量的增加,发热幅度呈相应增加,但在0.02 mg·kg-1剂量组和 0.03 mg·kg-1剂量组之间差异没有显著性(P>0.05)。Control组与CPZ组比较各时间点ΔT差异无显著性(P>0.05)。


Tab 1为各组在实验过程中体温变化最大值(ΔTmax)及体温反应指数TRI4及TRI7。在预先应用capsazepine的3个剂量组中,体温变化最大值由高至低的顺序为0.03 mg·kg-1剂量组、 0.02 mg·kg-1剂量组和0.01 mg·kg-1剂量组。TRI4及TRI7也呈现相似的变化趋势。
2.2下丘脑神经元[Ca2+]i的变化图2显示了不同组下丘脑细胞内[Ca2+]i水平。可见,Control组为(186.1±5.8)nmol·L-1,CPZ组为(178.0±2.4)nmol·L-1,两组之间差异没有显著性。LPS组为(275.2±5.8)nmol·L-1显著高于Control组和CPZ组,预先给与CPZ,再行LPS诱导发热的各实验组中0.01、0.02和 0.03 mg·kg-1剂量组测定值分别为(249.9±2.6)、(234.5±5.9)和(232.7±7.1)nmol·L-1,与LPS组比较明显降低(P<0.05),且表现为CPZ剂量依赖性下降。下丘脑[Ca2+]i的变化与体温的变化成正相关(r=0.942,P<0.01)Y=133.94+72.07X。
Tab 1Maximum change of temperature and thermal response

GroupΔTmax(℃)TRI4(cm2)TRI7(cm2)Control0.10±0.010.20±0.060.38±0.02LPS1.09±0.11*9.09±0.09*21.33±0.19*CPZ0.11±0.020.35±0.390.63±0.430.01mg·kg-1CPZ+LPS1.11±0.10*10.42±0.15*23.27±0.85*0.02mg·kg-1CPZ+LPS1.37±0.03*#12.07±0.36*#30.63±0.48*#0.03mg·kg-1CPZ+LPS1.42±0.02*#12.54±0.38*#30.65±0.40*#
*P<0.05vscontrol;#P<0.05vsLPS
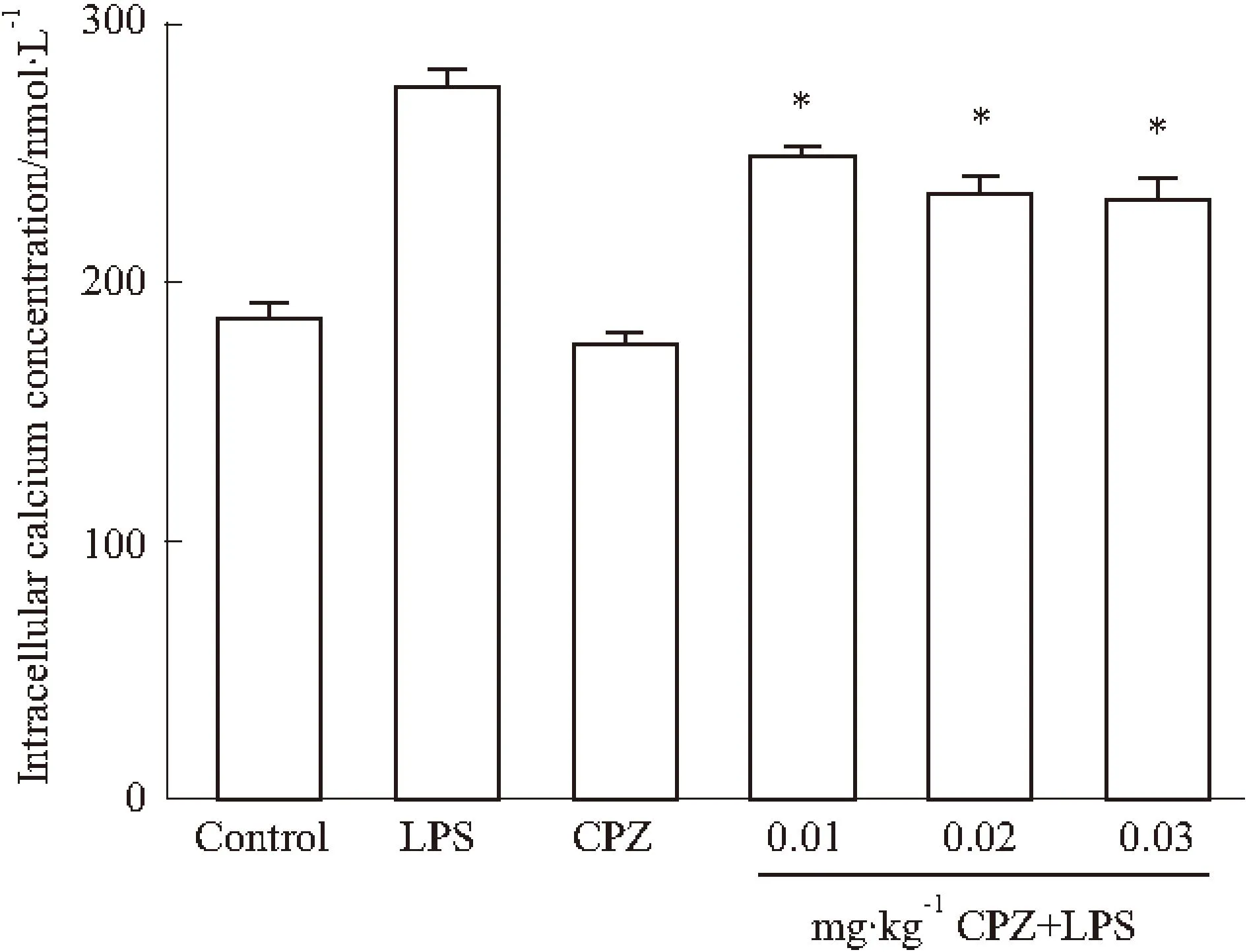
Fig 2 Concentration of intracellular calcium in hypothalamus

*P<0.05vsLPS group
2.3下丘脑组织TRPV1表达的变化Fig 3 显示了Western blot方法检测各实验组下丘脑组织中TRPV1的表达水平并进行图像定量分析的结果。可见,LPS组在给予LPS后TRPV1表达量明显高于Control组(P<0.05),而预先侧脑室注入CPZ后再给予LPS,0.01 mg·kg-1组与LPS组的表达水平差异无显著性,但0.02和0.03 mg·kg-1组的表达水平明显低于LPS组(P<0.05)。 Control组与CPZ组之间比较无显著性差异。
3讨论

Fig 3Expression of TRPV1 in hypothalamus in

A: Western blot result; B: Comparative analysis of Western blot result.**P<0.01vsgroup LPS
哺乳动物和人的体温在自主性体温调节和行为性体温调节下能够保持相对稳定的状态,但在某些生理或病理条件下可出现体温升高,而过高的体温不利于机体进行各种正常的功能活动,甚至引起不可逆性损伤。关于机体是如何调控发热时体温上限的,许多学者做了大量的研究,现已证实体内存在一些体温负调节物质,例如,精氨酸加压素(arginine vasopressin, AVP)、促黑素细胞激素(α-melanocyte stimulating hormone, α-MSH)、脂皮质蛋白(lipocortin)、膜联蛋白A1(annexin A1)等[8],但迄今为止,调控这些物质作用的生物学机制仍不清楚。TRP是近年来发现的主要与多种感受功能有关的膜通道蛋白家族,主要包括TRPC、TRPV、TRPM、TRPML、TRPP、TRPA、TRPN等7个亚族,其中,TRPV1、TRPV2、TRPV3、TRPV4、TRPM2、TRPM4、TRPM5、TRPM8和TRPA1具有温度感受特性,它们被激活的温度阈值各不相同。TRPV家族成员之一的TRPV1主要表达于背根神经节、三叉神经节的小型及中型神经细胞等感觉传入部位[9,10],多与伤害性热痛觉的产生相关联。最近有研究报道,在下丘脑体温调节中枢有TRPV1的表达。有研究发现[11],TRPV1的激活因素之间存在着相互作用,在pH 7.4条件下,热激活TRPV1的阈值是43℃;在酸性条件时,激活阈值向低温方向移动。用转染TRPV1的HEK293细胞实验证明,当温度>43℃时, TRPV1通道被激活,而在炎症介质存在下,TRPV1通道激活的温度阈值可降低到37℃左右[12]。TRPV1的温度感受特性提示其在下丘脑体温调节中枢很可能参与发热过程中的体温调节,特别是对限制体温升高的幅度具有重要的意义。
进一步探讨下丘脑TRPV1参与体温调节的生物作用,其特异性激动剂或拮抗剂的应用是重要的研究手段。Capsazepine是一种合成的辣椒素的类似物,能特异性阻断TRPV1通道,被广泛应用于TRPV1通道的研究中。其抑制钙离子内流的IC50为0.65 mmol·L-1。生物测定显示,capsazepine能有效的拮抗TRPV1激动剂辣椒素和树胶脂毒素(Resiniferatoxin, RTX)的作用,包括钙离子的内流、培养神经元的全细胞电流及辣椒素激活的单通道电流、反射性的去极化和神经肽的释放等[13]。
作为细菌内毒素的LPS是革兰阴性细菌细胞壁的主要成分,是一种常见的外源性致热原,它能够刺激机体产生内生性致热原,从而使体温升高。本实验通过给予大鼠腹腔注射外源性致热原LPS,复制大鼠发热模型,观察到大鼠腹腔注射LPS后,体温明显升高,给予不同剂量的capsazepine后,体温升高幅度呈现剂量依赖性增加,且在较高浓度时,发热高峰持续时间延长,同时检测到与之伴随的细胞内Ca2+浓度降低,提示了TRPV1可能参与发热过程的体温调节。实验还观察到应用capsazepine后,TRPV1表达量减少,说明capsazepine不仅能阻断TRPV1通道,可能还具有抑制TRPV1表达或抑制TRPV1向细胞膜转运的作用。以上的实验结果为深入研究体温调节中枢TRPV1的生理功能,明确机体体温调节自限现象的生物学机制奠定了基础,提供了重要的实验依据。期待随着系统的研究,取得对这一生命现象更深刻的认识。
参考文献:
[1]Mishra S K,Tisel S M, Orestes P, et al. TRPV1-lineage neurons are required for thermal sensation[J].EMBOJ, 2011, 30(3):582-93.
[2]Sokabe T, Tominaga M. Molecular mechanisms underlying thermosensation in mammals[J].BrainNerve, 2009, 61(7):867-73.
[3]Szallasi A, Blumberg P M. Vanilloid (Capsaicin) receptors and mechanisms[J].PharmacolRev, 1999, 51(2): 159-212.
[4]Cortriqht D N, Szallzsi A. Biochemical pharmacology of the vanilloid recepter TRPV1[J].EurJBiochem, 2004,271(10):1814-9.
[5]Trinklein N D, Murray J I, Hartman S J, et al. The role of heat shock transcription factor 1 in the genome-wide regulation of the mammalian heat shock response[J].MolBiolCell, 2004, 15(3):1254-61.
[6]Rohm B, Holik A K, Somoza M M, et al. Nonivamide, a capsaicin analog, increases dopamine and serotonin release in SH-SY5Y cells via aTRPV1-independent pathway[J].MolNutrFoodRes, 2013,57(11):2008-18.
[7]Milton A S, Wendlandt S. Effects on body temperature of prostaglandins of the A, E and F series on injection into the third ventricle of unanaesthetized cats and rabbits[J].JPhysiol, 1971,218(2):325-36.
[8]Roth J. Endogenous antipyretics[J].ChinicaActa,2006, 37 (1): 13-24.
[9]Smith W L, DeWitt D L, Garavito R M. Cyclooxygenases: structural, cellular, and molecular biology[J].AnnuRevBiochem, 2000,69: 145-82.
[10]王胜兰,戴毅,刘晓丽,等. TRP通道与偏头痛[J]. 中国药理学通报,2013,29(10):1352-4.
[10]Wang S L,Dai Y,Liu X L,et al. TRP channel and migracine[J].ChinPharmacolBull, 2013,29(10):1352-4.
[11]Nakagawa H, Hiura A. Capsaicin, transient receptor potential(TRP) protein subfamilies and the particular relationship between capsaicin receptors and small primary sensory neurons[J].AnatSciInt, 2006, 81(3): 135-55.
[12]Tominaga M. Molecular mechanisms of thermosensation[J].NipponYakurigakuZasshi, 2004, 124(4): 219-27.
[13]Alexandru B, Bogdan A, Ulrich K, et al. Cooling inhibits capsaicin induced currents in cultured rat dorsal root ganglion neurons[J].NeurosciLett, 2002, 317(6): 131-4.
Capsazepine in rats′ lateral ventricles: Effect of different doses on LPS-induced fever
BIBEK Khanal,SHI Bei, PUJA Paudel, ZHANG Pan, QIN Xin, CAO Yu
(DeptofPhysiology,ChinaMedicalUniversity,Shenyang110001,China)
Key words: fever; transient receptor potential vanilloid receptor 1; Capsazepine; LPS; hypothalamic; Ca2+
