SIRT1在丙戊酸对肝细胞毒性中的作用研究
2016-01-11侯相瑜,金晶,李宏亮等
网络出版时间:2014-12-4 13:45网络出版地址:http://www.cnki.net/kcms/doi/10.3969/j.issn.1001-1978.2015.01.008.html
◇论著◇
SIRT1在丙戊酸对肝细胞毒性中的作用研究
侯相瑜,金晶,李宏亮,柳睿,范晓梅,黄民
(中山大学药学院药物代谢与药动学实验室,广东 广州510006)
中国图书分类号:R322.47;R329.2;R394.2;R971.6;R977.6
摘要:目的探讨沉默信息调节因子1(SIRT1)在丙戊酸对肝脏HepG2细胞毒性中的作用。方法在HepG2细胞中,丙戊酸(2 mmol·L`(-1))孵育6、12、24、48 h,或丙戊酸(0.5、1、2 mmol·L`(-1))分别孵育48 h,通过Western blot方法检测丙戊酸对SIRT1蛋白表达的影响;通过瞬时转染SIRT1表达质粒和si-SIRT1,采用SRB方法,观察对SIRT1基因进行过表达和抑制后,丙戊酸对HepG2细胞毒性的改变情况。结果丙戊酸对SIRT1的表达有抑制作用,且具有时间和剂量依赖性。过表达SIRT1后,HepG2细胞对丙戊酸的毒性敏感性下降,转染前后IC50分别为(4.025±0.47)、(10.87±1.50) mmol·L`(-1);而干扰SIRT1后,HepG2细胞对丙戊酸的毒性敏感性增加,转染前后IC50分别为(1.938±0.16)、(0.663±0.05) mmol·L`(-1)。结论丙戊酸可抑制SIRT1的蛋白表达,并且过表达SIRT1可拮抗丙戊酸对肝细胞的毒性作用。
关键词:丙戊酸;SIRT1;蛋白表达;肝细胞毒性;HepG2;细胞生长
doi:10.3969/j.issn.1001-1978.2015.01.008
文章编号:
文献标志码:A1001-1978(2015)01-0031-04
收稿日期:2014-09-25,修回日期:2014-11-12
基金项目:国家自然科学基金资助项目(No 81102886);广东省医学科研基金资助项目(No B2012077)
作者简介:侯相瑜(1989-),男,硕士生,研究方向: 药物代谢及药物基因组学,E-mail: houxiangyu1111@126.com;
通讯作者金晶(1980-),女,博士,讲师,研究方向: 临床药理学,,Tel: 020-39943034,E-mail: jinjing@mail.sysu.edu.cn; 黄民(1963-),男,博士,教授,博士生导师,研究方向:临床药理学与药物基因组学,,Tel: 020-39943011,E-mail: huangmin@mail.sysu.edu.cn
Abstract:AimTo detect the role of sirtuin1 (SIRT1) in hepatotoxity caused by valproic acid (VPA). MethodsThe changes of SIRT1 expression of HepG2 cells were detected by Western blot. And then SIRT1 plasmid or siRNA was transfected to construct SIRT1 overexpressed or knocked-down HepG2 cells. Furthermore, SRB assays were taken to observe the changes of viability of these cells exposed to VPA. ResultsVPA suppressed SIRT1 expression in a time and dose-dependent manner. SIRT1 overexpression showed a protective effect to the cytotoxicity caused by
沉默信息调节因子1(silent information regulator 1, SIRT1)是Ⅲ类组蛋白去乙酰化酶Sirtuin家族的一个亚型,可以催化组蛋白和非组蛋白的赖氨酸残基的乙酰基的裂解[1]。研究表明[2-4],SIRT1使靶蛋白去乙酰化在抗氧化应激、抗炎、抗凋亡,调节线粒体生物合成及代谢,重塑、学习、记忆等过程中发挥作用。
丙戊酸(valproic acid,VPA)作为一线抗癫痫药物,是特发性全面性癫痫及癫痫全面性发作的首选用药,也是部分性发作、继发性发作及脑病性发作的次选用药[5]。然而个体差异大、不良反应多是困扰VPA临床用药的关键问题。它引起的不良反应主要包括:肝毒性、体重增加、胃肠道不适、血液系统毒性、致畸等[6]。VPA主要通过增加抑制性神经递质γ-氨基丁酸(GABA)水平而起到抗癫痫的作用[6]。此外,有报道称VPA可以抑制Sirt1,而导致小鼠胚胎发育畸形[7]。研究表明[8],VPA可以通过影响ABCG1、CPT1A等转运体和TGF-β等转录因子抑制HepG2的生长,而这种抑制作用是否与SIRT1有关目前还不清楚。因此,本文在细胞水平观察SIRT1在VPA对肝脏HepG2细胞毒性中的作用。
1材料与方法
1.1药品和试剂VPA、烟酰胺购买自Sigma公司,SIRT1一抗、β-actin一抗、GAPDH一抗,羊抗兔二抗、羊抗鼠二抗购买自CST公司,HepG2细胞株购买自中国科学院上海生科院细胞资源中心,DMEM培养基、胎牛血清购买自Hyclone公司,Lipofectamine 2000购买自Invitrogen公司,SIRT1过表达质粒购买自Addgene公司,siRNA购买自广州锐博公司,Kiton Red S (SRB) 购买自阿法埃莎(天津)化学有限公司
1.2细胞培养及转染HepG2细胞培养于FBS体积分数为0.1的DMEM培养液中,放置于37°C、5% CO2、90%相对湿度培养箱中。待细胞密度至70%,根据Lipofectamine 2000转染试剂的说明书转染pcDNA 3.1-SIRT1、pcDNA 3.1空载质粒或者siRNA进入细胞中。
1.3药物处理用培养基将VPA和烟酰胺稀释成梯度浓度,待细胞密度至70%时给药或在质粒转染后24 h、siRNA转染60 h后给药,实验重复 3次。
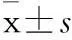
2结果
2.1VPA抑制SIRT1表达呈现时间依赖性如Fig 1所示,随着VPA(2 mmol·L-1)与肝HepG2细胞孵育的时间的延长,细胞内SIRT1蛋白表达不断下降,而在12、24、48 h明显降低(P<0.05)。提示VPA可以抑制SIRT1表达,并呈现时间依赖性。
2.2VPA抑制SIRT1表达呈现剂量依赖性不同剂量的VPA(0.5、1、2 mmol·L-1)和1 mmol·L-1阳性药物烟酰胺(nicotinamide,NAM)与HepG2细胞孵育48 h。如Fig 2所示,与对照组相比,随着VPA剂量的增加,SIRT1蛋白表达明显降低(P<0.05);2 mmol·L-1VPA比阳性药物1 mmol·L-1烟酰胺的抑制效果更明显。说明VPA可以抑制SIRT1表达,并呈现剂量依赖性。
2.3SIRT1高表达拮抗VPA引起的细胞毒性在HepG2细胞中分别转染SIRT1表达质粒pcDNA 3.1-SIRT1及其空载质粒pcDNA 3.1 24 h后,加入1 mmol·L-1的VPA孵育48 h。由Fig 3A可知,Western blot结果显示,与正常组相比,SIRT1过表达组SIRT1含量上调,而且VPA对SIRT1过表达组细胞仍有抑制作用。然后在SIRT1正常组和过表达组中分别加入梯度浓度的VPA孵育48 h后检测抑制率,IC50分别为(4.025±0.47)、(10.87±1.50) mmol·L-1(P<0.05),说明SIRT1高表达可拮抗VPA对细胞的毒性作用(Fig 3B)。

Fig 1 Western blot analysis of SIRT1 expression in HepG2 incubated
*P<0.05,**P<0.01vs0 h
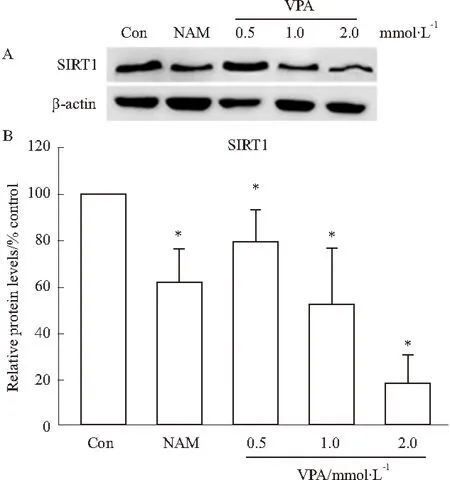
Fig 2 Western blot analysis of SIRT1 expression in
*P<0.05vscon

Fig 3Over expression of SIRT1 on VPA cytotoxity. (A) SIRT1 expression in HepG2 cells after transfected with SIRT1 plasmid and incubated with VPA. (B) The inhibitory effect of VPA on HepG2 cells and SIRT1 over-expressed HepG2 cells(n=3)
*P<0.05vsCon
2.4SIRT1 siRNA使细胞对VPA的毒性敏感性增加在HepG2细胞中分别转染SIRT1 siRNA及其对照si-con 24 h后,加入1 mmol·L-1的VPA孵育48 h。由Fig 4A可知,Western blot结果显示,SIRT1 siRNA成功干扰SIRT1表达,且VPA进一步抑制SIRT1低表达细胞中SIRT1表达。然后在SIRT1正常组和低表达组的细胞中加入梯度浓度的VPA孵育48 h后检测抑制率,IC50分别为(1.938±0.16),(0.663±0.05) mmol·L-1(P<0.05),说明干扰SIRT1表达使HepG2细胞对VPA的毒性敏感性增加(Fig 4B)。
3讨论
VPA是广谱高效的抗癫痫药物,然而限制其使用的一个重要缺陷就是它的肝毒性。研究表明[9-10],VPA的代谢产物为2-丙基-4-戊烯酸(2-propyl-4-pentenoic acid,4-ene VPA);VPA和4-ene VPA在线粒体基质或胞质中经中链脂酰辅酶A合成酶活化为VPA-CoA和4-ene VPA-CoA,在胞质中的复合物经肉碱棕榈酰转移酶转移进入线粒体基质,从而抑制线粒体β氧化,同时消耗大量辅酶A和肉毒碱,导致肝细胞脂质沉积和空泡变性,是VPA导致肝毒性的主要原因。VPA也可以通过抑制Nrf2、诱导Keap1而诱导内质网应激,造成细胞损伤[11]。
据报道,VPA的治疗窗为40~100 mg·L-1(300~700 μmol·L-1),而VPA的代谢存在较大的个体差异,血药浓度范围可以达到14.6~135 mg·L-1(100~1000 μmol·L-1)[12]。本课题的研究发现,VPA在1 mmol·L-1和2 mmol·L-1的剂量时会明显抑制SIRT1的表达,而且这种抑制作用也呈现时间依赖性,同时对肝HepG2细胞产生明显的毒性。这个实验结果提示我们临床上观察到的VPA的肝毒性可能与抑制SIRT1蛋白表达有关。

Fig 4Knockdoun of SIRT1 on VPA cytoxity (A) SIRT1 expression in HepG2 cells after transfected with SIRT1 siRNA and incubated with VPA. (B) The inhibitory effect of VPA on HepG2 cells and SIRT1 knocked-down HepG2 cells(n=3)
*P<0.05vsSi-con
为验证SIRT1在VPA引发毒性中的作用,通过转染SIRT1表达质粒,观察VPA对细胞生长的影响,结果显示,SIRT1高表达的HepG2细胞中VPA的生长抑制作用减弱,提示SIRT1对VPA引发的肝细胞毒性中起到保护作用。然后通过转染SIRT1 siRNA,构建低表达SIRT1的HepG2细胞。结果显示,VPA对SIRT1低表达细胞生长的抑制作用与正常表达细胞相比更明显,提示SIRT1低表达使细胞对VPA的毒性敏感性增加。SIRT1可以通过使肝细胞中LXR、PGC-1α、PPARα、FOXO1等核受体和转录因子去乙酰化而发挥促进脂肪酸氧化、抑制脂肪酸生成、调节胆固醇平衡、抗凋亡抗氧化应激等作用,从而起到肝保护作用[2-3,13]。VPA抑制SIRT1后,这些核受体与转录因子的活性及其调控的下游有肝保护作用的基因表达是否发生改变,值得继续深入研究。
综上所述,本研究阐明了VPA可明显下调SIRT1的蛋白表达水平,并引发细胞毒性。为使用SIRT1激动剂预防或治疗VPA引发肝毒性存在潜在可能提供理论依据。
参考文献:
[1]Shin-ichiro I, Christopher M A, Matt K, Leonard G. Transcriptional silencing and longevity protein Sir2 is an NAD-dependent histone deacetylase [J].Nature, 2000, 403(17): 795-800.
[2]Anne B, Sweeney L B, Sturgill J F, et al. Stress-dependent regulation of FOXO transcription factors by the SIRT1 deacetylase [J].Science, 2004, 303(5666): 2011-15.
[3]Kim E, Kho J, Kang M, Um S J. Active regulator of SIRT1 cooperates with SIRT1 and facilitates suppression of p53 activity [J].MolCell, 2007, 28(2): 277-90.
[4]刘宁,寻禹,李亚丹,等. 丙戊酸通过CREB上调脑红蛋白并保护N2a细胞免受双氧水诱导的神经损伤[J]. 中国药理学通报, 2014, 30(05): 619-23.
[4]Liu N, Xun Y, Li Y D, et al. Valproic acid induces neuroglobin protein by CREB and protects N2a cells against H2O2-induced neurotoxicity [J].ChinPharmacolBull, 2014, 30(05): 619-23.
[5]Glauser T, Ben-Menachem E, Bourgeois B, et al. ILAE treatment guidelines: evidence-based analysis of antiepileptic drug efficacy and effectiveness as initial monotherapy for epileptic seizures and syndromes [J].Epilepsia, 2006, 47(7): 1094-120.
[6]Chateauvieux S, Morceau F, Dicato M, Diederich M. Molecular and therapeutic potential and toxicity of valproic acid [J].JBiomedBiotechnol, 2010, 303: 1-18.
[7]Di Renzo F, Broccia M L, Giavini E, Menegola E. VPA-related axial skeletal defects and apoptosis: A proposed event cascade [J].ReprodToxicol, 2010, 29(1): 106-12.
[8]Ji Q, Shi X L, Lin R, et al. Participation of lipid transport and fatty acid metabolism in valproate sodium-induced hepatotoxicity in HepG2 cells [J].ToxicolinVitro, 2010, 24(4): 1086-91.
[9]Nanau R M, Neuman M G. Adverse drug reactions induced by valproic acid [J].ClinBiochem, 2013, 46(15): 1323-38.
[10]Silva M F, Aires C C, Luis P B, et al. Valproic acid metabolism and its effects on mitochondrial fatty acid oxidation: A review [J].JInheritMetabDis, 2008, 31(2): 205-16.
[11]Palsamy P, Bidasee K R, Shinohara T. Valproic acid suppresses Nrf2/Keap1 dependent antioxidant protection through induction of endoplasmic reticulum stress and Keap1 promoter DNA demethylation in human lens epithelial cells [J].ExpEyeRes, 2014, 121: 26-34.
[12]Silva M F, Selhorst J, Overmars H, et al. Characterization of plasma acylcarnitines in patients under valproate monotherapy using ESI-MS/MS [J].ClinBiochem, 2001, 34(8): 635-8.
[13]Chang H, Guarente L. SIRT1 and other sirtuins in metabolism [J].TrendsEndocrinMet, 2014, 25(3): 138-45.
Valproic acid suppresses SIRT1 inducing hepatotoxicity
HOU Xiang-yu, JIN Jing, LI Hong-liang, LIU Rui, FAN Xiao-mei, HUANG Min
(LabofDrugMetabolismandPharmacokinetics,SchoolofPharmaceuticalSciences,
SunYat-senUniversity,Guangzhou510006,China)
VPA, and the IC50before and after transfection was (4.025±0.47) and (10.87±1.50) mmol·L-1respectively. Moreover, transfection of SIRT1 siRNA sensitized HepG2 cells to VPA, and the IC50before and after transfection was (1.938±0.16) and (0.663±0.05) mmol·L-1respectively. ConclusionVPA suppressed SIRT1 expression in HepG2 cells and overexpression of SIRT1 could reduce cytotoxicity induced by VPA.
Key words: valproic acid; sirtuin 1; protein expression; hepatotoxity; HepG2; cell viability
欢 迎 咨 询!欢 迎 投 稿!
投稿信箱:zgylxtb8@163.com; 咨询信箱:zgylxtb@163.com
