马铃薯接骨木镰刀菌的分子检测
2016-01-09
马铃薯接骨木镰刀菌的分子检测
高云飞1,闵凡祥1,王文重1,杨帅1,魏琪1,吕典秋1*,郭梅1,吕涛2
(1.黑龙江省农业科学院植物脱毒苗木研究所,黑龙江哈尔滨150086;2.黑龙江省经济作物技术指导站,黑龙江哈尔滨150090 )
摘要:接骨木镰刀菌是马铃薯干腐病的主要致病菌,给黑龙江省马铃薯造成了一定的经济损失。采用马铃薯干腐病引物LDJ1对马铃薯干腐病、马铃薯晚疫病、马铃薯早疫病、马铃薯黑痣病的致病菌的ITS序列进行测定,只有马铃薯干腐病菌扩增出560 bp特异性片段。再分别对接骨木镰刀菌、燕麦镰刀菌和茄病镰孢变种的ITS序列进行BLAST比对分析,针对接骨木镰刀菌设计了特异引物L2,扩增特异性产物为278 bp,该引物所建立的PCR检测体系可检测DNA含量在50 pg/μL以上的目的基因。
关键词:马铃薯;ITS;PCR;接骨木镰刀菌;分子检测
马铃薯干腐病是由镰刀菌(Fusarium spp.)引起的一种真菌病害,可以导致薯块高度腐烂,是马铃薯贮藏的主要病害之一[1]。在窖藏过程中,由于窖温湿度适宜,干腐病会大面积发生,往往会导致“烂窖”,一般年份损失率约15%~35%,重灾年高达50%左右,已经给中国马铃薯产业造成了巨大的经济损失[2]。目前,马铃薯的干腐病已经成为影响黑龙江省马铃薯储藏和商品品质的重大病害,导致其商品薯率大幅下降,严重影响其经济和食用价值。不同国家报道的病原菌的优势种有所不同,但报道接骨木镰刀菌(F. sambucinum)为主要病原的文献较多[3-5]。据研究,它也是黑龙江省马铃薯干腐病主要致病菌之一[6]。依据镰刀菌的rDNA区域保守序列设计特异性引物对马铃薯干腐病主要病原菌进行了分子鉴定,并在此基础上进行常规PCR检测体系的建立,从而确立一套马铃薯干腐病的快速、灵敏、准确的分子检测体系,这些研究成果对于黑龙江省马铃薯真菌病害检测水平的提高具有重要的实践指导意义。
1 材料与方法
1.1供试菌株
本试验所用菌株(表1)均由农业部脱毒马铃薯种薯质量监督检验测试中心(哈尔滨)提供,马铃薯块茎样品2012年来自于重庆地区。

表1 供试菌株采集信息Table 1 Information of Fungi strains collected
1.2主要试剂和仪器
DNA提取主要药品:液氮、酚、氯仿、异戊醇、无水乙醇、β-琉基乙醇、EDTA。
PCR及电泳所用药品:TaKaRa公司的Premix Taq,琼脂糖Agarose购自Spain,TaKaRa公司的10x Loading Bufer、DNA Marker-DL2000。
主要仪器:PCR仪(TaKaRa公司),德国Sigma高速冷冻离心机,金属水浴锅,北京六一仪器厂DYY-8C型稳压稳流电泳仪、水平电泳槽,凝胶成像系统Alpha Innotech。
1.3主要方法
改良的SDS具体方法:
将单孢培养物接种于PDA培养基上,培养7 d以上,用接种针挑去菌丝。取50 mg菌丝在液氮中研磨成粉末状,转入1.5 mL离心管中。加750 μL DNA抽提液(1 mol/L Tris-HCl pH 8.0,0.5 mol/L EDTA,pH 8.0,l0% SDS,0.7313 g NaCl),20 μL β-巯基乙醇,充分混匀,68℃恒温金属浴60 min。加入750 μL酚ϑ氯仿ϑ异戊醇(25ϑ24ϑ1),震荡混匀,4℃,13 000 r/min离心15 min。取上清,再加入等体积的氯仿ϑ异戊醇(24ϑ1),轻轻颠倒均匀,13 000 r/min,4℃离心15 min。取上清,加入-20℃中存放的异丙醇,其体积是上清液的2.5倍,放置沉淀2 h以上。然后在13 000 r/min离心15 min,后弃上清,留取沉淀物,再用70%的酒精洗涤沉淀3次,将沉淀物晾干,晾干后加入100 μL无菌水溶解沉淀。
常规PCR鉴定:
在ITS区采用特异检测马铃薯镰刀菌干腐病引物,扩增片段长度560 bp[7]。
Forward Primer LDJ1: 5’-GTAAAAGTCGTAACAAGGTC-3’
Reverse Primer LDJ1: 5’-AAGTTCAGCGGGTATTC-3’
利用Primer 5.0软件设计一对接骨木镰刀菌特异性扩增引物,拟扩增片段长度278 bp。
Forward Primer L2: 5’-CGCCAGAGGACCCAAACT-3’
Reverse Primer L2: 5’-GCCGCCAGAAGGGCAGAGC-3’
以上两对引物均由上海生工合成。
反应体系:
Premix 12.5 μL
Forward Primer LDJ1 1.0 μL
Reverse Primer LDJ1 1.0 μL
DNA模板1.0 μL
ddH2O补足至25 μL
引物LDJ1反应条件:
预变性94℃90 s(变性94℃35 s,退火56℃30 s,延伸72℃60 s)变性至延伸共35个循环,最后一次延伸72℃5 min,PCR扩增产物4℃冰箱保存备用或送测序公司进行测序。
引物L2反应条件:
预变性94℃90 s(变性94℃35 s,退火59℃30 s,延伸72℃60 s)变性至延伸共35个循环,最后一次延伸72℃5min,PCR扩增产物4℃冰箱保存。
电泳检测:
PCR扩增产物用1.0%浓度的琼脂糖凝胶在1×TAE下电泳,利用凝胶成像仪在紫外光下检测并拍照。
2 结果与分析
2.1引物LDJ1特异性鉴定
由图1可知,在马铃薯干腐病的DNA特异性检测中,镰刀菌引物扩增出特异性条带560 bp,而没有其他马铃薯病害非特异性条带出现。
2.2引物L2特异性检测
由图2可知,在接骨木镰刀菌的DNA特异性检测中,唯有接骨木镰刀菌扩增出特异性条带278 bp,而其他镰刀菌没有扩增出特异性条带。

图1 特异性鉴定Figure 1 Specific identification
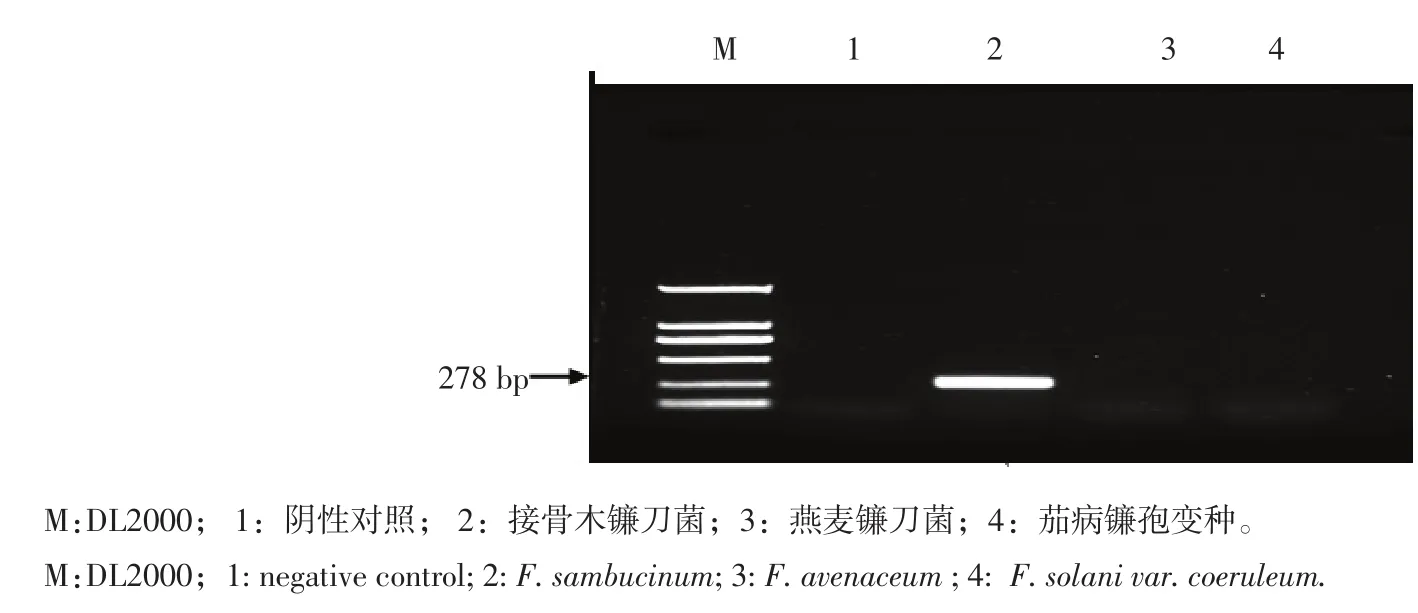
图2 接骨木镰刀菌特异性鉴定Figure 2 Specific identification of F.sambucinum

图3 引物L2的灵敏度鉴定Figure 3 Sensitivity of the primer L2
2.3引物L2灵敏度检测
由图3可以看出,引物对镰刀菌DNA的检测灵敏度随着DNA浓度的降低而降低,在50 pg/μl时达到最低,此后无目的条带出现,因此,针对该引物所建立的PCR检测体系可检测含量在50 pg/μl以上的目的基因。
2.4镰刀菌的PCR检测应用
采用改良的SDS法从马铃薯块茎中提取总DNA,在经过晾干后溶解在无菌水中,用1%的琼脂糖凝胶电泳进行DNA的检验。从图4中看出DNA除了12、13、18号样品未满足PCR分离基因的要求,其余样品均能够满足要求,可以用于进一步的试验。
采用镰刀菌rDNA-ITS特异引物LDJ1对马铃薯块茎进行PCR检测,其中5个样品为无发病症状薯块的DNA,扩增结果如图5所示。另外有10个样品为有发病症状薯块的DNA,扩增结果如图6所示。

图4 马铃薯块茎DNA的提取Figure 4 Extraction of DNA from potato tuber
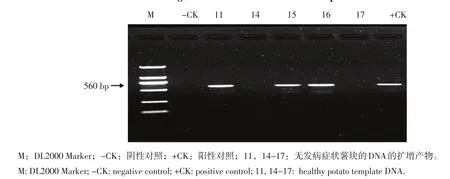
图5 引物LDJ1对无病症的薯块的检测应用Figure 5 Detection application of healthy tuber by primer LDJ1
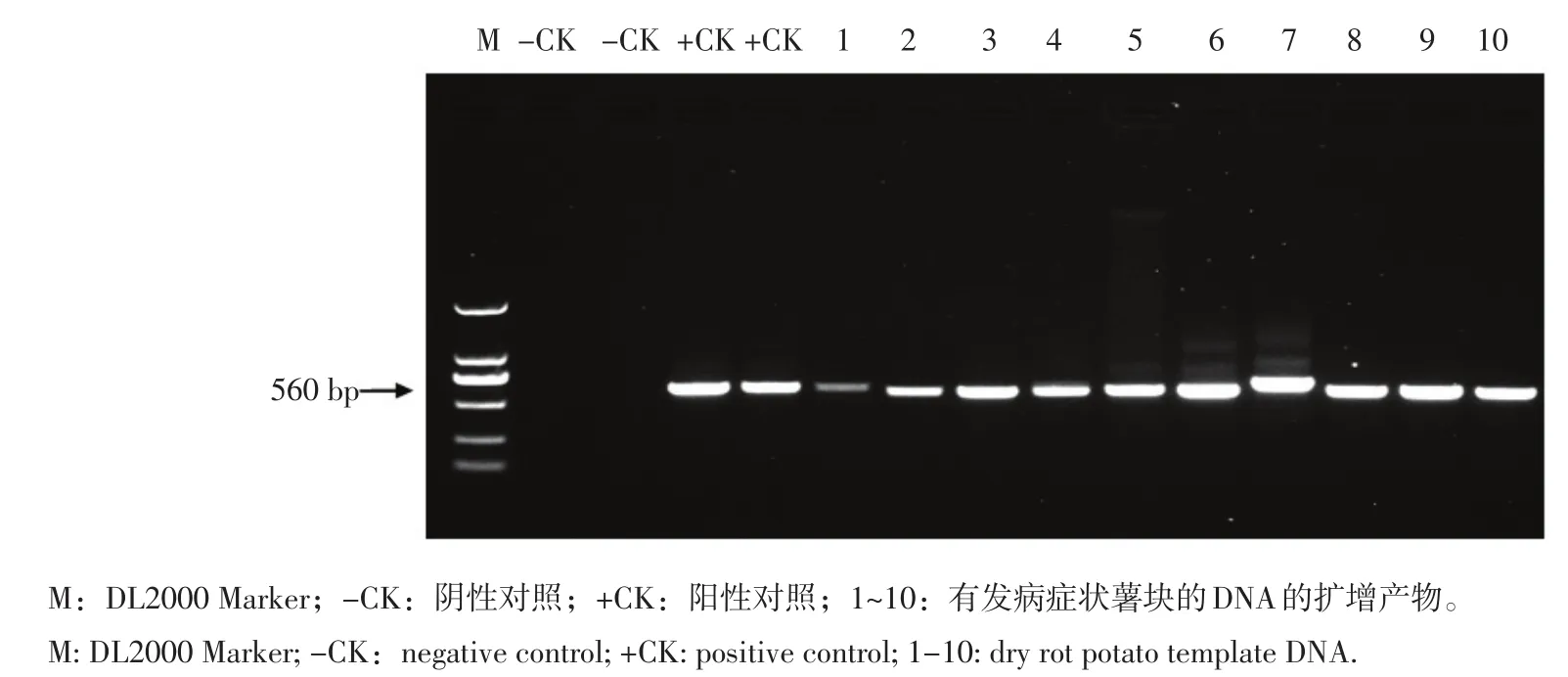
图6 引物LDJ1对有病症的薯块的检测应用Figure 6 Detection application of diseased tuber by primer LDJ1
从图5和图6可以看出,对于没有发病薯块也可以扩增出560 bp的特异性片段,这表明在这些薯块中已经有镰刀菌的侵染,特异引物在马铃薯块茎进行检测时,对于具有干腐病症状的块茎都可以扩增出大小为560 bp的特异性条带,由此结果可以看出,以此特异性引物为基础的PCR检测方法,可以直接用于检测发病组织中的镰刀菌。
2.5接骨木镰刀菌的PCR检测应用
从图7可看出,特异引物L2在对马铃薯块茎进行检测时,对15个薯块的DNA进行扩增,结果表明有8号和16号2个薯块的DNA中可以扩增出大小为278 bp的特异性条带,这表明接骨木镰刀菌为此次检测的部分薯块的致病菌,由以上结果看出,此特异性引物为基础的PCR检测方法,可以直接用于检测发病组织中的接骨木镰刀菌。
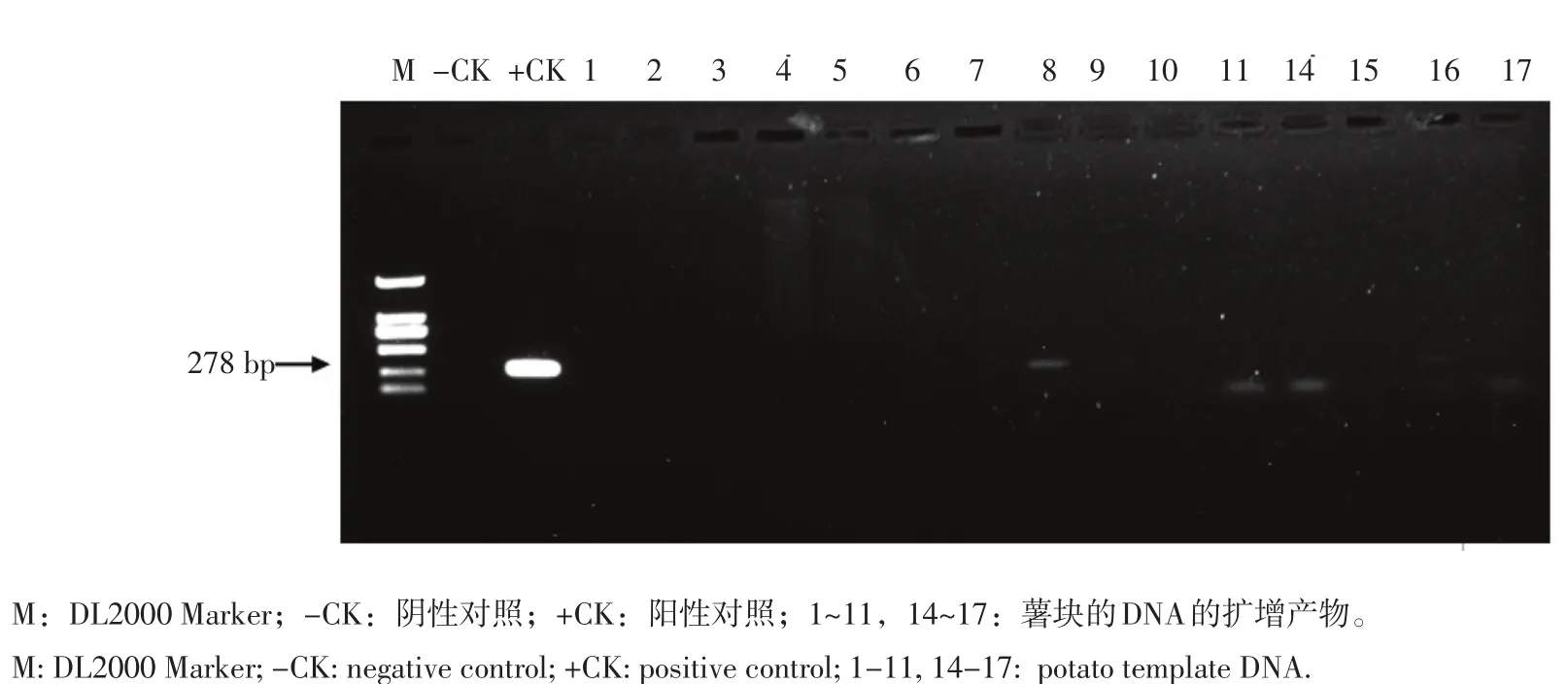
图7 引物L2对薯块的检测应用Figure 7 Detection application of tuber by primer L2
3 讨论
现在对镰刀菌的鉴定还是以形态学为主要手段,但是由于其有一定的局限性,受培养环境等因素影响。形态学鉴别既费时费力又程序繁琐,而且菌株状态易于发生变化,培养物状态也具有多样性,说明镰刀菌鉴定检测的工作复杂性,而且不宜从发病初期的植株或块茎中分离鉴定出镰刀菌,耗时长,难以做到对病害的早期检测。因此,建立快速、准确的马铃薯真菌病害检测技术具有重要的实际意义。
随着近几年的发展,分子生物学鉴定分类也迅速发展,对ITS序列的研究不仅能解决许多形态学分类研究中的疑难问题,而且在对植物病原菌的检测和鉴定上起到了事半功倍的效果。利用ITS序列设计特异性引物来鉴定镰刀菌种以在小麦、棉花、玉米等作物上有成功例子,但国内鲜有报道[8-10]。本研究采用了改良的SDS方法,提取效果与张宝俊等[11]、韩峰等[12]报道相一致,进行扩增时也验证LDJ1所建立的PCR检测体系可检测含量在1 pg/μL以上的目的基因的可行性。特异性引物L2可对接骨木镰刀菌进行检测,在L2所建立PCR检测体系可检测含量在50 pg/μL以上的目的基因,可初步用于窖藏马铃薯接骨木镰刀菌干腐病的检测。同时满足后续研究的进行,进一步完善马铃薯镰刀菌检测鉴定技术的研究工作,为马铃薯干腐病早期检测奠定理论基础。本研究使用了接骨木镰刀菌、燕麦镰刀菌和茄病镰孢变种等这三种菌,数量有限,有待于后续研究完善。
[参考文献]
[1]李金花,王蒂,柴兆祥,等.甘肃省马铃薯镰刀菌干腐病优势病原的分离鉴定[J].植物病理学报, 2011, 41(5): 456-463.
[2]陈彦云.宁夏西吉县马铃薯贮藏期病害调查及药剂防治研究[J].耕作与栽培, 2007, 3(4): 15-16.
[3] Boyd A W E. Potato storage diseases [J]. Review of Plant Pathology, 1972, 51: 298- 321.
[4]Hanson L E, Schwager S J. Sensitivity to thiabendazole in Fusarium species associated with dry rot of potato [J]. Phytopathology, 1996, 86: 378-384.
[5] Theron D J. Fusarium dry rot of potatoes: etiology, epidemiology, toxicity and control [D]. Bloemfontein: The University of the Orange Free State, 1999.
[6]闵凡祥,王晓丹,胡林双,等.黑龙江省马铃薯干腐病菌种类鉴定及致病性[J].植物保护, 2010, 36(4): 112-115.
[7]李凤兰,蒋先锋,史丽娟,等.两株马铃薯干腐病病原菌的分离和鉴定[J].作物杂志, 2013(4): 125-128.
[8] Doohan F M, Parry D W, Jenkinson N P. et al. The use of species-specific PCR-based assays to analyze Fusarium ear blight of wheat [J]. Plant Pahtology, 1998, 47: 197-205.
[9] Morrica S, Ragazzi A, Kasuga T, et al. Detection of Fusarium oxysporium f sp. vasinfectum in cotton tissue by polymerise chain reaction [J]. Plant Pahtology, 1998, 47: 486-494.
[10] Murillo I, Cavallarin L, Segundo B S. The development of a rapid PCR assay for detection of Fusarium moniliforme [J]. European Journal of Plant Pahtology, 1998, 104: 301-311.
[11]张宝俊,李志刚,张家榕,等. 4种镰刀菌基因组DNA提取方法的比较研究[J].安徽农业科学, 2008, 36(31): 13599-13560.
[12]韩峰,李凤兰,李学湛,等.马铃薯干腐病主要致病菌DNA提取方法比较[J].中国农学通报, 2011, 27(1) : 209-213.
Molecular Detection for Fusarium sambucinum on Potato
GAO Yunfei1, MIN Fanxiang1, WANG Wenzhong1, YANG Shuai1, WEI Qi1, LU Dianqiu1*, GUO Mei1, LU Tao2
( 1. Virus-free Seedling Research Institute, Heilongjiang Academy of Agricultural Sciences, Harbin, Heilongjiang 150086, China; 2. Heilongjiang Economic Crop Technical Guidance Station,Harbin, Heilongjiang 150090, China)
Abstract:F. sambucinum is the main pathogenic bacterium bringing about potato dry rot and causes economic losses to some extent in Heilongjiang Province. Tests were made to the ITS sequence of Fusarium spp., Phytophthora infestans,Alternaria solani and Rhizoctonia solani using the primer LDJ1, and 560 bp specific fragment was amplified only from Fusarium spp.. Comparative analysis of BLAST was conducted on ITS sequence of F. sambucinum, F. avenaceum, and F. solani var.coeruleum, and the specific primer L2 was designed. The target band amplified was 278 bp. The sensitivity of PCR detection system based on this primer was 50 pg/μLfor the target gene.
Key Words:potato;ITS;PCR;F. sambucinum;molecular detection
*通信作者(Corresponding author):吕典秋,博士,研究员,主要从事马铃薯栽培生理和生物技术研究,E-mail: small_potatoes@126.com。
作者简介:高云飞(1984-),男,助理研究员,主要从事马铃薯真菌病害研究。
基金项目:科技部国际科技合作计划项目(2010DFA32810);科技部“十二五”农村领域国家科技计划研究课题(2012BAD06B02);哈尔滨市科技攻关计划项目(2010AA6CN071);现代农业产业技术体系专项资金资助(CARS-10-P14);黑龙江省农业科技创新工程。
收稿日期:2014-03-01
文章编号:1672-3635(2015)01-0028-05
文献标识码:B
中图分类号:S532
