铜离子鳌合物人工抗原的合成与鉴定
2015-12-30付世杰秦保亮王亚楠王自良河南科技学院河南新乡453003
孙 勇,付世杰,秦保亮,王亚楠,王自良(河南科技学院,河南 新乡 453003)
铜离子鳌合物人工抗原的合成与鉴定
孙 勇,付世杰,秦保亮,王亚楠,王自良★
(河南科技学院,河南 新乡 453003)
该研究为获得铜离子螯合物人工抗原,采用异硫氰酯法,以异硫氰酸苄基乙二胺四乙酸(ITCBE)为双功能螯合剂,将载体蛋白牛血清白蛋白(BSA)和卵清蛋白(OVA)分别与Cu2+偶联,得到人工抗原(Cu2+-ITCBE-BSA)和包被原(Cu2+-ITCBE-OVA)。通过紫外分光光度法(UV)和电感耦合等离子体原子发射光谱法(ICP-AES),以及变性聚丙烯凝胶电泳(SDS-PAGE)和免疫学检测(Immunoassay)的方法对所获得的免疫原进行鉴定。结果显示获得人工抗原的浓度为9.21 mg/mL;Cu2+的含量为16.83 g/mL;免疫小鼠间接ELISA效价达1∶51 200以上,阻断ELISA检测Cu2+-EDTA的半数抑制浓度(IC50)为36.73 ng/mL,为抗铜离子单克隆抗体(mAb)的进一步研制奠定了基础。
铜离子;抗原合成;鉴定
随着城市化进程的不断加快和工业化水平的迅速提升,对重金属铜的应用越来越广泛,然而由于生产、生活所致的铜污染也日趋加重,通过食物链的富集对人和动物产生了极大的危害[1]。虽然铜是人和动物生命活动中许多重要酶的组成部分,但是过量的铜可引起急性或慢性中毒,并对一些水生动物有致死性威胁[2-3]。因此,定期监测食品及环境中铜的含量对保持人类健康和减少水产养殖损失具有重要意义。检测铜离子的传统方法多为物理化学仪器检测法,如原子吸收光谱分析法(AAS)、电感耦合等离子发射光谱法(ICP-AES)、原子荧光法(AFS)、紫外可见分光光度法(UV)、阳极溶出伏安法(ASV)和X射线荧光光谱法(XRF)等[4],这些检测方法虽然灵敏度高,精确性好,但是所需仪器价格昂贵并且需要专业培训,往往仅限于实验室人员操作而不适合大范围普及。而免疫学检测方法则有着快速、简便、特异、敏感、价格低廉的优点。因此,本研究旨在获得铜离子螯合物人工抗原,为抗铜离子单克隆抗体(mAb)的进一步研制奠定基础。
1.1 主要材料异硫氰酸苄基乙二胺四乙酸(ITCBE),购自上海同仁化学研究所;HEPES、BSA、OVA、弗氏完全佐剂、弗氏不完全佐剂、TMB、TEMED、SDS、巯基乙醇,均购自Sigma公司;透析袋、考马斯亮蓝R-250、丙烯酰胺、N,N-甲叉双丙烯酰胺、TRIS、过硫酸铵、甘氨酸,均购自北京索莱宝科技有限公司;羊抗鼠酶标二抗(GaMIgG-HRP),购于上海华美生物工程公司。
1.2 方法
1.2.1 人工抗原的合成 采用异硫氰酯法[5],称取5 mg ITCBE溶于0.5 mL二甲基亚砜(DMSO)中形成鳌合剂溶液;称取8.5 mg CuSO4·5H2O溶于200 μL pH 7.0的HEPES缓冲液(10 mm/L)中形成Cu2+溶液。将鳌合剂溶液逐滴加入Cu2+溶液中,室温条件下摇床反应12 h,获得Cu2+-ITCBE鳌合物半抗原。称取20 mg BSA溶于1 mL HEPES缓冲液中形成20 mg/mL的载体蛋白溶液。将1 mL载体蛋白溶液逐滴加入Cu2+-ITCBE鳌合物半抗原溶液中,边滴加边搅拌,并用NaOH调节pH至9.0,室温条件下摇床反应24 h,然后移入透析袋中透析12 d,即获得Cu2+-ITCBE-BSA完全抗原[6-8]。人工包被原Cu2+-ITCBE-OVA的合成方法同于人工免疫原的合成方法。
1.2.2 人工抗原的鉴定
1.2.2.1 人工抗原的浓度测定 以0.01 M pH 7.4的PBS缓冲液做为空白对照,1 mg/mL标准BSA溶液做为阳性对照,用微量蛋白核酸测定仪在280 nm波长下测定人工抗原中的蛋白浓度。
1.2.2.2 ICP-AES检测人工抗原中Cu2+的浓度 以PBS缓冲液做为空白对照,将免疫原Cu2+-ITCBE-BSA用PBS缓冲液稀释50倍,用电感耦合等离子体原子发射光谱仪测定人工抗原中Cu2+的含量[9]。
1.2.2.3 人工抗原紫外光谱(UV)鉴定 以PBS缓冲液做为空白对照,1 mg/mL BSA溶液、1 mg/mL ITCBE-BSA溶液为阳性对照,并将免疫原Cu2+-ITCBE-BSA用PBS缓冲液稀释成1 mg/mL。在波长220~400 nm范围内进行紫外扫描[10]。
1 材料与方法
1.2.2.4 人工抗原SDS-PAGE鉴定 根据BSA的分子量(6.62×104),选择5%浓缩胶,12%分离胶,浓缩胶电压为40 V,分离胶电压为60 V,点样量10 μg/孔,对BSA、Cu2+-ITCBE-BSA进行垂直SDS-PAGE电泳鉴定[11]。
1.2.2.5 多抗血清(pAb)免疫学鉴定 选取6~8周龄雌性Balb/C小鼠5只,采用背部皮下4点注射法进行免疫,免疫剂量为60 μg/只。免疫5次,每次间隔3周。最后1次免疫后10 d断尾采血,3 000 r/min离心5 min,收集血清备用。
1.2.2.5.1 效价测定 采用间接ELISA法测定pAb效价:将2 μg/mL Cu2+-ITCBE-OVA包板,50 μL/孔,4℃过夜;PBST洗板3次,用5%猪血清封闭,200 μL/孔,37℃孵育1 h;洗涤3次,从第一孔加pAb,用封闭液倍比稀释,50 μL/孔,设阴性对照(NC)和空白对照(BC),37℃孵育15 min;洗涤3次,每次间隔3 min,加HRP标记的羊抗鼠IgG(1:1 000),50 μL/孔,37℃孵育30 min;洗涤5次,每次间隔3 min,加酶底物TMB显色,50 μL/孔,室温避光反应5 min;加入2 mol/L H2SO4终止反应,50 μL/孔。测定各孔A450nm值,以待测孔A450nm≥NCA450nm的2.1倍(P/N≥2.1),判为阳性孔[12]。
1.2.2.5.2 敏感性鉴定 采用阻断ELISA法鉴定pAb敏感性:从第一孔加1 000 ng/mL的Cu2+-EDTA标准液,倍比稀释至倒数第二孔,50 μL/孔,最后一孔做阳性对照;加A450nm为1.0的pAb 50 μL/孔,设NC和BC,37℃孵育15 min;洗涤3次,每次间隔3 min,加酶标二抗,50 μL/孔,37℃孵育30 min;洗涤5次,每次间隔3 min,加酶底物TMB显色,50 μL/孔,室温避光反应5 min;加入终止液终止反应,50 μL/孔。测定各孔A450nm值,计算抑制率(B/ B0%,B0为Cu2+-EDTA 0浓度时的吸光值,B为Cu2+-EDTA不同浓度时的吸光值)。以B/B0%为纵坐标,不同浓度抑制剂的对数值为横坐标,绘制Cu2+-EDTA对Cu2+-EDTA pAb的抑制曲线,根据曲线趋势推导回归方程,计算pAb对Cu2+-EDTA的50%抑制浓度(IC50),并以IC50作为敏感度[13]。
2 结果与分析
2.1 紫外分光光度法测定抗原浓度结果利用Pharmacia蛋白质核酸分析仪在280 nm波长下测定抗原Cu2+-ITCBE-BSA的蛋白浓度为9.21 mg/mL。
2
2.2 ICPP--AAEESS测定抗原中CCuu22++含量结果稀释50倍后的样品读数结果见表1。由表1中数据计算可知,Cu2+-ITCBE-BSA和Cu2+-ITCBE-OVA中Cu2+的含量分别为16.83 μg/mL、6.42 μg/mL。

表1 ICP-AES测定样品中Cu2+含量Table1 The Cu2+concentration in sample assay with ICP-AES
2.3 紫外扫描载体蛋白和人工抗原图谱由图1可知,BSA在277 nm处出现最大吸收峰;ITCBE-BSA在274 nm处出现最大吸收峰;Cu2+-ITCBE-BSA在271 nm处出现吸收峰。峰值的改变证明了人工抗原合成成功。
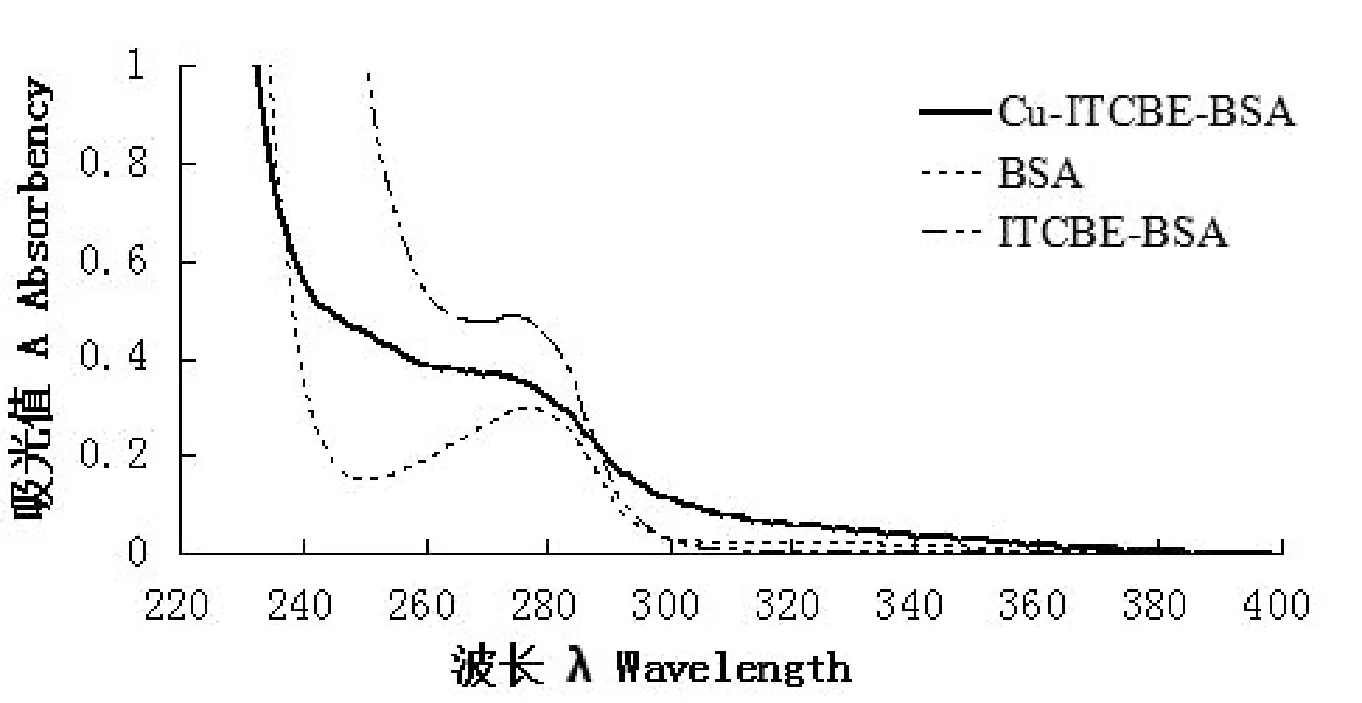
图1 BSA及人工抗原的紫外光谱图Fig.1 The UV spectra of BSA and artificial antigen
2.4 人工抗原SDS--PPAAGGEE电泳鉴定结果图2结果显示,人工抗原Cu2+-ITCBE-BSA相对于BSA,分子量有所增加。说明BSA与Cu2+-ITCBE偶联成功。
2.5 多抗血清的免疫学鉴定结果
2.5.1 间接ELISA效价测定 结果见表2。由表2可知,免疫的5只小鼠血清抗体效价均达到了10-4,说明获得了较好的免疫效果。
2.5.2 Cu2+-EDTA pAb敏感性鉴定 表3显示,5只小鼠的抗血清均产生了抑制,其中3号小鼠的抑制效果最好。由图3可知,3号小鼠的线性回归方程为y=-37.529x+108.74,R2为0.9512,IC50为36.73 ng/mL。
3 结论与讨论
Cu2+结构简单,无免疫原性,且带有电荷,能与机体内生物分子发生不可逆反应而导致机体中毒。因此必须通过螯合剂将Cu2+连接到载体蛋白上制备人工抗原。目前,常用的大分子双功能鳌合剂主要包括EDTA及其衍生物和DTPA及其衍生物[14]。本试验选择异硫氰酸苄基乙二胺四乙酸(ITCBE)作为双功能鳌合剂,Cu2+与ITCBE螯合后形成一个稳定的六齿状的配位化合物,与载体蛋白结合后能产生很好的免疫原性[15]。
关于Cu2+与双功能螯合剂ITCBE合成半抗原的反应条件关系到人工抗原的结合比。ITCBE在弱碱环境下能更好的螯合金属离子,而Cu2+在碱性条件下生成氢氧化铜沉淀。本试验采用pH=7.0的反应条件使Cu2+与ITCBE螯合,取得了较好的效果,是否还有更好的反应条件仍需进一步研究。
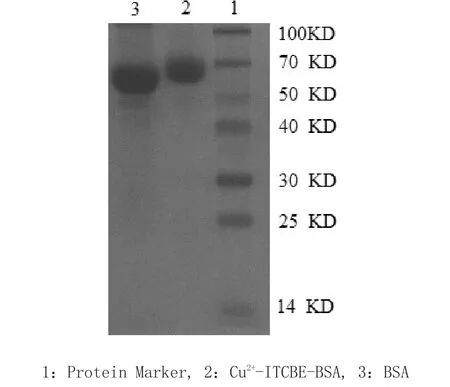
图2 免疫原Cu2+-ITCBE-BSA的SDS-PAGE鉴定Fig.2 Identification of Cu2+-ITCBE-BSA conjugation by SDS-PAGE

表2 小鼠抗Cu2+-ITCBE血清效价Table2 ELISA titers of antiserum against Cu2+-EDTA

表3 小鼠抗血清对Cu2+-EDTA的抑制效价Table3 Inhibitive titers of antiserum against Cu2+-EDTA

图3 小鼠多抗血清对Cu2+-EDTA的阻断ELISA抑制曲线Fig.3 The inhibitive curve for mouse 3 pAb to Cu2+-EDTA by blocking ELISA
[1]敖子强,熊继海,王顺发,等.畜禽养殖废弃物重金属铜的污染治理及循环利用[J].广东农业科学,2011,17:127-129.
[2]徐晨晨,王宝维.水禽微量元素营养需要量的研究进展[J].中国家禽,2013,20:39-42.
[3]谭树华,欧阳铭.铜对水生动物生理及毒性研究进展[J].江西农业学报,2010,22(11):139-142.
[4]王磊,胡骁飞,张改平,等.食品中重金属检测方法研究进展[J].中国公共卫生,2012,10:1390-1392.
[5]韩盈盈,李小兵,孔涛,等.重金属镉离子人工抗原的合成与鉴定[J].吉林农业大学学报,2013,2:188-191.
[6]蒋云,严文静,刘丽强,等.重金属汞螯合物人工抗原的合成与鉴定[J].食品科学,2011,32(7):54-57.
[7]王自良,张海棠,王艳荣,等.氯霉素多克隆抗体的制备及其免疫学特性鉴定[J].中国农学通报,2006,22(6):5-9.
[8]刘功良,王菊芳,李志勇,等.铅螯合物人工抗原的制备与鉴定[J].生物技术通报,2009,11:158-162.
[9]王琳,王娟.ICP-AES法在食品微量元素测定中的应用[J].微量元素与健康研究,2015,1:55-56.
[10]候迪波,张坚,黄平捷,等.基于紫外-可见光光谱的水质分析方法研究进展与应用[J].光谱学与光谱分析,2013,7:53-55.
[11]汪家政,范明,刘川,等.蛋白质技术手册[M].北京:科学出版社,2001:77-100.
[12]G·C·霍华德,M·R·凯瑟.抗体制备与使用实验指南[M].张权庚,张玉祥,丁卫等,译.北京:科学出版社,2010:63-68.
[13]姜金庆,张海棠,范国英,等.19-去甲睾酮单克隆抗体的筛选及icELISA方法的建立[J].科学通报,2011,56(20):1622-1628.
[14]段玉春,程作用.双功能螯合剂的研究进展[J].广东化工,2013,12:103-104.
[15]Xu Wu,Xie Peng,Fan Liu Yin,et al.Synthesis and characteristics of a novel artificial hapten using the copper mercaptide of penicillenic acid from penicillin G for immunoassay of heavy metal ions[J]. Life Science,2011,9:813-821.
Synthesis and Identification of Artificial Antigen Against Copper Ionic Chelate
Sun Yong,Fu Shijie,Qin Baoliang,Wang Yanan,Wang Ziliang*
(Henan Institute of Science and Technology,Henan Xinxiang 453003)
To obtain the artificial immunogen against copper ionic chelate.Copper ion[Cu(II)] was coupled to bovine serum albumin(BSA)and ovalbumin(OVA)which were carrier proteins via a bifunctional chelating agent Isothiocyanobenzyl-EDTA(ITCBE).The immunogen was identified by ultraviolet spectrophotometry(UV),inductively coupled plasma atomic emission spectrometry(ICPAES),denaturing polyacrylamide gel electrophoresis (SDS-PAGE), andimmunoassay.Theresults showed that the concentration of artificial antigen and Cu2+were 9.21 mg/mL and 16.83 μg/mL.The Cu2+-EDTA pAb of mouses had the titers of 1:51200 by indirect ELISA and the IC50 of Cu2+-EDTA is 36.73 ng/mL by blocking ELISA.The artificial antigen was successfully prepared and has a good immunogenicity,which provided foundations for the development of mAb against copper ions.
Copper ions;Antigen synthesis;Identification
R392.1
B
1672-9692(2015)12-0012-05
2015-11-10
孙勇(1990-),男,硕士,研究方向为动物性食品安全免疫检测。
王自良(1966-),男,博士,教授,研究方向为动物性食品安全免疫检测。
国家“十二五”科技支撑计划重大专项“重金属离子抗体的制备及其产品研发 ”(2011BAK10B01-15)
