芹菜素激活c-Src/NADPH氧化酶/ROS通路诱导HO-1表达从而抑制小鼠巨噬细胞过度分泌细胞因子
2015-12-28,,,,,,,,*
, , ,,,,,,*
(1.南华大学附属第二医院呼吸内科;2.南华大学附属第二医院药剂科;3.南华大学病原生物学研究所;湖南 衡阳 421001)
·基础医学·
芹菜素激活c-Src/NADPH氧化酶/ROS通路诱导HO-1表达从而抑制小鼠巨噬细胞过度分泌细胞因子
曾赛丽1,吴广2,谢莉1,张秀峰1,谭小武1,何振华1,游晓星3,赵兰华3,曾焱华3*
(1.南华大学附属第二医院呼吸内科;2.南华大学附属第二医院药剂科;3.南华大学病原生物学研究所;湖南 衡阳 421001)
目的观察芹菜素对脂多糖(LPS)诱导小鼠巨噬细胞分泌细胞因子的影响,并探讨其分子机制。方法体外培养小鼠巨噬细胞RAW 264.7,用不同浓度的芹菜素处理后,加入LPS刺激0~16 h。Western blot检测血红素氧合酶-1(HO-1)的表达以及c-Src和NADPH氧化酶p47phox亚基的磷酸化;荧光探针H2DCFDA检测活性氧(ROS)的产生;ELISA检测TNF-α和IL-6的产生。结果芹菜素作用RAW 264.7细胞30 min即可诱导c-Src和NADPH氧化酶亚基p47phox磷酸化。采用50 μmol/L c-Src抑制剂PP1预处理细胞后,p47phox磷酸化水平明显降低。同时,芹菜素能上调RAW264.7细胞内ROS的含量,而NADPH氧化酶抑制剂DPI可抑制其产生。芹菜素也能诱导RAW264.7细胞表达HO-1,而采用PP1、DPI或ROS抑制剂N-乙酰半胱氨酸(NAC)预处理细胞后,HO-1表达水平明显降低。此外,芹菜素处理能下调LPS诱导RAW264.7细胞分泌TNF-α和IL-6,而采用siRNA沉默HO-1表达后,能在一定程度上降低芹菜素对细胞因子的抑制效应。结论芹菜素可能通过激活c-Src/NADPH氧化酶/ROS通路诱导HO-1表达,从而抑制小鼠巨噬细胞过度分泌细胞因子。
芹菜素;血红素氧合酶-1;小鼠巨噬细胞
脓毒血症是指各种致病性微生物或其毒性产物持续存在于血液或组织中,并引起全身炎症反应和器官功能损害为特征的一种临床综合征,全球每年发病人数可达1800万以上。在美国,脓毒血症在ICU中的发病率可达30%~50%。革兰阴性细菌的脂多糖(Lipopolysaccharide,LPS)是引起脓毒血症最常见的致病物质[1]。早期革兰阴性细菌感染后,可通过固有免疫系统识别LPS,随后迅速激活单核、巨噬细胞系统,并诱导多种促炎细胞因子如TNF-α,IL-1,IL-6以及一氧化氮、巨噬细胞趋化蛋白-1等物质的产生,从而促进免疫系统清除病原体[2]。但如果致炎因素持续存在或炎症失控,最终可导致严重的组织损伤以及多器官功能衰竭[3,4]。传统治疗急性炎症反应主要采用固醇类和非甾体类药物治疗,但由于这些药物副作用严重而使其应用受限[5],因此寻求新的抗炎辅助药物对各类炎症相关疾病的治疗具有重要意义。
芹菜素(apigenin,APG)是广泛分布于水果、蔬菜(尤其是芹菜、大蒜和大白菜)中的一种黄酮类化合物,具有抗肿瘤、抗血小板聚集、抗氧化等多种生物学作用[6]。此外,体内外实验也表明APG具有一定的抗炎效应。如,Wang等研究发现,APG可通过ERK途径抑制巨噬细胞分泌TNF-α和IL-1β[7]。此外,APG也可诱导小鼠原代肝细胞表达血红素氧合酶-1(Heme oxygenase-1,HO-1),同时也能抑制尼古丁和LPS诱导牙周韧带细胞分泌炎症细胞因子[8]。也有研究表明,APG能抑制NF-κB的活性[6],但APG是否还存在其它的作用机制目前仍不明了。本研究旨在观察APG对LPS诱导巨噬细胞分泌细胞的影响,并初步探索其分子机制。
1 材料与方法
1.1试剂DMEM培养基、胎牛血清购自Invitrogen;APG、β-actin多克隆抗体为Sigma-Aldrich产品。鼠抗人p-c-Src,p-p47phox以及鼠抗人total-Src和total-p47phox购自Cell Signaling。抗血红素氧合酶-1(Heme oxygenase-1,HO-1)、以及各类二抗购自Santa Cruz。二亚苯基碘(Diphenyleneiodonium,DPI)、N-乙酰-半胱氨酸(N-acetyl-cysteine,NAC)以及2′,7′-二氯二氢荧光黄二乙酸酯(2′,7′-dichlorodihydrofluorescein diacetate,H2DCFDA)、钴原卟啉(Cobalt protoporphyrin,CoPP)购自Sigma-Adrich。HO-1 siRNA购自Santa Cruz,TNF-α和IL-1β ELISA试剂盒购自R&D System。磷酸酶、蛋白酶抑制剂购自Roche,siRNA转染试剂盒购自Qiagen。
1.2细胞培养与处理RAW 264.7细胞(ATCC)用含10%胎牛血清,100 U/mL青霉素和100 mg/mL链霉素,4.5 mg/mL L-谷氨酰胺以及4.5 g/mL的DMEM培养基中,于37 ℃,5% CO2条件下培养。2~3 d换液一次,待细胞生长至密度为80%时,根据不同的实验目的,细胞加入不同浓度的APG作用0~16 h,或随后加入1 μg/mL LPS刺激8 h。
1.3细胞总蛋白提取细胞处理结束后的细胞用冰冷PBS(pH7.4)漂洗1次,随后加入100 μL裂解缓冲液A(10 mmol/L HEPES pH 7.9,1.5 mmol/L MgCl2,0.5 mmol/L DTT,5 μmol/L 亮抑蛋白酶肽,2 μmol/L胃酶抑素A,1 μmol/L 抑肽酶,20 μmol/L PMSF和1×磷酸酶抑制剂混合物),通过反复冻融以充分裂解细胞。随后1 000×g离心10 min,获取上清再次离心15 min(10 000×g)后即为胞浆总蛋白。
1.4 Western blot 采用含有蛋白酶抑制剂的RIPA缓冲液(25mmol/L Tris-HCl pH7.4,150mmol/L NaCl,1% NP-40,1% SDS)裂解细胞,并用Bradford法于595nm波长处测定蛋白浓度。取等量蛋白经8%~10% SDS-PAGE后,转印至PVDF膜上,用5%脱脂奶粉封闭后,分别加入一抗和HRP标记二抗孵育,ECL显影。
1.5 ROS测定以H2DCFDA为荧光探针检测细胞内ROS水平。其原理是不发荧光的H2DCFDA能被过氧化物、氢过氧化物等氧化分解为二氯荧光黄而产生荧光,通过测定荧光的强度来反应ROS的含量。即,细胞中加入终浓度5 μmol/L的H2DCFDA染液,37 ℃避光孵育30 min。PBS洗细胞3次,重悬细胞,荧光分光光度计(SynergyHT,Bio-TeK)测量荧光强度(激发波长485 nm,发射波长530 nm),计算荧光的相对值(Relative fluorescence intensity)。
1.6 TNF-α和IL-6测定当生长于6孔板中的细胞长满80~90%视野时,弃培养基,并加入不同浓度的APG作用1 h后加入LPS作用8 h。操作方法按照试剂盒提供的双抗体夹心法进行。通过测定450 nm处的吸光度值,并根据标准曲线计算分泌至细胞外的TNF-α和IL-6含量。
1.7细胞转染约5×105细胞接种于60 mm培养皿中18~24 h。随后按照Qiagen提供的操作步骤,将100 nmol/L HO-1 siRNA或对照siRNA混合物孵育细胞。孵育4h后,用PBS漂洗细胞,换成完全培养基培养用于下一步研究。

2 结 果
2.1 APG诱导RAW264.7细胞c-Src磷酸化采用20 μmol/L APG作用RAW264.7细胞30 min即可诱导RAW264.7细胞中c-Src磷酸化,60 min后达到峰值,随后逐渐降低并持续至4 h,而细胞内总c-Src含量保持恒定(图1)。
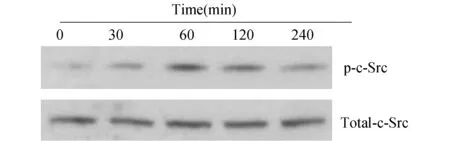
图1 APG诱导RAW 264.7细胞c-Src磷酸化
2.2 APG诱导RAW264.7细胞中NADPH氧化酶p47phox亚基磷酸化Western blot结果显示,空白对照组细胞NADPH氧化酶亚基p47phox磷酸化水平极低,20 μmol/L APG孵育30 min后,磷酸化p47phox有所增加,1 h后达到峰值。而同时采用50 μmol/L c-Src抑制剂PP1处理细胞1 h后,p47phox磷酸化水平明显降低(图2)。

图2 APG经c-Src诱导p47phox亚基磷酸化
2.3 APG激活NADPH氧化酶诱导ROS产生20 μmol/L APG处理RAW264.7细胞4 h后,可有效增加细胞内ROS的含量。而细胞在APG处理前给予10 μmol/L DPI预处理1 h,结果显示ROS含量明显降低(图3)。
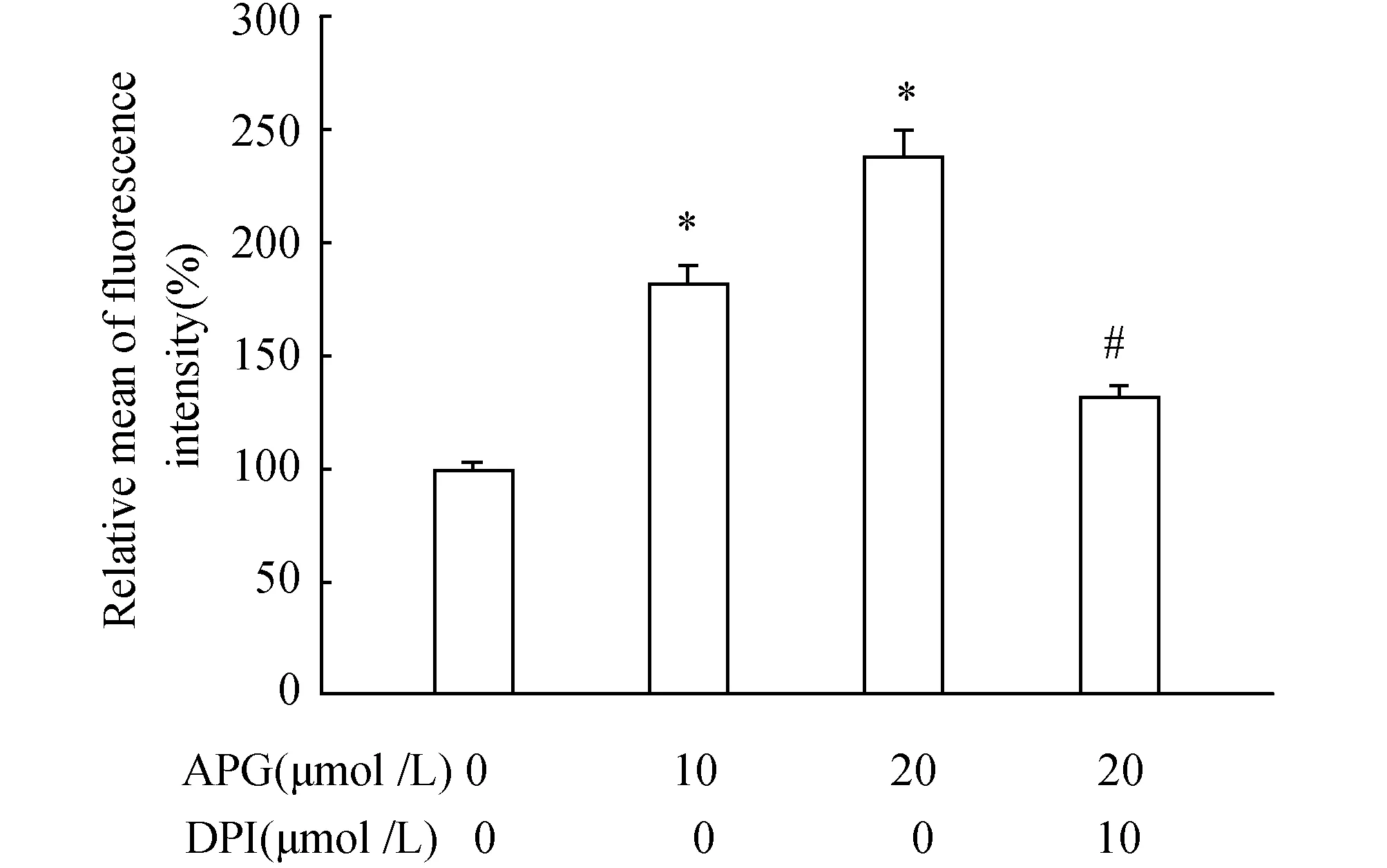
图3 APG与DPI对ROS产生的影响 与对照组(0 μmol/L APG)相比,*P<0.05;与20 μmol/L APG相比,#P<0.05
2.4 APG对HO-1表达的影响0~20 μmol/L APG作用RAW264.7细胞16 h后,可显著诱导其表达HO-1,并且呈一定的剂量依赖性(图4A)。随后用20 μmol/L APG作用细胞4 h后即可诱导RAW264.7细胞表达HO-1,随APG作用时间的延长,HO-1表达水平逐渐递增,持续到12 h~16 h(图4B)。

图4 APG诱导RAW 264.7细胞表达HO-1 A.不同浓度APG诱导RAW264.7细胞表达HO-1;B.20 μmol/L APG在不同时间内诱导RAW264.7细胞表达HO-1
2.5 APG经c-Src/NADPH氧化酶/ROS诱导HO-1表达RAW264.7细胞在APG处理前,分别用50 μmol/L c-Src抑制剂PP1、10 μmol/LNADPH氧化酶抑制剂DPI和10 mmol/L ROS抑制剂NAC预处理1 h,随后再用20 μmol/L APG孵育16 h。结果显示,PP1、DPI和NAC处理后,HO-1蛋白表达水平显著降低(图5)。

图5 PP1、DPI、NAC对APG诱导HO-1表达的影响
2.6 APG上调HO-1表达从而负调控TNF-α和IL-6过度分泌RAW264.7细胞经APG处理后,可显著下调LPS诱导其分泌TNF-α和IL-6。而RAW264.7细胞采用siRNA干扰HO-1表达后,与未转染组相比,TNF-α和IL-6含量明显增高。此外,LPS刺激前采用10 μmol/L HO-1激动剂CoPP诱导4 h也得到了类似结果(图6)。

图6 HO-1对TNF-α和IL-6分泌的影响 与LPS相比,*P<0.05
3 讨 论
巨噬细胞在各种病原微生物引起的炎症反应中发挥重要作用。各种细菌和病毒均可活化巨噬细胞并诱导其分泌一系列炎症细胞因子和介质。尽管在急性期这些物质对清除病原体感染、维持机体的稳态方面具有积极作用,但巨噬细胞的持续活化也是引起各种病理性损伤的重要原因[3]。因此采用药物干预炎症反应发生的强度,是有效预防各类病理损伤的重要途径。HO-1是催化血红素降解为胆红素、Fe2+和CO的限速酶,又称为热休克蛋白32。HO-1为诱导型,多种病理生理状态可诱导其表达等[9]。Stuart等研究表明,LPS通过上调HO-1的表达,从而抑制单核细胞系THP-1过度分泌细胞因子[10]。此外,在动物模型中,诱导HO-1表达可调节流感病毒引起的免疫反应[11]。而HO-1基因敲出动物对氧化应激以及多器官功能衰竭的敏感性增加[12],因此HO-1的表达可能是宿主细胞免受氧化应激与炎症损伤的一种获得性保护机制。在本研究当中,我们证实APG能上调HO-1的表达。但其调控机制尚不明了。一般认为,HO-1的表达主要受核转录因子Nrf2的调控,此外,PKC,PI3K/Akt和NAPDH氧化酶也参与了HO-1的表达[13]。为了进一步探讨APG的调控机制,本研究对HO-1可能的调控分子进行了观察。c-Src是一种非受体型酪氨酸蛋白激酶,c-Src未激活时,其527位酪氨酸残基(Tyr527)处于磷酸化状态而使c-Src呈空间卷曲。各种因素导致c-Src激活后,Tyr527发生去磷酸化,同时诱导其Tyr416残基磷酸化而使c-Src处于开放构象而激活[14]。有研究显示,多种病原体致病物质可通过激活c-Src而诱导HO-1表达[15]。本研究也证实,巨噬细胞经APG处理30min后即可检测出磷酸化c-Src。c-Src激活后能发挥广泛的酪氨酸激酶作用,如激活NAPDH氧化酶/ROS信号通路而诱导多种抗氧化、抗炎症相关蛋白的表达[15]。NADPH氧化酶是一个多组分活化的酶复合体,主要由质膜结合成分(包括gp91phox,p22phox,小GTP酶结合蛋白Rap1A)及胞浆成分组成(p47phox,p67phox,p40phox,小GTP酶结合蛋白 Rac2,Cdc42等)组成。外源性因素刺激下可诱导NADPH 氧化酶胞浆亚基p47phox磷酸化,随后转位到质膜或颗粒体膜,从而组装成有功能的NADPH氧化酶。因此p47phox的磷酸化是NAPDH氧化酶激活的标志[16]。在人体单核、巨噬细胞或中性粒细胞中,NADPH 氧化酶可通过一系列电子传递催化ROS的生成(氧化爆发),这是氧化应激或炎症条件下ROS的主要来源。ROS是生物体内产生的活性含氧化合物的总称,包括超氧阴离子(O2·)、过氧化氢(H2O2)、羟自由基(HO·)、一氧化氮(NO·)等。过量的ROS可引起细胞大分子的氧化损伤,适量的ROS是调节细胞生理功能状态的重要信号分子。本研究结果显示,APG处理后可诱导p47phox磷酸化,并能诱导细胞内ROS产生。且采用c-Src抑制剂PP1处理后,p47phox磷酸化水平明显降低。此外,采用NADPH氧化酶抑制剂DPI处理后,ROS含量也明显减少,表明APG处理后可激活c-Src/NADPH氧化酶/ROS通路。最后,分别采用c-Src、NAPDH氧化酶、ROS抑制剂PP1、DPI和NAC处理细胞后,HO-1的表达显著降低。这表明APG诱导HO-1的表达受c-Src/NADPH氧化酶/ROS调控。
HO-1可通过多种机制发挥对细胞的保护作用及免疫调控作用。为了进一步探讨为了明确HO-1在负调控炎症反应中的作用,本研究通过靶向沉默HO-1表达以及药物诱导的方式对TNF-α和IL-6的分泌进行了观察。RNA干扰HO-1表达后,与单纯LPS处理相比,TNF-α和IL-6分泌显著增高。同时采用CoPP诱导HO-1表达后,TNF-α和IL-1β水平再次降低。以上结果表明HO-1表达能在一定程度上调控炎症反应的强度,从而发挥对免疫功能的调控。
总之,本研究证实APG对LPS诱导巨噬细胞分泌细胞因子具有抑制作用。APG通过激活c-Src/NAPDH氧化酶/ROS信号通路,从而诱导HO-1的表达。当然,除了NADPH氧化酶以及ROS外,HO-1的表达还受PI3K/Akt以及蛋白激酶C的调控,在随后的研究当种我们将会对其开展更深一步探讨。
[1] Park BS,Lee JO.Recognition of lipopolysaccharide pattern by TLR4 complexes[J].Exp Mol Med,2013,45:e66.
[2] Roger T,Delaloye J,Chanson AL,et al.Macrophage migration inhibitory factor deficiency is associated with impaired killing of gram-negative bacteria by macrophages and increased susceptibility to Klebsiella pneumoniae sepsis[J].J Infect Dis,2013,207(2):331-339.
[3] Hotamisligil GS.Inflammation and metabolic disorders[J].Nature,2006,444(7121):860-867.
[4] Rosenblat JD,Cha DS,Mansur RB,et al.Inflamed moods:a review of the interactions between inflammation and mood disorders[J].Prog Neuropsychopharmacol Biol Psychiatry,2014,53:23-34.
[5] Walker JS,Nguyen TV,Day RO.Clinical response to non-steroidal anti-inflammatory drugs in urate-crystal induced inflammation:a simultaneous study of intersubject and intrasubject variability[J].Br J Clin Pharmacol,1994,38(4):341-347.
[6] Lefort EC,Blay J.Apigenin and its impact on gastrointestinal cancers[J].Mol Nutr Food Res,2013,57(1):126-144.
[7] Wang J,Liao Y,Fan J,et al.Apigenin inhibits the expression of IL-6,IL-8,and ICAM-1 in DEHP-stimulated human umbilical vein endothelial cells and in vivo[J].Inflammation,2012,35(4):1466-1476.
[8] Huang CS,Lii CK,Lin AH,et al.Protection by chrysin,apigenin,and luteolin against oxidative stress is mediated by the Nrf2-dependent up-regulation of heme oxygenase 1 and glutamate cysteine ligase in rat primary hepatocytes[J].Arch Toxicol,2013,87(1):167-178.
[9] 游晓星,马小华,刘良专,等.支原体脂肽经TLR2,6/c-Src/PI3K通路诱导单核细胞表达血红素氧合酶-1[J].中国免疫学杂志,2014,30(5):587-590.
[10] Rushworth SA,MacEwan DJ,O'Connell MA.Lipopolysaccharide-induced expression of NAD(P)H:quinone oxidoreductase 1 and heme oxygenase-1 protects against excessive inflammatory responses in human monocytes[J].J Immunol,2008,181(10):6730-6737.
[11] Cummins NW,Weaver EA,May SM,et al.Heme oxygenase-1 regulates the immune response to influenza virus infection and vaccination in aged mice[J].FASEB J,2012,26(7):2911-2918.
[12] Gozzelino R,Jeney V,Soares MP.Mechanisms of cell protection by heme oxygenase-1[J].Annu Rev Pharmacol Toxicol,2010,50:323-354.
[13] Zou W,Chen C,Zhong Y,et al.PI3K/Akt pathway mediates Nrf2/ARE activation in human L02 hepatocytes exposed to low-concentration HBCDs[J].Environ Sci Technol,2013,47(21):12434-12440.
[14] Byeon SE,Yi YS,Oh J,et al.The role of Src kinase in macrophage-mediated inflammatory responses[J].Mediators Inflamm,2012,2012:512926.
[15] Lee IT,Wang SW,Lee CW,et al.Lipoteichoic acid induces HO-1 expression via the TLR2/MyD88/c-Src/NADPH oxidase pathway and Nrf2 in human tracheal smooth muscle cells[J].J Immunol,2008,181(7):5098-5110.
[16] Pick E.Role of the Rho GTPase Rac in the activation of the phagocyte NADPH oxidase:outsourcing a key task[J].Small GTPases,2014,5:e27952.
ApigeninInducesHO-1Expressionbyc-Src/NADPHOxidase/ROStoProtectAgainstExcessiveCytokinesSecretioninMurineMacrophages
ZENG Saili,WU Guang,XIE Li,et al
(DepartmentofRespiratoryMedicine,TheSecondAffiliatedHospital,UniversityofSouthChina,Hengyang421001,Hunan,China)
ObjectiveTo investigate the effect and the mechanism of Apigenin on lipopolysaccharides (LPS)-induced cytokines production in murine macrophages.MethodsThe murine macrophage cell line RAW 264.7 cells were cultured in vitro,and were treated with different concentration of Apigenin followed by LPS stimulation.Expression of heme oxygenase-1 (HO-1),phosphorylation of c-Src and p47phox,the subunit of NADPH oxidase were detected by Western blot;The intracellular formation of reactive oxygen species (ROS) was detected by using the fluorescent probe H2DCFDA;Secretion of TNF-α and IL-6 were detected by ELISA.ResultsWestern blot indicated that phosphorylated c-Src and p47phoxwere induced by apigenin after 30min of incubation.While 50 μmol/L of PP1,an inhibitor of c-Src,could significantly inhibit p47phoxphosphorylation.In addition,Apigenin could also induce RAW264.7 cells accumulation of ROS,and this effect could be abrogated by the NAPDH oxidase inhibitor,DPI.HO-1 could be induced by Apigenin,and pretreatment of PP1,DPI and the ROS scavenger N-acetyl-cysteine (NAC) could block HO-1 production.Furthermore,apigenin could inhibit LPS-induced secretion of TNF-α and IL-6,and transfection of HO-1 siRNA could antagonize this action.ConclusionApigenin can induce HO-1 expression by c-Src/NADPH oxidase/ROS to protect against excessive cytokines secretion in murine macrophages.
Apigenin; Heme oxygenase-1; Murine macrophages
10.15972/j.cnki.43-1509/r.2015.04.003
2015-04-22;
2015-05-23
国家自然科学基金(31370207).
*通讯作者,E-mail:zengyihua21cn@126.com.
R967
A
(此文编辑:秦旭平)
