FlightlessⅠ与核质转运蛋白Importin β及核孔蛋白Nup88的相互作用
2015-12-27廖声友王翠华汤冬娥魏金梅贺玉娇熊海庭徐凤梅高学娟刘小会刘朗夏
廖声友,王翠华,汤冬娥,魏金梅,贺玉娇,熊海庭,徐凤梅,高学娟,刘小会,刘朗夏
FlightlessⅠ与核质转运蛋白Importin β及核孔蛋白Nup88的相互作用
廖声友,王翠华,汤冬娥,魏金梅,贺玉娇,熊海庭,徐凤梅,高学娟,刘小会,刘朗夏
广东省高校功能蛋白质研究重点实验室暨南大学生命与健康工程研究院,广东 广州 510632

廖声友, 王翠华, 汤冬娥, 等. FlightlessⅠ与核质转运蛋白Importin β及核孔蛋白Nup88的相互作用. 生物工程学报, 2015, 31(8): 1247–1254.Liao SY, Wang CH, Tang DE, et al. Interaction of FlightlessⅠwith Nup88 and Importin β. Chin J Biotech, 2015, 31(8): 1247–1254.
Fightless I (FLII) 是一个在肿瘤中高表达的蛋白,前期研究提示FLII可能参与核质转运过程,为鉴定FLII是否与核膜结合蛋白相互作用,构建GST-FLII、GST-LRR融合蛋白重组质粒并转化至大肠杆菌Rosetta 进行诱导表达,使用GST琼脂糖珠进行融合蛋白的纯化。通过SDS-PAGE对纯化蛋白进行验证之后,利用GST-pull down及免疫共沉淀技术证明了FLII与Importin β、Nup88蛋白的相互作用,并鉴定FLII上的LRR结构域为相互作用区域。研究结果提示FLII可能参与了Importin β的部分生物学作用,为进一步分析FLII与Importin β、Nup88的生物学功能奠定了基础。
分子生物学,RNA转运,GST-pull down,免疫共沉淀,FlightlessⅠ,Importin β,Nup88
核孔复合物是贯穿于核膜上作为细胞核质物质交换的主要通道,由不同的核孔蛋白形成巨大的蛋白复合体,跨双层脂质核膜。近年来,核孔蛋白复合体蛋白88 (Nup88) 在人卵巢癌、乳腺癌、结直肠癌肿瘤边缘等其他恶性肿瘤中过度表达,在胃癌肝癌等实体瘤中也呈高表达,而在对应的正常组织中则表达较弱,提示其与肿瘤的侵袭及形成能力密切相关[1-5],目前Nup88已被提议作为一种肿瘤标志物[2]。Importin β家族蛋白作为最主要的核质转运受体,在真核生物中分布广泛。Importin家族成员的N端可以结合RanGTP[6]、中部结合核孔蛋白 (Nups)[7]、C端结合底物 (Cargo)[8]或接头蛋白 (Adaptor)[9],从而将底物带入或带出细胞核。Importin β家族蛋白在核质转运中起到了极其重要的作用,因此Importin β家族蛋白本身的表达调控也成为了调节核质转运的一种重要方式。
FlightlessⅠ(FLII) 蛋白包含N端15个重复的LRR (Leucine-rich repeat) 结构域和C端5个重复的GLD (Gelsolin-like repeat) 结构域[10]。LRR结构域是蛋白与蛋白,蛋白与DNA/RNA相互作用的区域,与Ras信号转导通路相关[11-12],而GLD结构域主要与actin相关[13],然而两种结构对于结合多种核受体蛋白起转录共调节作用是必要的[14-20]。前期研究发现FLII是一个癌症相关蛋白,FLII的相互作用组学提示FLII与多种核转运蛋白相互作用,并鉴定到两个关键的核质转运蛋白Nup88和Importin β,说明FLII可能在核转运过程中起调节作用,或参与其部分生物学功能。早期研究发现,FLII参与胚胎发育[21]、信号转导、免疫应激[12-14,18,22-27]等过程,并具有与核激素受体(NR)协同NCOA2和CARM1一起发挥作用而激活转录等功能[14]。然而FLII作为一种核激素受体蛋白,其在转录后的相关功能及作用机制尚未清楚,对FLII是否与核转运蛋白Importin β、核孔蛋白Nup88相互作用,及是否调节核质转运过程没有相关文献报道。本文研究通过GST-pull down及免疫共沉淀技术证明了FLII与核转运蛋白Importin β、核孔蛋白Nup88相互作用,并发现LRR结构域在其相互作用过程中起重要作用。为进一步研究FLII是否调节核质转运过程及三者之间的生物学功能奠定了基础。
1 材料与方法
1.1 材料
肺腺癌细胞H1299购于中国科学院上海细胞生物研究所。原核表达载体pGEX-4T-1由实验室保存。FLII cDNA购于长沙赢润生物科技公司。琼脂糖粉购于美国Invitrogen公司。限制性内切酶 (HⅠ,Ⅰ)、T4 DNA连接酶、DNA Polymerase、DNA marker购于TaKaRa公司。凝胶回收试剂盒、质粒提取试剂盒购于天根公司。Importin β,FlightlessⅠ抗体购于Santa Cruz公司。HRP偶联鼠二抗购于Protein Tech Group公司。胎牛血清购于德国PAA公司。DMEM完全培养基购于Gibco公司。GST琼脂糖珠购于GE Healthcare公司。IPTG、预染蛋白marker和R250,G250染色试剂盒购自斯佳生物公司。
1.2 方法
1.2.1 pGEX-4T-1-FLII、pGEX-4T-1-LRR重组质粒的构建
从NCBI数据库中检索人FlightlessⅠ基因CDS序列,利用Primer 5.0软件设计FlightlessⅠ全长与LRR结构域片段引物。通过基因序列分析选择上游引物酶切位点为HⅠ,下游引物酶切位点为Ⅰ。引物序列如表1所示,由Invitrogen公司合成。以FLII cDNA载体为模板利用引物PCR扩增FLII基因及LRR片段,将扩增的片段用HⅠ与Ⅰ双酶切后克隆至同样酶切的pGEX-4T-1载体中,用T4 DNA连接酶连接目的片段与载体,经转化后用抗性筛选阳性克隆,并以双酶切法进行鉴定。选取双酶切正确的阳性克隆送至Invitrogen公司测序。
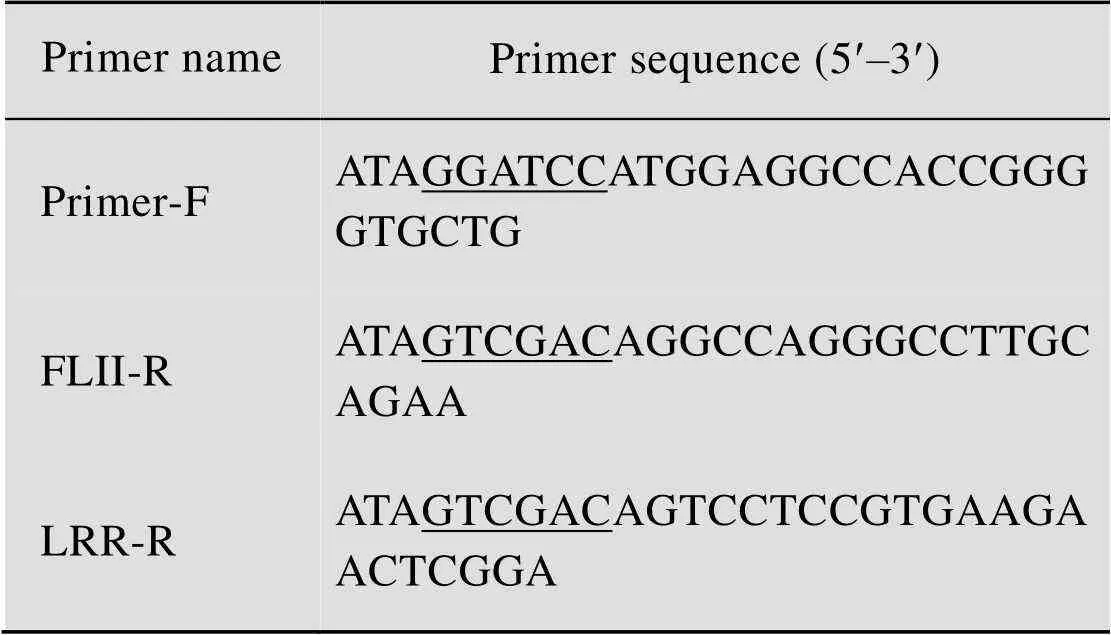
表1 GST-FLII及GST-LRR载体构建引物序列
Restriction sites were underlined. F: forward primer; R: reverse primer.
1.2.2 GST融合蛋白的诱导表达及融合蛋白的纯化、Western blotting鉴定
将GST融合蛋白质粒及表达GST的空载体转化至大肠杆菌Rosseta感受态细胞中,在含有氨苄抗生素的平板上划线,37 ℃过夜培养后挑取单菌落,将其接种于10 mL LB培养液中,37 ℃振荡培养过夜,第2天,按1∶100的比例接种于100 mL LB液体培养基中,当600吸光值达到0.6−0.8时,加入IPTG至终浓度为 0.2 mmol/L,室温诱导4−6 h;离心收集菌体,加入含有蛋白酶抑制剂的EBC 裂解液冰上裂解菌体10 min,再进行超声破碎20 min,4 ℃离心收集上清,加入DTT 至终浓度1 mmol/L。按照GE公司GST Fusion Protein Spin Purification Kit说明书,0.5 mL的GST珠子悬液,静置 30 min,待其完全沉降后,10倍体积的PBS清洗纯化柱,将裂解上清过柱,10倍体积的清洗缓冲液清洗纯化柱,然后3倍柱体积洗脱缓冲液洗脱蛋白,利用SDS-PAGE及后续的Western blotting分析蛋白的纯化情况。
1.2.3 GST-pull down检测FLII、LRR与Importin β、Nup88的相互作用
H1299细胞经EBC裂解液 (含0.5 mmol/L PI、1 mmol/L PMSF) 冰上裂解30 min后,4 ℃、12 000 r/min离心30 min,收集上清并用BCA法测定蛋白浓度,将纯化的GST融合蛋白与H1299全细胞裂解液混合,4 ℃旋转孵育过夜,用EBC裂解液清洗珠子5次,向所得样品中加入2×SDS上样缓冲液,煮沸10 min后进行Western blotting检测结合蛋白。
1.2.4 免疫共沉淀实验
H1299细胞中加入EBC裂解液冰上裂解细胞30 min,裂解后12 000 r/min、4 ℃离心30 min,收集上清后加入IgG和Protein A/G plusAgarose进行预洗,BCA法测定蛋白浓度后将H1299细胞裂解液分成2份,每份1 mg蛋白量。以IgG抗体作为阴性对照,Importin β抗体为实验组,细胞裂解液与抗体4 ℃旋转孵育过夜,18 h后加Protein A/G 琼脂糖珠孵育4 h,用EBC裂解液清洗珠子5次,向样品中加入2×SDS上样缓冲液,煮沸10 min后进行SDS-PAGE、Western blotting检测结合蛋白。
2 结果
2.1 pGEX-4T-1-LRR、pGEX-4T-1-FLII载体的构建
PCR的目的片段双酶切后克隆至pGEX-4T-1载体中,经连接转化等步骤筛选阳性克隆,将阳性克隆质粒进行双酶切鉴定。1%的琼脂糖凝胶电泳显示LRR酶切片段长度约1 500 bp,FLII酶切片段长度约3 800 bp,见图1和图2。表明目的片段LRR (图1) 和FLII (图2) 已成功克隆至载体pGEX-4T-1中。选取双酶切正确的LRR质粒1号及FLII质粒2号进行测序,测序结果与NCBI数据库FlightlessⅠ基因及LRR片段完全匹配,证明pGEX-4T-1-LRR、pGEX-4T-1-FLII质粒构建成功。
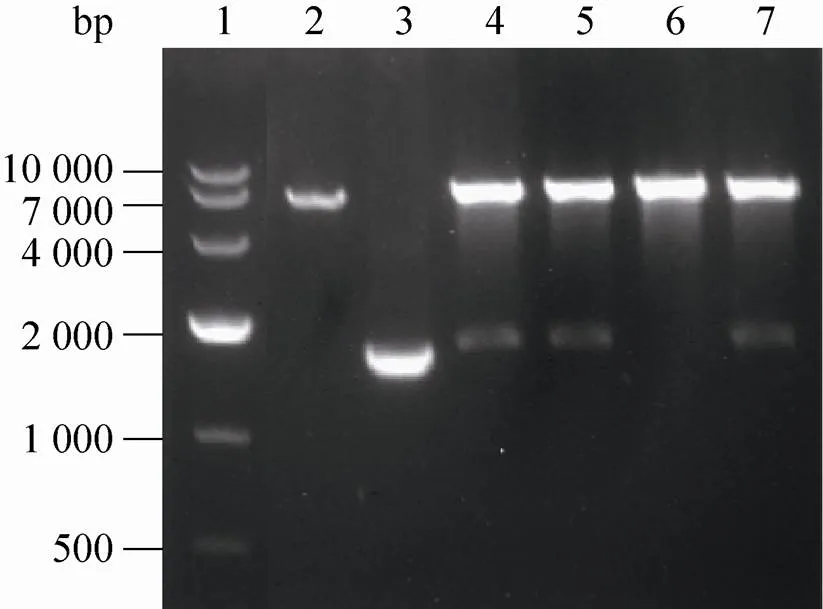
图1 pGEX-4T-1-LRR载体双酶切鉴定
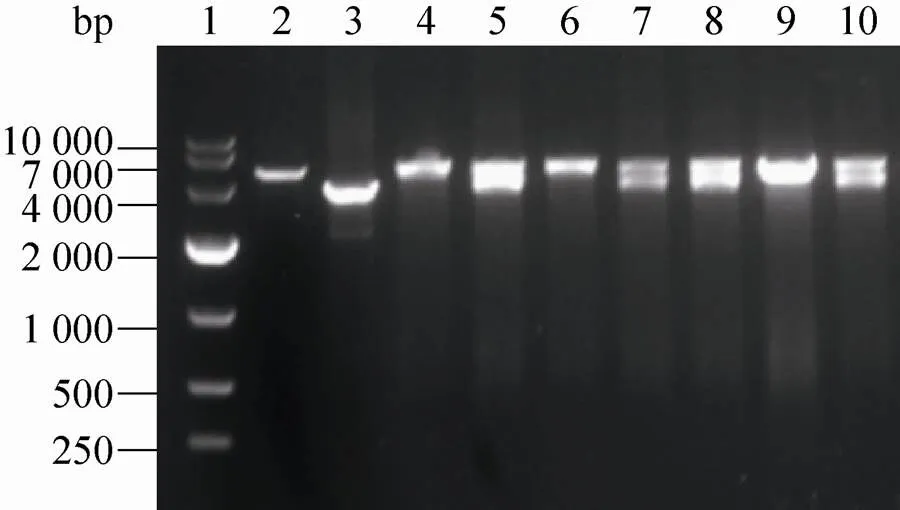
图2 pGEX-4T-1-FLII载体双酶切鉴定
2.2 GST、GST-FLII、GST-LRR蛋白的诱导表达及纯化
将构建好的GST标签载体转化到Rosetta菌株里,IPTG诱导菌株表达GST融合蛋白,收集菌体超声破碎裂解细胞,经过过柱纯化洗脱等步骤,使用SDS-PAGE检测纯化效果,蛋白电泳考马斯亮蓝染色结果见图3、4。经IPTG诱导后,表达产物在26 kDa出现了一条明显的GST蛋白条带 (图3,泳道2),并成功将GST蛋白纯化 (图3,泳道5)。同样的经IPTG诱导后,表达产物在172 kDa和83 kDa分别出现了明显的GST融合蛋白条带 (图4,泳道2和10),并经过纯化等步骤也成功将GST-FLII (图4,泳道6) 和GST-LRR (图4,泳道14) 融合蛋白纯化。表明GST及GST融合蛋白已经成功诱导并纯化。

图3 GST蛋白的诱导表达及纯化

图4 GST-FLII与GST-LRR蛋白的诱导表达
2.3 GST-pull down验证LRR、FLII与Nup88、Importin β的相互作用
为验证GST-LRR、GST-FLII与Nup88、Importin β是否直接相互作用,使用纯化的GST蛋白和GST-LRR、GST-FLII融合蛋白分别和H1299的全细胞裂解液混合并低温孵育过夜,通过蛋白相互作用的特异性结合,获得与GST-LRR、GST-FLII相互作用的蛋白复合物,并进行Western blotting分析。使用Nup88抗体检测结果显示,在GST对照中无Nup88蛋白条带存在,而在GST-LRR、GST-FLII中有明显的Nup88蛋白条带存在,使用Importin β抗体检测结果显示在对照中没有Importin β蛋白条带,在GST-LRR与GST-FLII中都有Importin β蛋白条带,见图5。结果表明GST-LRR与GST-FLII 能特异性地与Nup88、Importin β蛋白结合。因此验证FLII和Nup88、Importin β蛋白存在特异性的相互作用,并且LRR结构域作为相互作用结构域,发现其可以独立地与Nup88、KPNB1蛋白相互作用。

图5 GST-pull down验证LRR、FLII与Nup88、Importin β的相互作用
2.4 免疫共沉淀实验验证Importin β与 FLII的相互作用
为了进一步确认在细胞正常生理状态下FLII和Importin β存在相互作用,运用免疫共沉淀实验进行验证。用Importin β抗体进行免疫共沉淀实验,IgG为阴性对照,分别与H1299全细胞裂解液进行孵育,通过Protein A/G琼脂糖珠沉淀相互作用蛋白复合体,并进行Western blotting分析。检测结果如图6所示,Importin β抗体检测到免疫沉淀中具有Importin β蛋白,说明免疫沉淀Importin β实验正确,同时用FLII抗体在免疫沉淀Importin β的样品中检测到有明显的共沉淀FLII蛋白条带存在,结果表明内源Importin β与FLII存在特异的相互作用,与GST-pull down结果相一致。

图6 免疫共沉淀实验验证Importin β和FLII的相互作用
3 讨论
FlightlessⅠ (FLII) 蛋白含有1 256个氨基酸,分子量为145 kDa,是一个高度保守的蛋白,编码包括C-端肌动蛋白结合的类凝溶胶蛋白结构区域 (GEL domain) 和N-端富含亮氨酸重复的蛋白与蛋白结合区域 (LRRs domain)[28-31]。然而两种结构对于结合多种核受体蛋白起转录共调节作用是必要的[14-20]。已有相关文献证明FLII参与基因的转录起始,通过蛋白相互作用直接或间接调节结合到基因的启动子区域,从而调节转录活性[16,32]。FLII蛋白在癌细胞中高表达[33],而在正常组织中相对表达较弱,表明FLII在癌细胞中发挥重要作用。研究中利用GST-pull down及免疫共沉淀实验证实FLII与Nup88及Importin β具有特异性的相互作用,首先纯化出GST-FLII蛋白及其相互作用结构域GST-LRR蛋白,并与H1299全细胞裂解液进行沉淀。结果显示,FLII与Nup88及Importin β都有相互作用,并且发现LRR作为相互作用结构域可以单独与Nup88及Importin β蛋白相互作用。Importin β免疫共沉淀H1299全细胞裂解液,结果显示,Importin β与FLII蛋白在细胞内也存在特异性的相互作用。其三者的相互作用与前期蛋白相互作用组学结果相一致,表明FLII可能参与了Nup88及Importin β的部分生物学功能。
FLII的质谱相互作用组学鉴定提示FLII与多种核转运相关蛋白有联系,FLII作为一种既可以与Importin β结合又可以与核孔蛋白Nup88结合的相互作用蛋白,在体内可能参与二者在核转运过程中的功能,然而FLII作为一种核激素受体蛋白是否具有核转运功能还有待进一步验证。Nup88作为一种恶性肿瘤的分子标志物,而Importin β在肿瘤中具有调控作用,因此研究FLII蛋白与Nup88、Importin β的分子作用机制具有重要意义。本研究证明FLII与核转运蛋白有特异性的相互作用,并发现LRR可以单独行使其与Nup88及Importin β之间的相互作用功能。为研究FLII与Nup88、Importin β三者在体内的分子机制提供了理论基础,研究结果为进一步分析FLII与Nup88、Importin β三者的生物学功能奠定了基础。
[1] Emterling A, Skoglund J, Arbman G, et al. Clinicopathological significance of Nup88 expression in patients with colorectal cancer. Oncology, 2003, 64(4): 361–369.
[2] Hashizume C, Nakano H, Yoshida K, et al. Characterization of the role of the tumor marker Nup88 in mitosis. Mol Cancer, 2010, 9: 119.
[3] Martínez N, Alons A, Moragues MD, et al. The nuclear pore complex protein Nup88 is overexpressed in tumor cells. Cancer Res, 1999, 59(21): 5408–5411.
[4] Ramachandran PV, Ignacimuthu S. RNA interference-a silent but an efficient therapeutic tool. Appl Biochem Biotechnol, 2013, 169(6): 1774–1789.
[5] Zhao ZR, Zhang ZY, He XQ, et al. Nup88 mRNA overexpression in colorectal cancers and relationship with p53. Cancer Biomark, 2010, 8(2): 73–80.
[6] Chook YM, Blobel G. Structure of the nuclear transport complex karyopherin-beta2-Ran x GppNHp. Nature, 1999, 399(6733): 230–237.
[7] Bayliss R, Littlewood T, Stewart M. Structural basis for the interaction between FxFG nucleoporin repeats and importin-beta in nuclear trafficking. Cell, 2000, 102(1): 99–108.
[8] Lee SJ, Sekimoto T, Yamashita E, et al. The structure of importin-beta bound to SREBP-2: nuclear import of a transcription factor. Science, 2003, 302(5650): 1571–1575.
[9] Cingolani G, Petosa C, Weis K, et al. Structure of importin-beta bound to the IBB domain of importin-alpha. Nature, 1999, 399(6733): 221–229.
[10] Claudianos C, Campbell HD. The novel FlightlessⅠgene brings together two gene families, actin-binding proteins related to gelsolin and leucine-rich-repeat proteins involved in Ras signal transduction. Mol Biol Evol, 1995, 12(3): 405–414.
[11] Goshima M, Kariya K, Yamawaki-Kataoka Y, et al. Characterization of a novel Ras-binding protein Ce-FLI-1 comprising leucine-rich repeats and gelsolin-like domains. Biochem Biophys Res Commun, 1999, 257(1): 111–116.
[12] Kobe B, Deisenhofer J. A structural basis of the interactions between leucine-rich repeats and protein ligands. Nature, 1995, 374(6518): 183–186.
[13] Higashi T, Ikeda T, Murakami T, et al. FlightlessⅠ (Fli-I) regulates the actin assembly activity of diaphanous-related formins (DRFs) Daam1 and mDia1 in cooperation with active Rho GTPase. J Biol Chem, 2010, 285(21): 16231–16238.
[14] Lee YH, Campbell HD, Stallcup MR. Developmentally essential protein FlightlessⅠ is a nuclear receptor coactivator with actin binding activity. Mol Cell Biol, 2004, 24(5): 2103–2117.
[15] Lee YH, Stallcup MR. Interplay of Fli-I and FLAP1 for regulation of beta-catenin dependent transcription. Nucleic Acids Res, 2006, 34(18): 5052–5059.
[16] Wu L, Chen H, Zhu Y, et al. FlightlessⅠ homolog negatively regulates ChREBP activity in cancer cells. Int J Biochem Cell Biol, 2013, 45(11): 2688–2697.
[17] Waters JM, Lindo JE, Arkell RM, Cowin AJ. Regeneration of hair follicles is modulated by FlightlessⅠ (Flii) in a rodent vibrissa model. J Invest Dermatol, 2011, 131(4): 838–847.
[18] Muller AJ, Hoffmann C, Galle M, et al. The S. Typhimurium effector SopE induces caspase-1 activation in stromal cells to initiate gut inflammation. Cell Host Microb, 2009, 6(2): 125–136.
[19] Khurana S, Chakraborty S, Zhao X, et al. Identification of a novel LXXLL motif in alpha-actinin 4-spliced isoform that is critical for its interaction with estrogen receptor alpha and co-activators. J Biol Chem, 2012, 287(42): 35418–35429.
[20] Hayashi T, Funato Y, Terabayashi T, et al. Nucleoredoxin negatively regulates Toll-like receptor 4 signaling via recruitment of FlightlessⅠ to myeloid differentiation primary response gene (88). J Biol Chem, 2010, 285(24): 18586–18593.
[21] Kopecki Z, Yang GN, Arkell RM, et al. FlightlessⅠover-expression impairs skin barrier development, function and recovery following skin blistering. J Pathol, 2014, 232(5): 541–552.
[22] Cowim AJ, Adams DH, Strudwick XL, et al. FlightlessⅠ deficiency enhances wound repair by increasing cell migration and proliferation. J Pathol, 2007, 211(5): 572–581.
[23] Li J, Yin HL, Yuan J. FlightlessⅠ regulates proinflammatory caspases by selectively modulating intracellular localization and caspase activity. J Cell Biol, 2008, 181(2): 321–333.
[24] Morasso MI. The Influence of FlightlessⅠ: regeneration versus wound healing. J Invest Dermatol, 2011, 131(4): 816–817.
[25] Jeong KW. FlightlessⅠ(Drosophila) homolog facilitates chromatin accessibility of the estrogen receptor alpha target genes in MCF-7 breast cancer cells. Biochem Biophys Res Commun, 2014, 446(2): 608–613.
[26] Kopecki Z, Yang GN, Arkell RM, et al. FlightlessⅠover-expression impairs skin barrier development, function and recovery following skin blistering. J Pathol, 2014, 232(5): 541–552.
[27] Ruzehaji N, Kopecki Z, Melville E, et al. Attenuation of FlightlessⅠ improves wound healing and enhances angiogenesis in a murine model of type 1 diabetes. Diabetologia, 2014, 57(2): 402–412.
[28] Davy DA, Ball EE, Matthaei KI, et al. The FlightlessⅠ protein localizes to actin-based structures during embryonic development. Immunol Cell Biol, 2000, 78(4): 423–429.
[29] Campbell H, Schimansky T, Claudianos C, et al. The Drosophila melanogaster FlightlessⅠ gene involved in gastrulation and muscle degeneration encodes gelsolin-like and leucine-rich repeat domains and is conserved in Caenorhabditis elegans and humans. Proc Natl Acad Sci, 1993, 90(23): 11386–11390.
[30] Campbell HD, Webb GC, Young IG. A human homologue of the Drosophila melanogaster sluggish-A (proline oxidase) gene maps to 22q11. 2, and is a candidate gene for type-I hyperprolinaemia. Hum Genet, 1997, 101(1): 69–74.
[31] Seward ME, Easley CAt, McLeod JJ, et al. FlightlessⅠ, a gelsolin family member and transcriptional regulator, preferentially binds directly to activated cytosolic CaMK-II. FEBS Lett, 2008, 582(17): 2489–2495.
[32] Choi JS, Choi SS, Kim ES, et al. Flightless-1, a novel transcriptional modulator of PPARgamma through competing with RXRalpha. Cell Signal, 2015, 27(3): 614–620.
[33] Liu YT, Yin HL. Identification of the binding partners for FlightlessⅠ, a novel protein bridging the leucine-rich repeat and the gelsolin superfamilies. J Biol Chem, 1998, 273(14): 7920–7927.
(本文责编 陈宏宇)
Interaction of Flightless I with Nup88 and Importin β
Shengyou Liao, Cuihua Wang, Dong’e Tang, Jinmei Wei, Yujiao He, Haiting Xiong, Fengmei Xu, Xuejuan Gao, Xiaohui Liu, and Langxia Liu
,,,510632,,
High expression of Fightless I (FLII) is associated to multiple tumors. Based on our previous study that FLII might be involved in the nuclear export, we assessed the possible interaction of FLII with the nuclear envelop associating proteins Importin β and Nup88. We first constructed GST-FLII, GST-LRR recombinant plasmids and transformed them into the Rosetta strain to produce GST-FLII, GST-LRR fusion protein. After purification of these proteins, GST-pull down, as well as co-immunoprecipitation, were used to test the interaction of FLII with Importin β and Nup88. FLII interacted with Importin β and Nup88, and FLII LRR domain is responsible for these interactions. Thus, FLII may play a role in nuclear export through interaction with Importin β and Nup88.
molecular biology, RNA traffic, GST-pull down, CO-IP, FlightlessⅠ, Importin β, Nup88
10.13345/j.cjb.150047
January 23, 2015; Accepted:April 30, 2015
Langxia Liu. Tel: +86-20-85222573; E-mail: langxialiu@gmail.com, tliulx@jnu.edu.cn.
2015-05-26
http://www.cnki.net/kcms/detail/11.1998.Q.20150526.1645.001.html
