三元醇丙烯酰胺键合色谱固定相的制备及评价
2015-12-26成晓东冯钰锜
成晓东, 冯钰锜
(生物医学分析化学教育部重点实验室,武汉大学化学系,湖北 武汉430072)
早在20 世纪90 年代,Alpert[1]第一次提出亲水作用色谱(HILIC)的概念,并对其作了系统的阐述,但是在当时并没有引起重视。随着代谢组学、蛋白质组学、环境科学以及药物化学等学科的发展,对极性小分子的分析已经成为分析化学和生物化学研究的重要内容,而传统的反相色谱(RPLC)在分离这些极性分子时存在保留弱、分离选择性差的缺点。正相色谱(NPLC)能较好地解决极性分子的保留与分离问题,但极性分子在NPLC 流动相中溶解度差、所用流动相与质谱不兼容、色谱重现性差等因素制约了正相色谱在极性分子分离中的应用。而HILIC为强极性和离子型化合物包括氨基酸、碳水化合物、极性药物、多肽、天然产物等的分离分析提供了一个很好的选择,近年来得到了很快的发展[2-5]。
伴随着HILIC 的迅猛发展,越来越多的商品化HILIC 材料与学术报道的HILIC 材料种类越来越丰富。不同类型的固定相之间分离选择性存在着很大的差异,应用范围也因此迥然不同[3,6-11]。因此,新型亲水作用色谱材料的发展是促进亲水作用色谱应用与推广的关键。
通常亲水材料的制备是在材料的表面引入极性基团或者分子,而多元醇作为一种典型的具有较大极性的化合物,是制备亲水材料的理想单体。巯基-乙烯基“点击化学”方法有着条件温和、选择性好、产率高等优点,且能避免传统的叠氮-炔基“点击化学”方法中重金属的使用,近年来受到越来越多的关注[12]。我们利用含巯基的硅烷偶联剂与含双键的多元醇单体之间的点击反应制得含多元醇的功能化偶联剂,并将此硅烷偶联剂与硅胶反应得到多元醇键合固定相。经过元素分析对固定相进行了表征。考虑到固定相既具有极性多元醇官能团也有短的疏水碳链,在考察了固定相的亲水性与疏水性后成功地将此固定相应用于亲水与反相色谱两种模式,并对比了两种模式下流速对于柱效的影响。最后将固定相应用于烷基苯、水溶性维生素以及核苷的分离。
1 实验部分
1.1 仪器与试剂
安捷伦1200 液相色谱系统(Agilent Technologies,Palo Alto,CA,USA),由G1322A 脱气机、G1311A 四元泵、G1329A 自动进样器、G1315B DAD紫外检测器以及G1330B 柱温箱组成。元素分析由Vario EL III Universal CHNOS Elemental Analyzer(Elementar,Germany)测得。
硅胶(粒径:5 μm;孔径:10 nm;比表面积:300 m2/g)购 自Welch Materials,Inc. (Maryland,US)。巯丙基三甲氧基硅烷(MPS)购自武汉大学有机硅新材料公司。N-三羟甲基甲基丙烯酰胺(NA)、安息香二甲醚、核苷和碱基、维生素(B1、B2、B3、B3-amide、B6、B12)购自阿拉丁试剂。烷基苯、甲醇(MeOH)、三乙胺、乙腈(ACN)、乙酸、乙酸铵和甲酸铵购自上海国药试剂厂。实验所用的蒸馏水均取自成都艾柯纯水仪。
1.2 多元醇键合固定相的制备
利用巯基与乙烯基的“点击化学”反应合成了含多元醇的硅烷偶联剂,再将其引入到硅胶表面。图1 为固定相的合成路径。
首先制备了多元醇的硅烷偶联剂,合成方法如下:将MPS (15 mmol)、NA (15 mmol)、安息香二甲醚(0.3 mmol)放入20 mL 的透明玻璃瓶中混合均匀。将玻璃瓶置于20 W 的紫外灯(波长为365 nm)照射的环境下,磁力搅拌反应24 h。所得的透明液体即为多元醇功能化的硅烷偶联剂。
接着将合成的硅烷偶联剂与硅胶反应。具体合成方法如下:将所合成的硅烷偶联剂与5 g 硅胶分散于30 mL 无水甲苯中,N2保护下130 ℃回流反应20 h 后过滤,分别用甲苯、甲醇、水和丙酮洗涤3次,置于60 ℃真空环境下干燥过夜,备用。
1.3 色谱柱的填装和HPLC 条件
填装:以甲醇作为淋洗剂,ACN/H2O(70% /30%)混合液为匀浆剂,用装柱机在41 MPa 压力下填装30 min,将所得的NAS 填料填入150 mm×4.6 mm 的不锈钢色谱柱中。
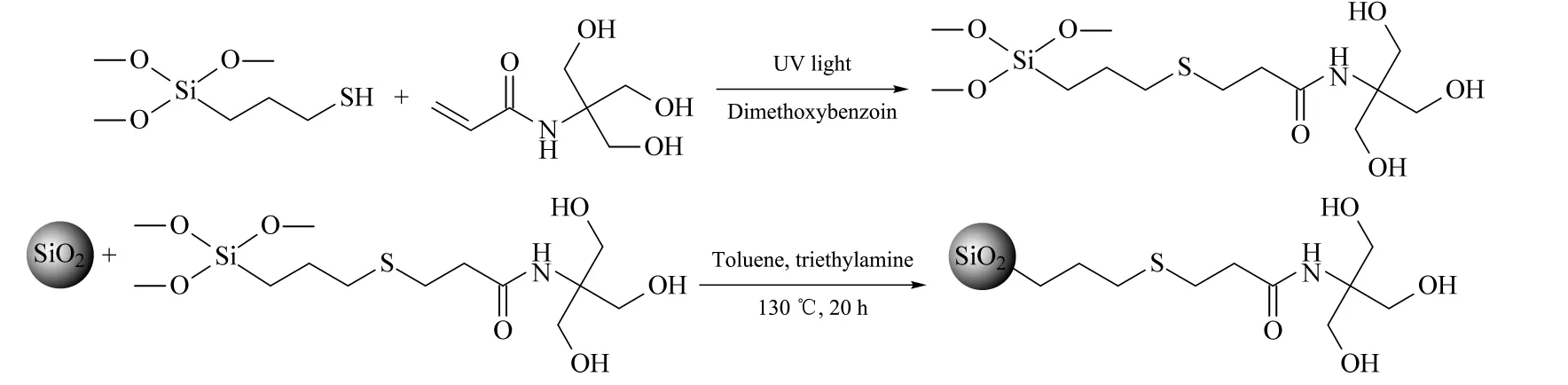
图1 三元醇丙烯酰胺(NAS)固定相的合成过程Fig.1 Synthesis procedure of the N-acryloyltris(hydroxymethyl)aminomethane-bonded silica (NAS)stationary phase
HPLC 条件:流速为1 mL/min;柱温为35 ℃;检测波长为254 nm 或230 nm;流动相为不同比例的有机溶剂与缓冲液的混合物。流动相使用前均经过过滤与超声脱气处理。所有的测定均重复两次以上。
2 结果和讨论
2.1 固定相的表征
我们对不同批次的NAS 固定相进行了元素分析,结果如表1 所示。N 与S 的存在证明了NA 单体已成功引入到固定相表面,而不同批次间硅胶相似的元素组成则证明合成方法具有良好的重现性。

表1 NAS 填料的孔结构表征与元素分析结果Table 1 Pore structure and elemental analysis of NAS stationary phase
2.2 溶质保留机理的考察
一直以来,关于HILIC 的溶质保留机理存在较大争议,主流的观点分为两种。其中被大家广泛接受的是Alpert 提出的分配机理[1]。该观点认为在分离过程中,极性固定相的表面会吸附流动相的水分子,使其在固定相表面形成水层,约4% ~13% 的硅胶孔体积会被水分子占据,而分析物会在水层与流动相之间达到一个分配平衡。基于这种机理的研究衍生出了如下的理论模型[13]:

其中k 为溶质保留因子,kw为仅用乙腈为流动相时分析物的保留因子,φ 为流动相中水的含量。而另一种观点则是正相色谱中常见的吸附机理[14]。这种观点认为分析物在固定相的表面存在着一种吸附与解吸的过程。这种观点早期不被大家所接受的原因是:通常正相色谱中流动相中是不含水的,因为水的极性较大,会迅速占据吸附位点导致分析物的保留减弱。而亲水作用色谱的流动相中含有较多的水分子,如果分析物是通过吸附作用与固定相作用的话会被水分子迅速替换掉。然而随着对HILIC 研究的深入,人们发现氢键作用、偶极矩作用以及静电作用均能与溶质分子产生吸附作用,因此仍有不少人认为HILIC 中吸附机理是存在的[8]。其保留因子与水含量之间的关系式为:
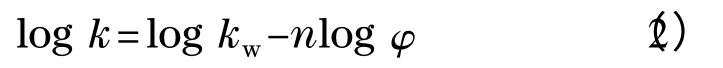
近年来随着亲水作用色谱的研究逐渐深入,一种新的多重保留机理被越来越多的人所接受[15],其理论模型中保留因子与水含量之间的关系式为:

这种机理在含短碳链的极性固定相中较为常见,它被认为是溶质与碳链间的疏水作用以及其与固定相极性官能团之间的极性相互作用两种作用共同产生的结果。其中m1衡量了疏水作用随流动相中水含量上升的增强幅度,m2则衡量了亲水作用随水含量上升的削弱程度。核苷、酚类物质以及水溶性维生素等分析物在HILIC 中的保留符合此种模型。
我们认为亲水色谱模式下的溶质保留机理的不确定性与分析物本身的理化特性以及亲水固定相结构的多样性分不开,分析物的结构与固定相的结构都会对两者之间的相互作用产生影响。为了考察所合成的多羟基固定相的溶质保留机理,我们选取了6 种核苷为分析物,考察了它们在固定相上的保留与流动相中水含量之间的关系,并按照上述的3 个方程对分析物的保留与水含量之间的关系进行了多重回归分析。如表2 所示,分析物的保留因子与水含量之间的关系与方程(3)最为吻合,相关系数均大于0.99。因此,固定相对于溶质的保留是一种吸附与分配作用均存在的多重保留机理。

表2 不同理论模型下NAS 柱上分析物保留因子与流动相中水含量的线性相关系数Table 2 Correlation coefficients of the retention factors of the tested analytes on the NAS columns and water content in mobile phase using different equations
2.3 固定相亲水性与疏水性的考察
固定相的结构中包含短的疏水碳链以及极性多羟基基团,我们通过改变流动相中乙腈的含量来观察分析物的保留时间变化,以此来考察固定相的亲水性与疏水性。如图2 所示,疏水性物质苯、甲苯、萘在乙腈含量较低时有较强的保留,证明了固定相可以在疏水模式下应用于这些弱极性化合物的分离。而在流动相中乙腈含量较高的情况下极性分析物的保留大大增强,证明固定相在此条件下具有较强的亲水性。由于固定相的这种特性,使其能同时应用于亲水与反相色谱两种模式。

图2 分析物的保留因子随流动相中乙腈含量变化的趋势图Fig.2 Plots of kvalues of the analytes vs. ACN volume fraction in mobile phase
2.4 反相与亲水色谱模式下流速对柱效的影响
流动相流速对塔板高度有着非常重要的影响[16]。根据Van Deemter 方程,塔板高度与流速之间存在如下的关系[12]:

其中H 为塔板高度,A 为涡流扩散项,B/u 为纵向扩散相,Cu 为传质项,u 为流动相线速度。我们研究了两种模式下流速对塔板高度的影响(见图3),可以看出在RPLC 模式下,分析物的种类对塔板高度的影响很大,不同分析物之间塔板高度相差较大。而在HILIC 模式下,不同物质的塔板高度相差不大。在较低流速下,由于纵向扩散严重,两种模式下塔板高度均随流速降低而有较大幅度升高。而在较高流速下,流速对于塔板高度的影响在两种模式下差别较大。在RPLC 中,塔板高度变化随流速变化较小。这就意味着在RPLC 中,可以适当增加流动相流速,这样可以在避免损失柱效的情况下有效减少分析时间。而在HILIC 中,较高流速下塔板高度随流速增大而急剧升高。因此在HILIC 模式下,不提倡过多提高流速,柱效降低将会对分离效率造成较大影响。
2.5 应用
2.5.1 水溶性维生素的分离
如图4 所示,固定相对6 种水溶性维生素有较好的分离效果,展现了良好的亲水性能。

图3 反相与亲水色谱两种模式下固定相的Van Deemter 曲线Fig.3 Van Deemter plots on the NAS column in RPLC and HILIC mode

图4 6 种水溶性维生素在NAS 固定相上的分离图Fig.4 Separation of six water-soluble vitamins on the NAS column
2.5.2 烷基苯以及核苷分别在亲水与反相色谱模式下的分离
如图5 所示,将固定相应用于亲水与反相色谱两种模式,分别对烷基苯以及核苷进行分离,均取得很好的分离效果,展示了固定相良好的应用前景。

图5 NAS 固定相上(a)烷基苯在RPLC 模式下与(b)核苷在HILIC 模式下的色谱图Fig.5 Chromatograms of (a)alkylbenzenes under RPLC mode and (b)nucleosides under HILIC mode on the NAS column
3 结论
本文利用巯基与乙烯基的“点击化学”反应合成了含多元醇的硅烷偶联剂,并将其引入到硅胶表面制得含多羟基的亲水固定相。采用元素分析表征证明了多羟基官能团已成功键合到硅胶表面。研究了亲水色谱模式下固定相的溶质保留机理,表明固定相对溶质具有多重保留机理。考察了固定相的疏水性与亲水性,并成功地将固定相同时应用于亲水与反相色谱两种模式,对比了反相色谱与亲水色谱模式下流速对柱效的影响,结果表明亲水色谱模式下高流速对柱效影响更大。最后将固定相应用于水溶性维生素、烷基苯以及核苷的分离中,取得了较好的效果,证明该固定相拥有良好的应用前景。
[1] Alpert A J. J Chromatogr,1990,499:177
[2] Wang X Y,Gao P,Xu G W. Chinese Journal of Chromatography (王希越,高鹏,许国旺. 色谱),2014,32(10):1084
[3] Yin W,Chai H H,Liu R H,et al. Talanta,2015,132:137
[4] Qian F Z,Zhu L B,Xu N B,et al. Chinese Journal of Chromatography (钱飞中,朱丽波,徐能斌,等. 色谱),2014,32(5):535
[5] Xu X F,Shen A J,Guo Z M,et al. Chinese Journal of Chromatography (徐雪峰,沈爱金,郭志谋,等. 色谱),2013,31(3):185
[6] Xu L L,Zhong M H,Chen X J. Chinese Journal of Chromatography (许丽丽,衷明华,陈小静. 色谱),2015,33(5):461
[7] Shen A J,Guo Z M,Yu L,et al. Chem Commun,2011,47(15):4550
[8] Qiao L Z,Dou A,Shi X Z,et al. J Chromatogr A,2013,1286:137
[9] Cheng X D,Peng X T,Yu Q W,et al. Chromatographia,2013,76(23/24):1569
[10] Hao J X,Wang F Q,Dai X J,et al. Talanta,2011,85(1):482
[11] Liu S J,Qiao X Q,Yang Y J,et al. Chinese Journal of Chromatography (刘士佳,乔晓强,杨艳军,等. 色谱),2014,32(10):1079
[12] Shen A J,Guo Z M,Cai X M,et al. J Chromatogr A,2012,1228:175
[13] Karatapanis A E,Fiamegos Y C,Stalikas C D. J Chromatogr A,2011,1218:2871
[14] Scott R P W,Kucera P. J Chromatogr A,1979,171:37
[15] Urban J,Skerikova V,Jandera P,et al. J Sep Sci,2009,32(15/16):2530
[16] Gritti F,Guiochon G. J Chromatogr A,2013,1302:55
