糖负荷后0.5 h高血糖者血糖波动特征分析
2015-12-26刘乐冯凭
刘乐 冯凭
糖负荷后0.5 h高血糖者血糖波动特征分析
刘乐 冯凭
目的分析口服葡萄糖耐量试验(OGTT)负荷后0.5 h高血糖者的血糖波动特征。方法4 351名受试者行OGTT试验,根据笔者前期试验得出诊断糖代谢异常的0.5 h血糖(0.5 hPG)切点值将整个人群分为糖耐量正常组(n=1 370)、糖尿病前期组(n=1 131)及糖尿病组(n=1 850),进行 0.5 hPG诊断标准及2008年美国糖尿病协会(ADA)诊断标准的一致性检验,比较3组的糖负荷后血糖及胰岛素峰值、胰岛素增量、糖负荷后血糖波动、胰岛素生成指数、Mastuda胰岛素敏感指数、30 min处置指数(DI30),并进行糖负荷后血糖波动与上述指标的线性相关性分析。结果0.5 hPG诊断标准与2008年ADA诊断标准具有较好的一致性(Kappa=0.563,P<0.001)。应用 0.5 hPG诊断的糖耐量正常组、糖尿病前期组的糖负荷后血糖峰值多数出现在1 h,而糖尿病组的血糖峰值则较多出现在 2 h(χ2=710.74,P<0.001)。随着 0.5 hPG水平的升高,3组糖负荷后血糖峰值及血糖波动依次增加(F=3 313.21,2 580.53,P均<0.01),而空腹胰岛素、糖负荷后胰岛素峰值、胰岛素增量、生成指数、Matsuda胰岛素敏感指数及DI30逐渐下降(F=8.78~1 697.16,P均<0.01)。糖负荷后血糖波动与生成指数、Matsuda胰岛素敏感指数、DI30呈负相关(r=-0.114,-0.148,-0.639,P均<0.01),与0.5 hPG呈正相关(r=0.796,P<0.01)。结论0.5 hPG是诊断糖代谢异常的良好补充,0.5 h高血糖人群中随着血糖水平的升高其糖负荷后血糖峰值出现时间逐渐后延,并且糖负荷后血糖波动逐渐加大。糖负荷后的血糖波动与早时相分泌功能及胰岛素敏感性有关。
糖尿病;口服葡萄糖耐量试验;0.5 h高血糖;血糖波动;糖负荷后血糖峰值
在临床工作中时常会遇到一部分患者口服葡萄糖耐量试验(OGTT)0.5 h血糖(0.5 hPG)水平高于7.8 mmol/L,而空腹及2 h血糖正常,此类人群的早时相分泌功能及胰岛素敏感性可能较0.5 hPG正常者差。糖代谢正常者的OGTT血糖峰值通常出现在0.5 h或1 h,而0.5 h高血糖者糖负荷后的血糖峰值可能更高,出现的更晚,因此血糖波动可能更大。本文旨在分析0.5 hPG诊断标准(标准1)与2008年美国糖尿病协会(ADA)诊断标准(标准2)的一致性及0.5 h高血糖者糖负荷后血糖波动特征。
1 对象与方法
1.1 观察对象 选取2013年1月—241014年12月行OGTT的天津医科大学总医院门诊受试者共4 351名,所有研究对象既往均未诊断过糖尿病,或已知糖尿病但未用药物干预,并除外严重的心、肝、肾疾病,贫血,应激,酮症,高渗状态,恶性肿瘤,妊娠及其他相关内分泌代谢疾病。本研究经医院伦理委员会批准,所有受试者均签署知情同意书。
1.2 研究方法 OGTT根据世界卫生组织的规定,受试者前1天晚餐后禁食8~14 h,空腹采血后于5 min内饮250~500 ml含75 g葡萄糖水。服糖前、服糖后0.5,1,2及3 h抽取血样检测血糖和胰岛素浓度。血糖检测采用自动化葡萄糖氧化酶法,胰岛素检测采用化学发光法,试剂盒购自德国拜耳公司。
1.3 诊断标准 根据2008年ADA糖尿病及糖尿病前期的诊断标准:空腹血糖<5.6 mmol/L且OGTT 2 h 血糖<7.8 mmol/L诊为正常糖耐量, 5.6 mmol/L≤空腹血糖<7.0 mmol/L和(或)7.8 mmol/L≤OGTT 2 h血糖<11.1 mmol/L诊为糖尿病前期,有典型糖尿病症状且随机血糖≥11.1 mmol/L或空腹血糖≥7.0 mmol/L或OGTT 2 h血糖≥11.1 mmol/L者,可诊断为糖尿病,如无糖尿病典型症状者另日复查后方可诊断[1]。
根据笔者前期研究结果,应用受试者工作特征曲线分析,以2008年ADA糖尿病诊断标准为参考标准,该研究观察对象中,OGTT 0.5 hPG诊断糖尿病的最佳切点值为10.79 mmol/L,诊断糖尿病前期的最佳切点值为8.69 mmol/L[2]。0.5 hPG<8.69 mmol/L者为糖耐量正常组,共1 370名;10.69 mmol/L<0.5 hPG≤8.69 mmol/L者为糖尿病前期组,共1 131名;0.5 hPG≥10.79 mmol/L者为糖尿病组,共1 850例。
1.4 计算公式 生成指数=(0.5 h胰岛素-空腹胰岛素)/(0.5 hPG-空腹血糖); Matsuda胰岛素敏感指数=10 000/(空腹血糖 ×空腹胰岛素× OGTT平均血糖值×OGTT平均胰岛素值)1/2; 30 min处置指数(DI30)=[30 min胰岛素曲线下面积(InsAUC30)/30 min葡萄糖曲线下面积(GluAUC30)]×Matsuda胰岛素敏感指数;糖负荷后血糖波动(PPGE)=OGTT血糖峰值-空腹血糖;胰岛素增量=(糖负荷后胰岛素峰值-空腹胰岛素)。

2 结果
2.1 标准1与标准2一致性检验 按照标准2与标准1诊断糖代谢异常具有较好的一致性(Kappa=0.563,P<0.001),但按照标准1诊断的糖尿病前期人群包含了21.92%的标准2诊断的糖耐量正常者及16.88%的标准2诊断的糖尿病患者,而按照标准2诊断的糖耐量正常人群包含了29.96%的标准1诊断的糖尿病前期者及2.27%的标准1诊断的糖尿病患者,见表1。

表1 两种诊断标准的一致性分析[n(%)]
注:标准1:0.5 h血糖诊断标准;标准2:2008年美国糖尿病协会诊断标准
2.2 两种诊断标准的血糖及胰岛素峰值、血糖波动、胰岛素增量的比较 血糖峰值及血糖波动在糖耐量正常组标准1略低于标准2,而在糖代谢异常的两组中标准1均略高于标准2;胰岛素峰值及胰岛素增量在糖耐量正常组及糖尿病前期组标准1均略低于标准2,而在糖尿病组标准1略高于标准2,见表2。

表2 两种诊断标准的血糖及胰岛素峰值、血糖波动、胰岛素增量的比较
注:标准1:0.5 h血糖诊断标准;标准2:2008年美国糖尿病协会诊断标准;PPGE:糖负荷后血糖波动
2.3 糖负荷后血糖峰值出现的时间分布 糖耐量正常组、糖尿病前期组、糖尿病组的OGTT负荷后血糖峰值出现的时间依次后延,前两组的血糖峰值多出现在0.5 h或1 h,而糖尿病组的血糖峰值则更多出现在2 h(P<0.001),3组间两两比较糖负荷后血糖峰值出现时间点都不同(P<0.001,表3)。

表3 糖负荷后血糖峰值的时间分布[n(%)]
2.4 糖负荷后血糖峰值、血糖波动情况及早时相胰岛素分泌功能、胰岛素敏感性比较 在糖耐量正常组、糖尿病前期组及糖尿病组,糖负荷后的血糖峰值逐渐升高(P<0.01),且血糖波动亦逐渐增大(P<0.01);而空腹胰岛素、胰岛素峰值及胰岛素增量、生成指数、Mastuda胰岛素敏感指数及DI30在3组呈逐渐下降趋势(P<0.01),见表4。
2.5 糖负荷后血糖波动与0.5 hPG、早时相胰岛素分泌功能及胰岛素敏感性的相关性分析 糖负荷后血糖波动与生成指数、Mastuda胰岛素敏感指数及DI30均呈负相关,与0.5 hPG呈正相关(P<0.01,表5)。
3 讨论
糖尿病是由遗传和环境因素共同作用而引起的一组以糖代谢紊乱为主要表现的临床综合征。胰岛素分泌、胰岛素作用或两者同时存在的缺陷引起碳水化合物、脂肪、蛋白质、水和电解质等代谢紊乱,临床以慢性高血糖为主要特征[3]。与非糖尿病人群相比,糖尿病人群中动脉粥样硬化性疾病的患病率高、发病年龄较轻、病情进展较快、多脏器同时受累较多。0.5 h高血糖者或血糖波动大者往往大血管病变发生率明显高于正常人群[4-5]。因此更早期发现糖代谢异常人群并加以干预就显得尤为重要,由此本研究选取了2008年ADA糖代谢异常的诊断标准,即糖耐量正常人群的空腹血糖<5.6 mmol/L。本文旨在比较0.5 h PG切点值与ADA糖代谢诊断标准的一致性并分析0.5 h高血糖者的血糖波动特征。
关于0.5 h高血糖的相关研究国内、外鲜有报道[6-7]。笔者前期研究应用受试者工作特征曲线确定0.5 hPG诊断糖尿病前期的切点值为8.69 mmol/L,诊断糖尿病的切点值为10.79 mmol/L,发现0.5 hPG切点值与标准2在诊断糖代谢异常方面具有较好的一致性,但单纯应用0.5 hPG切点值诊断糖代谢异常会将标准2中一部分糖耐量正常者诊断为糖尿病前期,而将一部分糖尿病者也诊断为糖尿病前期,因此笔者认为0.5 hPG虽不能单独诊断糖代谢异常但却可以作为现有糖代谢异常诊断标准的良好补充,以便更早期发现糖代谢异常个体并进行早期干预。研究结果亦表明,应用标准1诊断的糖耐量正常组的血糖峰值及血糖波动较标准2略低,而在糖尿病前期及糖尿病组相反;标准1诊断的糖耐量正常组及糖尿病前期组的糖负荷后胰岛素峰值及胰岛素增量较标准2略低,而在糖尿病组相反,上述结果提示标准1较标准2更能早期反映高血糖状态及血糖波动情况,且标准1诊断的糖尿病组较标准2胰岛素峰值及胰岛素增量均略高,可能说明单纯应用标准1诊断的糖尿病相对于标准2诊断的糖尿病者处于疾病的更早期,因此如将标准1作为现有诊断标准的很好补充,便可更早发现糖代谢异常人群并对其加以干预,防治疾病进一步进展。研究将整个人群按照0.5 hPG的切点值分为糖耐量正常、糖尿病前期、糖尿病3组,则血糖峰值出现时间依次后延,分别为0.5 h或1 h、1 h、2 h,且糖尿病组血糖峰值在0.5 h的仅有5.08%,可能提示此人群的早时相分泌功能严重缺失。糖耐量正常组、糖尿病前期组、糖尿病组的空腹胰岛素、糖负荷后的胰岛素峰值及胰岛素增量均逐渐下降,提示随着糖代谢异常的进展基础胰岛素及糖负荷后胰岛素分泌功能均依次下降。此外3组的血糖峰值依次升高,且糖负荷后的血糖波动程度也逐渐增大。Hanefeld等[8]观察正常糖耐量及糖调节受损人群进食511 kcal标准餐后血糖峰值分别为(7.69±1.48) mmol/L、(9.18±1.67)mmol/L,均略低于本研究,可能与其进食混合餐达峰速度慢且血糖峰值相对低有关。成都地区糖耐量正常者的餐后血糖峰值为(7.7±1.6) mmol/L,餐后血糖波动(2.3±1.6)mmol/L[9]。喻明等[10]对糖耐量受损者进行动态血糖监测,糖耐量减低者的早餐后血糖峰值最高,可达(9.3±1.8)mmol/L,均低于本文结果,可能与0.5 h高血糖者较传统分组的早时相分泌功能及胰岛素敏感性更差有关。随着0.5 hPG的升高,胰岛素生成指数、Mastuda胰岛素敏感指数及DI30均逐渐下降,并且在校正胰岛素敏感性因素后的早时相胰岛素分泌功能同样随着0.5 hPG的升高逐渐下降。此外,本研究发现血糖波动与胰岛素生成指数、Mastuda胰岛素敏感指数及DI30呈负相关,而与0.5 hPG呈正相关,且早时相胰岛素分泌与血糖波动的相关性独立于胰岛素敏感性,提示0.5 hPG越高,糖负荷后血糖波动越大。最近一项充血性心力衰竭动物模型研究表明,模拟餐后血糖高峰(25 min内血糖由3.89 mmol/L升至10 mmol/L)使血糖快速上升可使心脏异前列烷水平提升两倍,进一步增加心脏氧化应激反应[11]。Zhang等[5]研究表明血糖波动引起的炎性反应,可能诱发糖尿病患者发生冠心病。同时另一项研究发现血糖波动是ST段抬高心肌梗死患者预后的独立预测因子,尤其对于合并糖尿病患者[12]。无论0.5 h高血糖还是血糖波动都与大血管并发症紧密联系,因此0.5 h高血糖者的血糖波动更应该引起临床工作者的重视。
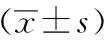
表4 各组血糖及胰岛素峰值、血糖波动、胰岛素增量、早时相分泌功能及胰岛素敏感性的比较
注:LSD法组间两两比较差异均有统计学意义(P<0.01);ISIm:Matsuda胰岛素敏感指数;DI30:30 min处置指数

表5 血糖波动与生成指数、胰岛素敏感指数及处置指数的相关性分析
注:PPGE:糖负荷后血糖波动;ISIm:Mastuda胰岛素敏感指数;DI30:30 min处置指数;0.5 hPG:0.5 h血糖
综上,0.5 h高血糖者糖负荷后的血糖峰值依次后延且高峰逐渐升高,血糖波动也越来越大。胰岛素早时相分泌的缺陷和胰岛素抵抗是导致糖负荷后血糖波动加大的重要原因,应给予更有针对性的治疗。
[1] American Diabetes Association. Standards of medical care in diabetes-2008[J]. Diabetes Care,2008,31 (Suppl 1):S12-S54.
[2] 刘乐,于会宁,郭晓坤,等.OGTT0.5 h血糖切点值在糖尿病及糖尿病前期中的临床意义[J].国际内分泌代谢杂志,2015,35(4):217-211.
[3] 王吉耀,廖二元,胡品津,等.内科学[M].北京:人民卫生出版社,2005:969.
[4] Chen G, Zou X, Yao J,et al. The correlation between the oral glucose tolerance test 30-minutes plasma glucose and risk factors for diabetes and cardiovascular diseases: a cross-sectional epidemiological study of diabetes in Fujian Province in the South-East of China[J]. J Endocrinol Invest, 2011,34(5): e115-e120.
[5] Zhang XG, Zhang YQ, Zhao DK, et al. Relationship between blood glucose fluctuation and macrovascular endothelial dysfunction in type 2 diabetic patients with coronary heart disease[J]. Eur Rev Med Pharmacol Sci,2014, 18(23):3593-3600.
[6] Zhou W, Gu Y, Li H,et al. Assessing 1-h plasma glucose and shape of the glucose curve during oral glucose tolerance test[J]. Eur J Endocrinol,2006,155(1):191-197.
[7] Zhou W, Li H, Gu Y,et al. The ROC analysis for different time points during oral glucose tolerance test[J]. Diabetes Res Clin Pract, 2006,72(1): 88-92.
[8] Hanefeld M, Sulk S, Helbig M,et al.Differences in glycemic variability between normoglycemic and prediabetic subjects[J].J Diabetes Sci Technol, 2014,8(2):286-290.
[9] 何利平,王椿,钟莉,等.成都地区糖耐量正常者血糖水平变化的特征分析[J].四川大学学报(医学版),2009,40(4):704-707.
[10] 喻明,周健,王锋,等.糖耐量受损患者的动态血糖监测[J].中国现代医学杂志,2007,17(2):200-202.
[11] Vimercati C, Qanud K, Mitacchione G, et al. Beneficial effects of acute inhibition of the oxidative pentose phosphate pathway in the failing heart[J]. Am J Physiol Heart Circ Physiol, 2014, 306(5): H709-H717.
[12] Zhang JW, He LJ, Cao SJ,et al. Effect of glycemic variability on short term prognosis in acute myocardial infarction subjects undergoing primary percutaneous coronary interventions[J]. Diabetol Metab Syndr, 2014,6:76.
Characteristicsofplasmaglucoseexcursioninsubjectswithhyperglycemiaat0.5hourpostglucoseload
LiuLe*,FengPing.
*TheCadreSanitarianDivision,The2ndHospitalAffiliatedofTianjinMedicalUniversity,Tianjin300211,China
FengPing,Email:xingxing626@sina.com
ObjectiveTo determine the characteristics of glycemic excursion of hyperglycemia at 0.5 h during oral glucose tolerance test(OGTT).MethodsA total of 4 351 subjects were recruited to take an OGTT. According to the cutoff values of 0.5 h plasma glucose (0.5 hPG) for diagnosing glucose metabolic abnormalities which were concluded in the preliminary experiments by author, all subjects were divided into three groups: normal glucose tolerance group(n=1 370),prediabetes mellitus group(n=1 131) and diabetes mellitus group(n=1 850), and the consistency between 2008 American Diabetes Association(ADA) diagnostic criteria and 0.5 hPG cutoff value was performed. Then the peak plasma glucose and insulin,insulin increment, glucose excursion, insulingenic index, Mastuda insulin insensitivity index, 30 min disposal index among three groups were compared. The correlation between plasma glucose excursion and β-cell function, insulin sensitivity was analyzed with linear correlation.Results2008-ADA diagnostic criteria and 0.5 hPG diagnostic criteria had good consistency (Kappa=0.563,P<0.001). According to 0.5 hPG cutoff value, peak of plasma glucose occurred at 1-hour in normal glucose tolerance group and prediabetes mellitus group, and 2-hour in diabetes mellitus group(χ2=710.74,P<0.001). Following with the increase of 0.5 hPG,peak plasma glucose and glucose excursion were also increased(F=3 313.21,2 580.53,allP<0.01). However,fasting insulin, insulin peak after glucose loading, insulin increment, insulingenic index, Mastuda insulin insensitivity index and 30 min disposal index decreased (F=8.78-1 697.16, allP<0.01). There was a negative correlation between glucose excursion and insulingenic index, Mastuda insulin insensitivity index,30 min disposal index(r=-0.114,-0.148,-0.639, allP<0.01), and a positive correlation between 0.5 hPG (r=0.796,P<0.01).Conclusions0.5 hPG cutoff value is a good supplement for diagnosis of glucose metabolism. The peak of plasma glucose delays and the plasma glucose excursion increases followed with the increase of plasma glucose in subjects with hyperglycemia at 0.5 h post glucose-load. Plasma glucose excursion is influenced by early-phase insulin secretion and insulin sensitivity.
Diabetes mellitus;Oral glucose tolerance test;0.5-Hour hyperglycemia;Plasma glucose excursion; Peak of postload glucose
(IntJEndocrinolMetab,2015,35:302-305)
10.3760/cma.j.issn.1673-4157.2015.05.004
300211 天津医科大学第二医院干部保健科(刘乐);300052 天津医科大学总医院代谢科(冯凭)
冯凭,Email:xingxing626@sina.com
2015-04-01)
