油樟叶多糖的提取及其体外抗自由基活性研究*
2015-12-25杜永华敖光辉魏琴曾月李玉杰
杜永华,敖光辉,魏琴,曾月,李玉杰
1(宜宾学院香料植物资源开发与利用四川省高校重点实验室,四川宜宾,644000)
2(内江师范学院,四川内江,641112)3(宜宾学院生命科学与食品工程学院,四川宜宾,644000)
4(宜宾学院 食品科学与工程研究所,四川宜宾,644000)
植物多糖是植物体内广泛存在的生物活性物质,除具有免疫调节、抗肿瘤、降血糖、抗病毒、降血脂等生物活性外,还具有清除自由基、抗氧化、抗衰老、抗疲劳作用,日益成为食品科学、天然药物、生物化学与生命科学研究领域的热点。油樟[Cinnamomum longepaniculatum(Gamble)N.Chao]是我国特有的樟科(Lauraceae)樟属(Cinnamomum)植物树种[1],其叶富含挥发油,比同属植物香樟[Cinnamomum.camphora(Linn.)Presl]叶含油量高1~2倍,是香料、食品、医药、日用和化工产品的重要原料来源[2]。研究表明,香樟叶除含有挥发油外,还含有多糖、黄酮、生物碱、多酚等生物活性成分[3-4],其多糖成分含量丰富,冬季干叶片多糖含量达116.55 mg/g,具有一定抗氧化活性[3,5]。油樟叶在提取挥发油后的残渣提取物具有抗微生物[6]、抗癌[7]、抗炎[8]和镇痛[9]作用。然而,目前对油樟叶中多糖成分的提取及其抗氧化活性研究未见相关文献报道。本实验采用均匀设计法优选油樟叶多糖的提取工艺,并对其体外抗自由基活性进行了研究。
1 材料与方法
1.1 材料与设备
油樟(C.longepaniculatum)叶,采摘于四川省宜宾市翠屏区邱场乡油樟种植基地;葡萄糖标准品购自贵州迪大生物有限公司,含量≥98%;1,1-二苯基-2-三硝基苯肼[1,1-Diphenyl-2-picrylhydrazyl radical 2,2-Diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH]梯希爱(上海)化成工业发展有限公司;其他试剂均为国产分析纯。
TU-1901双光束紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 油樟叶预处理
采用水上蒸馏的方法,将油樟叶用水蒸气蒸馏3 h除去挥发油,残渣于60℃烘干,粉碎,取60~80目油樟叶粉末,加石油醚(沸程30~60℃)索氏抽提1 h脱脂,残渣60℃烘干,即得脱油油樟叶粉,待用。
1.2.2 油樟叶多糖含量的测定
精密称取D(+)葡萄糖标准品50.0 mg,置于100 mL容量瓶中,加蒸馏水溶解并定容至刻度,摇匀,精密吸取14.0 mL至100 mL容量瓶中,加蒸馏水定容至刻度,摇匀即得0.07 mg/mL葡萄糖标准溶液。精密吸取 0.6、0.8、1.0、1.2、1.4、1.6、1.8 mL葡萄糖标准溶液分别至10 mL容量瓶中,用蒸馏水补至2.0 mL,加入1.0 mL 5%苯酚,摇匀后迅速加入5.0 mL浓H2SO4,充分混合均匀,室温放置20 min,以2.0 mL蒸馏水代替葡萄糖标准溶液同法显色作空白对照。在489 nm处测定吸光度A,以吸光度值A为纵坐标,葡萄糖质量浓度c(mg/L)为横坐标,绘制标准曲线,求得线性回归方程为A=0.731 6c-0.052 4,R2=0.999 3。
将油樟叶多糖提取液定容至250 mL,吸取2.5 mL稀释定容至50 mL,取定容液2.0 mL于10 mL容量瓶中,按标准曲线绘制的显色操作,测定吸光度值,根据标准曲线的回归方程和稀释倍数计算样品溶液中的多糖含量,计算多糖提取量。
多糖提取率/%=[提取液中多糖含量(g)/脱油油樟叶干粉质量(g)]×100
1.2.3 油樟叶多糖的提取工艺流程
脱油油樟叶粉→加入水→浸泡→回流提取→过滤→滤液减压浓缩→Sevage法去蛋白→体积分数80%乙醇沉淀→无水乙醇洗涤沉淀→真空冷冻干燥→粗多糖
1.2.4 单因素实验
考察提取温度(40、55、70、85、100 ℃)、液料比[(5、10、15、20、25)∶(mL∶g)]、浸泡时间(0、30、60、90、120 min)和提取时间(30、80、130、180、230 min)对油樟叶多糖提取率的影响。
1.2.5 均匀设计试验优化多糖提取工艺
在单因素实验基础上,选取提取温度、料液比、浸泡时间和提取时间4个因素,参考文献[10],选取(108)表安排试验,对油樟叶总多糖的提取工艺进行优选,并根据优选条件进行验证实验。
1.2.6 油樟叶多糖体外抗自由基活性
(1)DPPH自由基清除活性参考马金宝等[11]方法,取2.0 mL不同浓度多糖水溶液,在517 nm处测定其对DPPH自由基的清除活性,阳性对照组用同等浓度VC代替多糖溶液,每个样品平行测定3次。DPPH自由基清除率(E,%)计算:
E/%=[1-(A2-A1)/A0]×100
式中:A0为2 mL DPPH乙醇溶液+2 mL溶剂的吸光度值;A1为2 mL待测溶液+2 mL溶剂的吸光度值;A2为2 mL DPPH乙醇溶液+2 mL待测溶液的吸光度值。
(2)超氧阴离子自由基清除活性采用邻苯三酚自氧化法[12],取1.0 mL不同浓度多糖水溶液,在320 nm处测定其对超氧阴离子自由基的清除活性,空白对照组用等体积Tris-Hcl溶液代替多糖溶液,阳性对照组用同等浓度VC代替多糖溶液,每个样品平行测定3次。超氧阴离子自由基清除率(E,%)计算:
E/%=(A2-A1)/A2×100
式中:A2为空白对照的吸光度值;A1为待测溶液的吸光度值。
(3)羟基自由基清除活性采用 Fenton法[13],取1.0 mL不同浓度多糖水溶液,在510 nm处测定其对羟基自由基的清除活性,以蒸馏水为空白对照,阳性对照组用同等浓度VC代替,每个样品平行测定3次。羟基自由基清除率(E,%)计算:
E/%=[1-(A2-A1)/A0]×100
式中:A0为蒸馏水空白对照的吸光度值;A1为l.0 mL 9 mmol/L FeSO4+1.0 mL 9 mmol/L水杨酸-乙醇溶液+1.0 mL待测溶液+1.0 mL蒸馏水的吸光度值;A2为1.0 mL 9 mmol/L FeSO4+l.0 mL 9 mmol/L水杨酸-乙醇溶液+1.0 mL待测溶液+1.0 mL 8.8 mmol/L H2O2的吸光度值。
1.2.7 数据分析
采用DPS7.05统计软件的二次多项式逐步回归模型分析均匀设计实验数据,采用数量型数据几值分析模型计算各测试物对自由基的半数清除浓度(EC50)。
2 结果与分析
2.1 单因素实验结果
单因素实验结果见图1。由图1-a可知,在固定液料比15∶1(mL∶g)、浸泡时间 30 min、提取时间180 min条件下,随着提取温度的升高,油樟叶多糖分子扩散运动加剧,溶出量增加,油樟叶多糖提取率呈线性增加,100℃达最高为12.65%。表明在实验范围内温度对多糖提取率影响显著,多糖提取率随温度增加而增加,但温度超过100℃,可能对多糖的稳定性和活性产生影响[14],因此,多糖优选提取温度控制在100℃为宜。
由图1-b可知,在固定提取温度95℃,浸泡时间30 min,提取时间180 min条件下,油樟叶多糖提取率随着液料比的增加而增加,液料比超过15∶1时,大部分油樟叶多糖已溶出,溶剂与材料中多糖的浓度差变小,多糖提取率增幅减小。在液料比达20∶1时,多糖提取率最高达13.65%。超过此液料比后多糖提取率略有下降,可能是液料比过大时,杂质溶出增加,相当于多糖被稀释,得率反而降低[15]。因此,优选液料比为20∶1(mL∶g)。
由图1-c可知,在固定提取温度95℃,液料比15∶1,提取时间180 min条件下,油樟叶多糖提取率先随浸泡时间的延长而缓慢升高,浸泡60 min时多糖提取率最高达12.01%,此后多糖提取率缓慢下降。因此,浸泡时间以60 min为宜。但在实验所设浸泡时间范围内,由于油樟叶粉末粒度较小,溶剂分子能较快扩散到物料内部,迅速进入多糖动力学溶出过程,多糖提取率变化幅度较小。
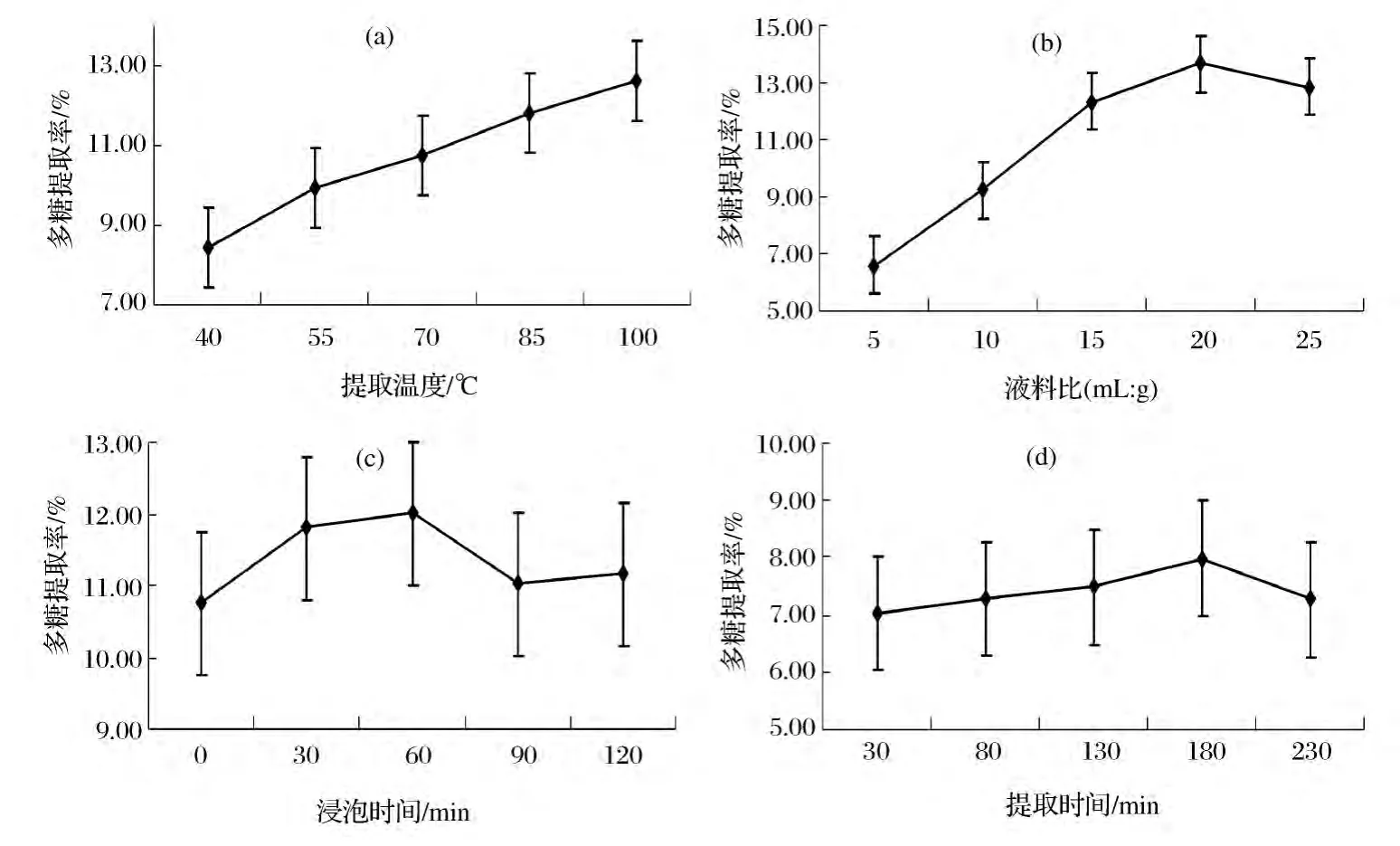
图1 提取温度(a)、液料比(b)、浸泡时间(c)和提取时间(d)对多糖提取率的影响Fig.1 Influence of extraction temperature,liquid-solid ratio,immersion time and extraction time on the extraction rate of polysaccharides
由图1-d可知,在固定提取温度95℃,液料比15∶1,浸泡时间30 min条件下,多糖提取率随提取时间的延长呈现先缓慢增加后下降趋势,180 min时提取率最高达7.99%。表明时间过短,多糖溶出不充分;时间过长,引起多糖结构变化而使提取率下降。因此,优选提取温度为180 min。在实验所设提取时间范围内,多糖提取率变化幅度不大。
2.2 均匀设计实验结果
2.2.1 数学回归模型的建立及显著性检验
在单因素实验基础上采用均匀设计实验优化油樟多糖提取工艺,实验设计及结果见表1。

表1 均匀设计实验安排与结果Table 1 Design matrix and results of uniformed design test
由表1可知,油樟多糖提取率最高实验组合为提取温度100℃,液料比23 mL/g,浸泡时间60 min,提取时间155 min,提取率为14.06%。采用DPS统计软件对实验数据进行二次多项式逐步回归分析,得油樟叶多糖提工艺参数的回归方程:

回归方程相关系数R=0.998 0,F=71.331 1,P=0.013 9<0.05,Durbin-Watson统计量d=1.743 6,接近2,多元回归模型可用。在建立多元回归模型的同时进行通径分析,决定系数R2=0.996 0,剩余通径系数ρe=0.063 1,通径分析成立。表明上述回归方程具有统计学意义,可以反映多元线性回归模型,回归分析有效。
由上述回归方程可知,X3和X4未入选方程,表明在实验所选因素水平范围内,浸泡时间(X3)和提取时间(X4)对油樟叶多糖提取率无显著影响,这与单因素实验结果相似。
对上述模型进行显著性分析,结果见表2。由表2可知,从偏相关系数大小来看,提取温度(X1)对多糖提取率的影响大于液料比(X2),前者的影响达到显著水平(P≤0.05)。提取温度与提取时间的交互影响达到显著水平(P≤0.05),液料比与浸泡时间、浸泡时间与提取时间之间存在交互作用,但对多糖提取率影响不显著(P>0.05)。

表2 各因素的显著性检验Table 2 Significance of each variable term in the fitted regression equation for he extraction rate of polysaccharides
2.2.2 提取工艺的优化与验证
通过DPS软件求解上述回归方程,得到油樟叶多糖提取工艺的优化条件为:提取温度100℃,液料比16∶1(mL∶g),浸泡时间 0 min,提取时间 215 min,多糖提取率模型预测值为15.73%。在此条件下进行3次验证试验,测得实际多糖提取率为14.36%,与预测值相近,且高于均匀设计实验中多糖提取率最高的组合(提取率为14.06%),表明均匀设计实验获得的多元回归模型可用于油樟叶多糖提取工艺的优化。优化的油樟叶多糖提取工艺的验证结果表明油樟叶中含有较丰富的多糖成分,其含量略高于香樟叶中总多糖含量(12.94%)[16]。
2.3 抗自由基活性
以优化工艺制备油樟叶多糖提取液,经浓缩、去蛋白、乙醇沉淀、洗涤和真空冷冻干燥得到黄褐色粉末状油樟叶粗多糖,粗多糖得率为10.32%,多糖纯度为318.40 mg/g。可见,多糖提取液经后续工艺处理后损失较大,需要进一步对后续工艺进行优化。
由图2-a可知,油樟叶多糖对DPPH自由基清除能力随质量浓度的增加而增强,在低浓度范围内与VC的清除能力差异较明显,质量浓度达0.2 mg/mL后,清除率逐渐接近VC。当多糖浓度达1.6 mg/mL时,其对DPPH自由基清除率达90.00%,表明油樟叶多糖在高浓度范围内对DPPH自由基的清除能力较强。这一趋势与紫椴花多糖清除DPPH自由基结果相似[15]。由表3可知,油樟叶多糖对DPPH自由基的清除能力与其质量浓度有较明显的线性关系(R=0.941 7),其 EC50为0.086 mg/mL,但仍不如VC的清除能力强(VC的EC50为0.002 mg/mL)。自由基清除剂通过转移传递电子或氢原子给DPPH来中和其自由基[17],因此,以上结果表明油樟多糖可能有较强的供氢能力。

图2 油樟叶多糖的体外清除自由基活性Fig.2 Radical scavenging activities of polysaccharides from C.longepaniculatum in vitro
由图2-b可知,在邻苯三酚自氧化反应体系中,油樟叶多糖具有一定清除超氧阴离子自由基作用,其清除能力随其质量浓度的增加而增强,但在所选质量浓度范围内,其清除率低于60%,而VC在质量浓度为0.4 mg/mL时的清除率达69.80%。在低质量浓度范围内,油樟多糖与VC对超氧阴离子的清除能力较为接近,质量浓度大于0.4 mg/mL后其抑制率明显低于VC。可见,油樟多糖对超氧阴离子自由基清除能力与VC有较大差距,在低质量浓度内有相对较强清除能力[18]。油樟多糖对超氧阴离子自由基的EC50为1.075 mg/mL,大于VC的6倍(表3)。
由图1-c和表3可知,油樟多糖对羟基自由基的清除能力随着质量浓度的增加而呈线性增强(R=0.986 9),当质量浓度为3.2 mg/mL时,对羟自由基清除率达80.20%,但明显低于同浓度VC的清除率(95.30%)。几率值分析计算出油樟多糖和VC对羟自由基EC50分别为0.905、0.140 mg/mL。可见,油樟多糖对羟自由基具有一定清除作用,但其清除能力弱于VC。
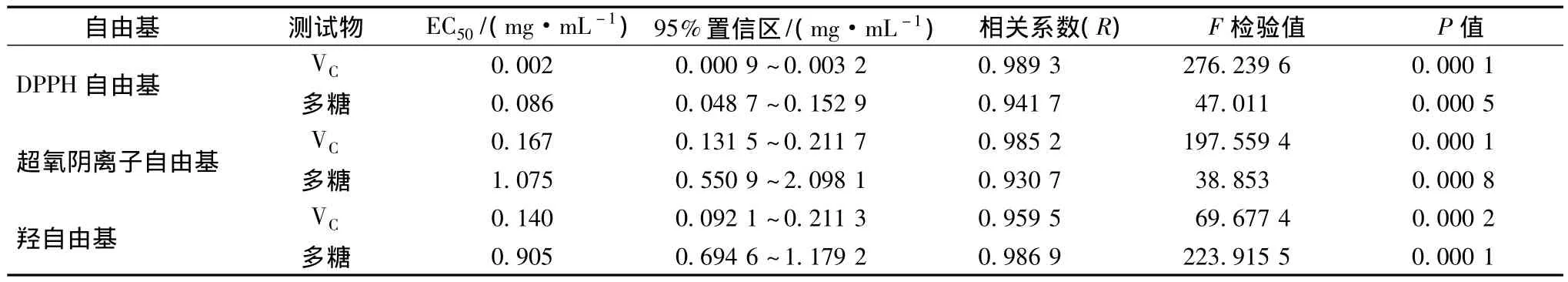
表3 油樟叶多糖对DPPH自由基、超氧阴离子自由基、羟自由基的半数清除浓度Table 3 The half scavenging concentration of polysaccharides from C.longepaniculatum on DPPH·,O2-· and·OH
3 结论
采用热水浸提法,在单因素实验基础上,以提取温度、液料比、浸泡时间、提取时间为自变量,多糖提取率为考察指标,经均匀设计实验优化油樟叶多糖的提取工艺条件为提取温度100℃、液料比16∶1(mL∶g)、浸泡时间0 min、提取时间215 min,多糖提取率为14.36%,与模型预测值接近,回归模型能较准确地拟合油樟叶多糖的提取工艺。
采用化学比色法,以VC为阳性对照,测定油樟叶多糖对不同自由基的体外清除能力,表明在不同抗自由基体系中油樟叶多糖表现出不同的清除能力,在一定质量浓度范围内呈现明显的量效关系,对DPPH、超氧阴离子和羟基自由基的 EC50分别为0.086、1.075、0.905 mg/mL,其清除能力均低于VC。可见,油樟叶多糖具有一定抗自由基活性,对油樟多糖的进一步研究与开发具有重要意义。
[1] 吴征镒,孙航,周浙昆,等.中国植物区系中的特有性及其起源和分化[J].云南植物研究,2005,27(6):577-604.
[2] 罗中杰,李维一,魏琴,等.宜宾油樟的现状及未来[J].四川师范大学学报:自然科学版,2001,24(3):317-319.
[3] 王先.芳樟叶黄酮和多糖的提取分离、结构鉴定及抗氧化活性研究[D].厦门:厦门大学,2008:4-6.
[4] 周海旭,李忠海,钟海雁,等.樟树叶多酚超声波提取法提取工艺的响应面优化[J].经济林研究,2013,31(4):152-156.
[5] 王娜,王凯旋,李静,等.樟树叶片水溶性粗多糖提取及抗氧化活性研究[J].北方园艺,2010(24):70-73.
[6] 张超,魏琴,杜永华,等.脱油油樟叶提取物的体外抑菌活性研究[J].广西植物,2011,31(5):690-694.
[7] 叶奎川.油樟叶提取物的体外抗肝癌活性及其作用机理研究[D].雅安:四川农业大学,2012:30-46.
[8] 魏琴,殷中琼,杜永华,等.油樟叶乙醇提取物抗炎活性的研究[J].中国兽医科学,2011,41(8):859-864.
[9] 陶翠.油樟叶提取物的抗菌、镇痛和抗炎活性及其作用机理研究[D].雅安:四川农业大学,2011:49-56.
[10] 蒲忠慧,杜永华,魏琴等.均匀设计法优选仙茅提取工艺的试验[J].中国兽医杂志,2012,48(12):70-72.
[11] 马金宝,沈业寿,李峰,等.亮菌多糖-1b清除自由基作用研究[J].中国食用菌,2008,27(6):38-40.
[12] 刘长建,姜波,刘亮,等.枸杞子多糖提取工艺优化及体外抗氧化活性研究[J].时珍国医国药,2009,20(3):661-663.
[13] 吴彦.升麻多糖提取及其抗氧化作用[J].光谱实验室,2013,30(5):2 444-2 446.
[14] 郭永霞,王艳丽,殷奎德.山杏果肉水溶性多糖提取工艺参数优化[J].食品科学,2010,31(14):116-119.
[15] 王婧杰,陈玉霞,穆立蔷.紫椴花多糖的微波提取及体外抗氧化活性[J].食品与生物技术学报,2014,33(3):321-329.
[16] 孙崇鲁.香樟叶中多糖的提取及含量测定[J].应用化工,2011,40(8):1 434-1 436.
[17] 王艳群,孟宪军,刘丽,等.五味子废渣中多糖的分离及体外抗氧化活性[J].食品与生物技术学报,2013,32(2):163-168.
[18] 孟宪军,孙希云,朱金艳,等.蓝莓多糖的优化提取及抗氧化性研究[J].食品与生物技术学报,2010,29(1):56-60.
