N-cadherin通过β-catenin调控鸡胚脊髓连合纤维向对侧的投射①
2015-12-24杨慈清李小英王聪睿张必超林俊堂新乡医学院生命科学技术学院新乡453003
杨慈清李小英 王聪睿张必超 李 晗 林俊堂(新乡医学院生命科学技术学院,新乡453003)
N-cadherin通过β-catenin调控鸡胚脊髓连合纤维向对侧的投射①
杨慈清②李小英王聪睿②张必超李晗林俊堂③
(新乡医学院生命科学技术学院,新乡453003)
[摘要]目的:阐明鸡胚发育过程中神经钙黏蛋白(N-cadherin)和β-连环蛋白(β-catenin)在脊髓连合纤维发育中的作用。方法:在鸡胚发育第3天(stage22),将N-cadherin和β-catenin干扰载体通过活体电转基因技术导入脊髓,电转后继续培养3 d(stage29),取材、固定、包埋和切片。分为N-cadherin干扰组、β-catenin干扰组,β-catenin和N-cadherin共同干扰组以及转染pGU6-GFP-neo表达质粒对照组;采用荧光免疫组织化学法检测N-cadherin和β-catenin蛋白表达变化;根据GFP表达结果,观察脊髓连合纤维的投射情况。结果:在鸡胚发育过程中,在脊髓抑制N-cadherin的表达会降低β-catenin的表达;在N-cadherin抑制表达72 h后观察到脊髓连合纤维向对侧的投射产生被抑制;抑制β-catenin表达出现类似向对侧投射障碍; N-cadherin和β-catenin同时被干扰时,连合纤维投射的抑制效果相似。结论: N-cadherin参与调控脊髓连合纤维的发育过程,其部分作用机制可能是通过下调β-catenin的表达实现的。
[关键词]鸡胚;神经钙黏蛋白;β-连环蛋白;神经纤维
①本文受2013年河南省教育厅科学技术研究重点项目(13A320866)、新乡医学院科研培育基金(2013QN125)、新乡医学院科研培育基金(2013QN115)和新乡医学院博士启动基金(505090)资助。
②河南省医用组织再生重点实验室,新乡453003。
N-cadherin regulates projection of spinal commissural axons via β-catenin during chicken embryonic development
YANG Ci-Qing,LI Xiao-Ying,WANG Cong-Rui,ZHANG Bi-Chao,LI Han,LIN Jun-Tang.College of Life Science and Technology,Xinxiang Medical University,Xinxiang 453003,China
[Abstract]Objective: To explore the role of N-cadherin and β-catenin in the formation of spinal commissural axon projection during chicken embryonic development.Methods: Fertilized eggs were cultured for three days(stage22),N-cadherin or β-catenin interference plasmid was injected into the neural tube and in vivo electroporation was performed.Three days after the electroporation,embryos were collected,fixed with 4% PFA,embeded with OCT,and cut into frozen sections.Four groups (knockdown of N-cadherin or βcatenin or both of them,and control) were included in this study.Immunohistochemistry method was used to analyze the protein expression result of N-cadherin or β-catenin.The changes of spinal commissural projections were observed with GFP fluorescence.Results: During chicken embryonic development,knockdown of N-cadherin inhibited the expression of β-catenin in the spinal cord.The commissural nerve fibers projecting to the contralateral side of the spinal cord was impaired after knockdown of N-cadherin or β-catenin; this phenotype was similar after knocking down both of them.Conclusion: N-cadherin is implicated in the formation of spinal commissural projection in the developing spinal cord,possibly via β-catenin.
[Key words]Chicken embryonic; Neural cadherin;β-catenin; Nerve fibers
神经系统具有左右对称的结构特征,连合纤维是系统两侧信息交换的主要形式。在鸡胚发育过程中,脊髓两侧的神经纤维也存在交互向对侧的投射,即脊髓的连合纤维[1]。杨琳等[2]曾以成年大鼠作为动物模型,应用辣根过氧化物酶逆行标记脊髓连合纤维,证明了在哺乳动物脊髓中也存在神经纤维的投射。在胚胎发育过程中,连合纤维神经元产生于神经管的背侧,在向腹侧迁移过程中发出连合纤维,经过底板投射到对侧脊髓。这一过程受到多种神经导向因子的调控,如表达在脊索和底板的Netrin诱导表达其受体DCC的连合纤维的轴突朝向腹侧中线的生长过程[3,4]。N-cadherin是一种重要的黏附分子,在鸡胚发育过程中N-cadherin在脊髓中的表达具有典型的时空性变化,尤其在连合纤维的发育阶段[5]。连环蛋白β-catenin是经典Wnt通路的重要和关键分子,作为转录辅助因子在神经系统发育中发挥重要作用。如它参与神经系统的模式发生、神经前体细胞增殖分化以及神经元突起形成等方面。研究显示胞内β-catenin浓度的较高水平是维持神经干细胞增殖状态的必要条件,在剔除β-catenin的基因突变鼠,大脑和脊髓的神经组织体积下降,神经前体细胞数量显著减少[6-8]。对海马等神经元的研究发现,细胞内游离β-catenin水平还影响着神经元突起的形态发生,高水平的β-catenin能促进神经元树突的分支[9]。本实验借助鸡胚活体电转基因技术,下调N-cadherin和β-catenin的表达,分析其对脊髓神经纤维投射的影响,为了解它们在中枢神经系统中的作用提供证据。
1 材料与方法
1.1材料与仪器pCAGGS-GFP(绿色荧光蛋白)质粒由本实验室保存; N-cadherin干扰载体(百奇生物科技有限公司合成),干扰靶序列: GCAAATGAAGGTGAAGCTAAC,所用载体pGPU6-GFP-Neo; β-catenin干扰载体(百奇生物科技有限公司合成),干扰靶序列: GCTTTAGGACTCCACCTTACA,所用载体pGPU6-GFP-Neo;一抗兔抗鸡N-cadherin(Redies实验室馈赠) ;小鼠抗β-catenin单克隆抗体(中杉金桥生物技术有限公司) ;二抗山羊抗兔Cy3标记(中杉金桥生物技术有限公司) ;山羊抗小鼠Cy3标记(中杉金桥生物技术有限公司) ; Dapi(Roche公司) ;质粒DNA大量提取试剂盒(北京康为世纪生物技术有限公司) ;受精鸡蛋(本地种鸡场) ; CUY-21型多功能活体电转仪(日本NEPAGene公司) ; M205FA型倒置体视荧光显微镜(德国Leica公司) ; Nikon ECLIPSE 80i荧光显微镜(日本NIKON) ; CM1850冰冻切片机(德国Leica)。
1.2方法
1.2.1鸡胚培养从种鸡厂购买的新鲜受精鸡蛋,当天带回实验室,用温水洗净、擦干,水平放入孵化箱。在温度37.8℃,湿度65%,转蛋间隔2 h的条件下孵育到第3天(stage 22),用10 ml注射器针头吸取3~4 ml蛋清,用眼科手术剪刀从上方针孔处将上面蛋壳剪开2~4 cm圆形开口,暴露卵黄和胚盘,进行活体电转基因操作。转染后医用胶布密封开口继续培养到特定时间进行观察和取材。
1.2.2鸡胚转染2 μg/μl的pGU6-GFP-neo-N-cadherin-shRNA质粒和0.5 μg/μl的pCAGGS-GFP质粒混合液,2 μg/μl的pGU6-GFP-neo-β-cateninshRNA质粒与0.5 μg/μl pCAGGS-GFP质粒混合液; 2 μg/μl的pGU6-GFP-neo-N-cadherin-shRNA质
粒和2 μg/μl的pGU6-GFP-neo-β-catenin-shRNA质粒与0.5 μg/μl pCAGGS-GFP质粒混合液,以及2 μg/μl的pGU6-GFP-neo和0.5 μg/μl pCAGGS-GFP的对照质粒,分别各取0.5~1 μl混合液用显微注射毛细玻璃针在体视显微镜下注射到神经管的中央管内;电极放在已注射质粒的神经管两侧,阳性电极在拟转基因一侧。电转电压18 V,电脉冲长度60 ms,间隔90 ms,电脉冲6次。电击后用医用胶布密封开口,整个过程在无菌操作工作台内完成;放回培养箱继续培养3 d,依次在倒置体视荧光显微镜下观察结果,电转部位呈现绿色荧光者视为阳性。
1.2.3取材与切片每组至少收集3个胚胎。取出整个胚胎,切下脊髓区域,置于4%多聚甲醛(PFA)中过夜;取出组织,吸干液体,转移到18%蔗糖溶液过夜;待沉淀到管底部时取出组织,用OCT包埋,置于液氮中冷冻后放-80℃冰箱储存备用。切片时从-80℃冰箱取出已包埋的组织,在冷冻切片机上连续切片,切片分为10套;切片后置烤片机37℃烤片30 min以上,置-80℃冰箱保存备用。
1.2.4荧光免疫组织化学从-80℃低温冰箱中取出的冷冻切片置40℃干燥20 min,4%PFA中4℃固定15 min,用1×TBS清洗3次,每次5 min,在含0.1%Triton X-100的1×TBS中再孵育5 min。每张载玻片上加1 ml免疫组化封闭液孵育1 h。去除封闭液后每张载玻片加300 μl用封闭液稀释的合适浓度的一抗:兔抗鸡N-cadherin(1∶500)或鼠抗βcatenin(1∶100) 4℃孵育过夜。经l×TBS清洗3次,每次5 min,每张片加300 μl用封闭液稀释的用Cy3标记的针对一抗的二抗(1∶500稀释),室温孵育4 h。经DAPI衬染后封片,在荧光显微镜下观察并拍照。用Photoshop CS3软件处理图片,将3颜色同位拼合在一起,从而分析不同蛋白质的表达定位;荧光强度平均光密度和面积采用Image-Pro Plus 6.0软件进行分析;数据处理采用SPSS Statistics17.0软件进行统计分析。
2 结果
2.1鸡胚发育过程脊髓中敲减N-cadherin或βcatenin的表达在实验中,采用shRNA干扰质粒,借助鸡胚活体原位电转基因技术,在鸡胚脊髓中对N-Cadherin和β-catenin分别进行干扰。在转染质粒的一侧(图1B),N-cadherin的表达相对于对侧降低(图1C),说明N-cadherin的shRNA干扰载体能够抑制N-cadherin在鸡胚脊髓中的表达。在转染β-catenin干扰质粒的脊髓切片中,同样可以观察到电转侧(图1N)的β-catenin表达也受到抑制(图1O)。在N-cadherin和β-catenin干扰质粒共同干扰组中,电转侧的N-cadherin(图1S)和β-catenin(图1W)的表达同时发生下降。在对照组中,N-cadherin(图1A')或β-catenin(图1E')在电转侧的表达与对侧没有差别。为进一步验证其干扰效果,对N-cadherin和β-catenin荧光免疫组化结果借助图像分析软件进行分析,在分析过程中为了结果更具有可比性,充分利用鸡胚脊髓的定时定位转染优势,将脊髓横切片从脊髓中央分为转染测和对侧未转染侧,在同一个采集视野范围内,统计平均光密度值,避免了由于组间拍照曝光时间长度的差异。根据统计结果从图中(图2)可以看出,转染N-cadherin的shRNA干扰载体组中,转染侧N-cadherin和βcatenin表达的平均光密度值极显著(P<0.01)地低于对侧。在转染β-catenin干扰载体组中,转染侧N-cadherin的平均光密度与对侧没有太大差别,而βcatenin是低于对侧的;在混合转染组中转染侧N-cadherin和β-catenin都有降低,但差异不显著;对照组中转染侧和对侧N-cadherin和β-catenin不存在明显的差别,统计结果与图片中观察到的结果一致,从该统计结果图中能更直观地看出其干扰的效果。

Note: The first column is nuclei staining with DAPI; the second column is the results of the report gene GFP expression; the third column C,K,S,A' is the results of N-cadherin (red) expression,and G,O,W,E' is the results of β-catenin (red) expression; the fourth column is the merge result.Scale bar is 200 μm in F' for all panels.
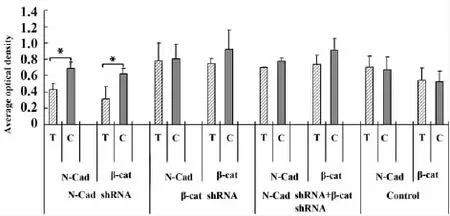
Note: * .show significant differences(P<0.001) .
2.2下调N-cadherin或β-catenin的表达影响脊髓连合纤维的发育在抑制N-cadherin表达后,GFP标记的神经纤维向对侧的投射明显减少(图1B、F)。在下调β-catenin表达的脊髓中,GFP标记的神经纤维向对侧的投射也明显减少(图1J、N)。在同时下调N-cadherin和β-catenin的情况下,GFP标记的神经纤维向对侧脊髓腹侧白质内也出现显著降低,但并没有显示出比前两情形更严重(图1R、V)。在对照组中,GFP标记的神经纤维在对侧脊髓白质内大量分布(图1Z、D')。为了更为直观地对比连合纤维被抑制的结果,借助图像分析软件对脊髓横切片GFP标记的细胞进行了分析,从脊髓中央分隔,统计被转染侧GFP表达面积,然后统计对侧投射连合纤维GFP表达面积,计算投射连合纤维GFP表达面积与被转染侧GFP表达面积的比值,投射纤维越多比值越大,根据统计结果绘制柱形图,从图中(图3)可以看到,与对照组相比,转染组中都极显著(P<0.01)低于对照组,而转染组间差异不显著,统计结果与图片中观察到的现象统一。以上结果充分说明在抑制N-cadherin或β-catenin表达会影响连合纤维向脊髓对侧的投射。
2.3 N-cadherin抑制表达对β-catenin表达的影响及其对神经纤维投射影响作用的探讨在抑制N-cadherin表达条件下,对β-catenin的表达进行了染色。从结果可以看到,在N-cadherin抑制表达的一侧脊髓,β-catenin的表达也明显下降(图1G)。相反,抑制β-catenin表达后N-cadherin的表达并没有明显的变化(图1K),说明N-cadherin调控β-catenin的表达,而β-catenin并不调控N-cadherin的表达。因此,下调N-cadherin抑制脊髓连合纤维的投射作用中很可能是通过下调β-catenin的表达实现的。

图3 不同组GFP标记脊髓横切片对侧投射纤维与转染侧GFP表达面积百分比Fig.3 Percentage of GFP expression in spinal cord slices from different groups of GFP labeled spinal cord slices
3 讨论
在细胞内β-catenin有两个定位池:一个位于细胞膜,一个在细胞浆。β-catenin在细胞中有双重作用:一是通过与细胞膜上cadherin相互作用,参与细胞间黏附。当β-catenin表达上调时,增强细胞间黏附作用,使细胞不容易发生侵袭和转移。反之,βcatenin表达下调时,细胞间黏附作用被破坏,细胞更容易发生侵袭和转移。另一作用是作为经典Wnt信号通路中最重要的信息分子,调控细胞生长、分化和凋亡。Wnt/β-catenin信号转导通路在生物进化中极为保守,从低等生物果蝇至高等哺乳动物,其成员都具有高度的同源性,Wnt/β-catenin信号转导通路的活化由细胞质中β-catenin蛋白水平决定[10]。有研究表明β-catenin在细胞内的表达与N-cadherin呈正相关[11]。在我们的实验中表明细胞内βcatenin的表达受到N-cadherin的调控,但是N-cadherin的表达并不受β-catenin的调控,该研究结果与已报道的结果保持一致[11]。在前期实验中,课题组研究表明N-cadherin可能影响位于膜上的β-catenin,N-cadherin表达抑制后会导致膜上β-catenin向细胞核聚集[12]。而关于β-catenin在Wnt/β-catenin信号通路的研究在肿瘤中的报道比较多[13,14],在神经纤维发育中作用的研究并不多。
在我们的实验中,通过活体原位电转基因技术和shRNA干扰技术结合,实现了在活体内N-cadherin或β-catenin的抑制表达,观察到在N-cadherin或β-catenin抑制表达的条件下都会影响到鸡胚发育过程脊髓连合纤维向对侧的投射。关于N-cadherin在神经元以及神经突起形成方面的研究早有报道[15],但其机制并不清楚。在本实验中我们发现,在抑制N-cadherin表达时β-catenin的表达下调,而在抑制β-catenin表达的条件下N-cadherin的表达并没有变化,说明N-cadherin的表达正向调控β-catenin的表达。此外,抑制N-cadherin还是βcatenin的表达都会对脊髓连合纤维向对侧的投射产生明显的影响,但同时抑制两者表达的表型与单独抑制时类似。因此推测抑制N-cadherin表达影响脊髓连合纤维发育的作用很可能是通过β-catenin实现的。考虑到N-cadherin和β-catenin组成的复合体在细胞黏附中发挥重要作用以及三种抑制表达的表型的相似性,N-cadherin和β-catenin很可能通过该方式参与脊髓连合纤维的发育过程。
参考文献:
[1]杨慈清,石晓卫,胡阿珍,等.应用鸡胚活体电转GFP示踪技术观察脊髓左右两侧神经元纤维投射[J].中国免疫学杂志,2012,28(8) : 718-721.
[2]杨琳,刘娜,杨连雪,等.应用辣根过氧化物酶逆行示踪技术观察左右侧脊神经节间纤维联系[J].中国临床康复,2005,9(41) : 32-33.
[3]Moore SW,Tessier Lavigne M,Kennedy TE.Netrins and their receptors[J].Adv Exp Med Biol,2007,621: 17-31.
[4]Culotti JG,Merz DC.DCC and netrins[J].Curr Opin Cell Biol,1998,10(5) : 609-613.
[5]杨慈清,杜蕊,林俊堂,等.鸡胚发育过程N-Cadherin和Neurofilament在脊髓中共表达模式的研究[J].中国免疫学杂志,2013,29(3) : 232-235.
[6]Willert K,Brown JD,Danenberg E,et al.Wnt pro-teins are lipid-Modified and can act as stem cell growth factors[J].Nature,2003,423 (6938) : 448-452.
[7]Zecher D,Fujita Y,Hulsken T,et al.Beta-Catenin signals regulate cell growth and the balance between progenitor cell expansion and differentiation in the nervous system[J].Dev Biol,2003,258(2) : 406-418.
[8]Muroyama Y,Fujihara M,Ikeya M,et al.Wnt signaling plays an essential role in neuronal specification of the dorsal spinal cord[J].Genes Dev,2002,16(5) : 548-553.
[9]Yu X,Malenka RC.Beta-catenin is critical for dendritic morphogenesis[J].Nat Neurosci,2003,6(11) : 1169-1177.
[10]杜彦艳,刘鑫,单保恩.Wnt/β-catenin信号转导通路与肿瘤关系的研究进展[J].肿瘤,2009,29(8) : 803-806.
[11]占大钱,黄志勇,纪桂宝,等.N-cadherin、β-连环素在肝癌组织中的表达及与Wnt信号途径的关系[J].中华实验外科杂志,2011,28(9) : 1473-1474.
[12]李小英,杨慈清,范义峰,等.N-Cadherin异常表达对293T细胞形态结构及连环蛋白表达的影响[J].中国免疫学杂志,2013,29(9) : 914-917.
[13]Fan K,Li N,Qi J,et al.Wnt/β-catenin signaling induces the transcription of cystathionine-γ-lyase,a stimulator of tumor in colon cancer[J].Cell Signal,2014,26(12) : 2801-2808.
[14]Zhang Y,Wang CP,Ding XX,et al.FNC,a novel nucleoside analogue,blocks invasion of aggressive non-hodgkin lymphoma cell lines via inhibition of the Wnt/β-catenin signaling pathway[J].Asian Pac J Cancer Prev,2014,15(16) : 6829-6835.
[15]Zhu H,Luo L.Diverse functions of N-cadherin in dendritic and axonal ter minal arborization of olfactory projection neurons[J].Neuron,2004,42(1) : 63-75.
[收稿2015-04-17修回2015-07-07]
(编辑张晓舟)
doi:10.3969/j.issn.1000-484X.2015.10.013
作者简介:杨慈清(1979年-),男,博士,副教授,主要从事发育神经生物学研究,E-mail: yangciqing@ 126.com。
通讯作者③,E-mail: developmentlab@ 126.com。
文章编号1000-484X(2015) 10-1357-05
文献标志码A
中图分类号Q954.48