乳清蛋白酶解条件优化
2015-12-20刘晓慧牟光庆
孙 洋 钱 方 赵 磊 刘晓慧 牟光庆
(1.大连工业大学信息科学与工程学院,辽宁 大连 116034;2.大连工业大学食品学院,辽宁 大连 116034)
近年来随着人们营养健康意识的增强,蛋白质和脂肪含量相当于原料乳10倍的干酪,成为世界上唯一保持连续上升的乳制品[1]。按生产1t干酪排放9t乳清计,每年有上亿吨的乳清等待利用和处理[2]。乳清不仅产量大,且营养丰富(含乳清蛋白、脂肪、乳糖、矿物质和水溶性维生素等),必需氨基酸组成完全符合或超出FAO/WHO要求[3]。由于蛋白酶能部分降解乳清蛋白多肽骨架,增加特殊功能基团,具有改变乳清蛋白的乳化性、稳定性等功能特性[4]。也是降低其过敏反应的有效方法之一[5]。本研究为便于乳清蛋白酶解后直接用于乳制品中,因此在自然pH下对乳清蛋白预处理及酶解条件进行优化,以提高乳清蛋白酶解产物的利用率和营养价值。
1 材料与方法
1.1 材料
乳清浓缩蛋白(WPC80):美国哥兰比亚乳业公司;
中性蛋白酶:酶活14.6万U/g,广西南宁庞博生物工程有限公司;
木瓜蛋白酶:酶活21.4万U/g,广西南宁庞博生物工程有限公司;
胰蛋白酶:酶活10.0万U/g,北京索莱宝科技有限公司。
1.2 仪器与设备
电热恒温水浴锅:DK-S22型,上海精密实验设备有限公司;
光栅分光光度计:722型,山东高密彩虹分析仪器有限公司;
精密pH计:pH S-3B型,上海雷磁仪器厂;
多管架自动平衡离心机:TDZ5-WS型,湘仪离心机仪器有限公司。
1.3 方法
1.3.1 测定项目及方法
(1)蛋白酶活力测定:福林—酚法[6,7]。
(2)蛋白含量测定:微量凯氏定氮法[8]。
(3)蛋白水解度(DH)测定:改进pH-stat法[9,10]。
1.3.2 预处理方式对乳清蛋白酶解的影响 分别采用63℃/30min,80℃/10min,95℃/5min的预处理方式对乳清蛋白WPC80进行处理,以未经预处理的作对照。水解条件:WPC80 8%,初始pH 6.8,木瓜蛋白酶量5 000U/g·蛋白,温度50℃,时间60min。通过乳清蛋白水解程度来确定最佳的预处理方式。
1.3.3 不同蛋白酶水解乳清蛋白的效果比较 选用木瓜蛋白酶、中性蛋白酶和胰蛋白酶,在加酶量5 000U/g·蛋白,初始pH 6.8,50℃,60min的条件下对终浓度8%的乳清蛋白(WPC80)进行酶解,并经沸水10min,冷至室温后,通过比较水解程度来确定乳清蛋白酶解的最佳酶。
1.3.4 单因素试验
(1)加酶量对酶解乳清蛋白的影响:在初始pH 6.8、水解温度50℃、水解60min条件下,用最佳酶对终浓度8%的乳清蛋白进行酶解,分别测定在1 000,3 000,5 000,7 000,9 000U/g·蛋白加酶量的水解度。
(2)水解温度对酶解乳清蛋白的影响:在初始pH 6.8、加酶量5 000U/g·蛋白、水解60min条件下,用最佳酶对终浓度8%的乳清蛋白进行酶解,分别测定在40,45,50,55,60℃水解温度下的水解度。
(3)水解时间对酶解乳清蛋白的影响:在初始pH 6.8、水解温度50℃、加酶量5 000U/g·蛋白条件下,用最佳酶对终浓度8%的乳清蛋白进行酶解,分别测定30,60,90,120,150min水解时间的水解度。
1.3.5 正交旋转回归试验设计 基于单因素试验结果,以木瓜蛋白酶的水解温度、水解时间和加酶量3个因素为自变量,以乳清蛋白水解度为响应值,设计20个试验点的正交旋转回归试验,保证试验点最小的前提下,提高乳清蛋白酶解效率,并用Design Expert 8.0.6统计软件对结果进行分析。
2 结果与分析
2.1 预处理方式对酶解乳清蛋白的影响
由于乳清蛋白的热稳定性较差,不同的预处理方式对其酶解效果影响较大。为了得到最佳水解效果,按表1的预处理方式及水解条件酶解乳清蛋白WPC,并测其水解度。
由图1可知,其中80℃处理10min的水解度最大,达9.21%。所以选用80℃处理10min对酶解前乳清蛋白进行预处理。

图1 不同预处理方式水解乳清蛋白的比较Figure 1 Comparison of different pretreatments of enzymolysis of whey protein
2.2 不同蛋白酶水解乳清蛋白的效果比较
考虑到酶解反应受温度、加酶量、底物浓度和水解时间等多种因素影响。为寻找水解乳清蛋白的适宜酶及其最佳酶解条件,本研究分别用木瓜蛋白酶、中性蛋白酶和胰蛋白酶3种酶,在相同酶解条件水解乳清蛋白,比较其水解程度。由图2可知,木瓜蛋白酶水解度最大,达8.96%。因此选用木瓜蛋白酶作为乳清蛋白水解最佳用酶。
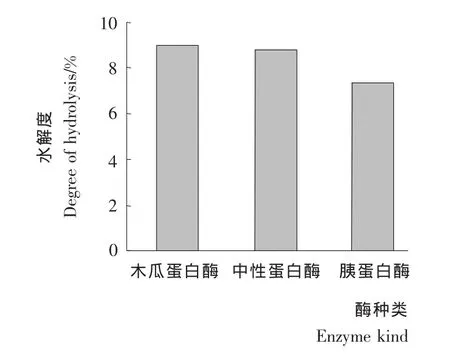
图2 不同蛋白酶水解乳清蛋白的比较Figure 2 Comparison of different proteases of enzymolysis of whey protein
2.3 单因素试验
2.3.1 加酶量对酶解乳清蛋白的影响 由图3可知,在同一初始pH、水解温度和时间下,当木瓜蛋白酶量低于5 000U/g·蛋白时,乳清蛋白水解度随酶量的增加而明显升高;而加酶量高于5 000U/g·蛋白时,由于底物浓度和酶逐渐达到饱和,水解度升高幅度不明显。因此,初步确定木瓜蛋白酶水解乳清蛋白适宜用酶量为5 000U/g·蛋白,相应水解度DH为9.65%。
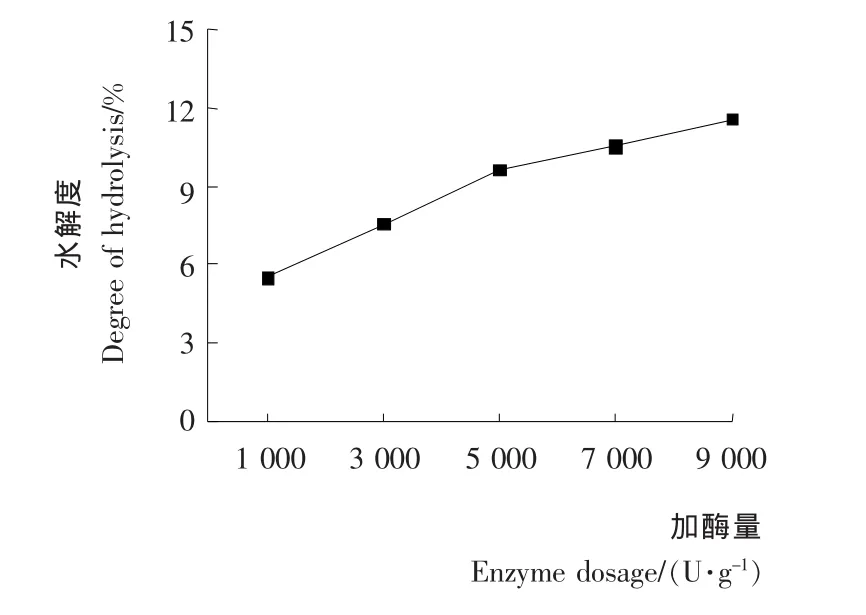
图3 加酶量对蛋白酶水解乳清蛋白的影响Figure 3 Effects of different enzyme dosage on whey protein enzymolysis
2.3.2 水解温度对酶解乳清蛋白的影响 由图4可知,在同一初始pH、水解时间和加酶量下,酶解温度控制在40~55℃时,乳清蛋白水解度随温度上升而增大,而高于55℃时,则随着温度升高,水解度降低,说明酶活力下降。木瓜蛋白酶水解乳清蛋白的适宜水解温度为55℃,相应水解度DH为9.96%。
2.3.3 水解时间对酶解乳清蛋白的影响 由图5可知,在同一水解温度、初始pH值和加酶量下,乳清蛋白水解度随水解时间的延长而升高。而水解90min后,水解度趋势线变缓。因此,初步确定木瓜蛋白酶水解乳清蛋白适宜水解时间为90min,相应水解度DH为9.87%。

图4 水解温度对酶解乳清蛋白的影响Figure 4 Effects of different temperature on whey protein enzymolysis

图5 水解时间对酶解乳清蛋白的影响Figure 5 Effects of different time on whey protein enzymolysis
2.4 正交旋转回归试验
2.4.1 正交旋转回归设计酶解乳清蛋白试验结果分析 根据单因素试验结果确定的回归正交旋转试验因素水平取值见表1,木瓜蛋白酶解乳清蛋白回归正交旋转试验结果见表2,方差分析见表3、4。
用Design-Expert软件进行回归分析,对各因素回归拟合后得回归方程:


表1 正交旋转回归设计的因素水平编码表Table 1 Factors level coding schedule of regression orthogonal rotary tests

表2 正交旋转回归设计酶解乳清蛋白试验与结果Table 2 Design and results of orthogonal rotational regression of whey protein enzymolysis
由表3可知,模型交互项X1X2、X1X3、X2X3及二次项X22差异不显著,模型一次项X2、X3及二次项X12、X32差异极显著,模型一次项X1差异显著,说明响应面分析所选的3个主效应显著。其中各种因素间的交互作用较小。同时由F值(各项均方/剩余误差均方)可看出,水解温度、水解时间、加酶量3个因素中加酶量对乳清蛋白水解度影响最大,其次为水解时间和温度。
表3 正交试验结果方差分析表Table 3 Variance analysis table of the result of orthogonal tests

表3 正交试验结果方差分析表Table 3 Variance analysis table of the result of orthogonal tests
*为显著(P<0.05),**为高度显著(P<0.01);F0.01(1,10)=10.04,F0.05(1,10)=4.96;F0.01(5,5)=11.0,F0.05(5,5)=5.05;F0.01(9,10)=4.95,F0.05(9,10)=3.02。
变异来源 系数估计值平方和SS 自由度 均方MS F 值 显著性截距 10.40 ——X1 0.22 0.66 1 0.66 7.10 *X2 0.30 1.26 1 1.26 13.55 **X3 1.31 23.30 1 23.30 250.54 **X1X2 0.02 0.00 1 0.00 0.03 X1X3 0.01 0.00 1 0.00 0.01 X2X3 -0.04 0.01 1 0.01 0.13 **X12 -0.39 2.20 1 2.20 23.66 X22 -0.16 0.35 1 0.35 3.76 **X32 -0.40 2.28 1 2.28 24.52 **回归模型30.35 19 29.42 9 3.27 35.16剩余误差 0.93 10 0.09纯误差 0.18 5 0.04失拟项 0.75 5 0.15 4.17总变异

表4 乳清蛋白水解度模型的方差分析Table 4 Variance analysis of the model of DH
本试验模型不同处理间差异极显著,说明回归方程描述各因子与响应值之间的关系时,其应变量与全体自变量之间的线性关系是显著的。同时变异系数(CV=12.96%)也说明了这种试验方法是可靠的。复相关系数平方R2=回归平方和/总平方和=96.94%,说明由这3个因素及二次项能解释96.94%响应值的变化。由表3可知,回归方程的显著性检验F值=35.16>F0.01(9,10)=4.95极显著,说明试验数据与采用的数学模型相符合;回归方程的失拟性检验F值=4.17<F0.05(5,5)=5.05不显著,可认为所选用的二次模型是适当的[11-15]。
2.4.2 响应面效应分析 用Design Expert软件进行分析,作出响应面和等高线,得到因素间的交互关系及对乳清蛋白水解度的影响。由图6可知,水解体系加酶量一定时,乳清蛋白水解度随着反应时间增长而增大,当时间达到一定值后水解度的增大变缓;在水解体系加酶量一定时,乳清蛋白水解度随着温度增加而增加,当温度达到一定时水解度开始下降。在适当中间区域的反应时间和温度两种因素交互作用下,可获得水解度较高的酶解产物。
同样,由图7和8可看出,水解温度与加酶量、水解时间和加酶量等之间的关系均与图6水解温度和水解时间的分析结果类似。
2.5 酶解乳清蛋白最佳水解条件确定
为进一步确定乳清蛋白最佳酶解条件,对回归方程取一阶偏导数为零整理得:

联立上述3个方程求解,得到极值点X1=0.324、X2=0.794、X3=1.607。换算后得乳清蛋白最优酶解条件,即在反应温度56.62℃、加酶量为8 213.77U/g·蛋白条件下,木瓜蛋白酶水解乳清蛋白113.83min时能获得最大水解度,其最大水解度为11.60%。考虑到实验可操作性,验证实验在反应温度57℃、加酶量8 214U/g·蛋白、水解时间114 min条件下进行,所得到乳清蛋白水解度为11.72%,与模型值(11.60%)相符。

图6 水解温度和水解时间对水解度的交互影响Figure 6 Mutual influence of temperature and time on DH

图7 水解温度和加酶量对水解度的交互影响Figure 7 Mutual influence of temperature and enzyme dosage on DH

图8 水解时间和加酶量对水解度的交互影响Figure 8 Mutual influence of time and enzyme dosage on DH
3 结论
为更好地提高乳清蛋白酶解产物的利用率和营养价值,本研究比较了乳清蛋白在不同预处理方式下酶解程度,分析了酶切位点相异的蛋白酶自然pH下对乳清蛋白的酶解效果,并通过正交旋转回归设计优化了乳清蛋白的酶解条件。研究表明乳清蛋白水溶液经80℃10min预处理后,加入8 214U/g·蛋白的木瓜蛋白酶,57℃水解114min后能获得最大水解度。以往关于酶解乳清蛋白的研究,都是控制蛋白酶在其各自最适pH下且未考虑预处理对水解产物的影响,这势必会影响到乳清蛋白在食品中的应用。本研究不仅提高了乳清蛋白酶解效率,同时还可将其酶解产物—乳清蛋白肽直接地应用于液态乳制品等功能性食品中。
1 杜琨,张亚宁.干酪的营养价值及研究动态[J].中国食物与营养,1995(10):45~46.
2 严宝兴.乳清资源的综合利用[J].草业与畜牧,2008(9):52~55.
3 郭本恒.乳品化学[M].北京:中国轻工业出版社,2001:246~247.
4 Scheme I,Muschiolik G.Effects of various whey protein hydrolysates on the emulsifying and surface properties of hydrolysed lecithin[J].Colloids and Surfaces B:Biointerfaces,2001(21):107~117.
5 Ena J M,Van Beresteijn E C H,Robben A J P M,et al.Whey protein antigenicity reduction by fungal proteinases and a pepsin/pancreatic combination[J].Journal of Food Science,1995,60(1):104~116.
6 Mamoru S,Masao I,Masanori S,et al.A new method for protease activity measurement[J].Analytical Biochemistry,1979,97(1):11~16.
7 周景祥,王桂芹.蛋白酶和淀粉酶活性检测方法探究[J].中国饲料,2011(11):78~86.
8 王镜岩.生物化学[M].第三版.北京:高等教育出版社,2002:196~199.
9 袁斌,吕桂善,刘小玲.蛋白质水解度的简易测定[J].广西农业生物科学,2002,21(2):113~115.
10 Jens Adler-Nissen.Control of the proteolytic reaction and of the level of bitterness in protein hydrolysis processes[J].Chem.Tech.Biotechnol.,1984(34B):215~222.
11 官波,郑文诚.山药多糖提取工艺的优化[J].食品与机械,2010,26(1):98~101.
12 刘军海,黄宝旭,蒋德超,等.响应面分析法优化艾叶多糖提取工艺研究[J].食品科学,2009,30(2):114~118.
13 王曙光,贾士儒,乔长晟,等.响应面法优化鸡骨泥酶解条件的研究[J].中国酿造,2009(2):80~82.
14 林伟静,吴广枫,王强,等.燕麦全粉中β-葡聚糖提取工艺优化[J].食品与机械,2010,26(1):121~124.
15 吴波,陈运中.响应面分析法优化鱼鳞脱钙条件的研究[J].食品科学,2008(9):123~129.
