桉树提取物与苯唑西林对MRSA的抗菌作用
2015-12-20崔海英张雪婧赵呈婷
崔海英 张雪婧 周 慧 赵呈婷 李 伟 林 琳
(江苏大学食品与生物工程学院,江苏 镇江 212013)
金黄色葡萄球菌是医院内感染的主要病原菌之一,其中以耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA)尤为重要[1]。随着抗菌药物种类的不断增多及抗菌药物的不合理使用,在临床感染金黄色葡萄球菌的病例中,MRSA所占的比例越来越高[2]。MRSA的耐药机制复杂,其主要机制是获得编码低亲和力的青霉素结合蛋白2a(PBP2a)的mecA基因,从而表现出对甲氧西林、苯唑西林及其他β-内酞胺类抗生素耐药[3]。它的多重耐药性给临床诊疗和院内感染控制带来非常大的困难,因此,MRSA的防治工作十分严峻[4]。
桉树叶可以提炼挥发油,具有较强的抗菌、消炎、防腐及杀虫驱蚊等作用,在食品、化工、医药、能源等方面有着广泛的用途。而桉树又是世界上三大速生丰产树种之一[5],因此,桉树叶在抑菌方面具有极大的开发利用潜力。
尽管桉树叶提取物和苯唑西林各自都有着良好的抗菌杀菌作用。但是,怎样降低用药量,提高杀菌效率,鲜有人研究。因此,本研究拟通过比较桉树提取物与苯唑西林对MRSA的抗菌作用,探索桉树提取物与苯唑西林的协同作用,及其降低MRSA耐药性的作用机制,从而为克服MRSA对苯唑西林的耐药性打下基础,也为开发桉树植物抗菌剂提供试验依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
供试菌种:耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA)No.11、No.16、No.23、No.36、No.38、B-26、11D1677,由日本广岛大学提供;
苯唑西林:国药集团化学试剂有限公司;
乙醇:分析纯,国药集团化学试剂有限公司;
PBP2’胶乳凝集试剂盒:日本Deka2Seiken公司。
1.1.2 培养基
M-H琼脂培养基:酸水解酪蛋白17.5g/L,牛肉浸膏粉2g/L,淀粉1.5g/L,琼脂12g/L。
1.1.3 主要仪器设备
高压蒸汽灭菌锅:MLS-3020型,鸟取三洋电机(广州)有限公司;
生化培养箱:LRH-250型,上海恒一科技有限公司。
1.2 方法
1.2.1 相关成分的提取方法
(1)桉树叶洗净,剪切,烘干,用无水乙醇浸泡提取,桉叶与乙醇质量比例为1∶9,浸泡48h。过滤取得滤液,利用旋转蒸发仪蒸掉无水乙醇,即得到桉树乙醇提取物[6]。
(2)桉树叶洗净,剪切,烘干,用蒸馏水浸泡加热提取,桉叶与蒸馏水质量比例为1∶9,加热温度为100℃,加热1 h,过滤取得滤液,再用过滤灭菌法将滤液灭菌,得到浓度为10%的桉树水提取物[6]。
1.2.2 桉树提取物对7种MRSA的MIC测定 在无菌的培养皿里加入添加了40g/L NaCl的M-H琼脂培养基与桉树乙醇提取物或桉树水提取物,使得桉树乙醇提取物或桉树水提取物的浓度分别为0.5,1.0,2.0,5.0,10.0g/L;用划线接种法接种各种前培养的MRSA,于35℃静止培养48h,根据各培养基上划线处是否有明显的细菌生长痕迹来确定MIC的浓度。
1.2.3 苯唑西林对7种MRSA的MIC测定 苯唑西林钠一水合物用蒸馏水溶解,溶解浓度为10g/L,用过滤灭菌法灭菌。在无菌的培养皿里加入添加了40g/L NaCl的 M-H琼脂培养基与苯唑西林钠溶液,使苯唑西林的浓度为31.3,62.5,125.0,250.0,500.0mg/L。用划线接种法接种各种前培养的MRSA,于35℃静止培养48h,根据各培养基上划线处是否有明显的细菌生长痕迹来确定MIC的浓度。
1.2.4 桉树提取物与苯唑西林共同作用对7种 MRSA的抗菌活性 苯唑西林钠一水合物用蒸馏水溶解,溶解浓度为10g/L,用过滤灭菌法灭菌[7]。在无菌的培养皿里加入添加了40g/L NaCl的M-H琼脂培养基之后,添加苯唑西林钠溶液,使苯唑西林钠的浓度为3.9,7.8,15.6,31.3,62.5,125.0,250.0mg/L,再分别添加0.2g/L的桉树乙醇提取物与1.0g/L的桉树水提取物。用划线接种法接种各种前培养的MRSA。于35℃静止培养48h,根据各培养基上划线处是否有明显的细菌生长痕迹来确定MIC的浓度。
1.2.5 利用FIC index法测定桉树提取物与苯唑西林对7种MRSA的协同效应 苯唑西林钠一水合物用蒸馏水溶解,溶解浓度为10g/L,用过滤灭菌法灭菌。在无菌的培养皿里加入添加了40g/L NaCl的 M-H琼脂培养基之后,添加苯唑西林溶液,使苯唑西林的浓度为3.9,7.8,15.6,31.3,62.5,125.0,250.0mg/L,再分别添加0.2g/L的桉树乙醇提取物与1.0g/L的桉树水提取物。用划线接种法接种各种前培养的MRSA。于35℃静止培养48h,根据各培养基上划线处是否有明显的细菌生长痕迹来确定MIC的浓度。
桉树提取物与苯唑西林的协同效果采用测定分级抑制浓度指数[fractional inhibitory concentration(FIC)index]法来进行评价[8],其计算方法为:

式中:
FIC index——分级抑制浓度指数;
m1——并用时桉树提取物的 MIC,g/L;
m2——单独使用时桉树提取物的 MIC,g/L;
m3——并用时苯唑西林的 MIC,mg/L;
m4——单独使用时苯唑西林的 MIC,mg/L。
FIC index≤0.5,协同效果;0.5<FIC index≤1.0,相加效果;1.0<FIC index≤2.0,无效果;FIC index>2.0,拮抗效果。
1.2.6 桉树提取物降低 MRSA耐药性的作用机制 采用MRSA乳胶凝集法探索桉树提取物降低MRSA耐药性的作用机制,即使用PBP2’胶乳凝集试剂盒来测定PBP2’的产生,并采用包被有抗PBP2a单克隆抗体的乳胶颗粒与生长于血平板上纯的金黄色葡萄球菌菌落进行凝集试验。即在无菌M-H液体培养基里,添加2.0g/L的桉树乙醇提取物与前培养的试验菌,于35℃培养24h。培养液用pH 7无菌磷酸生理盐水缓冲液(phosphate-buffered saline,PBS)清洗3次,再加200μL 0.1MNaOH使沉淀悬浮,其金黄色葡萄球菌的细胞数为109Cells/200μL,悬浮液加热3min,使菌体释放PBP2’,再添加50μL的 KH2PO4,进行离心(3 000r/min,5 min)。载玻片上各滴入50μL上清液的原液、2倍、4倍以及8倍稀释液,再添加25μL的抗PBP2’单克隆抗体搅拌,反应3min,观察有没有凝集现象。结果判断根据说明书,分3+,2+,+,-的4个层次表示凝集程度。
2 结果与分析
2.1 桉树提取物对7种MRSA的MIC测定
本试验的桉树提取物对7种院内感染病原菌——MR-SA显示了良好的抑菌效果(表1):桉树乙醇提取物和桉树水提取物对7种MRSA的MIC分别为2~5g/L和5g/L,桉树乙醇提取物为佳。

表1 桉树提取物对各种耐甲氧西林金黄色葡萄球菌的抗菌活性Table 1 Inhibition effect of Eucalyptus Extract against MRSA
2.2 青霉素类抗生素苯唑西林对7种MRSA的MIC测定
由表2可知:苯唑西林对7种MRSA的抑菌浓度范围为62.5~250.0mg/L。根据美国临床实验室标准化委员会标准[9,10],苯唑西林 MIC≥4μg/mL为耐药,即所有的试验菌对苯唑西林均显示了很强的耐药性。

表2 苯唑西林对各种耐甲氧西林金黄色葡萄球菌的抗菌活性Table 2 Inhibition effect of oxacillin against MRSA
2.3 桉树提取物与苯唑西林共同作用对7种 MRSA的MIC
由图1可知,苯唑西林对7种MRSA的最小抑菌浓度范围为62.5~250.0mg/L,而添加0.02%的桉树乙醇提取物之后,苯唑西林对7种MRSA的最小抑菌浓度范围减小至7.8~31.3mg/L,添加0.1%的桉树水提取物之后,苯唑西林对7种MRSA的最小抑菌浓度范围,除了试验菌株MRSA No.16,均减小至7.8mg/L,而 MRSA No.16的最小抑菌浓度从250.0mg/L减小至62.5mg/L,以上结果,充分证明桉树乙醇提取物与水提取物明显减小MRSA对苯唑西林的耐药性,二者显示了良好的协同效果。
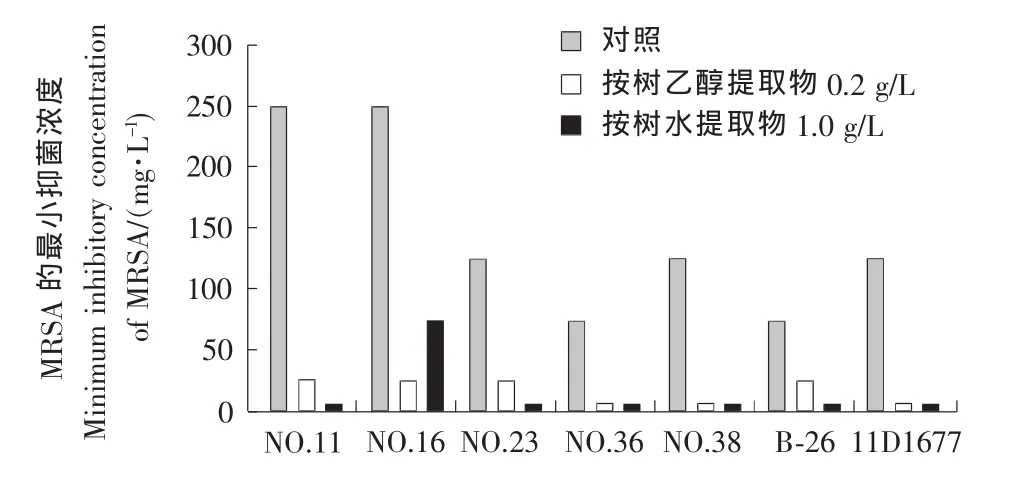
图1 桉树提取物与苯唑西林共同作用对7种MRSA的MICFigure 1 MIC of eucalyptus extract in combination with oxacillin of MRSA
2.4 利用FIC index法测定桉树提取物与苯唑西林对7种MRSA的协同效应
由表3可知,添加0.05%(1/4MIC)的桉树乙醇提取物,可使苯唑西林的最小抑菌浓度范围从62.5~250.0mg/L降低至0.49~0.98mg/L,其分级抑制浓度指数为0.11~0.26,即小于0.5,显示了协同效应,添加0.2g/L(1/10MIC)的桉树乙醇提取物时,分级抑制浓度指数为0.13~0.60,除No.11之外均显示了良好的协同效应。同样,如表6所示,添加1.0g/L(1/5MIC)和0.5g/L(1/10MIC)的桉树水提取物时,其分级抑制浓度指数分别为0.20~0.26,0.13~0.60,显示了良好的协同效应。
表3 桉树乙醇提取物与苯唑西林对MRSA的FIC indexTable 3 FIC index of ethanol extract of eucalyptus in combination with oxacillin of MRSA
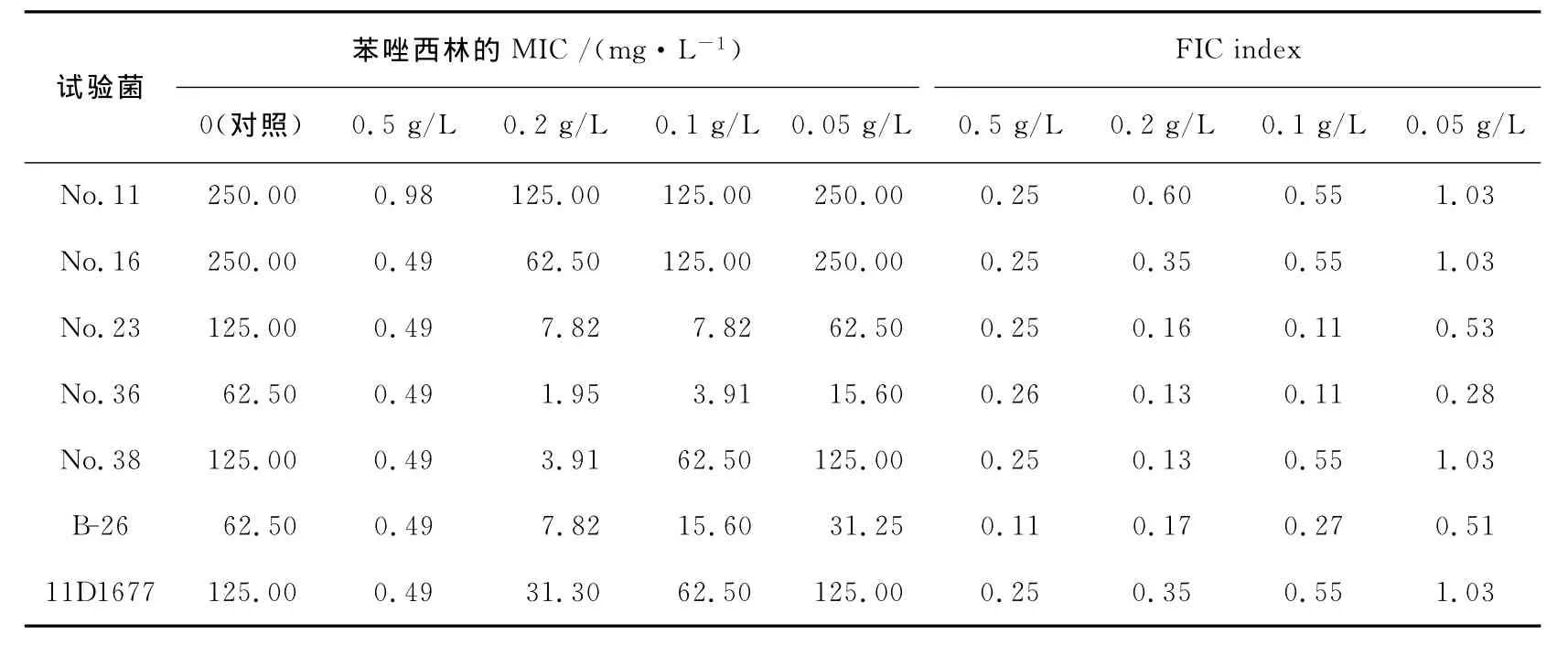
表3 桉树乙醇提取物与苯唑西林对MRSA的FIC indexTable 3 FIC index of ethanol extract of eucalyptus in combination with oxacillin of MRSA
桉树乙醇提取物对MRSA的MIC为2.0g/L。
FIC index 0.5g/L 0.2g/L 0.1g/L 0.05g/L No.11 250.00 0.98 125.00 125.00 250.00 0.25 0.60 0.55 1.03 No.16 250.00 0.49 62.50 125.00 250.00 0.25 0.35 0.55 1.03 No.23 125.00 0.49 7.82 7.82 62.50 0.25 0.16 0.11 0.53 No.36 62.50 0.49 1.95 3.91 15.60 0.26 0.13 0.11 0.28 No.38 125.00 0.49 3.91 62.50 125.00 0.25 0.13 0.55 1.03 B-26 62.50 0.49 7.82 15.60 31.25 0.11 0.17 0.27 0.51 11D1677 125.00 0.49 31.30 62.50 125.00 0.25 0.35 0.55 1.03试验菌苯唑西林的 MIC/(mg·L-1)0(对照) 0.5g/L 0.2g/L 0.1g/L 0.05g/L
表4 桉树水提取物与苯唑西林对MRSA的FIC indexTable 4 FIC index of water extract of eucalyptus in combination with oxacillin of MRSA

表4 桉树水提取物与苯唑西林对MRSA的FIC indexTable 4 FIC index of water extract of eucalyptus in combination with oxacillin of MRSA
桉树水提取物对MRSA的MIC为5.0g/L。
试验菌苯唑西林的 MIC/(mg·L-1)0(对照) 1.0g/L 0.5g/L 0.2g/L 0.1g/L FIC index 1.0g/L 0.5g/L 0.2g/L 0.1g/L.60 1.04 1.02 35 1.04 1.02 No.16 250.00 1.95 62.50 250.00 250.00 0.21 0.35 1.04 1.02 No.23 125.00 1.95 7.82 125.00 125.00 0.22 0.16 1.04 1.02 No.36 62.50 0.49 1.95 62.50 62.50 0.21 0.13 1.04 1.02 No.38 125.00 0.49 7.82 125.00 125.00 0.20 0.16 1.04 1.02 B-26 62.50 3.91 3.91 62.50 62.50 0.26 0.16 1.04 1.02 11D1677 125.00 7.82 62.50 125.00 125.00 0.26 0 No.11 250.00 15.60 62.50 250.00 250.00 0.26 0.
2.5 桉树提取物降低MRSA耐药性的作用机制
由表5可知,对7个供试菌株,对照样品均显示了很强的凝集反应。添加2g/L桉树乙醇提取物的样品,从原液到稀释至8倍,均显示了较弱的凝集反应。PBP2'(penicillinbinding protein2')是葡萄球菌中的肽聚糖合成酶,是一种青霉素结合蛋白2(PBP2’),该蛋白的存在是细菌对β-内酰胺类耐药的主要根源。

表5 桉树乙醇提取物对MRSA产PBP2’的影响Table 5 Impact of ethanol extract of eucalyptus on the produce of PBP2’of MRSA
3 结论
本试验通过对比桉树提取物与苯唑西林对7种MRSA的抗菌效果,发现桉树提取物显示了更好的抗菌效果,其中桉树的乙醇提取物,比水提取物具有更强的抗菌效果。而加入桉树提取物的苯唑西林能够明显减弱MRSA对其耐药性,试验也接着证明了桉树提取物与苯唑西林确实有着良好的协同作用。
桉树提取物降低MRSA耐药性的作用机制是桉树提取物抑制青霉素结合蛋白2(PBP2’)的合成,从而降低 MRSA对苯唑西林的耐药性。这为MRSA的临床诊疗和院内感染控制提供了新的途径,同时也为桉树植物类抗菌剂开辟了新的应用领域。
1 李元君,余良芳,王东杰.178株金黄色葡萄球菌的耐药性分析[J].中华医院感染学杂志,2011,21(7):1 468~1 469.
2 李兴德,宋沧桑,杨艳.我院2009~2011年铜绿假单胞菌与耐甲氧西林金黄色葡萄球菌对常用抗菌药物的耐药性变迁情况研究[J].中国药房,2013,24(10):894~898.
3 薛黎明,季伟,王宇清.2006~2009年苏州地区儿童呼吸道感染金黄色葡萄球菌耐药性分析[J].儿科药学杂志,2011,17(3):41~43.
4 王珊,齐慧敏,张再红,等.苯唑西林诱导金黄色葡萄球菌形成L型研究[J].中国临床药理学杂志,2010,26(7):502~505.
5 刘宇珍,张朝如.桉叶油及其包合物的抗菌作用研究[J].卫生职业教育,2011,29(6):114~115.
6 吴青业,关业枝,张清民,等.两种方法提取桉树叶挥发油成分的比较研究[J].中药材,2011,10(8):1 346~1 349.
7 钱昆,周涛.植物香辛料复配抑菌效果的研究[J].食品与机械,2007,23(2):93~96.
8 吴菲,王小莺,韩晓萍.三种抗菌药物对大肠杆菌和胸膜肺炎放线杆菌MIC值及FIC指数的测定[J].黑龙江畜牧兽医,2013,3(3):137~138.
9 Manu Chaudhary,Shailesh Kumar,Renu Bansal.Anurag payasi synergy of a novel antibiotic adjuvant entity against multi drug resistant methicillin-resistantStaphylococcusaureusand heterogeneous glycopeptide-intermediateStaphylococcusaureus[J].Journal of Pharmacy Research,2013,7(9):781~786.
10 陈民钧.美国临床实验室标准化委员会2004年版有关药敏试验标准化更新要点[J].中华检验医学杂志,2004,27(9):1 055~1 057.
