新型凹土基益生菌乳化液制备研究
2015-12-20赵玉萍王煨捷
赵玉萍 王煨捷 杨 莉
(淮阴工学院生命科学与化学工程学院,江苏 淮安 223003)
凹土是凹凸棒石黏土的简称,是天然非金属富镁铝硅酸盐黏土矿物,表面含有大量极性羟基,是一维纳米棒晶形态结构,其独特的晶体结构和堆积方式,使凹土具有较好的胶体性能、吸附能力等优点[1,2],还具有保护消化道黏膜、作为营养元素载体、促进养分吸收及吸附有毒物质等生物活性功能[3]。凹土作为一种新型材料已广泛应用于医药、化工、石油、建材、农业和环保等领域[4]。
乳酸杆菌是能够产生乳酸的革兰氏阳性菌,广泛存在于人和动物的胃肠道内,是具有重要生理功能的肠道益生菌[5]。
益生菌常见微胶囊产品在一定程度上能够对人和动物胃肠道逆环境具有一定的耐受性,但常见微胶囊生产工艺比较复杂,成本也高,其粒径分布一般为微米级,若作为食品或饲料添加剂,分散性不好[6]。本研究拟以大豆分离蛋白、植物油复合凹土制备成乳状液,尽管该乳状液具热力学不稳定性,但因其粒径小且分布范围较窄,所以作为食品或饲料添加剂使用时较为方便。
1 材料与方法
1.1 材料与仪器
乳酸杆菌:本实验室保藏;
台式高速冷冻离心机:TGC-16G-A型,上海安亭科学仪器厂;
紫外光栅分光光度计:752型,上海精密科学仪器有限公司;
恒温恒湿培养箱:HWS智能型,宁波新江南仪器有限公司;
pH酸度计:PHSJ-4A型,上海精密科学仪器有限公司;
大豆分离蛋白:生化试剂,北京奥博星生物试剂有限公司;
植物油:食品一级,金龙鱼股份有限公司;
凹土:原矿,盱眙博图凹土高新技术开发有限公司;
胃蛋白酶、胰蛋白酶、蛋白胨、牛肉膏、酵母膏、葡萄糖:生化试剂,日本Sigma公司;
其他试剂:均为分析纯,国药集团化学试剂有限公司。
1.2 培养基及人工胃、肠液配制方法
1.2.1 MRS培养基 蛋白胨10g,牛肉膏10g,酵母膏5 g,磷酸氢二铵2g,葡萄糖20g,乙酸钠5g,吐温80 1mL,MgSO4·7H2O 0.58g,MnSO4·4H2O 0.25g,H2O 1 000mL,pH 6.2~6.4,121℃灭菌15min[7]。
1.2.2 人工胃、肠液
(1)人工胃液:胃蛋白酶1%,NaCl 0.2%,用1mol/L HCl调节pH 至2.5[8]。
(2)人工肠液:胰蛋白酶1%,KH2PO41.4%,用0.4%的 NaOH 调节调节pH 至6.8[8]。
人工胃液和肠液配好后用0.2μm滤膜过滤备用。
1.3 试验方法
1.3.1 菌悬液的制备 乳酸杆菌接种于 MRS培养基,于37℃培养24h,于7 000r/min离心12min弃上清液,取菌泥沉淀,以无菌生理盐水离心洗涤2次后,将菌体悬浮于无菌生理盐水中,并将菌体浓度调节至108CFU/mL。
1.3.2 凹土的处理 将未经处理的凹土研磨,200目过筛,以10%的量加入去离子水,磁力搅拌器搅拌24h后,静置4 h,取中间层凹土悬液,以10%的量加入去离子水,重复3次。悬浮于去离子水中,使 OD值达1.5,备用[8]。
1.3.3 大豆分离蛋白的处理 将7%(m/V)的大豆分离蛋白溶 于 0.7mol/L 的 HCl中,调 节 pH 至 4.5,于 8 000r/min离心弃上清,并用去离子水补足至初始体积,以1 mol/L的NaOH调节pH至10,静置澄清后待用[9]。
1.3.4 乳化液制备方法 大豆分离蛋白与凹土混合制备悬液,滴入含0.2%吐温80的植物油中,搅拌,静置30min,使乳化层和水层及油层分离,得到乳化层。
(1)水包油(O/W)型乳化液制备:O/W 型乳化液是将油相高度分散在水相中,本试验中以植物油为油相,与处理后的大豆分离蛋白、凹土及菌悬液形成的水相混合制成稳定的乳化液,但该乳化液的形成是非自发过程,因此需要加入表面活性剂吐温80。经多次单因素试验确定最佳添加顺序为:在菌悬液中依次添加凹土悬液、大豆分离蛋白、植物油及吐温80。乳酸杆菌悬液浓度为4.8×108CFU/mL,按上述的顺序依次加入,振荡10min后静置30min,待油层、乳化层和水层逐渐分层后,取中间乳化层,采用稀释涂布法,于MRS培养基中涂布,得乳化包埋活菌数,计算包埋率,以直接测量法测量各试样乳化度,并用SDS分光光度法再次验证乳化的效果。
(2)油包水(W/O)型乳化液制备:W/O型乳化液即将水相高度分散在油相中,将油相和水相各组成成分进行单因素试验,获得最佳乳化条件。
(3)正交试验:比较O/W和 W/O型乳化液各项指标,选择最佳乳化液,在单因素试验基础上进行正交试验,获得最优乳化条件。
1.3.5 菌体检测方法
(1)水包油型包埋率[10,11]:取乳化层经梯度稀释后,于MRS培养基中涂布,测定CFU,计算包埋后总菌体CFU,以此数值除以起始总菌体数CFU,得水包油型菌体包埋率。
(2)油包水型包埋率[10,11]:取未包埋部分液体,测定CFU,计算未包埋总菌体CFU,以此数值除以起始总菌体数CFU,得未包埋率,再按式(1)计算油包水型包埋率。

(3)释放率:在人工模拟胃肠环境中,每隔1h或2h取样,于MRS培养基中涂布,测定CFU,计算人工胃肠液总CFU,以此数值除以乳化样品中总菌体数CFU,得菌体释放率。
1.3.6 乳化性能测定方法
(1)直接测量法:按1.3.5制备乳化液,静置后呈现油、乳液、水3个清晰的界面,测量乳化层体积、试样总体积,运用式(2)计算乳化能力(Ec)[12]。
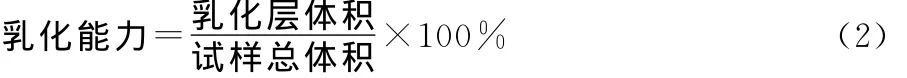
(2)分光光度法:以0.1%(m/V)SDS为空白,并用其稀释乳化液,于500nm处测量各样品吸光度值。由于SDS是表面活性剂,与油作用后即可破乳,因此0min时的吸光度值可表示乳化试样的乳化性[13]。
2 结果与讨论
2.1 水包油乳化液制备试验结果
由表1可知,水包油的包埋率都在50%~70%,多数为60%左右。且包埋效果和乳化性能相关参数,即直接测量法结果和分光光度法测定乳化性的结果相对应。但本试验组的最佳乳化效果仍然不明显,并且试验中各组试样均存在一定的絮状沉淀。
2.2 油包水乳化液制备试验结果分析
由表2、3可知,油包水的包埋率普遍都比水包油的高,最高达到了85.11%。经过直接测量法和产品乳化性能测定,油包水型中分离蛋白、吐温80、凹土和植物油的添加量分别为2.0,1.0,1.5,3.0mL。以此试验参数设计正交试验。
2.3 油包水乳化条件正交试验优化结果
根据上述单因素优化结果,选择大豆分离蛋白、凹土、吐温80和植物油的量4个因素进行优化,设计4因素3水平正交试验,因素及水平见表4。试验菌液浓度为5.6×1010CFU/mL,以乳化性为评价指标,试验结果见表5。
由表5可知,4个因素中对乳化性影响的显著程度为:植物油>凹土>大豆分离蛋白>吐温80,乳化最佳条件为:大豆分离蛋白含量为2.0mL、凹土含量为1.5mL、吐温80含量为1.4mL、植物油含量为3mL。
根据正交试验的结果,A2B2C3D2组是最优条件,在此条件下进行验证实验,乳化性达到了2.176,每毫升活菌数为5.171×1010CFU,包埋率为92.31%。
表1 水包油型试验结果Table 1 Results of the oil-in-water type
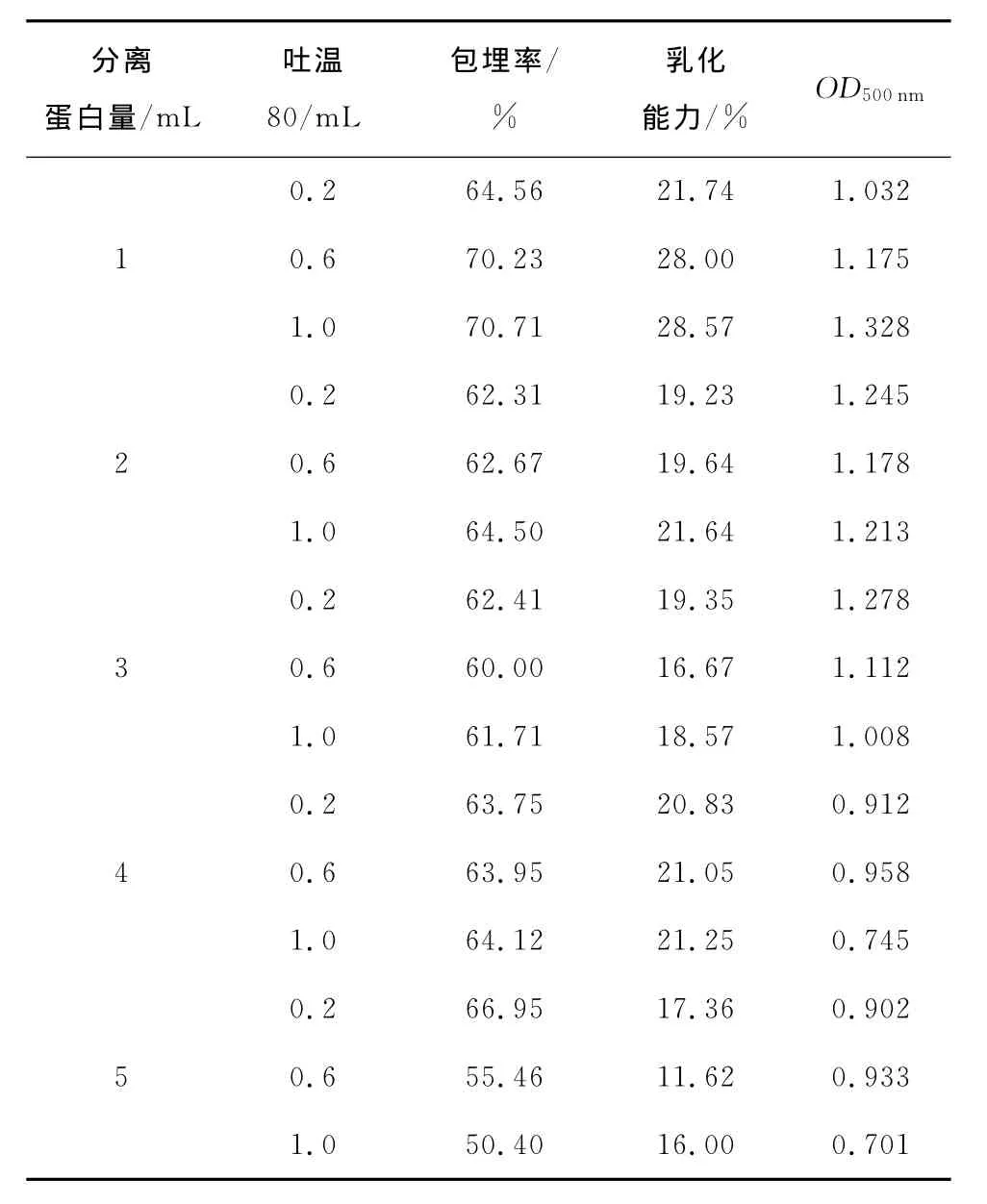
表1 水包油型试验结果Table 1 Results of the oil-in-water type
菌、植物油、凹土均为1mL。
分离蛋白量/mL吐温80/mL包埋率/%乳化能力/% OD500nm 0.2 64.56 21.74 1.032 1 0.6 70.23 28.00 1.175 1.0 70.71 28.57 1.328 0.2 62.31 19.23 1.245 2 0.6 62.67 19.64 1.178 1.0 64.50 21.64 1.213 0.2 62.41 19.35 1.278 3 0.6 60.00 16.67 1.112 1.0 61.71 18.57 1.008 0.2 63.75 20.83 0.912 4 0.6 63.95 21.05 0.958 1.0 64.12 21.25 0.745 0.2 66.95 17.36 0.902 5 0.6 55.46 11.62 0.933 1.0 50.40 16.00 0.701
表2 油包水型试验分离蛋白和吐温80测定结果Table 2 Results of the water-in-oil type of soy protein and Tween 80
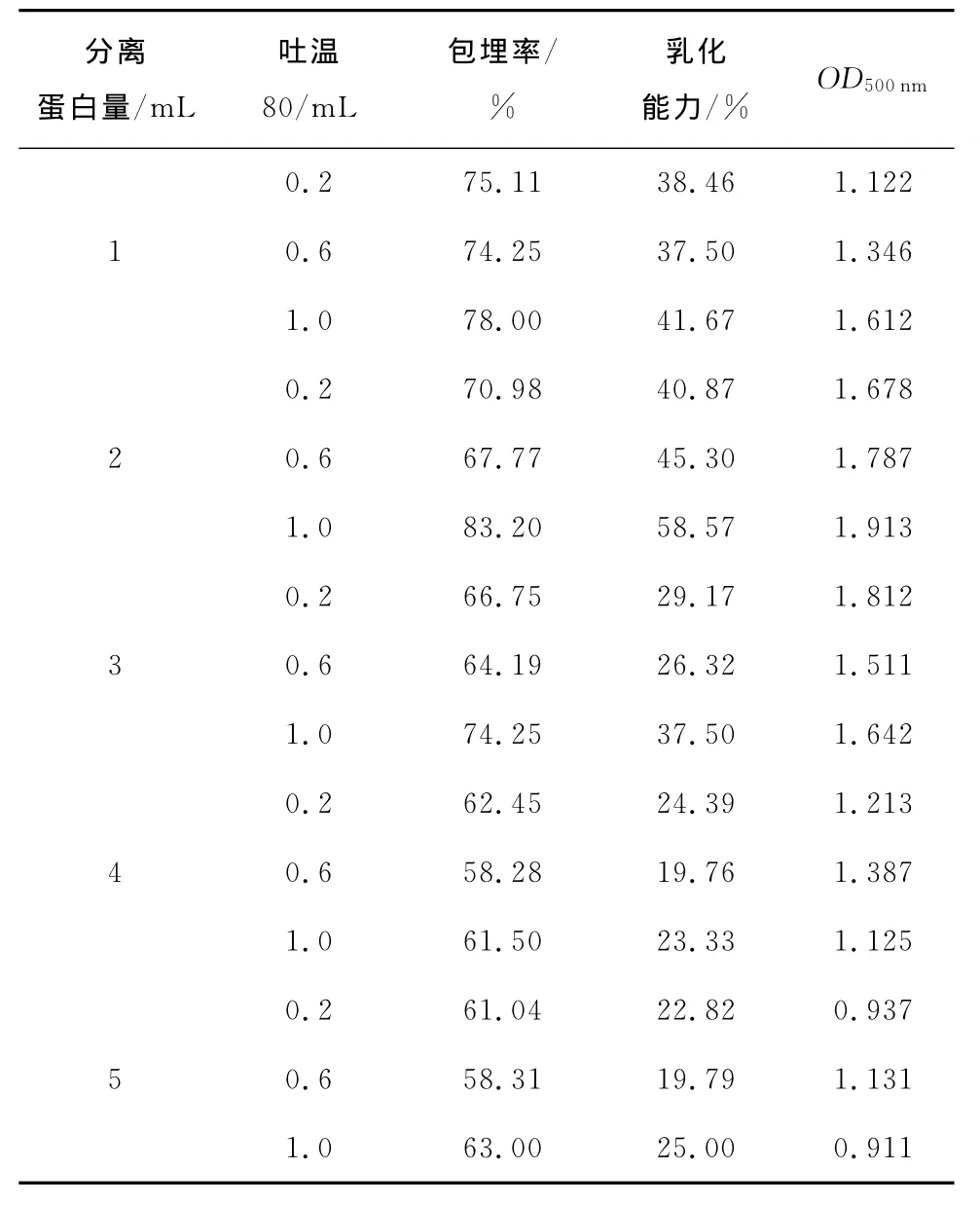
表2 油包水型试验分离蛋白和吐温80测定结果Table 2 Results of the water-in-oil type of soy protein and Tween 80
菌、凹土均为1mL,植物油2mL。
分离蛋白量/mL吐温80/mL包埋率/%乳化能力/% OD500nm 0.2 75.11 38.46 1.122 1 0.6 74.25 37.50 1.346 1.0 78.00 41.67 1.612 0.2 70.98 40.87 1.678 2 0.6 67.77 45.30 1.787 1.0 83.20 58.57 1.913 0.2 66.75 29.17 1.812 3 0.6 64.19 26.32 1.511 1.0 74.25 37.50 1.642 0.2 62.45 24.39 1.213 4 0.6 58.28 19.76 1.387 1.0 61.50 23.33 1.125 0.2 61.04 22.82 0.937 5 0.6 58.31 19.79 1.131 1.0 63.00 25.00 0.911
表3 油包水型试验凹土和植物油测定结果Table 3 Results of the water-in-oil type of attapulgite clay and vegetable oil
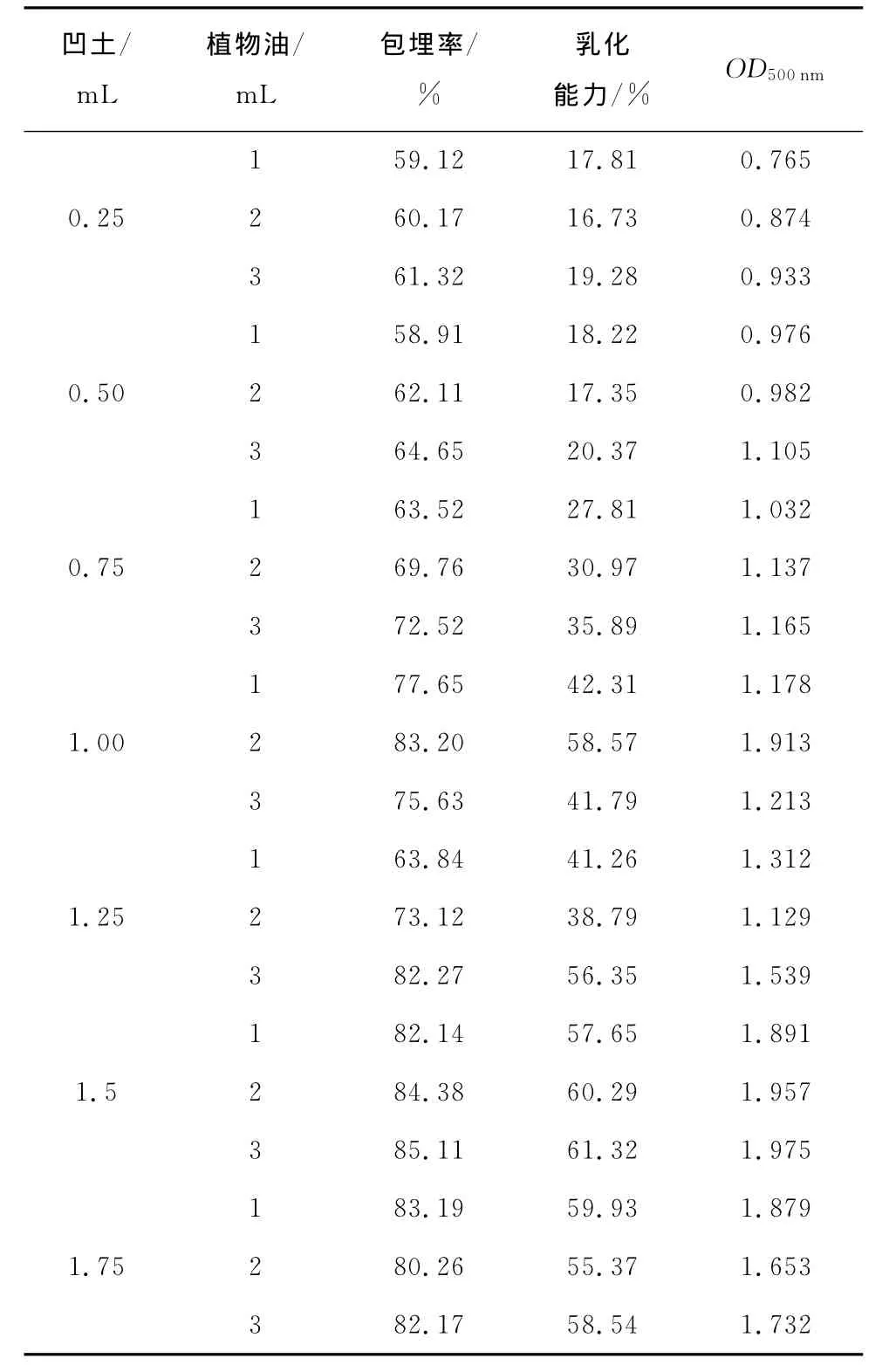
表3 油包水型试验凹土和植物油测定结果Table 3 Results of the water-in-oil type of attapulgite clay and vegetable oil
分离蛋白2mL,菌、吐温80 1mL。
凹土/mL植物油/mL包埋率/%乳化能力/% OD500nm 1 59.12 17.81 0.765 0.25 2 60.17 16.73 0.874 3 61.32 19.28 0.933 1 58.91 18.22 0.976 0.50 2 62.11 17.35 0.982 3 64.65 20.37 1.105 1 63.52 27.81 1.032 0.75 2 69.76 30.97 1.137 3 72.52 35.89 1.165 1 77.65 42.31 1.178 1.00 2 83.20 58.57 1.913 3 75.63 41.79 1.213 1 63.84 41.26 1.312 1.25 2 73.12 38.79 1.129 3 82.27 56.35 1.539 1 82.14 57.65 1.891 1.5 2 84.38 60.29 1.957 3 85.11 61.32 1.975 1 83.19 59.93 1.879 1.75 2 80.26 55.37 1.653 3 82.17 58.54 1.732

表4 因素水平表Table 4 Factors and levels table mL
2.4 油包水乳化液人工模拟胃液和肠液中存活结果
将上述各组乳化试样,模拟人工胃液和肠液,检测各时间段活菌数。各组试样在人工胃液和肠液中活菌数见图1、2。
各试验组在胃中随着时间的增加有所下降,在肠中活菌数刚开始随着时间的增加而增加,即菌体不断释放的过程,普遍在第6小时时达到最大,之后又逐渐衰减,即使在10h后,活菌数数量仍超过108CFU/mL,因此该乳油能够很好地发挥乳酸杆菌的作用。比较各试验组,其中又以3号试验组在肠中的活菌数释放最高,在人工肠液的第6小时达到最大释放效率。
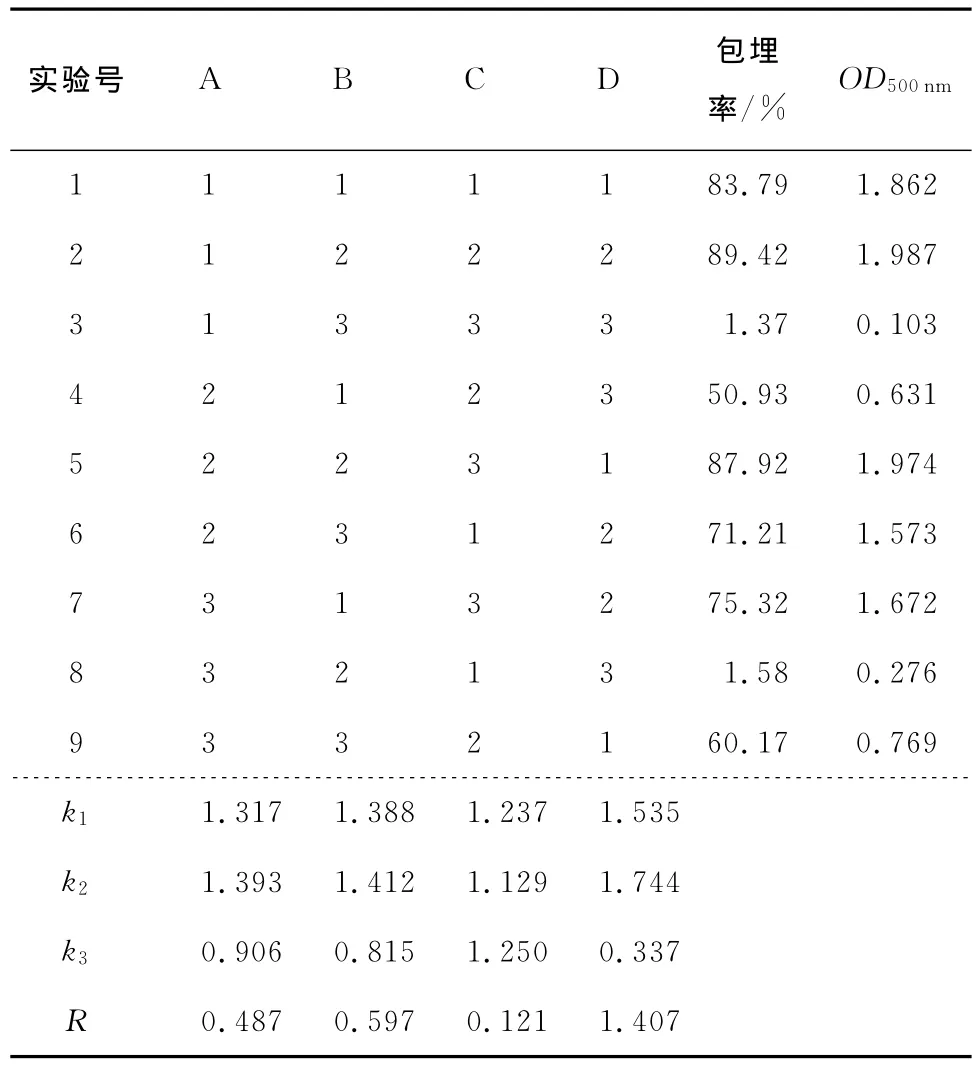
表5 正交试验结果Table 5 Orthogonal results of conditions
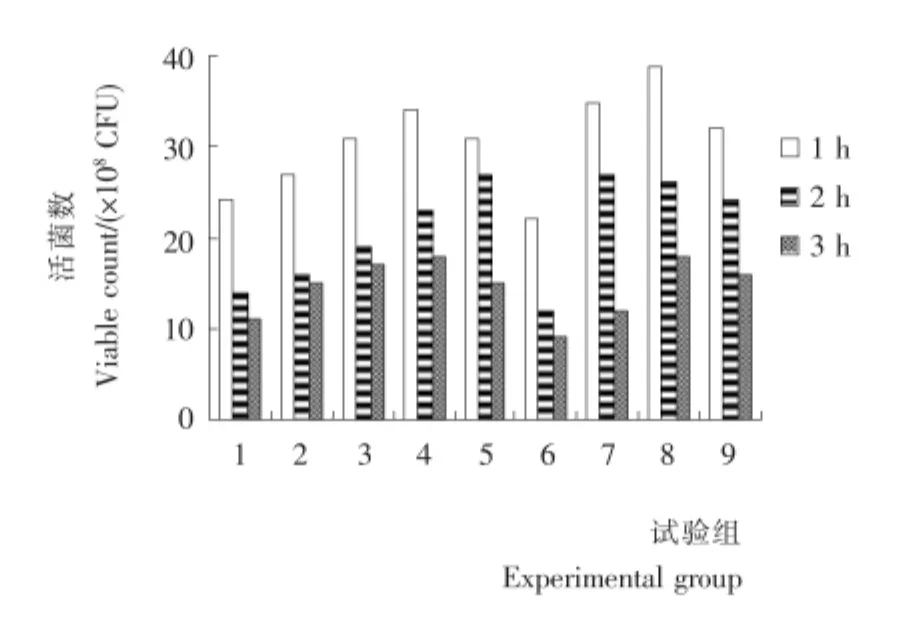
图1 人工模拟胃液各时间段活菌数Figure 1 CFU of emulsiton in artificial simulation gastric juice
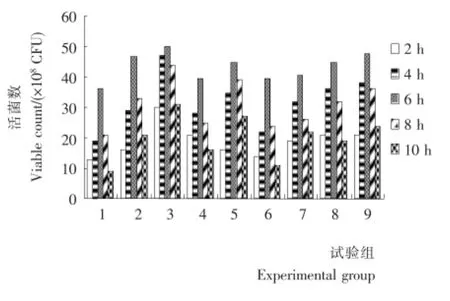
图2 人工模拟肠液中各时间段活菌数Figure 2 CFU of emulsiton in artificial simulation intestinal juice
3 结论
本试验以凹土悬液、大豆分离蛋白、植物油及吐温80制备乳酸杆菌水包油型乳化液,水包油型乳化液包埋率低,乳化能力一般;油包水型乳化液,包埋率好,乳化性能好,在人工模拟胃液中存活率高,在人工模拟肠液中第6小时可达到益生菌的最大释放,有利于益生菌很好地发挥肠定植作用。说明采用凹土复合大豆分离蛋白和植物油制备的油包水型乳化液,可以很好地包埋益生菌,抵抗胃的逆环境,以较高的存活率到达肠道,并在肠道中达到最高量的释放。本试验为更好地开发益生菌保护剂材料提供了较好的参考,同时为凹土作为新型材料在食品和医药领域的应用提供参考。
1 杨利营,盛京.凹凸棒粘土的研究开发应用[J].江苏化工,2001,29(6):33~37.
2 樊国栋,沈茂.凹凸棒粘土的研究及应用进展[J].化工进展,2009,28(1):99~105.
3 郑茂松,王爱勤,詹庚申.凹凸棒石黏土应用研究[M].北京:化学工业出版社,2007:13~59.
4 王郑,沈巍,林子增,等.凹凸棒土在水处理中应用的研究进展[J].安徽农业科学,2012,40(16):9 048~9 050.
5 Partty A,Kalliomaki M,Endo A,et al.Compositional development ofBifidobacteriumandLactobacillusmicrobiota is linked with crying and fussing in early infancy[J].PLoS One,2012,7(3):324~329.
6 祝艳梅.水分散性DHA乳油制备及稳定研究[D].无锡:江南大学,2009.
7 郭本恒.益生菌[M].北京:化学工业出版社,2004:22.
8 赵玉萍,黄颖娟,吴洁,等.以凹土为载体的新型益生菌制剂的制备[J].食品工业科技,2013(3):141~144.
9 孙庆申,韩德权,赵曜,等.一种载乳酸菌的大豆分离蛋白/果胶/壳聚糖复合微胶囊的制备方法:中国,201210163675[P].2012—09—26.
10 陈合,宋雅娟,王野,等.除氧剂及益生元对双歧杆菌BB01和BB28微胶囊化的影响[J].食品与机械,2014,30(1):5~10.
11 刘楠楠.喷雾干燥法制备芝麻油微胶囊的研究[J].食品与机械,2013,29(1):219~222.
12 陈超,杨剑,朱俊晨,等.益生菌微胶囊化壁材与方法的研究进展[J].食品工业科技,2012,33(14):403~407.
13 张根生,岳晓霞,李继光,等.大豆分离蛋白乳化性影响因素的研究[J].食品科学,2006,27(7):48~50.
