花芸豆铁蛋白的分离纯化
2015-12-20田童童王由美魏永辉张月茹杨金月
田童童 江 英 张 建 王由美 魏永辉 张月茹 杨金月
(石河子大学食品学院,石河子 832000)
花芸豆铁蛋白的分离纯化
田童童 江 英 张 建 王由美 魏永辉 张月茹 杨金月
(石河子大学食品学院,石河子 832000)
为了从花芸豆中获取纯化的植物铁蛋白,试验利用盐析及柱层析对花芸豆中的铁蛋白进行分离纯化。研究表明,铁蛋白提取的最佳工艺条件为:提取温度53.79℃,样液pH值为7.23,氯化镁浓度511.15 mmol/L,柠檬酸三钠浓度为685.24 mmol/L。该条件下模型预测花芸豆中铁蛋白的含量为4.40 mg/g,实际试验值为(4.27±0.09)mg/g。经DEAE-Sepharose Fast Flow阴离子交换柱和Sephacryl S-500分子筛柱纯化得到的电泳纯铁蛋白的相对分子质量为560 000,且只含有1种亚基,其相对分子质量为27 000。通过Western-Blot法对纯化所得的花芸豆蛋白质进行试验验证,结果确定该蛋白质为铁蛋白。
花芸豆 铁蛋白 分离 纯化
铁蛋白具有调节铁代谢平衡和解除亚铁离子毒性的双重功效。从细菌到植物再到人的铁蛋白,其结构非常保守[1-2]。铁蛋白是由24个亚基组成的中空球状分子,每2个亚基反向平行形成1组,再由这12组亚基对构成1个近似正八面体,成4-3-2倍轴对称。1个铁蛋白分子中可贮存4 500个无机三价铁化合物。脊椎动物铁蛋白分子中存在重链和轻链2种类型亚基,每个亚基都由1个4α螺旋簇和1个短螺旋簇构成,其中重链型亚基包括1个亚铁氧化红心,能够快速氧化亚铁离子[3-5]。
植物铁蛋白被认为是21世纪新型的补铁功能因子[6]。在已经发现的植物中,只有豆科类植物是将其近90%的铁储藏于种子的铁蛋白中[7]。铁是生物体生存所必需的矿物质元素[8]。据世界卫生组织2005年统计数据表明,全球大约有35亿人缺铁。天然的铁蛋白具有贮藏大量的铁和调节细胞内铁的动态平衡的双重作用。它可以形成血红素、铁硫原子簇,这使得其在呼吸作用、氮的固定等生理代谢过程中起着举足轻重的作用[9-11]。
花芸豆(PhaseolusvulgarisLinn.sp)属豆科菜豆属一年生草本植物,其生物学名叫菜豆,其中铁含量尤其丰富[12]。花芸豆蛋白是一种优质蛋白质,其氨基酸谱与FAO建议的理想蛋白质必需氨基酸模式谱比较,除甲硫氨酸外,其余均高出22%~63%,其中赖氨酸高出 31%~47%[13]。
因此,本试验以花芸豆为研究对象,在单因素试验的基础上,利用响应面分析法优化铁蛋白的提取工艺,且采用层析法对其进一步纯化,以期为植物铁蛋白的开发利用提供参考。
1 材料与方法
1.1 材料、试剂与仪器
花芸豆:石河子市农贸市场;丙烯酰胺(Acr)、甲叉双丙烯酰胺(Bis)、考马斯亮蓝R-250、十二烷基硫酸钠(SDS)和四甲基乙二胺(TEMED):美国Sigma公司。
DEAE-Sepharose和Sephacryl S-500:美国GEHealthcare Bio-Sciences AB公司;PVDF膜:美国millipore公司;Mini-proteinⅢ:美国Bio-Rad公司。
1.2 方法
1.2.1 花芸豆粗蛋白的制备
称取1 kg花芸豆浸泡于4℃双蒸水中处理24 h。去皮后倾倒于 2倍体积的 PBS(0.05 mol/L KH2PO4-Na2HPO4,pH 7.0,1%PVP)中,30 min后匀浆2 min,过滤。清液于55℃下水浴10 min,冷却至室温,于3 500 r/min离心15 min,上清液即为粗提液[14]。
1.2.2 粗提液的盐析
在粗提液中加入MgCl2晶体使其终物质的量浓度为500 mmol/L,静置20 min后加入柠檬酸三钠晶体使其终物质的量浓度为700 mmol/L,然后于4℃下静置过夜。在12 000 r/min,4℃下离心30 min,此时的花芸豆铁蛋白不再溶于上清液。加入2倍体积上清液,离心10 min,弃上清,重复3~4次直至只有褐色沉淀。将沉淀溶于2倍体积蒸馏水中,离心30 min,弃上清。重复2次用5倍体积蒸馏水溶解沉淀,离心30 min,合并上清液。花芸豆铁蛋白盐析后的溶液用pH 7.5的PBS缓冲液进行透析,透析液经抽滤后进行弱阴离子交换柱层析。
1.2.3 柱层析
1.2.3.1 阴离子交换柱层析
用 PBS(pH 7.5)平衡 DEAE-Sepharose Fast Flow后,将样液上柱(1.6 cm×25 cm),用4倍体积PBS洗脱,再用含0~0.8 mol/L NaCl的600 mL PBS进行梯度洗脱,流速为1.0 mL/min,每管5 mL,分管收集。将具有铁蛋白活性的收集液超滤浓缩到5 mL,以待进一步纯化。
1.2.3.2 凝胶过滤柱层析
用含有0.15 mol/L NaCl的 PBS平衡 Sephacryl S-500,待上柱(1.6 cm×50 cm)后,再用含有0.15 mol/L NaCl的 PBS洗脱,流速为 0.5 mL/min,每管 5 mL,分管收集。
1.2.4 Ferrozine试剂法测定Fe浓度
用微量移液器取20μL待测溶液,加入250μL 30%TCA,再加入超纯水使总体积达到1 mL。再于10 000 r/min离心1 min。取700μL上清液于新离心管中,依次向其中加入100μL饱和乙酸铵,62.5 μL 0.12 mol/L抗坏血酸,62.5μL 0.25 mol/L Ferrozine,最后加入超纯水使总体积达到1 mL。4 h后,在562 nm下比色,得到吸光值A562nm,即可用于表示铁含量(μg/dL)[15]。
1.2.5 Native-PAGE检测蛋白质分子纯度
用样品缓冲液以1∶2(V/V)的比例稀释样品,样品缓冲溶液中含有25%甘油,12.5%pH 6.8,0.5 mol/L Tris-HCl,1%溴酚蓝,充分混合后参照 Laemmli方法进行 Native-PAGE[16]。电泳结束后用考马斯亮蓝G-250染色法进行染色[17]。
1.2.6 SDS-PAGE检测蛋白质亚基纯度
聚丙烯酰胺凝胶电泳(SDS-PAGE)参照Chalkley等[18〛\报道的方法进行试验。样品分子质量的确定根据标准蛋白Marker的相对迁移率计算获得。
1.2.7 蛋白免疫印迹(Western-Blot)
1.2.7.1 SDS-PAGE电泳
将纯化后的蛋白质参照1.2.6部分电泳。
1.2.7.2 电转移
将1.2.7.1获得的电泳胶裁剪成适当大小,从上往下黑面、纤维板、滤纸、电泳胶、PVDF膜、滤纸、纤维板、白面依次放好,置于电泳槽中,于4℃条件下(100 mV,3 h)转膜。
1.2.7.3 曝光显影
将1.2.7.2得到的电泳条带切成合适大小,用丽春红染色0.5~1 min,依次用水、电转液、水和TBST冲洗干净;用含 2.5/100(m/V)无抗乳粉的TBST室温下封闭2 h;加入一抗后置于4℃冷藏柜中过夜,然后用TBST冲洗干净后;加入二抗后置于4℃冷藏柜中过夜,仍然用TBST冲洗干净,然后用纯水洗去TBST;膜与底物放映5 min后直接放与暗匣黑暗操作;曝光3 min、显影液中漂洗3 min、定影液中漂洗1~3 min。
2 结果与分析
2.1 花芸豆铁蛋白提取条件的优化
试验通过对可能影响花芸豆铁蛋白提取的4个因素(浸提液pH值、氯化镁物质的量浓度、柠檬酸三钠物质的量和提取温度)进行详细的单因素试验分析,结果表明,在浸提液的 pH值7.0,氯化镁物质的量浓度500 mmol/L,柠檬酸三钠物质的量浓度700 mmol/L及加热温度55℃的条件下花芸豆铁蛋白含量为(3.89±0.07)mg/g。
在单因素结果的基础上,为了得到花芸豆铁蛋白提取的最优工艺参数,利用响应面分析法对铁蛋白的提取做了进一步的优化。响应面分析因素水平编码如表1所示,试验结果如表2所示,方差分析结果如表3所示。

表1 盐析法提取铁蛋白响应面分析因素水平编码表
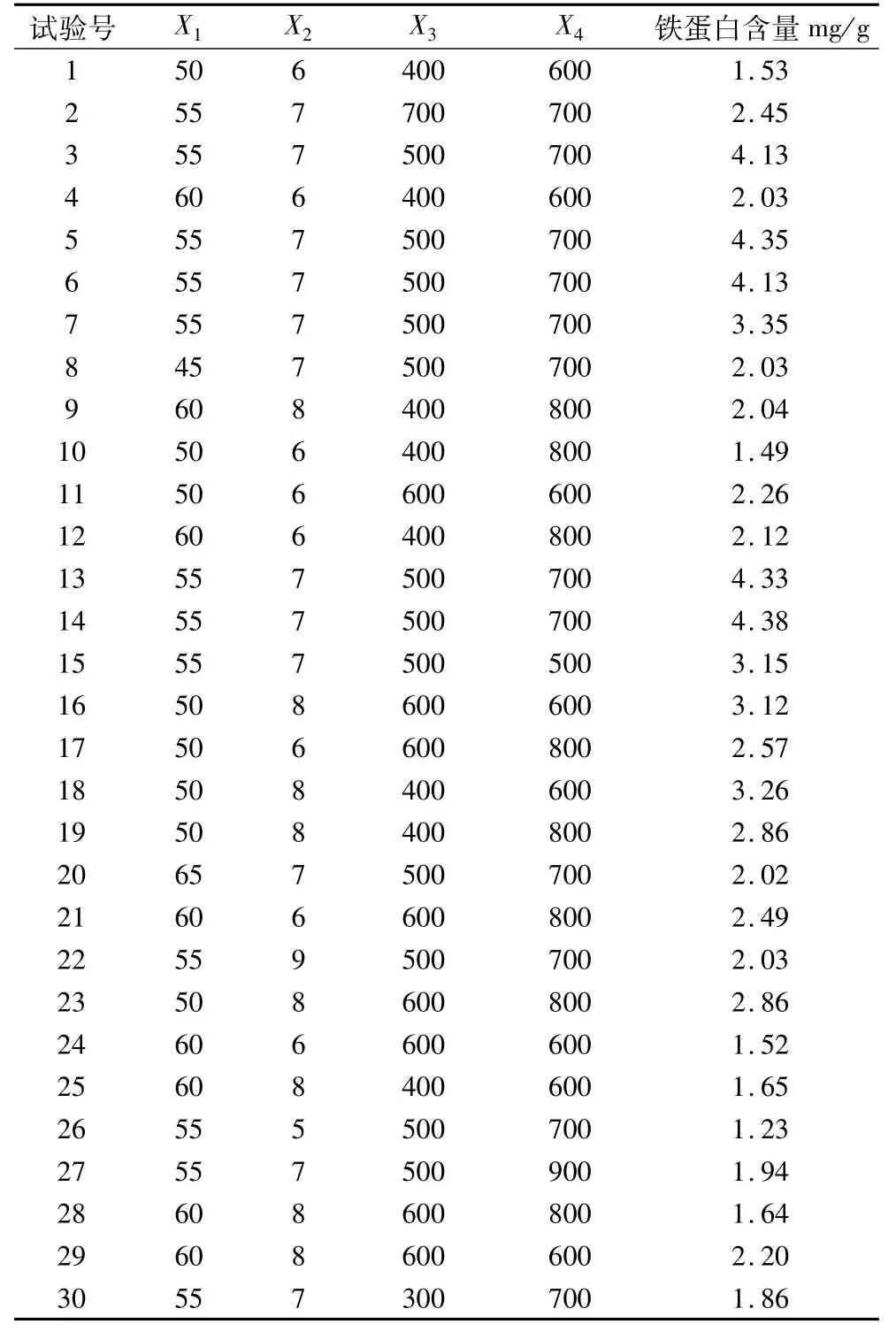
表2 中心组合设计试验结果
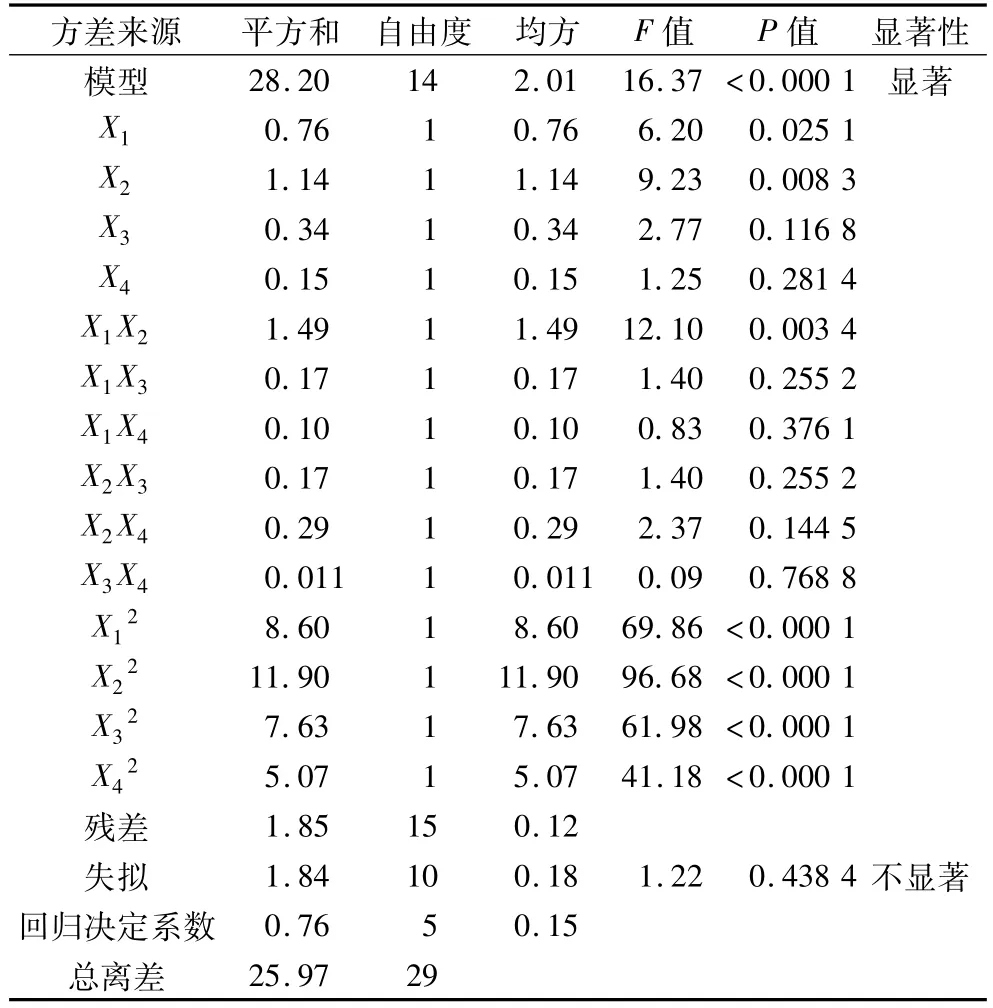
表3 方差分析结果
当P<0.05时,影响因素对响应值影响为差异显著,当P<0.001时为差异高度显著,P<0.000 1时为差异极显著[19]。表 3中显示模型的P<0.000 1,说明试验模型具有高度的显著性,失拟项的P=0.438 4>0.05,不显著,表明响应面设计的模型与实际试验拟合良好,模型的相关系数R2=93.86%,更加说明该模型的可信度较高。由表3可知,X1的P=0.008 3<0.05,表明 pH值起着显著性的影响;X1的P=0.025 1<0.05,与X2相比不是很显著,说明温度的影响次于pH值。各个因素经过回归拟合后,经解得到的铁蛋白提取量的回归方程为:
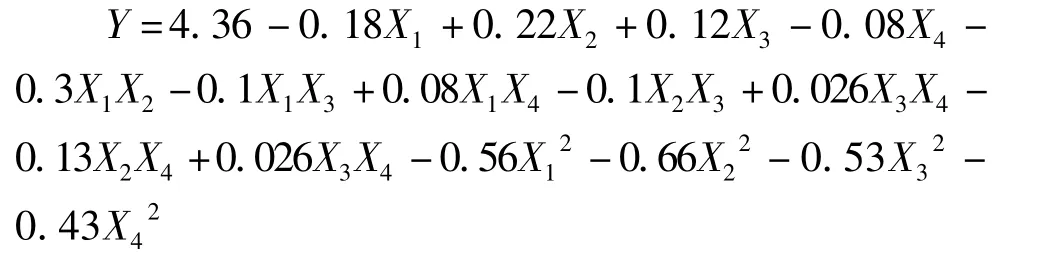
通过软件求解方程,得出最优工艺条件为温度53.79℃、pH为 7.23、氯化镁物质的量浓度为511.15 mmol/L、柠檬酸三钠物质的量浓度685.24 mmol/L,此时铁蛋白达到4.40 mg/g。为检验模型的可靠性,课题组做了验证试验,结果显示铁蛋白提取率为(4.27±0.09)mg/g,与理论预测值基本吻合。
响应面分析方法的图形是特定的响应面(Y)与对应的因素X1、X2、X3、X4构成的1个三维空间在二维平面上的等高图,每个响应面对其中2个因素进行分析,另外2个因素固定在零水平。从中可以直观地反映各因素对响应值的影响,从试验所得的响应面分析图上可以找到它们在提取过程中的相互作用,花芸豆铁蛋白提取回归优化响应曲面如图1所示。
由图1可知,温度、pH值、氯化镁浓度和柠檬酸三钠浓度4个因素之间相互作用对花芸豆铁蛋白含量均呈现出显著的二次效应。结合方差分析表3中二次项的P值均小于0.01,表明各个因素之间的交互作用极显著。从图1a中可知温度与pH值对铁蛋白含量的影响曲面较陡,说明温度与pH值的交互影响显著,pH和柠檬酸三钠的交互影响仅次于温度与pH,如图1e所示。由图1b和图1d及方差分析表3可知,温度与氯化镁及pH值与氯化镁之间的交互作用程度是相同的。由图1c和图1f可知,温度与柠檬酸三钠浓度及氯化镁和柠檬酸三钠浓度之间的交互影响作用最小。综上所述,影响花芸豆铁蛋白提取的各个因素之间既有相互促进的效果,又有相互制约的作用,说明在分离提取花芸豆铁蛋白时,要细致全面的考虑各因素之间的影响作用,要做到利用促进作用避免抑制作用,进而达到最佳的提取效果。
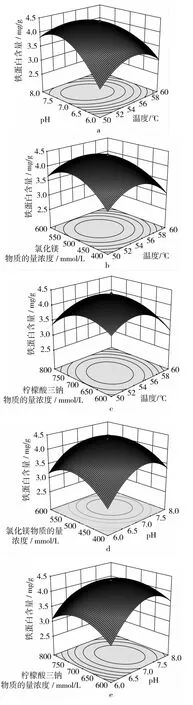
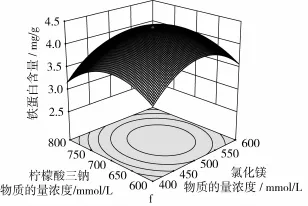
图1 花芸豆铁蛋白提取响应曲面图
2.2 花芸豆铁蛋白的纯化
花芸豆铁蛋白样品经DEAE-Sepharose Fast Flow阴离子交换柱和Sephacryl S-500分子筛柱洗脱图谱分别如图2~图3所示。花芸豆铁蛋白纯化过程中的电泳图谱如图4所示。
由图2可知,花芸豆铁蛋白样品经过DEAESepharose阴离子交换层析后得到1个较为明显的吸收峰,经电泳检测后显示该峰下的蛋白质为杂质蛋白,如图4a所示。将蛋白含量较高的收集管合并,超滤浓缩至5 mL,然后经过Sephacryl S-500分子筛柱进行层析纯化。由图3可知,凝胶层析后得到1个花芸豆铁蛋白吸收峰,经SDS-PAGE电泳检测得知该峰下的蛋白质为电泳纯的花芸豆铁蛋白,且只含有1个亚基,其相对分子质量约为27 000,如图4b所示。凝胶层析纯化后的铁蛋白经过Native-PAGE检测其相对分子质量为560 000,如图5所示。
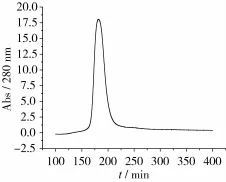
图2 花芸豆粗铁蛋白经DEAE-Sepharose阴离子交换柱洗脱图谱图
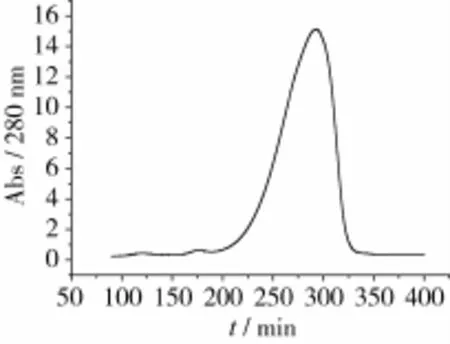
图3 花芸豆粗铁蛋白经Sephacryl S-500凝胶层析柱的洗脱图谱
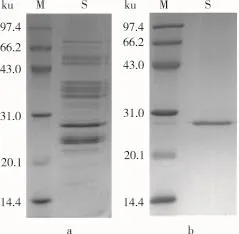
图4 花芸豆铁蛋白纯化过程中的SDS-PAGE电泳图谱
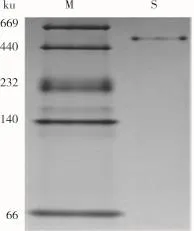
图5 经过Sephacryl S-500凝胶层析柱后铁蛋白样品的Native-PAGE电泳图谱
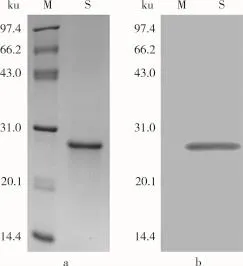
图6 花芸豆铁蛋白Western-Blot分析结果
蛋白免疫采用的是抗体免疫反应,然后抗体再和二抗(其自身的抗体,具有显色作用)结合,如果样品中存在特定蛋白,经过曝光反应后,会发生显影。反之,则不会发生变化。将从花芸豆中纯化的铁蛋白经过SDS-PAGE分离后,其中一块凝胶用考马斯亮蓝染色,如图6a所示。另一块凝胶中铁蛋白转移到聚偏二氟乙烯膜上与其抗体发生反应,然后再与二抗反应,最后曝光显影。经过显影后发现胶片上在相对分子质量为27 000处有条带,如图6b所示,说明纯化的蛋白为铁蛋白。
3 结论
3.1 花芸豆铁蛋白提取分离的最佳工艺参数为:温度53.79℃、pH为7.23、氯化镁物质的量浓度为511.15 mmol/L、柠檬酸三钠物质的量浓度685.24 mmol/L,此时花芸豆粕中铁蛋白的提取率达到4.40 mg/g。经验证,结果显示铁蛋白提取率为(4.27±0.09)mg/g,与理论预测值基本吻合。
3.2 样品经阴离子交换层析后出现1个吸收峰,该处的样品经SDS-PAGE电泳后显示蛋白峰为杂质蛋白峰。将该段时间收集的蛋白液超滤浓缩至5 mL,然后上分子筛柱分离纯化,收集样品得到目标蛋白。经柱层析分离、纯化所得的花芸豆铁蛋白达到电泳级,且只有一种相对分子质量为27 000的亚基。从花芸豆中分离纯化的蛋白质为铁蛋白。
[1]Harrison P M,Arosio P.The ferritins:molecular properties,iron storage function and cellular regulation[J].Biochimica et Biophysica Acta:Bioenergetics.1996(3):161-203
[2]Chasteen N D,Harrison P M.Mineralization in ferritin:an efficient means of iron storage[J].Journal of Structural Biology,1999,126(3):182-194
[3]Zhao G H,Bou-Abdallah F,Arosio P,et al.Multiple pathways for mineral core formation in mammalian apoferrtion.The role of hydrogen peroxide[J].Biochemistry,2003,42(10):3142-3150
[4]Liu X F,Theil E C.Ferritins:dynamic management of biological iron and oxygen chemistry[J].Accounts of Chemical Research,2005,38(3):167-175
[5]Corsi B,Cozzi A,Arosio P,et al.Human mitochondrial ferritin expressed in HeLa cells incorporates iron and affects cellular iron metabolism[J].Journal of Biological Chemistry,2002,277(25):22430-22437
[6]云少君,赵广华.植物铁代谢及植物铁蛋白结构与功能研究进展[J].生命科学,2012,24:809-816
[7]Ambe S,Ambe F,Nozuki T.Mossbauer study of iron in soybean seeds[J].Journal of Agricultural and Food Chemistry,1987,35(3):292-296
[8]Zhao GH.Phytoferritin and its implications for human health and nutrition[J].Biochimica et Biophysica Acta:General Subjects,2010,1800(8):815-823
[9]Grady J K,Chen Y,Chasteen N D,et al.Hydroxyl radical production during oxidative deposition of iron in ferritin[J].Journal of Biological Chemistry,1989,264(34):20224-20229
[10]Theil E C.Iron,Ferritin and Nutrition[J].Annual Review of Nutrition,2004,24:327-343
[11]Davila-Hicks P,Theil E C,Lonnerdal B.Iron in ferritin or in salts(Ferrous Sulfate)is equally bioavailable in nonanemic women[J].The American Journal of Clinical Nutrition,2004,80(4):936-940
[12]何照范.粮油籽粒品质及其分析[M].北京:中国农业出版社,1985
[13]卿晓红,熊绿芸.芸豆不同品种的营养成分分析[J].贵州农学院学报,1996,15(2):59-61
[14]Laulhere J P,Laboure A M,Briat J F.Mechanism of the transition from plant ferritin to phytosiderin[J].Journal of Biological Chemistry,1989,264(6):3629-3635
[15]Carter P.Spectrophotometric determination of serum iron at the submicrogram level with a new reagent(ferrozine)[J].Analytical Biochemistry,1971,40(2):450-458
[16]Chalkley R J,Burlingame A L.Identification of GlcNAcylation sites of peptides and alpha-crystallin using Q-TOF mass spectrometry[J].Journal of the American Society for Mass Spectrometry,2001,12(10):1106-1113
[17]朱厚础.蛋白质纯化与鉴定指南[M].北京:科学出版社,1999,249-259
[18]Laemmli U K.Cleavage of structure proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,277(5259):680-685
[19]丁仲鹃,毕玉芬,戴云,等.中心组合试验设计响应面分析法优化蜂胶总多酚提取工艺[J].食品科学,2013,34(2):17-21.
Isolation and Purification of Ferritin from the Phaseolus vulgaris
Tian Tongtong Jiang Ying Zhang Jian Wang Youmei Wei Yonghui Zhang Yueru Yang Jinyue
(Food College of Shihezi University,Shihezi 832000)
In order to obtain the purified phytoferritin from thePhaseolusvulgaris,ferritin was isolated and purified through salting out method and column chromatography.As a result,the ferritin yield was up to(4.27±0.09)mg/g under the condition that extraction temperature 53.79℃,sample solutions pH 7.23,concentration of MgCl2511.15 mmol/L,concentration of sodium citrate 685.24 mmol/L.Ferritin of electrophoresis level,the molecular weight of 560 000,was obtained by further chromatographic purification which contains only one subunit of 27 000.Simultaneously,protein extracted from the phaseolus vulgaris was identified with the help of the Western Blot.The result revealed that the protein was ferritin.
phaseolusvulgaris,ferritin,isolation,purification
Q51
A
1003-0174(2015)09-0030-06
时间:2015-06-01 17:38
网络出版地址:http://www.cnki.net/kcms/detail/11.2864.TS.20150601.1738.001.html
新疆生产建设兵团科技支疆专项计划(2010ZJ13),石河子大学创新团队(2011ZRKXTD-0803),石河子大学青年骨干教师培训(3152SPXY01027)
2014-09-15
田童童,男,1990年出生,硕士,食品生物化学
张建,男,1979年出生,副教授,食品生物化学
