鲤鱼肌肉蒸制过程中的品质变化*
2015-12-16郑皎皎吴琼王垚范馨茹董秀萍辛丘岩潘锦锋
郑皎皎,吴琼,王垚,范馨茹,董秀萍,辛丘岩,潘锦锋
1(大连工业大学食品学院,辽宁大连,116034)2(国家海洋食品工程技术研究中心,辽宁 大连,116034)
鲤鱼(Cyprinus carpio L.)是我国重要的经济淡水鱼类,含有丰富的完全蛋白质、不饱和脂肪酸以及大量磷脂质、胶原蛋白、蛋氨酸和 VA等营养素[1]。2012年,中国鱼类总产量3 476.40万t,淡水鱼类养殖量2 334.11万t,其中鲤鱼产量289.70万t,位居全国淡水养殖鱼类总量第三位[2]。蒸制加工是传统且常见的加工方式,加热不仅能使肉质成分产生有利的变性,最大限度保持其营养价值和感官特性,同时能够抑制微生物的生长延长货架期[3]。蒸制加工在畜禽类肉质品质方面研究较多,如羊羔肉[4]、鸭肉[5]、火鸡肉[6]、牛肉[7]等,在鱼肉质品质方面的研究则较少。已有研究主要集中于海水鱼,如研究蒸制对大菱鲆过敏原免疫原性的影响[8]以及对刀鲚挥发性成分的影响[9]等。实际生产中,蒸制工艺控制不当,会严重影响产品的质量和出品率,影响生产企业的效益提升。本文通过考察新鲜鲤鱼背部肌肉蒸制过程中理化性质、微观组织结构以及质构的变化,探讨鲤鱼肌肉在蒸制过程中的品质变化规律。
1 材料与方法
1.1 材料与仪器
新鲜鲤鱼,购于大连市美林园菜市场。
无水乙醇,二甲苯,甲醛,天津市大茂化学试剂厂;石蜡,上海三精工贸公司;Tris,上海生工生物工程技术公司;酸性复红,天津市化学试剂研究所;苦味酸,广东化学试剂厂;考马斯亮蓝G-250,索莱宝科技公司。顺丁烯二酸,苏木精,国药集团化学试剂公司。
探针式温度测定仪,台湾泰仕电子工业有限公司;CF16RXⅡ型冷冻离心机,日本日立集团;T6新世纪紫外可见分光光度计,北京普析通用仪器有限公司;TP1020脱水机,EG1150C包埋机,RM2245切片机,德国徕卡有限公司;BX51倒置显微镜,奥林巴斯公司;TA-XTPLUSZ质构仪,英国Stable Micro System公司。
1.2 实验方法
鲤鱼头部致晕,于碎冰中平衡30 min。取鱼背部肌肉(鳃盖后缘至肛门,侧线以上部分)切成不同规格的小块,于饱和蒸汽中分别蒸制 2、4、6、8、10、12、14、16 min。
1.2.1 升温曲线的测定
将1.0、1.5、2.0 cm3的鱼背部肌肉小块分别置于聚乙烯蒸煮袋真空包装和玻璃培养皿中,冰水浴平衡30 min。将温度探针插入鱼块几何中心处,放入98~100℃饱和蒸汽的锅中隔水加热,每15 s记录1次温度计读数,直至温度稳定。以鱼块的中心温度对加热时间作图,即为鱼块的传热曲线。
1.2.2 失重率与失水率的测定
将鱼背部肌肉切成1.5 cm3小块,测定蒸制前后样品质量和水分含量。失重率以试样加热前后质量差值与试样加热前比值的百分比计算,失水率以试样加热前后水分含量差值与试样加热前水分含量比值的百分比计。

1.2.3 pH值的测定
将规格为1.5 cm3鱼块蒸制前后样品碾磨均匀,加9倍体积去离子水,匀浆2 min,4℃冰箱内静置10 min,用 pH 计测定 pH 值[10]。
1.2.4 肌原纤维蛋白的提取及测定
将蒸制前后规格为1.5 cm3鱼块样品加入10倍体积0.05 mol/L KCl-20 mmol/L Tris-maleate缓冲液(pH 7.0),匀浆,4℃下12 000×g离心10 min,弃去上清液,重复操作1次,所得沉淀加入8倍体积0.6 mol/L KCl-20mMol/L Tris-maleate缓冲液(pH 7.0),再进行匀浆,4℃冰箱内静置1h后,于4℃下18 600×g离心20 min。取上清液采用Bradford法测定肌原纤维蛋白含量[11]。
1.2.5 聚丙烯酰胺凝胶电泳
收集规格为1.5 cm3蒸制后肌肉组织流失液,并对其进行SDS-PAGE电泳分析以观察蛋白质种类。电泳条件为5%的浓缩胶与12%的分离胶,电压为15V,上样量为 20μL,分离时间为 30 min[12]。
1.2.6 组织学观察
参照刘世新方法[13],将规格为1.5 cm3鱼块样品蒸制前后肌肉组织用中性甲醛溶液固定,经梯度乙醇脱水、二甲苯透明、石蜡包埋后,切片成6μm,再经脱蜡后采用V-G法染色,在光学显微镜下成像,拍照。
1.2.7 TPA测试和剪切力测试
参照刘铁玲法[14],TPA测试样品为纵切1.0 cm3小块,选用型号P50探头,测试前速度2.00 mm/s,测试中速度 1.00 mm/s,测试后速度1.00 mm/s,压缩深度60%,时间间隔5 s,压缩次数2次,数据收集由计算机软件完成,实验重复5次。
剪切力测定参照农业部肉品标准[15],加热后去膜切块,于冰水浴中平衡一段时间,再置于80℃恒温水浴锅中加热至中心温度达到60℃(约60 s)后测定。测试样品为纵切2.0 cm×1.0 cm×1.0 cm小块,选用ECB型号探头。设定测试参数为剪切速度1.00 mm/s,数据收集由计算机软件完成,实验重复五次。
2 结果与分析
2.1 蒸制过程中鱼肉升温曲线
图1-A中聚乙烯袋包装的1.0、1.5、2.0 cm3鱼块,从5℃升高至100℃,分别需要2.5、4和6 min;图1-B中用玻璃培养皿加热的组织分别需要5、6和9 min。温度变化过程呈S型增加。
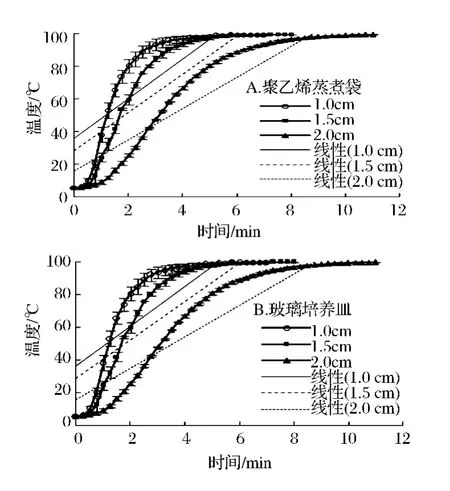
图1 蒸制过程中鲤鱼肌肉组织升温曲线Fig.1 Center temperature of carp tissue during steam cooking
可见,鱼块规格和加热容器对升温速率有明显影响,组织规格越小,介质越薄,组织中心达到预设温度越快。加热初期,热量从表面传到中心需要一定时间,温度短时内保持较低;随着加热时间的延长,鱼块中心部位的温度不断升高;加热后期,组织表面可能形成凝胶,阻碍了热量向内传递,使中心温度上升缓慢。孙丽[16]对金枪鱼的研究中发现长10 cm、宽6 cm、厚4 cm的肌肉组织蒸制时,中心温度在加热初期100 s内基本不变,接着700 s内由10℃迅速升至50℃,而后500 s内由50℃缓慢升至70℃,最后消耗500 s中心温度才由70℃升至80℃。可见在实际应用中,应根据鱼的种类和规格来确定加热的温度及时间,以保证样品的品质。
2.2 蒸制过程中鱼肉失重率与失水率
在图2中,加热2 min时,组织失重约为6%,主要是蛋白质受热变性,游离水流出。随温度的升高(2~12 min),肌原纤维蛋白和胶原蛋白开始变性,持水力下降,蛋白质降解渗出组织。加热12~16 min,蛋白质几乎全部变性,重量损耗严重,这些作用共同使得加热后期鱼肉的质量不断降低,失重率近20%。

图2 蒸制过程中鲤鱼肌肉组织失重率及失水率Fig.2 Rate of mass and moisture loss of carp tissue during steam cooking
2~10 min时,失水率缓慢上升,在10~14 min区间迅速上升,16 min失水率约达7%。加热初期,鱼肉组织细胞内的游离水释放出来,失水程度增加。继续加热,肌原纤维蛋白和胶原蛋白逐渐变性,纤维收缩,持水力降低,水分从中心向表面迁移,使鱼块失水率继续增加,这些作用共同使加热后期鱼肉的失水率上升。当中心温度进一步升高,鱼肉大部分区域已完成变性,可变性区域的减少使得可释放出的水分的量减少,同时已经变性的蛋白质分子在表面和纤维间产生凝聚,阻碍了水分向表面迁移。这与鲍鱼腹足[17]肌肉蒸煮研究变化规律一致。
肉类在加热过程中最明显的变化就是汁液流失和质量减轻,蒸煮时间越长,组织收缩越明显,质量损失越大。鱼肉水分的流失及变性蛋白质等从组织的溶出[18],对鱼肉营养含量和产品得率会造成不利影响。
2.3 蒸制过程中鱼肉pH值变化

图3 蒸制过程中鲤鱼肌肉组织pH值Fig.3 pH value of carp tissue during steam cooking
鲤鱼在宰杀后初期pH值会偏低,基本呈中性。随热处理时间延长,脂肪发生氧化,产生了烷烃、醛、酮等物质,这些物质多为碱性或中性分解产物,使pH值有所上升[19]。也可能是蛋白质受热变性,酸性基团减少,使pH值升高。从图3中可以看出,加热初期,pH值上升的速率较为快速(0~4 min),加热后期,pH值变化不大,整个加热过程中pH值升高了0.28。鲤鱼肌肉组织在加热2 min时,中心温度升至60℃,其pH值增加了0.16,此后缓慢升高。
2.4 蒸制过程中鱼肉肌原纤维蛋白提取率
随加热时间延长,肌原纤维蛋白含量逐渐减少。加热2 min时,肌原纤维蛋白含量迅速减小为0.2%,继续加热,肌原纤维蛋白含量减少速度减缓,结果见图4。

图4 蒸制过程中鲤鱼肌肉组织肌原纤维蛋白提取率Fig.4 Myofibrillar protein extraction rate of carp tissue during steam cooking
蛋白质变性程度是评价肉类食品熟化的重要指标,而加热是应用最广泛的食物蛋白质变性方法,鱼肉蛋白质主要是肌原纤维蛋白,鱼肉保水性等诸多加工特性都与肌原纤维蛋白的特性相关[20]。因此通过热处理使大部分肌原纤维蛋白变性,减少流失率是保证产品特性的重要措施。研究结果显示,加热2 min时肌原纤维蛋白提取率仅为未加热时提取率的12%,4 min时肌原纤维蛋白提取率仅为未加热时提取率的10%,此时肌原纤维蛋白90%变性,鱼肉基本熟化[21]。由以上结果可知,规格为1.5 cm3的鲤鱼肌肉加热4 min,可完成肉质熟化并较大程度地保留肌原纤维蛋白含量。
2.5 蒸制过程中鱼肉组织流失液电泳

图5 蒸制过程中鲤鱼组织流失液电泳蛋白图谱Fig.5 Protein pattern of carp tissue on SDS-PAGE electrophoresis during steam cooking
肌肉组织流失蛋白质基本为肌浆蛋白等分子量相对较小的水溶性蛋白,在图5中主要分布于相对低分子量区域。水溶性蛋白中除肌浆蛋白外,还有一些多肽以及肌原纤维蛋白的分解产物,因此相对高分子质量区域也有一些条带分布。比较电泳条带发现,加热时间较长的组织流失蛋白高分子质量区域条带数量显著减少或深度显著减弱,说明其中的高分子蛋白大都已发生变性。同时低分子质量区域的条带数量也减少或深度变浅,说明肌肉组织中的低分子质量的蛋白也发生了变性,但大部分尚处在未变性状态。鲤鱼肌肉组织在加热2 min,中心温度为60℃时,分子质量大于116kDa的蛋白尚未全部消失。
2.6 蒸制过程中的鱼肉组织结构
肌肉组织形态是影响鲤鱼品质和口感的主要因素。图6中黄色为肌原纤维,红色为结缔组织,白色为纤维间隙。肌束间的肌膈膜呈红色,可能含有胶原蛋白等结缔组织成分,且随加热时间的延长,红色越来越少,说明胶原纤维蛋白有一定程度的溶解、流失。加热前的肌束均平行排列构成肌肉,在低温及短时高温加工后,纤维簇的间隙均逐渐明显;随着温度的升高和时间的延长,纤维簇中纤维间的空隙逐渐增大,并开始出现断裂,见图6。肌原纤维的这种变化与加热处理的温度和时间密切相关。因此,在加工过程中,选择合适的时间和温度,可有效地控制鱼肉加工制品的品质。

图6 蒸制过程中鲤鱼组织组织结构Fig.6 Histological structure of carp tissue during steam cooking
2.7 蒸制过程中的鱼肉质构特性
如图7所示,随加热时间的延长,各指标呈下降趋势,且均先迅速下降后缓慢下降。硬度与咀嚼性有一定的相关性,硬度、咀嚼性和回复性在加热4 min后变化不大。肌肉的剪切力主要与肌纤维蛋白和胶原蛋白的性质有关,随加热时间延长,肌原纤维组织松散、甚至断裂,胶原蛋白随水分溶出,剪切力不断下降,在4 min后趋势基本不变。而三黄鸡胸肉80℃加热5 min后,硬度和咀嚼性增大,加热20 min后基本不变,而回复性则随加热时间延长而减小,至加热15 min时达到最小值,此后缓慢增加[22];鲍鱼80℃加热0~120 min的剪切力大于98℃加热时的剪切力,二者均呈先上升后下降的趋势,80℃加热10 min时剪切力达到最大值,98℃加热15 min时剪切力达到最大值[23]。可见不同动物种类组织蛋白在蒸制过程中的质构变化规律不尽相同,鱼蛋白的肌肉纤维单元较小,鱼蛋白质构变化时间也较短。
3 结论
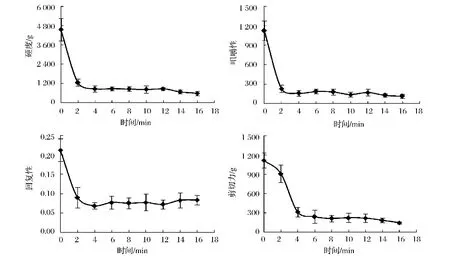
图7 蒸制过程中鲤鱼质构Fig.7 Texture of carp tissue during steam cooking
(1)鲤鱼肌肉在蒸制过程中,失重率、失水率和pH值显著上升。肌原纤维蛋白提取率降低,肌浆蛋白溶出,高分子质量蛋白条带减弱或消失,低分子质量蛋白条带变浅,大部分肌原纤维蛋白及部分低分子蛋白发生了变性。
(2)随加热时间延长,微观组织结构明显变化,肌原纤维间空隙变大,纤维变粗,并出现断裂。
(3)硬度、咀嚼性、回复性及剪切力均随加热时间延长而降低,1.5 cm3厚的鲤鱼肉加热4 min后4项品质指标基本不变。
(4)1.5 cm3厚的鲤鱼肉蒸制4 min综合品质较好。
[1] 彭增起,刘承初,邓尚贵.水产品加工学[M].北京:中国轻工业出版社,2010:12.
[2] 董金和.2013中国渔业统计年鉴[M].北京:中国农业出版社,2012.
[3] 易先勇.传统蒸菜向左走新派蒸菜向右走[J].中国食品,2008,(15):48-49.
[4] 杨小波,刘敦华,吴华玉,等.响应面法优化清蒸羊羔肉工艺配方[J].肉类研究,2013,25(9):15-20.
[5] 苏赵,李诚.方便粉蒸鸭肉加工工艺[J].农产品加工·综合刊,2013,(3):20-21.
[6] Mora B,CurtiE,VittadiniE,et al.Effect of different air/steam convection cooking methods on turkey breast meat:physical characterization,water status and sensory properties[J].Meat Science,2011,88(3):489-497.
[7] Modzelewska-KapitulaM,DabrowskaE,JankowskaB,et al.The effect of muscle,cooking method and final internal temperature on quality parameters of beef roast[J].Meat Science,2012,91(2):195-202.
[8] 李振兴,黄榕芳,吴玟静,等.热蒸加工对大菱鲆过敏原免疫原性的影响[J].食品安全质量检测学报,2012,3(4):279-284.
[9] 吴薇,陶宁萍,顾赛麒,等.蒸制刀鲚肉挥发性成分的鉴定与分析[J].食品工业科技,2013,34(20):82-86.
[10] Sethuraman V,Haq B,Chezhian A,et al.Changes due to the effect of the heavy metals(HgCl2and ZnSO4)concentrationon themarine fish,Tilapia Mossambica[J].Archives of Applied Science Research,2011,3(6):333-341.
[11] 姜凤英.温度对海捕和养殖对虾蛋白特性的影响[D].青岛:中国海洋大学,1997.
[12] 安建平,王延璞.生物化学与分子生物学实验技术教程[M].兰州:兰州大学出版社,2005:71-77,208-217.
[13] 刘世新.实用生物组织学技术[M].北京:科学出版社,2004:3.
[14] 刘铁玲,何新益,李昀.冻藏对鲢鱼、鲤鱼鱼肉质构影响的比较研究[J].食品与机械,2010,26(2):13-18.
[15] 农业部行业标准.NY/T 1180-2006.肉嫩度的测定剪切力测定法[S].
[16] 孙丽,夏文水.蒸煮对金枪鱼肉及其蛋白质热变性的影响[J].食品与机械,2010,26(1):22-25.
[17] 肖桂华,朱蓓薇,董秀萍,等.热加工条件对鲍鱼腹足部分加工特性的影响[J].大连工业大学报,2012,31(1):1-7.
[18] 邱澄宇.鲮鱼肌肉加热变形规律的研究[J].集美大学学报:自然科学版,2007,12(3):217-220.
[19] 郭建凤,武英,呼红梅,等.不同储存温度、时间对长白猪肌肉pH及失水率的影响[J].西北农业学报,2009,18(1):33-36.
[20] Riebroy S,Benjakul S,Visessanguan W,et al.Acid-induced gelation of natural actomyosin from Atlantic cod(Gadus morhua)and burbot(Lota lota)[J].Food Hydrocolloids,2009,23(1):26-39.
[21] Warne R D,Kauffman R G,Greaser M L.Muscle protein changes postmortem quality Traits[J].Meet Science,1997,45(3):339-352.
[22] 张立彦,吴兵,包丽坤.加热对三黄鸡胸肉嫩度、质构及微观结构的影响术[J].华南理工大学学报:自然科学版,2012.40(8):116-121.
[23] Chiou T K,Tsai C Y,Lan H L,et al.Chemical,physical and sensory changes of small abalone meat during cooking[J].Fisheries Science,2004,70(5):867-874.
