数字RT-PCR检测鲤春病毒血症的方法建立与应用
2015-12-16申翠翠张晨曦胡德聪肇慧君
吴 斌,申翠翠,张晨曦,胡德聪,肇慧君,张 琳
(1.辽宁出入境检验检疫局,辽宁大连 116001;2. 大连大学,辽宁大连 116622;3. 湖北出入境检验检疫局,湖北武汉 430050)
数字RT-PCR检测鲤春病毒血症的方法建立与应用
吴 斌1,申翠翠1,张晨曦2,胡德聪3,肇慧君1,张 琳1
(1.辽宁出入境检验检疫局,辽宁大连 116001;2. 大连大学,辽宁大连 116622;3. 湖北出入境检验检疫局,湖北武汉 430050)
[目的] 通过实时定量RT-PCR和数字RT-PCR两种方法的比对试验,建立快速检测鲤春病毒血症的数字RT-PCR方法。[方法]利用同一对引物和探针,以梯度稀释的方法测定两种方法针对SVCV的灵敏性、特异性及重现性。[结果]两种方法均能够检测出104倍稀释的SVCV,而数字RT-PCR可以检测出单个微滴中的SVCV,其灵敏度性高于实时定量RT-PCR。同时,两种方法的特异性都很强,对其他病毒,如传染性胰腺坏死病毒(IPNV)、传染性造血器官坏死病毒(IHNV)、病毒性出血败血病毒(VHSV)均未有扩增反应。两种方法的重现性也较好。[结论]数字RT-PCR方法比实时定量RT-PCR具有更高的灵敏度,在鲤春病毒血症的早期快速诊断方面具有重要作用。
鲤春病毒血症(SVC);数字RT-PCR;实时定量RT-PCR;灵敏性;特异性;重现性
鲤春病毒血症(spring viraemia of carp ,SVC)又称鲤鱼传染性腹水症,是一种急性、出血性传染性败血病[1]。该病可以危害鲤鱼、鲶鱼、鲫鱼、鲢鱼、鳙鱼等[2-3],在欧亚均有流行[4]。鲤春病毒血症是鱼类口岸检疫的第一类检疫对象,世界动物卫生组织(OIE)将其列为需申报疫病[5],我国农业部将其定为一类动物疫病。
在鲤春病毒血症检测中,常面临的问题有:检测方法是否准确,检测灵敏度和范围是否达到要求。数字RT-PCR(digital RT-PCR)技术是通过“油包水”的形式将反应体系分割成一个个小微滴,然后
进行RT-PCR扩增,并对发生扩增反应的样品进行计数的一种技术。数字RT-PCR技术可以达到检测大量样品中的微量待测分子的目的,在疾病检测中有着广泛的应用。本文通过比较实时定量RT-PCR与数字RT-PCR两种检测方法的灵敏性、特异性及重现性,建立检测SVCV中的数字RT-PCR方法,并应用于实际样品的检测,达到快速检测鲤春血症病毒的目的。
1 材料与方法
1.1 材料
1.1.1 病毒
实验室保存的病料,经细胞系EPC(鲤鱼上皮瘤细胞)分离和增殖得到SVCV;特异性检测用的传染性胰腺坏死病毒(IPNV)、传染性造血器官坏死病毒(IHNV)、病毒性出血败血病毒(VHSV)均为实验室保存;样品为实验室接收的病鱼材料。
1.1.2 仪器和试剂
1.1.2.1 仪器
实时定量RT-PCR仪,Applied Biosystems 公司生产的7300Real-time RT-PCR System;数字RTPCR仪,伯乐公司生产的QX200Droplet Generator,PX1 RT-PCR Plate Sealer,S1000 Thermal Cycler,QX200 Droplet Reader。
1.1.2.2 试剂
One step prime script RT-RT-PCR kit(perfect real time)试剂盒,购自宝生物公司;One-step RT-ddRT-PCR kit for probes试剂盒,购自伯乐公司。
1.2 方法
1.2.1 引物和探针的设计
选取SVCV的糖蛋白基因,由大连宝生物公司合成的引物和探针如表1所示。

表1 SVCV引物和探针序列
1.2.2 RNA提取
取鱼组织匀浆,采用Takara RNA 提取试剂盒按照要求提取病毒RNA。RNA提取后作为原始模板并分别作10-1,10-2,10-3,10-4,10-5,10-6稀释,-20 ℃保存备用。
1.2.3 实时定量RT-PCR试验
用实时定量RT-PCR方法测定SVCV原始模版×100,10-1,10-2,10-3,10-4,10-5,10-6,IPNV、IHNV、VHSV、NTC(H2O)的扩增曲线及Ct值,重复三次。
1.2.4 数字RT-PCR试验
采用RT-ddRT-PCR方法测定SVCV原始模版×100,10-1,10-2,10-3,10-4,10-5,10-6,IPNV、IHNV、VHSV、NTC(H2O)的扩增的微滴数目,重复三次。按表2反应体系(20μL)配置反应液。

表2 数字RT-PCR反应体系
数字RT-PCR反应条件如表3所示。
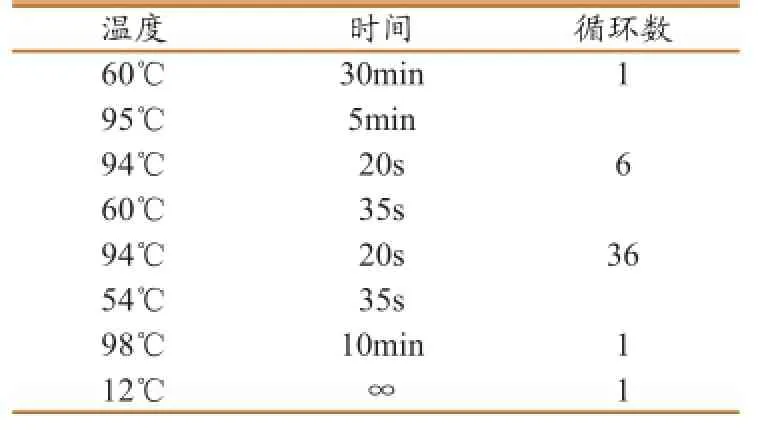
表3 数字RT-PCR的反应条件
1.2.5 鱼类样品的检测
选择合适的鱼类样品,并用上述方法(1.2.3、1.2.4)进行验证。
1.2.6 数据分析
实时定量RT-PCR反应体系利用SDS软件进行数据分析,查看扩增曲线及Ct值,在结果的判断过程中,主要以扩增曲线是否为“S”型和荧光值得大小作为判断标准。数字RT-PCR反应扩增结
束后利用Droplet Reader进行结果的读取,判断以存在扩增的微滴为准。
2 结果与分析
2.1 灵敏性分析
2.1.1 实时定量RT-PCR的灵敏度
将SVCV原液作10倍系列稀释,进行定量RT-PCR检测,图1表示各个稀释度的扩增曲线。其中X轴表示RT-PCR的反应循环数,Y轴表示荧光信号强度。可以看出,浓度为原始模版×100、10-1、10-2、10-3、10-4、10-5、10-6的7个数量级范围内实时定量RT-RT-PCR均为“S”型的增长曲线;进一步分析发现,其中原始模版×100、10-1、10-2、10-3、10-4、10-5的指数增长期的曲线基本平行,反映RT-PCR的扩增效率相近;原始模版×10-5、10-6的Ct值与对照组的Ct值相近,因此检测灵敏度为原始模版×10-4。
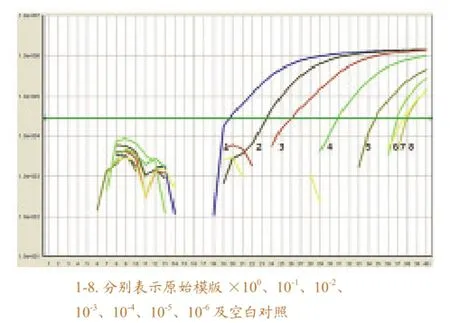
图1 SVCV实时定量RT-RT-PCR反应的扩增曲线
2.1.2 数字RT-PCR的灵敏度
将SVCV原始模板作10倍系列稀释,进行数字RT-PCR检测,图2表示各个稀释度的扩增量。其中X轴表示反应的微滴数,Y轴表示荧光信号强度。可以看出,SVCV的最低检出限度为原始模板的106倍稀释。从每个稀释度的扩增的微滴数可以看出,原始模版×100、10-1、10-2、10-3、10-4的几个稀释度扩增的微滴数与原始模板的稀释倍数成反比,原始模板的扩增数为4 260拷贝/μL,而稀释104倍是的扩增数仅为4.8拷贝/μL,对照组的扩增数目为零。

图2 数字RT-PCR反应对SVCV检测的灵敏性
2.1.3 两种方法灵敏度的比较
两种方法检测SVCV的灵敏度基本一致,检测低限均为10-4稀释,大于10-4的稀释倍数时,实时定量RT-PCR所得到的Ct值与空白对照的Ct值接近,数字RT-PCR测得的拷贝数分别为0.3,0.53拷贝/μL,虽然发生扩增反应的微滴数虽然少,但是能够得到检测数值,这是数字RT-PCR相对于实时定量RT-PCR的优点,这一优点在SVCV的检测尤其是早期预防中有着重要的应用,可以及时地发现并控制病原,防治疾病蔓延,减少损失。
2.2 特异性分析
2.2.1 实时定量RT-PCR的特异性
提取SVCV、IPNV、IHNV、VHSV核酸,进行实时定量RT-PCR检测,扩增曲线如图3所示,SVCV呈“S”型的扩增曲线,而IPNV、IHNV、VHSV的扩增曲线为不规则的折线型,没有典型的
“S”型的扩增曲线,表明引物和探针对IPNV、IHNV、VHSV均没发生扩增反应。

图3 实时定量RT-RT-PCR检测SVCV的特异性实验
2.2.2 数字RT-PCR的特异性
SVCV、IPNV、IHNV、VHSV 的RNA原始模板的扩增情况图4所示,由图可知,SVCV病毒的特异性较好,其扩增的微滴数为4790拷贝/μL,而其他三种病毒(IPNV、IHNV、VHSV)的扩增数仅为0.3、0.14、0.25拷贝/μL,可忽略不计。

图4 数字RT-PCR反应对SVCV检测的特异性
2.2.3 两种方法特异性的比较
两种方法均表现出较强的特异性,均能特异性地扩增出SVCV RNA,而对IPNV、IHNV、VHSV的RNA未出现扩增反应,说明本文设计的引物和探针特异性良好,符合实验要求。
2.3 重现性分析
通过8次重现试验得到实时定量RT-PCR与数字RT-PCR方法检测SVCV的重现性,如表4所示。可知,8次重现试验的误差较小,故实验的重现性较好。其中实时定量RT-PCR的Ct值8次重复使得的标准误差在0.41~1.29之间,误差较小;数字RT-PCR的微滴数8次重复试验的标准误差小于总微滴数(Droplet Reader读取的总微滴数为2 000个/μL)的1.5%,重现性良好。

表4 实时定量RT-PCR与数字RT-PCR检测的重现性(mean±SE)
2.4 鱼类样品的检测
2.4.1 实时定量RT-PCR对样品的检测
用建立的实时定量RT-RT-PCR方法检测待检的鱼类样品,在检测的过程中,分别以SVCV RNA、健康鱼组织RNA和水作为阳性、阴性和空白对照,以排除假阴性和假阳性的可能性。实时定量RT-RT-PCR的检测结果如图5所示,阳性对照的结果呈“S”型的扩增曲线,空白对照和阴性对照无明显的“S”型的扩增曲线,实验质量符合要求,可以排除假阴性和假阳性的结果。待检鱼类样本的检测结果发现其成明显的“S”型的扩增曲线,可判断为含有SVCV。

图5 感染SVCV的检测样本的实时定量RT-RT-PCR反应的扩增曲线
2.4.2 数字RT-PCR对鱼类样品的检测
用建立的实时定量RT-RT-PCR方法对检测待检的鱼类样品,在检测的过程中,分别以SVCV RNA、健康鱼组织RNA和水作为阳性对照、阴性对照和空白对照,以排除假阴性和假阳性结果。检测结果,阳性对照有明显的扩增,而阴性对照和空白对照几乎没有扩增,可以排除假阴性和假阳性的结果。待检样本的检测结果如图6所示,结果表明,待检样本中含有SVCV病毒。
2.4.3 两种方法的比较
两种方法均能达到检测鱼类样品的的目的,选择相同的样品分别用两种方法进行检测,检出
率相同,且1-5样品中含有的SVCV量逐渐减少。数字RT-PCR方法检测出空白对照中含有微量的SVCV,分析是实验过程中污染造成的。
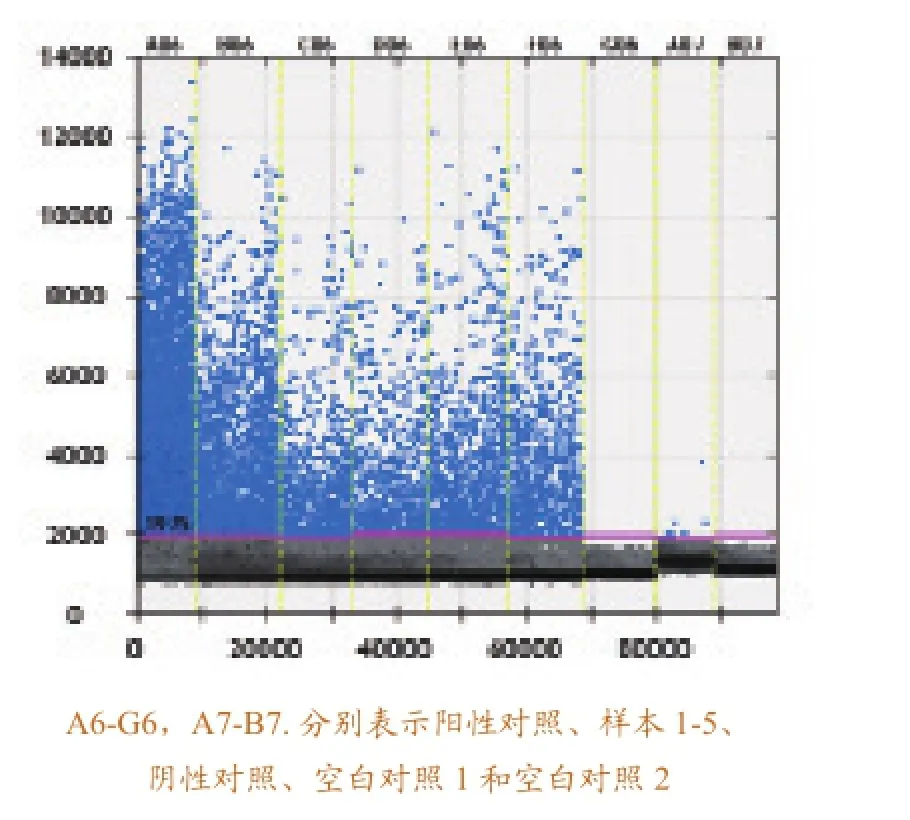
图6 数字RT-PCR反应对感染SVCV的检测样本的检测
3 结论与讨论
传统的SVCV诊断方法是对病毒先进行细胞培养,再通过ELISA等方法进行鉴定,这些方法往往耗时较长,而SVCV难以制备高效价抗血清[6]。实时定量RT-PCR方法是病毒常见的检测方法,在鱼类病毒疾病的诊断中有着泛的应用。本文建立的数字RT-PCR检测技术,可以检测到单个微滴中SVCV的存在,达到对样品中微量病毒检测的目的,实现疾病的早期的防控。
本文通过对实时定量RT-RT-PCR 与数字RTPCR 两种方法的比较得到如下结论:数字RT-PCR比实时定量RT-RT-PCR 灵敏度高,而且能够对单个微滴中的目标基因进行检测,因此可以实现痕量病原检测,比实时定量RT-PCT方法应用更为广泛;所设计的引物和探针特异性强,只对SVCV有扩增反应,可应用于日常的SVCV检测;数字RTPCR相比于实时定量RT-RT-PCR方法,检测重现性更高,因此在常规检测中可以作为确诊方法。
总之,本文建立的数字RT-PCR体系能够实现对鲤春病毒血症的准确诊断,且该方法操作简单、灵敏度高、特异性强、使用方便,可以在短时间内对大量样品进行检测,并且可以对鱼病进行早期诊断,及时切断传播途径,促进鱼类养殖业健康发展。
[1]景宏丽,张旻,王娜,等. 鲤春血症病毒单克隆抗体建立及免疫学特性鉴定[J].检验检疫学刊,2014(3):55-59.
[2]Reschova S,Pokorova D ,Nevorankova Z,et al. Detection of spring viraemia of carp virus(SVCV)with monoclonal antibodies[J]. Veterinarni Medicina,2007,52(7):308-316.
[3]The Center for Food Security and Public Health. Spring Viremia of Carp[R].Iowa State University:2007:1-4.
[4]Wolf K. Fish Viruses and Fish Viral Diseases[M]. New York:Cornell University Press,1988.
[5]OIE. Manual of Diagnostic Tests for Aquatic Animals[M]. Paris:OIE,2009.262-278.
[6]高隆英,史秀杰,刘荭,等. 用RT-PCR法快速检测鲤春病毒血症病毒基因[J]. 水生生物学报,2002,26(9):452-456.
(责任编辑:胡藕祥)
Establishment and Application of Digital RT-PCR Assay for Detection of Spring Viraemia of Carp
Wu Bin1,Shen Cuicui1,Zhang Chenxi2,Hu Decong3,Zhao Huijun1,Zhang Lin1
(1. Liaoning Entry-Exit Inspection and Quarantine Bureau,Dalian,Liaoning 116001;2. Dalian University,Dalian,Liaoning 116622;3. Hubei Entry-Exit Inspection and Quarantine Bureau,Wuhan,Hubei 430050 )
[Objective] To established a rapid digital RT-PCR assay for detection of spring viraemia of carp virus by comparison of real-time quantitative RT-PCR and digital RT-PCR. [Methods] Same primers and probes were used in the digital RT-PCR assay and the real-time quantitative RT-PCR to test their sensitivity,repeatability and specifi city for detection of SVCV by means of gradient dilution. [Result] Both the digital RT-PCR and real-time quantitative RT-PCR assays could detect SVCV diluted to 10-4,and the former could detect SVCV in a single droplet,more sensitive than the real-time quantitative RT-PCR. At the same time,the specifi city of the two methods were strong,there were no amplifi cation reaction with other viruses,such as infectious pancreatic necrosis virus(IPNV),infectious hematopoietic necrosis virus(IHNV),viral haemorrhagic septicemia virus(VHSV). There was a better reproducibility of the two methods. [Conclusion] Digital RT-PCR had a better sensitivity than the real-time quantitative RT-PCR,and could play an important role in early and rapid diagnosis of spring viraemia of carp virus.
spring viraemia of carp (SVC);digital RT-PCR;real-time RT-PCR;sensitivity; specificity;repeatability
S941.41+6
B
1005-944X(2015)07-0072-05
国家公益项目(201410059)
