抗坏血酸/谷氨酸Maillard 反应体系中间产物和褐变程度的研究
2015-12-09周永妍余爱农
周永妍,李 亚,余爱农
(湖北民族学院 化学与环境工程学院,湖北 恩施445000)
Maillard 反应是食品加工和储藏过程中的羰基化合物(主要是还原糖类)与氨基化合物在一定温度下发生的一系列非酶褐变反应,又称为羧氨反应[1].Maillard 反应是食品在加工和储藏过程中最常发生的主要的反应之一,可生成易挥发的小分子[2]和棕色的大分子类物质类黑精[3],从而影响食品的风味和色泽,因此被广泛研究.
对经典Maillard 反应的研究大多集中于还原糖与氨基酸的反应[4],然而随着还原糖研究的完善,人们将研究转向能发生Maillard 反应的其他羰基化合物上[5]. 抗坏血酸是一种广泛存在于植物性食品如水果蔬菜[6]以及动物食品如牛乳和肝中的羰基化合物.此外,在食品和饲料贮藏加工过程中,抗坏血酸也是一种常见的食品添加剂,具有较好的抗氧化性能.对基于抗坏血酸的Maillard 反应进行研究有利于人们更深入的了解食品的加工和储藏过程,控制食品中的反应向人们期望的方向进行.
由于Maillard 反应极其复杂,产物种类繁多,因此分别进行细致的研究存在一定难度,但其很多性质与颜色的变化存在关系[7],例如有关文献提到Maillard 产物的抗氧化作用与颜色线性相关[8],且某些条件下得到的反应产物抗氧活性优于天然植物及提取物[9-10].因此对Maillard 反应所产生的颜色物质进行研究具有十分重要的意义.
据文献可知颜色物质产生于Maillard 反应的末期,由许多Maillard 反应高级阶段形成的活性中间体进一步反应而得到[7].通常认为294 nm 下吸光值的变化反映了Maillard 反应体系生成无色中间产物的量的变化[11],此无色中间产物被认为是Maillard 反应或者焦糖化反应中褐色素形成的前体物质[12].颜色物质的产生常通过测定体系在特定波长下的吸光值来研究,通常认为420 nm 下的吸光值可反映体系颜色物质的产生,也可称其为褐变程度[12-14]. 目前关于还原糖与氨基酸体系中间产物及褐变程度的研究已较为完善[14-15],但作为Maillard 反应研究的又一研究方向,针对抗坏血酸与氨基酸体系Maillard 反应褐变程度的研究还较少.为找出抗坏血酸/氨基酸体系褐变的变化规律,本实验拟制备三种不同质量分数的反应液,比较其在294 nm 和420 nm 下的吸光值并与反应物的消耗联系起来.
1 材料与方法
1.1 材料与试剂
P160001 厚壁耐压反应瓶:北京欣维尔玻璃仪器有限公司.
L-抗坏血酸(分析纯),L-谷氨酸(分析纯),氢氧化钠(分析纯),偏磷酸(分析纯),磷酸氢二钠(分析纯),磷酸二氢钠(分析纯),乙腈(分析纯),乙腈(色谱纯),碳酸氢钠(分析纯)均为上海国药集团化学试剂有限公司;2,4-二硝基氟苯(≥99%),上海梯希爱化成工业发展有限公司;试验用水皆为二次蒸馏水.
1.2 仪器与设备
UV2550 型紫外-可见光分光光度计(日本岛津公司);10 mm 比色皿(日本岛津公司);精密电子天平(瑞士Startorius 公司);PB-21 型实验室pH 计(瑞士Startorius 公司);DF-101S 集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);HPLC1260 高效液相色谱仪(美国安捷伦科技公司).
1.3 方法
1.3.1 缓冲溶液的制备 称取3.12 g 二水合磷酸二氢钠于100 mL 容量瓶中并用二次蒸馏水稀释至刻度,混合均匀;称取71.6 g 十二水合磷酸氢二钠于1 000 mL 容量瓶中并用二次蒸馏水稀释至刻度,混合均匀,配制成0.2 mol/L 的磷酸盐溶液备用.分别取53 mL 磷酸二氢钠溶液和947 mL 磷酸氢二钠溶液于1 000 mL 容量瓶中混合均匀,配制成0.2 mol/L pH8.0 的磷酸缓冲溶液(现配现用)[16-19].
1.3.2 样品制备 氨基酸过量反应液的制备:样品的制备参考文献[16-18]的方法. 称取0.880 7 g(5 mmol)抗坏血酸和8.827 8 g(60 mmol)谷氨酸溶于250 mL 磷酸缓冲溶液,适当加热搅拌并用固体NaOH 将溶液pH 值调至8.00(25℃),使其完全溶解.取15 mL 溶液密封于P160001 厚壁耐压反应瓶中,在130℃的油浴中搅拌加热,反应30、60、90、120、150 min,冷水快速冷却至室温,冰箱冷藏,每个实验点均反应三份作为平行样.
抗坏血酸过量反应液的制备:称取10.567 8 g(60 mmol)抗坏血酸和0.735 7 g(5 mmol)谷氨酸溶于250 mL 磷酸缓冲溶液,适当加热搅拌并用固体NaOH 将溶液pH 值调至8.00(25℃),使其完全溶解.取15 mL 溶液密封于P160001 厚壁耐压反应瓶中,与氨基酸过量溶液在相同条件下反应,每个实验点均反应三份作为平行样.
反应物等摩尔反应液的制备:称取0.880 65(5 mmol)抗坏血酸和0.735 7(5 mmol)谷氨酸溶于250 mL 磷酸缓冲溶液,适当加热搅拌并用固体NaOH 将溶液pH 值调至8.00(25℃),使其完全溶解.取15 mL 溶液密封于P160001 厚壁耐压反应瓶中,与上述两种溶液在相同条件下反应,每个实验点均反应三份作为平行样.
1.3.3 抗坏血酸质量分数的测定 标准曲线的绘制:准确称取25.0 mg 抗坏血酸并小心移至250 mL 棕色容量瓶中,用3%的偏磷酸溶液溶解,并稀释至刻度,配制成0.1 mg/mL 母液备用(现配现用).分别取0.2,0.4,0.6,0.8,1.0,1.4,1.8,2.2,2.6,3.0,4.0,5.0 mL 母液,用3%偏磷酸溶液稀释至10 mL,混合均匀.对溶液进行进行全波长扫描,找到最大吸收波长,在此波长下以3%偏磷酸做参比,得到抗坏血酸质量分数与吸光值的关系,并绘制标准曲线.
样品的测定:取100 μL 反应液小心移入25 mL 棕色容量瓶中用3%偏磷酸稀释至刻度,测其吸光值,并换算成样品中抗坏血酸的质量分数[18].
1.3.4 谷氨酸质量分数的测定 色谱条件:安捷伦C18 色谱柱;二极管阵列检测器;流动相:由A,B,C 三组分组成,A 为水,B 为乙腈,C 为0.01 mol/L 磷酸缓冲溶液;流速为1.0 mL/min;柱温30℃;进样量10 μL;梯度洗脱见表1.
标准曲线的测定:取0.25 g 谷氨酸用100 mL pH8 的磷酸缓冲溶液溶解,用磷酸缓冲溶液稀释将其为0,0.2,0.4,0.6,0.8,1.0,1.5,2.0,2.5 mg/mL 的谷氨酸标准溶液.依次取1 mL 谷氨酸标准溶液、1 mL0.5 mol/L 碳酸氢钠溶液、1 mL 1% 2,4-二硝基氟苯的乙腈溶液移入10 mL 棕色容量瓶并于60℃下反应60 min.反应结束后用磷酸缓冲溶液稀释至刻度并进样测定,得到谷氨酸衍生物的峰面积[19].
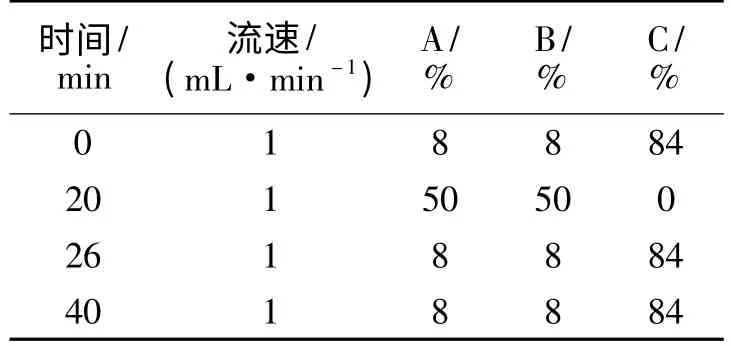
表1 梯度洗脱表Tab.1 Gradient elution program
样品测定:取1 mL 反应液按标准曲线测定中的方法进行衍生和检测,得到峰面积并换算成样品中谷氨酸的含量.
1.3.5 样品褐变程度的测定 如前文所述,褐变程度的变化常用波长420 nm 下吸光值的变化来表示[10-12].根据反应液的不同,将反应液稀释0~25 倍不等,以二次蒸馏水做参比,采用UV2550 紫外-可见光分光光度计在λ420 nm 处测定吸光值,并换算成原反应液的吸光值.
1.3.6 样品中间产物的测定 如前文所述,常认为λ294 nm 下吸光值的变化反映了体系Maillard 反应生成无色中间产物的量的变化,此无色中间产物可能是美拉德反应或者焦糖化反应中褐色素形成的前体物质[11-12].依据参考文献[19]的测定方法,根据反应液的不同,将反应液用3%的偏磷酸稀稀释25~250 倍不等,以3%的偏磷酸做参比溶液,在λ294 nm 处测定其吸光值,并换算成原反应液的吸光值.
2 结果与分析
2.1 抗坏血酸与氨基酸的消耗
由图1 可知反应体系中谷氨酸初始质量分数一致,在抗坏血酸过量情况下Maillard 反应液中谷氨酸剩余质量分数远小于两种反应物等摩尔的情况,即增大反应物的量有利于Maillard 反应的进行.但图2 却显示抗坏血酸参与反应并不受氨基酸含量的影响,这表明,抗坏血酸并未像还原糖体系那样直接与氨基酸发生羰氨缩合形成不稳定的亚胺衍生物希夫碱.据文献推测[8],在试验条件下抗坏血酸首先发生自身热解,热解产物含有醛基能与氨基酸发生羰氨缩合,本试验证实了这一点,并推测抗坏血酸/氨基酸的Maillard 反应与还原糖/氨基酸体系相比在中间产物和褐变程度的生成上有较大区别.

图1 抗坏血酸过量和等摩尔情况下剩余谷氨酸的质量分数Fig.1 The concentration of glutamic under excessive ascorbic acid or equimolar concentration

图2 谷氨酸过量和等摩尔情况下剩余谷氨酸的质量分数Fig.2 The concentration of ascorbic acid under excessive glutamic or equimolar concentration
2.2 反应物对褐变程度的影响
颜色物质与反应液的许多理化性质有关,有研究表明Maillard 产物的抗氧化作用与其颜色线性相关[18],一般认为反应液颜色越深,反应程度越深.对褐变程度的测定常选取420~490 nm 间某一固定波长,并测其吸光值,绝大多数文献选取420 nm 作为褐变程度测定的波长[14-15].为便于与其他文献对Maillard 反应褐变的研究进行参考与对比,本试验在420 nm 下测三种反应液的吸光值,结果见图3.
图3 显示抗坏血酸过量时体系的吸光值显著增加,褐变程度加深,褐色聚合物增长极快.由图1 可知,抗坏血酸过量时,剩余氨基酸质量分数降低,体系反应速率加快,因此褐色聚合物的增长将加快,420 nm 处吸光值增大.而当谷氨酸过量时,同样相当于增加反应物质量分数,体系反应速率也应相应增大,但图3 中显示谷氨酸过量时的褐变程度与等摩尔反应下基本一致,这可能是由于抗坏血酸的热解是整个反应的速率控制步骤.据文献[19-20]可知,还原糖/氨基酸体系中,任意增大某一反应物的量,另一反应物消耗增加,反应速率加快,褐色聚合物增长加快,体系颜色加深,这与抗坏血酸/氨基酸体系的褐变规律不一样.
2.3 反应物对中间产物的影响
通常认为294 nm 下吸光值的变化反映了体系Maillard 反应生成无色中间产物的量的变化[9],也有文献认为此类物质为糖基化过程中产生的无色中间产物,如糖、醛和小分子酮等[10].Ajandouz 等人认为该类物质可能是美拉德反应或者焦糖化反应中褐色素形成的前体物质[10],因而研究294 nm 下吸光值的变化同样对揭示体系颜色的变化十分重要.
由图4 可知随着Maillard 反应的进行,294 nm 下的吸光值逐渐升高.将三种反应液在此波长下的吸光值进行比较,结果显示抗坏血酸过量时体系的吸光值显著增加,中间产物含量增长极快.将图4 与图1 和图3联系可知,增加抗坏血酸含量,其热解产物增多,谷氨酸消耗加快,体系反应速率显著增加,生成更多中间产物并迅速聚合成棕色大分子类黑精等物质,使体系颜色加深.此外,294 nm 下吸光值的迅速升高还可能是因为这些中间产物主要是糖基化过程产生[10],增加抗坏血酸含量,其热解产物增多,醛类和小分子酮类含量增加.
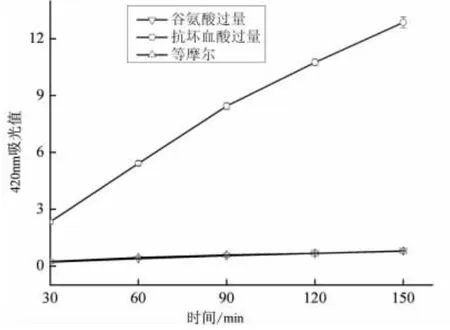
图3 三种不同反应液在420 nm 的吸光值Fig.3 The absorbance of three different solutions at 420 nm

图4 三种不同反应液在294 nm 的吸光值Fig.4 The absorbance of three different solutions at 294 nm
与图3 中420 nm 下吸光值情况不同的是,谷氨酸过量与反应物等摩尔情况下反应液在420 nm 的吸光值差别不大,但谷氨酸过量时反应液在294 nm 下的吸光值仍明显高于等摩尔.这可能是因为除反应速率的影响外,不同反应物所提供的结构在形成新化合物时,对吸光值也有影响.由图2 和图3 可知,谷氨酸过量和等摩尔条件下,抗坏血酸热解量变化不大,420 nm 下吸光值基本一致,据此猜测,420 nm 下吸光值受抗坏血酸影响.造成两种不同波长下吸光值变化差异的原因可能是抗坏血酸与谷氨酸均能产生生色团,但在形成大分子类黑精的过程中,抗坏血酸产生的生色团在形成类黑精的过程中形成共轭体系,吸收波长移向长波方向,谷氨酸产生的生色团没有参与形成类黑精而是转变为小分子挥发性物质或是在类黑精中没有形成共轭体系.因此推测420 nm 下具有吸光值的结构是由抗坏血酸提供;而在294 nm 下具有吸光值的结构是由抗坏血酸与谷氨酸共同提供.
3 结论
在抗坏血酸/氨基酸液相体系中抗坏血酸通过自身热解产生醛类等物质进行Maillard 反应,故与还原糖/氨基酸体系在中间产物的产生和褐变程度上有很大差异.
与传统的还原糖/氨基酸体系相比,在抗坏血酸/氨基酸体系中增大氨基酸的含量并不能加深体系Maillard 反应的褐变程度,对无色中间产物的产生帮助也较为有限,而抗坏血酸对体系褐变程度的加深及中间产物的生成均起到十分明显的促进作用,这对控制反应体系的颜色以满足人们对食品色泽的要求具有十分重要的意义.
[1] Martins S I F S,Jongen W M F,Boekel M A J S.A review of Maillard reaction in food and implications to kinetic modeling[J].Trends in Food Science & Technology,2000,11(9):364-373.
[2] Limacher A,Kerler J,Davidek T,et al.Formation of furan and methylfuran by maillard-type reactions in model systems and food[J].Journal of Agricultural and Food Chemistry,2008,56(10):3639-3647.
[3] Martins S I F S,van Boekel M A J S.Melanoidins extinction coefficient in the glucose/glycine maillard reaction[J].Food Chemistry,2003,83(1):135-142.
[4] Giribet M C,Ribas A I.Kinetics of colour development in aqueous fructose systems at high temperatures[J].Journal of the Science of Food and Agriculture,2000,80(14):2105-2113.
[5] Nicolau L P,Revel G D,Bertrand A.Formation of flavor components by the reaction of amino acid and carbonyl compounds in mild conditions[J].Journal of Agricultural and Food Chemistry,2000,48(9):3761-3766.
[6] 蔡自建,王永,文勇立,等.种养结合循环利用模式下蔬菜的维生素C 含量及其抗氧化活性测定[J]. 西南民族大学学报:自然科学版,2013,39(1):5-7.
[7] Morales F J,Jimenez-Perez S. Free radical scavenging capacity of Maillard reaction products as related to colour and fluorescence[J]. Food Chemistry,2001,72(1):119-125.
[8] Hashiba H.The browning reaction of Amadori compounds derived from various sugars[J].Agricultural Biological Chemistry,1982,46(2):547-548.
[9] 杨赫鸿,刘骞,孔保华,等.美拉德反应中乳清分离蛋白特性的变化[J].食品科学,2012,33(23):98-102.
[10] Ajandouz E H,TchiakpeL S,Ore F D,et al.Effects of pH on caramelization and Maillard reaction kinetics in fructose-lysine model systems[J].Journal of Food Science,2001,66:926-931.
[11] Murakami M,Shigeeda A,Danjo K,et al. Radical-scavenging activity and brightly colored pigments in the early stage of the maillard reaction[J].Journal of Food Science,2002,67(1):93-96.
[12] 李菁,刘骞,孔保华,等.L-赖氨酸与3 种还原糖美拉德反应产物的理化特性及抗氧化活性[J].食品科学,2013,34(3):80-84.
[13] 邓启辉.L-抗坏血酸/氨基酸模式体系中Maillard 反应产物的抗氧化活性研究[D].恩施:湖北民族学院,2011.
[14] 钟存贵.抗坏血酸与谷胱甘肽的Maillard 反应形成香味化合物的研究[D].恩施:湖北民族学院,2012.
[15] 唐乐攀,周永妍,余爱农.紫外分光光度法和高效液相色谱法测定Maillard 体系中抗坏血酸含量的比较[J]. 食品工业科技,2014,35(10):79-82.
[16] 唐乐攀.抗坏血酸/半胱氨酸体系非酶褐变反应动力学研究[D].恩施:湖北民族学院,2014.
[17] 刘应煊.抗坏血酸与半胱氨酸的Maillard 反应形成香味化合物的研究[D].武汉:中国地质大学,2010.
[18] Anese M,Manzocco L,Nicoli M C,et al.Antioxidant properties of tomato juice as affected by heating[J].Journal of the Science of Food and Agriculture,1999,79(5):750-754.
[19] Baisier W M,Labuza P L.Maillard browning kinetics in a liquid model system[J].Journal of Agricultural and Food Chemistry,1992,40(5):707-713.
[20] 杨春涛,曾晓丽,戴建辉,等.麻栎树皮多酚含量的测定及抗氧化活性的研究[J].云南大学学报:自然科学版,2014,23(6):404-407.
