一株贫营养异养硝化-好氧反硝化菌的筛选及脱氮特性
2015-12-05黄廷林张丽娜张海涵苏俊峰郭琳赵金亚张凯
黄廷林,张丽娜,张海涵,苏俊峰,郭琳,赵金亚,张凯
西安建筑科技大学环境与市政工程学院,陕西 西安 710055
一株贫营养异养硝化-好氧反硝化菌的筛选及脱氮特性
黄廷林*,张丽娜,张海涵,苏俊峰,郭琳,赵金亚,张凯
西安建筑科技大学环境与市政工程学院,陕西 西安 710055
为了探究并优化菌剂应用于微污染水源水体修复的机制和条件,主要针对水库沉积物内筛选出的贫营养好氧反硝化菌进行了菌种鉴定及脱氮特性研究,考察菌株在不同环境条件下的脱氮效果,明确了该菌株的最适宜生长条件,并基于水库水体中贫营养条件对菌株进行水源水库原水的驯化培养试验研究,以期实现该菌株对微污染水源水库原水中氮源污染物的脱除,为原位投菌技术实际工程应用提供理论依据。从微污染水源水库沉积物中驯化筛分出一株高效异养硝化-好氧反硝化菌A14,通过扫描电镜观察、生理生化特征、16S rRNA基因测序和Biolog GenⅢ鉴定,确定该菌株为革兰氏阴性短杆菌,鉴定为皮特不动杆菌(Acinetobacter pittii)。在好氧条件下,菌株细胞内表达反硝化功能基因napA,以NO3-为唯一氮源进行反硝化作用时,36 h时NO3-去除率为78.89%。以NH4+为唯一氮源时,48 h NH4+去除率为95.25%,TN去除率达80.42%,TOC去除率达98.30%,表明该菌株具有异养硝化-好氧反硝化特性。在改变环境条件过程中,该菌株在以乙酸钠为碳源,温度为30 ℃,C/N为12,pH为7,接种量为10%时,NO3-去除率最高为86.62%,并且在10 ℃下脱氮率达到40.18%。在水源水库原水脱氮实验中,接种处理TN去除率为50.95%,NO3-去除率为80.25%。结果表明,菌株A14在微污染水源水体菌剂脱氮修复中具有良好的应用潜力。
异养硝化;好氧反硝化;微污染水源水;功能基因
近年来,我国主要饮用水水源之一——城市水库水体的水质污染控制受到广泛关注。在微污染水源水处理工艺中,一些传统的物理化学方法并不能保证稳定良好的污染物去除效果,相比之下,微生物处理是通过微生物群体的新陈代谢活动来去除水中的污染物,能去除传统工艺难以去除的污染物,且有利于后续工艺的进行(何斐等,2008)。其中,原位投菌技术更是以其价格低廉、高效节能等优点已被广泛应用。
在城市饮用水的水质安全隐患中,水源水富营养化占很大的比例(苏俊峰等,2013),脱氮已成为许多学者研究的热点问题。而生物脱氮法由于其低耗、经济、环保且效果良好等优势,成为水处理过程中行之有效的方法之一。
传统生物脱氮途径主要有自养硝化和厌氧反硝化两种,然而近年来,有关好氧条件下进行反硝化作用的研究屡见报道,目前已发现副球菌属(Paracoccus sp.)(刘燕等,2010),不动杆菌属(Acinetobacter sp.)(王景峰等,2011;Ren等,2014),假单胞菌属(Pseudomonas sp.)(Miyahara等,2012;Yang等,2011)和产碱杆菌属(Alcaligenes sp.)(Wang等,2011;Makoto等,2014),弧菌属(Vibrio sp.)(Duan等,2015)等多个属的细菌具有好氧反硝化功能。Joong等(2005)筛选出的芽胞杆菌菌株具有异养硝化-好氧反硝化性能,并且能够在脱氮过程中将含氮化合物转化为含氮气体,从而释放氮。王兆阳等(2014)筛选出的好氧反硝化菌株GL19可以利用不同的氮源进行快速高效的脱氮,并且具有一定的耐寒性,可以应用于不同含氮水质废水的脱氮处理,对冬季的废水脱氮处理具有一定的应用价值,上述研究均表明了研究在向实际应用逐渐发展。目前筛选出的好氧反硝化菌虽然都具有良好的脱氮性能(乔森等,2014),然而多数菌种只能在高C/N下生长良好,因此在废水处理中应用很多(陈茂霞等,2013),而关于微污染水源水的微生物脱氨相关研究工作却鲜见报道。因为微污染水体具有较低的C/N,且存在季节更迭的温度变化,能够在贫营养以及低温条件下生长的菌种对于微污染水体处理具有重要的理论和工程应用价值(苏俊峰等,2013)。
目前,新型的生物脱氮技术——异养硝化-好氧反硝化已成为生物脱氮领域的研究热点,它可以在空间和时间上同步完成硝化反硝化两个过程,将原本两个独立的环节结合在一起,微生物在去除氮的同时,也消耗了有机碳,同时降低碳和氮(乔森等,2014;陈茂霞等,2013),这对于自然水库和湖泊环境条件下的微污染水体尤其适用。本研究从山东枣庄周村微污染水源水库沉积物中驯化分离出一株高效异养硝化-好氧反硝化菌株 A14,通过 16S rRNA基因鉴定确定分类地位,进一步研究该菌的脱氮特性,通过逐步驯化培养,在微污染水源水库原水中考察其脱氮效果,以期实现该菌株在微污染水源水菌剂脱氮工程应用。
1 材料与方法
1.1 培养基
选择性反硝化培养基(1WP):NaAc 0.1 g·L-1、NaNO30.02 g·L-1、K2HPO40.02 g·L-1、CaCl20.01 g·L-1、MgCl20.01 g·L-1(黄廷林等,2013);BM培养基:NaAc 0.1 g·L-1、NaNO30.02 g·L-1、K2HPO40.02 g·L-1、CaCl20.01 g·L-1、MgCl20.01 g·L-1、琼脂 20 g·L-1(黄廷林等,2013);异养硝化培养基(1WX):NaAc 0.15 g·L-1、NH4Cl 0.014 g·L-1、K2HPO40.04 g·L-1、CaCl20.02 g·L-1、MgCl20.02 g·L-1(魏巍等,2010);菌种鉴定BUG+B培养基的制备:取0.57 g BUG培养基粉加入95 mL蒸馏水,高温高压蒸汽灭菌,取 SM0101冻干脱纤维羊血(北京友康科技有限公司),加入5 mL无菌水稀释,待BUG培养基冷却至45~50 ℃,加入稀释后的脱纤维羊血,在超净工作台中倒入平板以备使用。
1.2 菌株A14的筛选
参考魏巍等(2010)的方法,取适量水库沉积物样品加入1WP培养基中,置于250 mL锥形瓶中,在30 ℃恒温振荡培养箱中培养,以120 r·min-1持续振荡,培养液浓度每5 d按初始浓度的10%递减。经1个月的富集驯化后,摇匀,取泥水混合液采用平板梯度稀释法进行分离纯化,即在10-1、10-2、10-3、10-4梯度下在BM培养基上培养,在30 ℃恒温培养箱中培养5~7 d,通过形态观察比较,筛选出生长良好、有代表性的反硝化菌,挑取单菌落在BM培养基上再进行划线分离培养,重复5~6次,最终分离纯化出单一菌株,将其-20 ℃低温保存在甘油中。将纯化后的单一菌株接种于1WP培养基中48 h后,测定TN、NO3-、NO2-及NH4+浓度变化,根据去除效果挑选出优势菌种进行深入研究(魏巍等,2010)。
1.3 菌株鉴定
1.3.1 形态学鉴定
将菌株A14接种于5倍浓度1WP培养基中,在30 ℃恒温振荡培养箱中120 r·min-1下培养24 h后,取10 mL于10000 r·min-1条件下离心15 min,使用2.5%戊二醛固定24 h后,通过高分辨冷场发射扫描电镜拍摄观察菌体特征和细胞个体形态(陈茂霞等,2013)。
1.3.2 生理生化分析
菌株生理生化特性依据《伯杰细菌鉴定手册》进行分析(Holt等,1994)。
1.3.3 DNA提取与16S rRNA基因测序
DNA提取步骤如下:取菌液离心后,加 PBS洗涤,于1200 r·min-1离心,弃去上清液,重复洗涤3次,离心后,加2 mL TE重悬,取0.8 mL上述样品与0.8 mL DNA提取液混合,加入200 μL蛋白酶K,置于摇床内反应20 min,设置条件为225 r·min-1,37 ℃。最后加入200 μL SDS,置于温度65 ℃水浴1.5 h,间隔20 min轻轻摇动数次(Zhou等,1996)。
采用由美国英杰Invitrogen(上海)公司合成的引物,其中正向引物 27F:5’-AGAGTTTGATCCTGGCTCAG-3’,1492R:5’-GGTTACCTTGTTACGACTT-3’,反应体系(50 μL):2×Taq Mastermix 25.0 μL,正向引物27F(10 μm)1.0 μL,反向引物1492R(10 μm) 1.0 μL,ddH2O22 μL,模板DNA1.0 μL(Chun等,2007)。
PCR反应程序:95 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,32个循环;72 ℃最终延伸10 min(Zhou等,1996)。PCR扩增产物使用1%琼脂糖凝胶电泳检测,100 V下电泳1 h,GelRed染色10 min,在凝胶成像系统下成像拍照,确定扩增条带(Zhou等,1996),割胶回收、纯化后的PCR产物送至上海生工生物工程股份有限公司进行测序分析。
1.3.4 系统发育分析
将测序结果提交至NCBI,通过Blast检索进行比对,搜索同源性序列,根据已有研究结果,采用MEGA5软件对其进行系统发育分析。以Neighbor-joining法构建系统发育树(赵丹等,2013;林娜等,2012),进化距离计算方法为最大似然法(全向春等,2007)。
1.3.5 Biolog菌种鉴定
参考李雯等(2014)的方法,取已纯化菌株A14在BM培养基上连续培养2代后,将单菌落转接至BUG+B固体培养基,30 ℃连续培养2代。在无菌条件下,使用Inoculatorz棉签从平板中沾取直径3 mm的菌落,调节浊度至95%~98%,接种至GENⅢ微孔板中,33 ℃下培养3~36 h,读板确定鉴定结果。相似性(SIM)和位距(DIS)作为BIOLOG鉴定中重要的参数,来共同表征鉴定结果与数据库数据的匹配度。在BIOLOG系统中:培养16~24 h, SIM≥0.5,DIST<5.0时,系统自动给出鉴定结果(李雯等,2014)。
1.4 周质硝酸还原酶(napA)的扩增
参考修海峰等(2011)的方法,napA扩增所用引物:其中正向引物 NAP1:5’-TCTGGACCATGG-GCTTCA ACCA-3’,反向引物NAP2:5’-ACGACGACCGGCCAGCGCAG-3’,反应体系为:2×PCR Mix(100 mmol·L-1KCl,20 mmol·L-1Tris-HCl,3 mmol·L-1MgCl2,400 μmol·L-1dNTP混合液,TaqDNA聚合酶),12.5 μL;DNA模版,1 μL;上述引物各1 μL;加去离子水至体积为25 μL。
PCR反应条件:94 ℃预变性5 min;94 ℃,30 s;65 ℃,30 s;72 ℃,1 min,进行20个循环;72 ℃延伸7 min(王兆阳等,2014)。PCR扩增产物进行1%琼脂糖凝胶电泳检测,电压100 V,电泳45 min,GelRed染色10 min,凝胶成像系统成像拍照。
1.5 脱氮特性测定
参考孙雪梅等(2012)的方法,并稍作改进。平板接种单菌落 A14至灭菌 1WP培养基中,在30 ℃恒温振荡培养箱中,120 r·min-1活化24 h后,接10%菌液分别至灭菌1WP、1WX培养基中,测定6、12、24、48、72 h的TN、NO3-、NO2-、NH4+、TOC质量浓度变化,测定设置3个平行(n=3)。
1.6 好氧反硝化特性影响因素分析
参考韩永和等(2013)的方法,并稍作改进。接10%菌液分别至不同碳源、不同C/N、不同pH、不同温度、不同接菌量的相应培养基中,摇床转速120 r·min-1,不同条件下培养48 h,测定NO3-、NO2-质量浓度变化,每种影响因素下设置 3个平行(n=3)。研究在不同因素条件下,菌株A14对NO3-的去除能力。
1.7 菌株驯化及其在原水中脱氮性能研究
参考魏巍等(2010)的方法,接种菌株A14至100 mL灭菌5倍浓度1WP培养基中,30 ℃、120 r·min-1条件下振荡培养48 h后,接10%菌液至100 mL灭菌水库原水中,对菌株进行逐步驯化,即在30 ℃恒温振荡培养箱中,120 r·min-1振荡培养 48 h,使之适应微污染水源水库原水的贫营养环境。接 10%驯化适应后菌液至 100 mL水库原水中,30 ℃恒温振荡培养箱中,120 r·min-1振荡条件下,测定2、3、4、5 d的TN、NO3-质量浓度,测定设置 3个平行。TN、NO3-、NO2-、NH4+浓度采用德国SEAL AA3流动分析仪测定(全向春等,2007),pH值采用哈希pH仪(HQ-11d)测定,DO采用哈希溶解氧仪(HQ-14d)测定,OD600由日本岛津分光光度计(UVmini-1240),TOC浓度采用日本岛津TOC仪(TOC-L CPN)测定。
2 结果与分析
2.1 菌株鉴定
2.1.1菌株A14的形态特征和生理生化特性
在BM培养基上,30 ℃培养72 h后,观察菌落为半透明、较小、圆形、边缘整齐、表面凸起、湿润、透过光线菌落有荧光。扫描电镜下观察,菌株A14呈短杆状、菌体较小、约0.9 µm×1.0 µm、无鞭毛、无芽孢,菌株的具体细胞形态如图1所示。
菌株A14的生理生化检测结果如表1所示。

图1 菌株A14的扫描电镜照片(20000×)Fig. 1 Scanning Electron Microscope (SEM) of A14 strain(20000×)

表1 菌株A14的生理生化特征解析Table 1 Chemical and physical characteristics of A14 strain
2.1.2 16S rRNA基因测序和系统发育分析
以菌株A14的DNA为模板,27F、1492R为引物,PCR扩增得到一条约1500 bp的特征条带,并测定了其序列。经16S rRNA基因测序及同源性比较,结合常规生理生化鉴定,异养硝化-好氧反硝化菌A14与多株皮特不动杆菌(Acinetobacter pittii)的相似性水平在97%以上,结合菌株的形态学和生理学特征,确定分离的菌株A14为皮特不动杆菌(A. pittii)。将该菌株与同源性高的细菌进行系统发育分析,得到系统进化发育树(图2)。
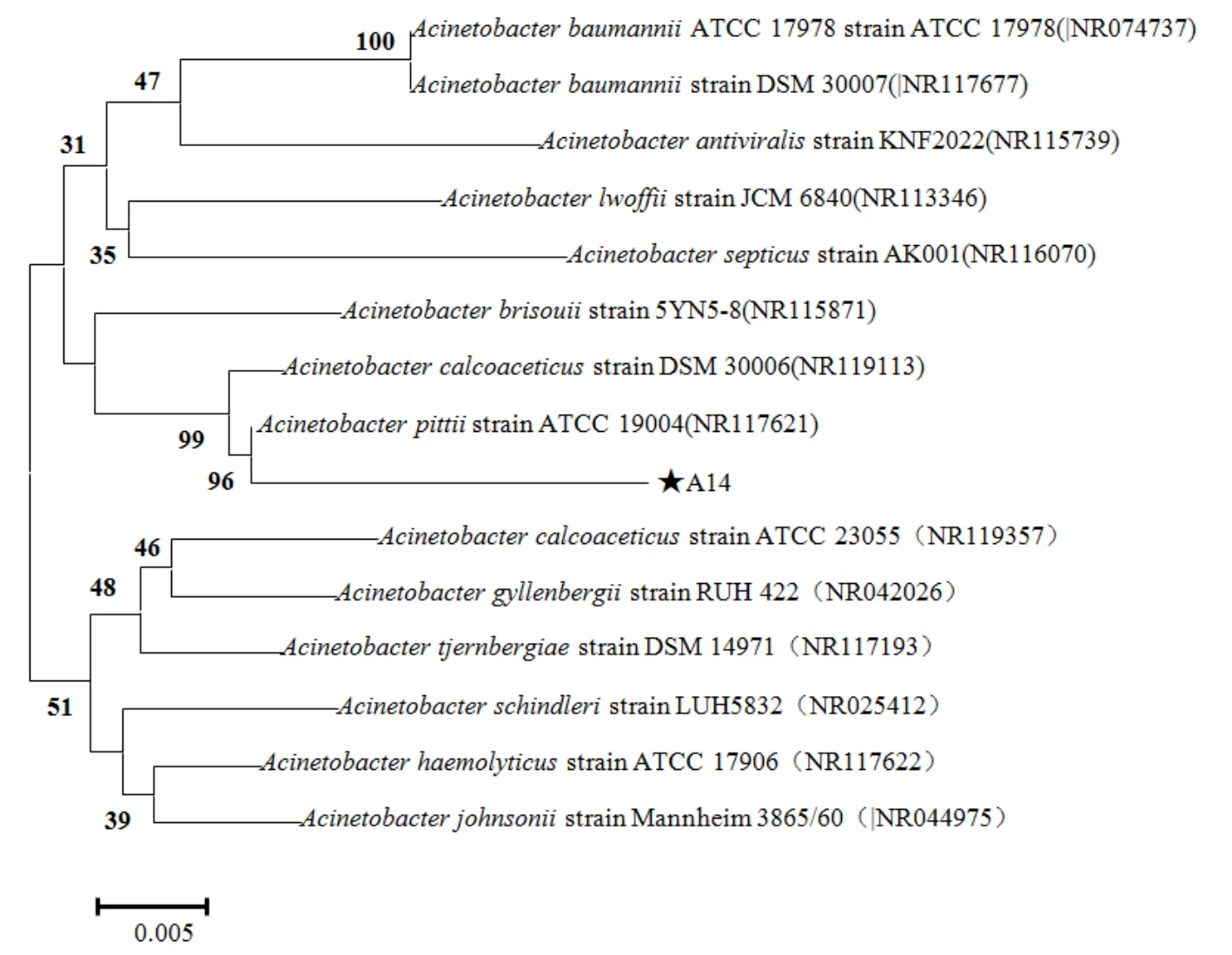
图2 基于16S rRNA序列同源性构建菌株A14的系统发育树Fig. 2 Unrooted phylogenetic trees based on the 16S rRNA sequences of strain A14
2.1.3 功能基因(napA)扩增
利用引物NAP1/NAP2对A14菌株的DNA样品进行扩增,并进行琼脂糖凝胶电泳,得到870 bp左右处清晰的目标条带(图3)。根据Cindy等(2007)的研究可知,周质NAR的亚基napA基因均在870 bp左右,因此可初步判断,该菌含有napA基因。周质硝酸还原酶(napA)是一种在有氧条件下发挥作用的酶,在反硝化作用中,它使某类细菌可以利用硝酸盐和亚硝酸盐分子中结合更紧密的氧原子作为最终电子受体,因此,napA可以被作为菌株具有好氧反硝化功能的依据(陈茂霞等,2013;修海峰等,2011)。表明菌株A14细胞具有在好氧条件下表达反硝化功能基因的功能。

图3 A14的napA基因PCR扩增Fig. 3 Amplification of napA in strain A14 by PCR
2.1.4 菌株A14的Biolog鉴定结果
表2为菌株A14在培养20 h时的BIOLOG鉴定结果。结果显示:该菌对葡萄糖、果糖、L-丙氨酸、L-精氨酸、L-天冬氨酸等碳源代谢程度高,与数据库标准菌株代谢指纹比对后,鉴定该菌为Acinetobacter pittii,与16S rRNA测序鉴定结果一致。

表2 菌株A14的Biolog鉴定结果Table 2 Biolog’s identification result of strain A14
2.2 菌株A14的脱氮特性分析
2.2.1 菌株A14的好氧反硝化特性
当NO3-为唯一氮源时,由图4A可看出,12 h的 TN去除率和 NO3-去除率分别为 10.11%和17.64%,12~36 h为对数生长期,其中24 h的NO3-去除率达到最大值78.89%,36 h的TN去除率达到最大值 57.60%,可看出脱氮主要发生在对数生长期。在观测的72 h内,NO2-积累量很小,在对数生长期时,达到 0.33 mg·L-1,之后逐渐降低至 0.09 mg·L-1,说明该菌在脱氮过程中无明显NO2-积累。12和36 h的TOC去除率分别为18.93%和88.66%,随着 TOC的降低,培养基内碳源不足,该菌株进入衰亡期,不再进行脱氮过程,氮质量浓度趋于稳定,TOC与NO3-质量浓度降解趋势有一致性。

图4 不同氮源条件下菌株A14脱氮特性Fig. 4 Nitrogen removal of strain A14 with different nitrogen as the sole nitrogen sources
2.2.2 菌株A14的异养硝化特性
当NH4+为唯一氮源时,该菌脱氮效果明显。由图4-B可看出,12 h的TN去除率和NH4+去除率17.23%和7.82%,12~48 h为对数生长期,其中48 h的氮去除率达到最大值,TN去除率达到80.42%,NH4+去除率达到 95.25%,TOC的去除率达到92.1%,说明发生了异养硝化作用。48 h后,TOC浓度降至3.68 mg·L-1,培养基内碳源不足,菌株进入衰亡期,氮含量无显著变化。
整个脱氮过程中,无NO2-积累,也无明显NO3-积累,说明该菌同时进行着硝化和反硝化反应,这与周迎芹(2013)、赵丹等(2013)的研究结果相似。目前,Richardson等(1989)提出的关于异养硝化的脱氮假想途径已得到广泛认可,即NH4+经过氨单加氧酶(AMO)氧化为羟胺,羟胺在羟胺氧化酶(HAO)作用下有两种转化方式(林娜等,2012),方式一是转变为NO3-和NO2-,肖继波(2012)、孙雪梅等(2012)人的研究结果与之相似;方式二是直接转变为 N2O、N2。由于实验过程中未检测到NO3-和 NO2-生成,因此推测菌 A14的异养硝化途径属于方式二。
2.3 好氧反硝化特性研究
2.3.1 碳源对菌株A14好氧反硝化特性的影响
异养硝化-好氧反硝化是氧化还原反应,碳源在菌株的生长过程中可以提供必要的能源和电子供体,进而影响反应的进行,不同的碳源具有不同的氧化还原电位,因此,也会产生不同的脱氮效果(乔森等,2014;苏婉昀等,2013)。本实验选取葡萄糖、草酸钠、丁二酸钠、柠檬酸三钠、乙酸钠5种不同碳源,研究不同碳源条件对菌株A14的脱氮性能的影响,如图 5所示。可以看出,碳源对 NO3-去除率有一定的影响,当以乙酸钠为唯一碳源时,NO3-去除率可以达到86.62%,明显高于其他碳源培养基,略有NO2-积累;当以柠檬酸三钠和丁二酸钠为唯一碳源时,NO3-去除率为59.59%和59.96%;而以葡萄糖、草酸钠为唯一碳源时,NO3-去除率相对较低。因此,菌株A14在以乙酸钠为碳源时,脱氮效果最好,这可能是由于乙酸钠的分子量较小,容易被细胞吸收代谢。

图5 碳源对菌株A14好氧反硝化特性的影响Fig. 5 Effect of carbon source on denitrification of strain A14
2.3.2 C/N对菌株A14好氧反硝化特性的影响
不同碳氮比对菌株 A14好氧反硝化特性的影响如图6所示。其中,碳氮比(C/N)中C指代乙酸钠中碳质量浓度,N指代硝酸钠中氮质量浓度,可以看出,碳氮比对菌株 A14的脱氮效果影响很大,当C/N=8时,菌株A14的NO3-去除率为86.62%,当C/N达到16时,NO3-可以完全去除,且无NO2-积累。当C/N=20时,NO3-去除率反而有所下降,所以该菌株的最适C/N为16。这与王弘宇等(2007)的研究结果一致,即充足的碳源可以提供充足的电子流,进而提供充足的能源供菌体生长,但当碳源量大于菌体所需量时,脱氮率基本不再受C/N影响(王弘宇等,2007)。

图6 C/N对菌株A14好氧反硝化特性的影响Fig. 6 Effect of C/N on denitrification of strain A14
低C/N条件时,虽然NO3-去除率有所降低,但当C/N=5时,该菌株的NO3-去除率仍然可以达到60%,这说明菌株A14在低C/N下也有一定的NO3-去除能力,这使该菌在微污染水源水脱氮修复中具有实际工程应用价值。
2.3.3 pH对菌株A14好氧反硝化特性的影响
由于氢离子浓度不同会引起微生物细胞膜电荷的变化,进而决定微生物摄取营养物质的能力(王弘宇等,2007),因此pH是影响微生物活性的重要指标之一(周迎芹等,2013)。图7描述了pH对菌株A14脱氮效果的影响,当pH为7时,菌株A14的NO3-去除效果最佳,而当环境条件偏酸或偏碱时,其NO3-去除率有所下降,在不同pH条件下,NO2-积累均不明显,说明菌种A14最适宜生长酸碱条件为中性。
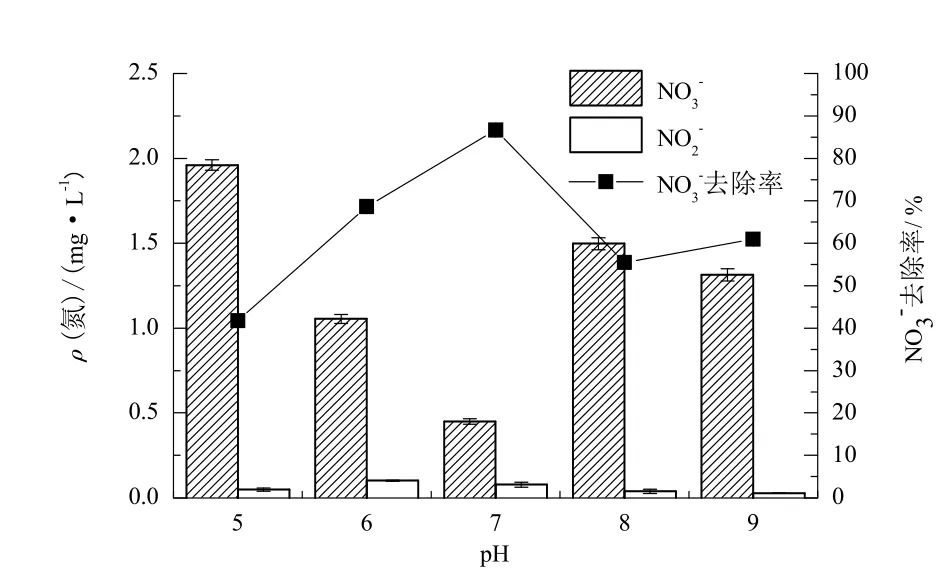
图7 pH对菌株A14好氧反硝化特性的影响Fig. 7 Effect of pH on denitrification of strain A14
Timmermans等(1983)研究显示,反硝化酶活性的最适pH值是中性或微碱性,否则微生物中反硝化酶的活性会有所抑制,进而影响脱氮效果,这与本实验研究结果一致。
2.3.4 温度对菌株A14好氧反硝化特性的影响
温度对菌株A14脱氮效果的影响如图8所示。温度过高或过低,微生物的好氧反硝化酶活性都会受到影响,从而改变脱氮效果。本实验考察了在低中高(10、20、30、35、45 ℃)不同温度条件下的脱氮特性,可以看出,当温度在 30 ℃时,NO3-去除率最大,可以达到86.62%,说明该菌株的最适温度为30 ℃。在10 ℃下,该菌株的NO3-去除率可以达到40.18%,在45 ℃下,NO3-去除率却只有12.78%,但低温条件下,NO2-积累量高于中高温条件。这说明该菌株在低温条件下可以生长,但无法适应高温条件。

图8 温度对菌株A14好氧反硝化特性的影响Fig. 8 Effect of temperature on denitrification of strain A14
这是因为低温条件下,酶活性会受到抑制,高温条件下,微生物的蛋白质会变性从而使酶系统失活(周莉等,2013)。所以该实验说明,菌株 A14的好氧反硝化酶最适温度为 30 ℃,且可以适应适当的低温条件。

图9 接菌量对菌株A14好氧反硝化特性的影响Fig. 9 Effect of inoculating ratio on denitrification of strain A14
2.3.5 菌剂投加量对菌株A14好氧反硝化特性的影响
韩永和等(2013)研究发现NO3-去除率与好氧反硝化菌接种量有直接关系,因此考察了不同接菌量对好氧反硝化特性的影响。由图9可以看出,当接菌量>0.1%时,NO3-去除率可以达到 60%以上,当接菌量为5%时,NO3-去除率接近80%,当接菌量为10%时,NO3-去除率达到最大值86.62%,而当接菌量为15%时,NO3-去除率反而有所下降,且有明显NO2-积累。这与苏俊峰等(2013)人的结论一致,贫营养条件下,接菌量过低无法实现高效反硝化;而接菌量过高时,则无法满足微生物生长数量所需营养物质,否则死亡的菌体会发生自溶现象,进而释放胞内有机氮。
2.4 菌株A14在微污染水源水库原水中的贫营养驯化脱氮实验
依照实验步骤2.8在5倍浓度1WP培养基、灭菌水库原水中依次对菌株A14进行培养、驯化,使之能够在短时间内适应贫营养环境条件,然后接种至微污染水源水库原水(原水取自山东枣庄某水库,水质指标如表3所示)中,考察A14对实际水源水中氮污染物的脱除效果。

表3 山东枣庄某水源水库水质指标Table 3 The water quality of reservoir in Zaozhuang, Shandong Province
如图10所示,接种到水库原水中48 h时,TN质量浓度由初始值1.736 mg·L-1降至1.042 mg·L-1,TN去除率达到 39.98%,NO3-质量浓度由初始值1.223 mg·L-1降至 0.629 mg·L-1,NO3-去除率达到48.57%,接种120 h时,TN最终去除率达到50.95%,NO3-最终去除率达到80.25%。在水库原水的脱氮过程中,NO3-和TN均有明显的去除率,说明该菌株在逐步驯化培养过程中,具有良好的脱氮效果。

图10 山东枣庄某水库原水中菌株A14脱氮情况Fig. 10 Nitrogen removal of strain A14 in raw water of reservoir in Zaozhuang, Shandong Province
由于本次研究中采用的菌株 A14是从山东枣庄某水库沉积物中筛选所得,将其应用至该水库原水脱氮中,不易产生生态风险,并且更容易与土著菌结合,形成更加有效的复合菌群。因此,菌株A14在微污染水源水脱氮处理中的应用具有良好应用前景。
3 结论
1)从贫营养水源水库沉积物中筛选出好氧反硝化菌A14,菌落形态为短杆菌,菌落为半透明,菌体较小,约0.9 µm×1.0 µm,无鞭毛,无芽孢,革兰氏阴性。16S rRNA基因测序、Biolog GenⅢ鉴定和生理生化分析确定菌株 A14为皮特不动杆菌(Acinetobacter pittii),并且胞内表达napA基因,表明该菌可以在好氧条件下进行反硝化作用。
2)对筛选出的菌株A14进行脱氮特性研究,发现该菌株同时具备好氧反硝化和异养硝化能力,在以NO3-为氮源的培养基中,菌株A14的NO3-去除率达到 78.89%,TN去除率达到 57.60%;在以NH4+为氮源的培养基中,菌株A14发生了同步硝化-反硝化作用,TN去除率达到83.53%,NH4+去除率达到95.25%。在两脱氮过程中,该菌均无NO2-积累。
3)在好氧反硝化特性研究中,通过对不同影响因素分析,得到菌株A14的最适宜生长条件为:以乙酸钠为碳源,温度为30 ℃,C/N为16,pH为7,接菌量为10%。并且该菌株在10 ℃下NO3-去除率可以达到40.18%,在C/N=5时,NO3-去除率可以达到60%,说明该菌可以在低温、低C/N条件下生长。
4)采用逐步驯化培养法,将菌株A14经过5倍浓度 1WP培养基和灭菌水库原水的驯化培养后,接菌液接种至水库原水中培养,120 h时TN去除率达到50.95%,NO3-去除率达到80.25%,证明该菌株在贫营养水库原水中适应性良好,具有明显的脱氮效果,可作为微污染水源水脱氮过程的高效菌剂。
CHUN J, LEE J H, JUNG Y, et al. 2007. EzTaxon: a web-based tool for the identification of prokaryotes based on 16S ribosomal RNA gene sequences[J]. International Journal of Systematic and Evolutionary Microbiology, 57(10): 2259-2261.
CINDY J S, DAVID B N, LIANG F D, et al. 2007. Diversity and abundance of nitrate reductase genes (narG and napA), Nitrite reductase genes (nirS and nrfA), and their transcripts in estuarine sediments[J]. Applied and Environmental Microbiology, 73(11): 3612-3622.
DUAN J M, FANG H D, SU B, et al. 2015. Characterization of a halophilic heterotrophic nitrification-aerobic denitrification bacterium and its application on treatment of saline wastewater[J] Bioresource Technology, 179: 421-428.
HOLT J G, KRIEG N R, SNEATH PHA, et al. 1994. Berger’s Manual of Deteminative Bacteriology, 9th Ed[M]. Baltimore: The Williams and Wilkins Co.
KYOUNG J P, KYOUNG S C, SOO W N, et al. 2005. Aerobic nitrification-denitrification by heterotrophic Bacillus strains[J]. Bioresource Technology, 96(17): 1897-1906.
MAKOTO S, YOICHI I. 2014. Heterotrophic nitrification and aerobic denitrification of high-strength ammonium in anaerobically digested sludge by Alcaligenes faecalis strain No. 4[J]. Journal of Bioscience and Bioengineering, 117(6): 737-741.
MIYAHARA M, KIM S W, ZHOU S, et al. 2012. Survival of the aerobicdenitrifier Pseudomonas stuzeri strain TR2 during co-culture with activated sludge under denitrifying conditions[J]. Bioscience, Biotechnology, and Biochemistry, 76(3): 495-500.
RICHARDSON L A, CORNELISSE R, DE V P, et al. 1989. Aerobic denitrification in various heterotrophic nitrifiers[J]. Antonic Van Leeuwenhoek, 56(4): 289-299.
TIMMERMANS P, VAN HAUTE A. 1983. Denitrification with methanol: Fundamental study of the growth and denitrification capacity of Hyphomicrobium sp[J]. Water Research, 17(10): 1249-1255.
WANG X, LI T L, DONG M Y, et al. 2011. Reducing nitrate in groundwater by stabilized iron nanoparticles and denitrifying bacteria[J]. Journal of Agro-Environment Science, 30(4): 739-745.
YANG Y, ZHU H, COLVIN V L, et al. 2011. Cellular and transcriptional response of Pseudomonas stutzeri to quantum dots under aerobic and denitrifying conditions[J]. Environmental Science & Technology, 45(11): 4988-4994.
REN Y X, LEI Y, LIANG X. 2014. The characteristics of a novel heterotrophic nitrifying and aerobic denitrifying bacterium, Acinetobacter junii YB[J]. Bioresource Technology, 171: 1-9.
ZHOU J Z, BRUNS M A, TIEDJE J M. 1996. DNA recovery from soil of diverse composition[J]. Applied and Environmental Microbiology, 62(2): 316-322.
陈茂霞, 王欢, 周后珍, 等. 2013. 异养硝化-好氧反硝化菌 HN-02的筛选及其特性[J]. 应用与环境生物学报, 19(4): 688-693.
韩永和, 章文贤, 庄志刚, 等. 2013. 耐盐好氧反硝化菌A13菌株的分离鉴定及其反硝化特性[J]. 微生物学报, 53(1): 47-58.
何斐, 李磊, 徐炎华. 2008. 微污染水源水处理技术研究进展[J]. 安徽农业科学, 36(11): 4672-4685.
黄廷林, 刘婷婷, 张海涵, 等. 2013. 水库贫营养好氧反硝化细菌分离及其对水体微生物群落影响[J]. 西安建筑科技大学学报: 自然科学版, 44(6): 876-882.
李雯, 阎爱华, 黄秋娴, 等. 2014. 尾矿区不同植被恢复模式下高效固氮菌的筛选及Biolog鉴定[J]. 生态学报, 34(9): 2329-2337.
林娜, 郭楚玲, 郭延萍, 等. 2012. 红树林湿地中好氧-厌氧反硝化菌脱氮特性及其种群结构分析[J]. 环境科学学报, 32(1): 173-181.
刘燕, 甘莉, 黄哲强, 等. 2010. 脱氮副球菌 YF1的反硝化特性研究[J].水处理技术, 36(10): 61-65.
乔森, 刘雪洁, 周集体, 等. 2014. 异养硝化-好氧反硝化在生物脱氮方面的研究进展[J]. 安全与环境学报, 14(2): 128-135.
全向春, 岑艳, 钱殷, 等. 2013. 2株好氧反硝化菌的筛选及其强化贫营养生物膜脱氮效果[J]. 环境科学, 34(7): 2862-2868.
苏俊峰, 杨少斐, 黄廷林, 等. 2013. 低温贫营养好氧反硝化细菌 SY13的反硝化特性[J]. 城市环境与城市生态, 26(6): 39-42.
苏婉昀, 高俊发, 赵红梅, 等. 2013. 异养硝化-好氧反硝化菌的研究进展[J]. 工业水处理, 33(12): 1-5.
孙雪梅, 李秋芬, 张艳, 等. 2012. 一株海水异养硝化-好氧反硝化菌系统发育及脱氮特性[J]. 微生物学报, 52(6): 687-695.
王弘宇, 马放, 苏俊峰, 等. 2007. 好氧反硝化菌株的鉴定及其反硝化特性研究[J]. 环境科学, 28(7): 1548-1552.
王景峰, 金敏, 谌志强, 等. 2011. 1株好氧脱氮菌的筛选与脱氮特性研究[J].环境科学, 32(8): 2409-2413.
王兆阳, 陈国耀, 姜珂, 等. 2014. 1株耐冷兼性嗜碱好氧反硝化菌的分离鉴定及反硝化特性[J]. 环境科学, 35(6): 2341-2347.
魏巍, 黄廷林, 苏俊峰, 等. 2010. 1株贫营养好氧反硝化菌的分离鉴定及其脱氮特性[J]. 生态环境学报, 19(9): 2166-2171.
肖继波, 江惠霞, 褚淑祎, 等. 2012. 好氧反硝化菌 Defluvibacter lusatiensisstr.DN7的分离鉴定和异养硝化性能[J]. 应用生态学报, 23(7): 1979-1984.
修海峰, 朱仲元, 丁爱中, 等. 2011. 好氧反硝化菌种DF2的分离鉴定及生理生化特性分析[J]. 生态环境学报, 20(8/9): 1307-1314.
赵丹, 于德爽, 于津, 等. 2013. 菌株ZD8的分离鉴定及其异养硝化和缺氧/好氧反硝化特性研究[J]. 环境科学学报, 33(11): 3007-3016.
周莉, 李正魁, 王易超, 等. 2013. 纯种氨氧化菌短程反硝化特性[J]. 环境工程学报, 7(4): 1219-1224.
周迎芹, 信欣, 姚力, 等. 2013. 一株高效异养硝化-好氧反硝化菌的分离鉴定及脱氮性能[J]. 环境工程学报, 7(10): 4127-4132.
Screening and Nitrogen Removal Characteristics of A heterotrophic Nitrification-aerobic Denitrification Strain
HUANG Tinglin*, ZHANG Lina, ZHANG Haihan, SU Junfeng, GUO Lin, ZHAO Jinya, ZHANG Kai
School of Environmental and Municipal Engineering, Xi’an University of Architecture & Technology, Xi’an 710055, China
To investigate the feasibility that the strain can used to treat micro-polluted water, the research is mainly about the identification and the denitrification characteristics of the aerobic-denitrification strain that was isolated from sediment in water reservoir and the effects of nitrogen removal under different environmental factors. The optimal conditions of the strain can be determined. Through the method of cultivation and acclimatization to make the strain adapt to the oligotrophic condition and make effects on nitrogen removal, which all prove a theoretical basis for the practical application of onsite biological treatment in the future. A high efficient heterotrophic nitrification-denitrification aerobic bacteria (A14) was isolated from sediment in water reservoir. Based on its microscopic observation, biochemical/morphological characteristics, its 16S rRNA sequence homologic analysis and Biolog GenⅢ identification, this strain was a gram-negative bacillus and was identified as Acinetobacter pittii. The efficient nitrogen removal in 36 hours can be 78.89% when nitrogen as the nitrogen source and the strain’s partial napA functional gene was cloned. When ammonia as the nitrogen source, TN removal rate can be 80.42%, ammonia removal rate can be 95.25%, TOC removal rate can be 98.3%. The highest nitrite removal rate reaches 86.62% when carbon resource is NaAc, temperature=30 ℃, C/N=12, pH=7, inoculating ratio is 10%. In addition, the nitrite removal rate can reach 40.18% under 10 ℃. When the strain is cultivated and acclimated in reservoir raw water, TN removal can be 50.95%, the nitrogen removal can be 80.25%. It is therefore demonstrated that the strain A14 can be used to treat micro polluted water.
heterotrophic nitrification; aerobic denitrification; micro polluted water; functional genes
X172
A
1674-5906(2015)01-0113-08
10.16258/j.cnki.1674-5906.2015.01.017
黄廷林,张丽娜,张海涵,苏俊峰,郭琳,赵金亚,张凯. 一株贫营养异养硝化-好氧反硝化菌的筛选及脱氮特性[J]. 生态环境学报, 2015, 24(1): 113-120.
HUANG Tinglin, ZHANG Lina, ZHANG Haihan, SU Junfeng, GUO Lin, ZHAO Jinya, ZHANG Kai. Screening and Nitrogen Removal Characteristics of A Heterotrophic Nitrification-aerobic Denitrification Strain [J]. Ecology and Environmental Sciences, 2015, 24(1): 113-120.
国家科技支撑计划项目(2012BAC04B02);国家自然科学基金项目(51208413)
黄廷林(1962年生),男,教授,博士,主要研究方向为水源水库水质微污染控制。E-mail:huangtinglin@xauat.edu.cn;*通讯作者
2014-11-06
