Ni掺杂黄铁矿型FeS2的溶剂热合成及其可见光催化活性
2015-12-05张明月何金云武晓鹂邹正光有色金属及材料加工新技术教育部重点实验室桂林54004桂林理工大学材料科学与工程学院桂林54004
龙 飞 张 劲 张明月 何金云, 武晓鹂, 邹正光,(有色金属及材料加工新技术教育部重点实验室,桂林 54004) (桂林理工大学材料科学与工程学院,桂林 54004)
Ni掺杂黄铁矿型FeS2的溶剂热合成及其可见光催化活性
龙飞*,1,2张劲2张明月2何金云1,2武晓鹂1,2邹正光1,2
(1有色金属及材料加工新技术教育部重点实验室,桂林541004) (2桂林理工大学材料科学与工程学院,桂林541004)
以FeSO4·7H2O、Na2S2O3·5H2O和NiSO4·6H2O为原料,采用溶剂热法合成了Ni掺杂的黄铁矿FeS2粉体,利用XRD、XPS、FE-SEM、UV-Vis、拉曼光谱等测试手段对所得产物进行了表征分析。结果表明,掺杂适量的Ni可促进白铁矿FeS2向黄铁矿FeS2的晶型转变。Ni掺杂有利于提高NixFe1-xS2的可见光催化活性,当Ni的掺入量x为0.125时,样品的光催化性能最好。在可见光照射210 min后,亚甲基蓝的降解率为62.8%,与未掺杂FeS2相比,其降解率提高了26.2%。
溶剂热合成;FeS2;Ni掺杂;光催化活性;亚甲基蓝
0 引 言
CoS2、FeS2和MoS2等过渡金属硫化物具有优良的电学、光学和磁学性能,可广泛应用于太阳能光电转换[1-2]和锂离子电池[3]等领域。FeS2作为一种过渡金属硫化物,具有白铁矿和黄铁矿两种晶体结构[4]。其中,立方晶系黄铁矿型FeS2具有较高的光吸收系数 (λ≤700 nm时,光吸收系数不小于5×105cm-1)、合适的禁带宽度(Eg=0.95 eV),并且原料来源丰富、无毒、环境相容性好,在光伏[5-6]和锂离子电池[7-8]等领域都是很有发展潜力的材料。FeS2还有望应用于光催化材料[9],但FeS2的带隙偏小,光催化活性不高,尤其是其可见光催化活性未见报导。
金属离子掺杂是改善半导体材料理化性质的一种有效方法,利用该项技术在催化领域已取得了很好的成效[10-12]。近些年,FeS2的掺杂改性研究取得了一定的进展:如张辉等[13]分别采用离子注入和磁控溅射法对FeS2薄膜进行了Zn和Co元素掺杂,结果表明,通过离子注入法掺杂Zn和Co元素后,薄膜的光吸收系数和禁带宽度得到了提高,但薄膜的光学性能有所降低;Xia等[14]采用溶剂热法成功合成了Sn4+掺杂的FeS2薄膜,掺杂Sn4+后,FeS2薄膜的禁带宽度提高到了1.71 eV;Han等[15]制备了一系列Co掺杂的FeS2,发现产物的形貌的和磁性能随着Co的掺入发生了较大的变化。本课题组的前期工作中,也开展了FeS2的Co掺杂研究,当每摩尔FeS2中掺入0.33 mol的Co时,在可见光下照射210 min后,亚甲基蓝的降解率达48.9%[16]。鉴于这些研究成果,本文通过溶剂热法合成Ni掺杂的FeS2,对FeS2的带隙进行调控,试图进一步研究Ni元素对FeS2可见光催化活性的影响。
1 实验部分
1.1样品合成
FeS2光催化剂的制备:分别称取5 mmol的FeSO4·7H2O和Na2S2O3·5H2O放入25 mL乙醇和乙二醇的混合溶剂中 (其中:乙醇5 mL、乙二醇20 mL),置于磁力搅拌器中搅拌溶解30 min。待原料完全溶解至溶液澄清后,将溶液转移至带有聚四氟乙烯内胆的不锈钢反应釜中,密封后放入烘箱中,在200℃下反应24 h。反应结束后将其自然冷却至室温取出,将所得产物分别用去离子水和无水乙醇离心洗涤数次,将洗涤后所得产物放入真空干燥箱中80℃下干燥8 h,得到黄铁矿FeS2光催化剂。
NixFe1-xS2(x=0.1,0.125,0.2)光催化剂的制备:分别称取5 mmol的FeSO4·7H2O和Na2S2O3·5H2O放入25 mL乙醇和乙二醇的混合溶剂中(其中:乙醇5 mL、乙二醇20 mL),再按照nNi∶nFe=x∶(1-x)的比例,加入不同质量的NiSO4·6H2O于反应溶液中,置于磁力搅拌器中搅拌溶解30 min;将溶液转移至带有聚四氟乙烯内胆的不锈钢反应釜中,密封后放入烘箱中,在200℃下反应24 h。反应结束后将其自然冷却至室温取出,将所得产物分别用去离子水和无水乙醇离心洗涤数次,将洗涤后所得产物放入真空干燥箱中80℃下干燥8 h,制备得到不同Ni掺杂量的FeS2光催化剂。
1.2样品表征
采用X射线粉末衍射仪 (荷兰帕纳科公司X′Pert PRO型)对样品的物相进行分析,工作参数:铜靶(λ=0.154 056 nm),加速电压40 kV,电流10 mA,扫描速度0.02°·s-1,扫描范围10°~80°;采用X射线光电子能谱仪(ESCALAB 250Xi型)对样品的元素存在形态进行分析;采用场发射扫描电子显微镜(Hitachi S-4800型)对合成产物的形貌进行表征;采用紫外-可见分光光度计 (Shimadzu UV-3600型)测定产物的紫外-可见吸收光谱 (以BaSO4作为参比样)。
1.3光催化性能测试
光催化反应在BL-GHX-V型(上海,比朗)光催化反应器中进行。光反应器中心光源为400 W的金卤灯(金卤灯与反应器间加入滤光片,λ>420 nm)。在光催化反应中,亚甲基蓝溶液的初始浓度为10 mg· L-1,溶液体积为50 mL,催化剂的用量为50 mg。在光催化反应前,将含催化剂的亚甲基蓝悬浮液在黑暗条件下搅拌吸附40 min使溶液达到物理吸附和脱附平衡,然后打开光源,在400 W金卤灯光源下边照射边搅拌。光照每隔一段时间取出约5 mL样液,进行高速离心分离(9 000 r·min-1),以除去样液中的催化剂颗粒,得到上清液;用UV-3600型分光光度计在664 nm(亚甲基蓝的最大吸收波长)处测定上清液的吸光度。根据(C0-Ct)/C0(其中C0为亚甲基蓝溶液的初始浓度,Ct为光催化反应不同时间后亚甲基蓝溶液的浓度)公式计算亚甲基蓝溶液的降解率。
2 结果与讨论
2.1样品的X射线衍射图
图1是未掺杂FeS2和NixFe1-xS2(x=0.1,0.125,0.2)样品的X射线衍射图。从图中可以看出,所有产物的特征峰均对应于立方晶系黄铁矿(pyrite)FeS2(JCPDS No.71-0053)。但未掺杂FeS2中含有少量的白铁矿(makasite)杂峰,当掺入一定量的Ni2+后,产物中白铁矿的特征峰消失,且衍射峰向低角度方向偏移,但当Ni的掺杂量增加到0.2时,产物中出现了NiS2的特征峰。
由于所掺杂的Ni2+与Fe2+离子半径不同 (rNi2+= 0.069 nm,rFe2+=0.061 nm),掺杂少量Ni2+时,Ni2+替代了晶格中部分Fe2+的格点形成了替位点缺陷,在替代原子附近,会导致晶格发生一定程度的变化,使这些位置的能量增高,因而促进了白铁矿相向黄铁矿相的转变。而Ni2+替代晶格中部分Fe2+的格点后会导致晶格膨胀,同时也使得原有晶体结构的有序度降低,因此,产物的衍射峰向低角度偏移并且衍射峰强度略有减弱。继续增大Ni2+的掺杂量至x=0.2时,产物中出现了NiS2的相,说明此时(Ni,Fe)S2体系中Ni与Fe不能形成连续固溶体,过多的Ni会使得体系分相。

图1 未掺杂FeS2和NixFe1-xS2(x=0.1,0.125,0.2)样品的XRD图Fig.1 XRD patterns of the undoped FeS2and NixFe1-xS2(x=0.1,0.125,0.2)samples
2.2样品的拉曼光谱分析
图2为未掺杂FeS2与NixFe1-xS2(x=0.1,0.125)样品的拉曼光谱图。从图中可以看出:未掺杂的FeS2样品的拉曼光谱图中,分别位于344、381和430 cm-1的特征峰与文献报导的黄铁矿FeS2的拉曼光谱相一致[17],但未掺杂的FeS2样品在326 cm-1处出现了较弱的白铁矿的拉曼特征峰,说明样品中含有少量的白铁矿FeS2。当掺入一定量的Ni2+后,样品中只有位于344、381和430 cm-1的黄铁矿FeS2的特征峰,而没有出现白铁矿的特征峰,说明掺入Ni2+后,样品为纯的黄铁矿FeS2,这与XRD的结果相一致。
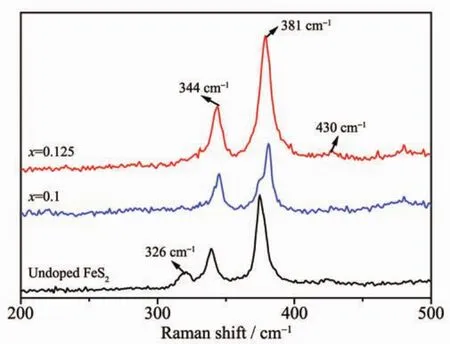
图2 未掺杂FeS2和NixFe1-xS2(x=0.1,0.125,0.2)样品的拉曼光谱图Fig.2 Raman spectras of the undoped FeS2and NixFe1-xS2(x=0.1,0.125,0.2)samples
2.3样品的光电子能谱分析
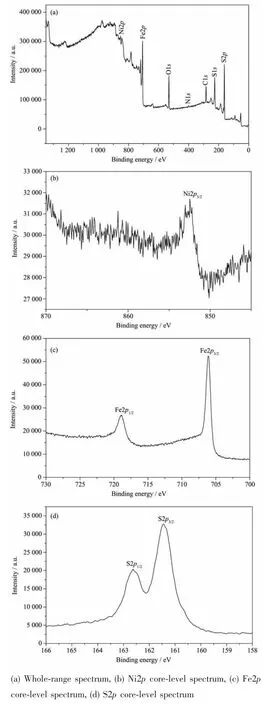
图3 Ni0.125Fe0.875S2样品的XPS图谱Fig.3 XPS spectra of Ni0.125Fe0.875S2sample
为研究样品中存在元素的价态,对Ni0.125Fe0.875S2样品进行了XPS分析,如图3所示。从图3(a)样品的XPS全谱图中可以看出,样品的表面主要存在Fe、Ni、S、N、C和O元素,其中C、N和O是由于测试仪器以及环境污染引入的元素。图3(b)为Fe元素的高分辨谱图,可以看出Fe2p的光电子峰,其结合能分别为706.12和718.92 eV,这与晶格中Fe2+的结合能相一致[14]。图3(c)中Ni2p轨道的光电子峰的结合能分别为852.60和870 eV,分别对应于Ni2p3/2和Ni2p1/2,说明该样品中Ni元素的价态为+2[18]。图3 (d)中位于161.44和162.62 eV的光电子峰分别对应于S2p3/2和S2p1/2,说明S元素以S2-的形式存在[14]。
2.4样品的形貌分析
图4为未掺杂FeS2与Ni0.125Fe0.875S2样品的FESEM照片。未掺杂时,FeS2(图4a)主要为球形颗粒,其粒径分布范围较宽(1~3 μm),并存在一定程度的团聚。与未掺杂的FeS2相比,Ni0.125Fe0.875S2样品的形貌发生了较大的变化,样品变为由大量纳米粒子(粒径约为100 nm)组成的软团聚体,其颗粒大小分布较均匀(图4b)。由此可见,Ni2+的掺入阻止了FeS2的晶粒生长,减小了FeS2样品的颗粒尺寸。小颗粒的光催化剂与大颗粒光催化剂相比,具有更大的比表面积和更好的光催化活性,因此掺入镍离子后,将有利于提高FeS2材料的光催化性能。

图4 样品的FE-SEM照片Fig.4 FE-SEM images of the samples:
2.5样品的光吸收谱
未掺杂FeS2与Ni0.125Fe0.875S2样品的紫外-可见漫反射光谱如图5所示。从图中可以看出,未掺杂FeS2与Ni0.125Fe0.875S2样品在紫外和可见光区均有明显的吸收。掺入镍离子后,样品在紫外光区的吸收有所减弱,但其在可见光区的吸收明显增强,预示了掺杂镍离子样品可见光催化活性的提高。
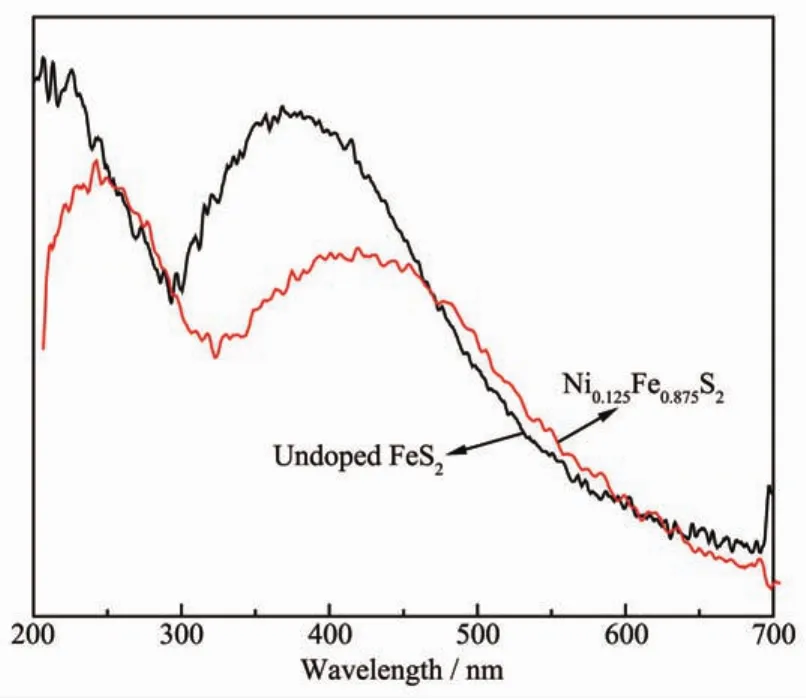
图5 未掺杂FeS2与Ni0.125Fe0.875S2样品的紫外-可见吸收光谱Fig.5 UV-Vis diffuse reflectance spectra of the undoped FeS2and Ni0.125Fe0.875S2samples
2.6光催化性能测试
为了研究镍离子掺杂对黄铜矿FeS2可见光催化性能的影响,对比了未掺杂FeS2与NixFe1-xS2(x= 0.1,0.125)样品在可见光照射下对亚甲基蓝的降解效果(如图6):可见光照射210 min后,空白对照样降解了16.7%,说明在可见光照下,亚甲基蓝自身也会发生一定的光降解;同等条件下以未掺杂FeS2作为光催化剂,可见光照射210 min后,亚甲基蓝的降解率为36.6%。当Ni的掺入量x小于0.125,即x= 0.1时,掺杂样品的可见光催化活性与未掺杂FeS2的相差不大。但当Ni的掺入量x为0.125时,FeS2的光催化活性得到了很大提高:光照210 min后,亚甲基蓝的降解率达到62.8%,相比于未掺杂的FeS2样品,提高了26.2%,其催化效果也明显优于掺Co的FeS2[16]。Ni的掺入量x不同时,FeS2样品光催化性能不同的原因如下:当Ni的掺入量x为0.1时,没有达到合适的掺杂量,未能有效调控FeS2的带隙;而当Ni的掺量x为0.125时,FeS2的带隙得到了有效的调控,同时催化剂的颗粒生长得到了有效抑制,样品的比表面积得到了很大提高,因而大幅度地提高了FeS2的可见光催化活性。
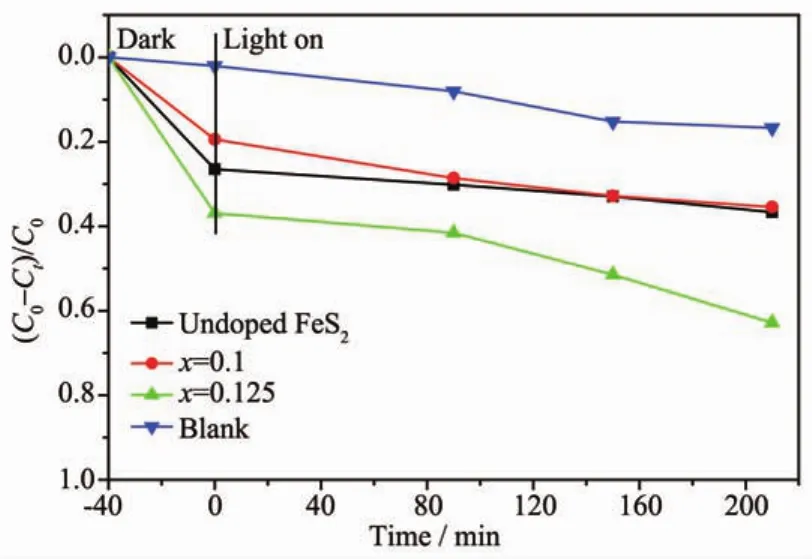
图6 未掺杂FeS2与NixFe1-xS2(x=0.1,0.125)样品的可见光光催化活性Fig.6 Visible-light-driven photocatalytic performance of the undoped FeS2and Ni0.125Fe0.875S2samples
掺入镍离子后FeS2样品可见光催化活性得到提高的原因如下:一方面,半导体光催化剂中掺入金属离子后,杂质金属可作为电子的有效受体,捕获从价带激发到导带的光生电子,阻止半导体光生电子与空穴的复合,从而提高半导体材料的可见光催化活性。此外,从Ni0.125Fe0.875S2样品的紫外-可见吸收光谱可知:掺入镍离子后,样品在紫外光区的吸收有所减弱,同时在可见光区的吸收明显增强,说明带隙得到有效的增加,如此不但增强了对可见光区光子的利用率,而且提高了对有机物的氧化电势,从而改善了FeS2的可见光催化活性。另一方面,光催化材料的催化活性与材料的比表面积密切相关,掺入镍离子后,减小了FeS2样品的颗粒尺寸,增大了材料的比表面积,因此提高了FeS2样品的可见光催化活性。
图7是可见光下,以未掺杂FeS2和Ni0.125Fe0.875S2样品为光催化剂时,亚甲基蓝溶液随照射时间变化的吸收光谱图。从图7a可以看出,以未掺杂FeS2为催化剂时,随光照时间的增加,亚甲基蓝溶液的降解较为缓慢。当使用Ni0.125Fe0.875S2样品为光催化剂时,随着光照时间的增加,亚甲基蓝溶液的浓度不断下降(图7b),说明镍离子掺杂后,增强了FeS2光催化剂的可见光催化活性。
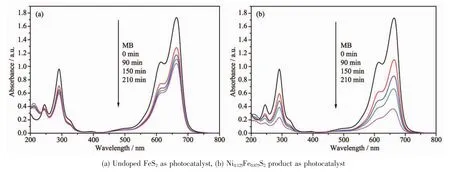
图7 可见光下催化剂降解MB吸收光谱的变化Fig.7 Absorbance changes of MB under visible-light irradiation
3 结 论
利用溶剂热法,合成了黄铁矿FeS2,但产物中伴有少量白铁矿的杂相;当每摩尔FeS2掺入0.1~0.125 mol的Ni2+时,促进了产物由白铁矿向黄铁矿的晶型转变,且产物由较大颗粒的微球转变成纳米球形颗粒团聚体。当Ni的掺杂量x达到0.2时,产物中出现了NiS2。随着Ni2+的掺入,样品的吸收带边明显红移,样品的可见光催化活性得到了有效改善。当掺入量x为0.125时,样品的可见光催化性能最好,其可见光下照射210 min后,亚甲基蓝溶液的降解率为62.8%,与未掺杂FeS2相比,其降解率提高了26.2%,其可见光催化活性明显优于文献报导的Co0.33Fe0.67S2的光催化活性。掺入镍离子后,黄铁矿可见光催化活性得到了有效改善的原因是:一方面,抑制了FeS2催化材料的电子和空穴的复合,拓宽了它的光响应范围,从而提高了其在可见光区光子的利用率;另一方面,掺入镍离子后,抑制了FeS2样品的晶粒生长,提高了样品的比表面积。
[1]WANG Ming-Xu(王明旭),YUE Guang-Hui(岳光辉),GEN Zhong-Rong(耿中荣),et al.J.Synth.Cryst.(人工晶体学报), 2007,36(3):650-652
[2]Ferrer I J,Sanchez C.Solid State Commun.,1992,81(5):371 -374
[3]QIU Bing(邱彬).Thesis for the Doctorate of Beijing University of Technology(北京工业大学博士学位论文),2013.
[4]Ennaoui A,Fiechter S,Pettenkofer C,et al.Sol.Energy Mater. Sol.Cells,1993,29:289-370
[5]Raturi A K,Waita S,Aduda B,et al.Renewable Energy, 1999,20:37-43
[6]Abass A K,Ahmed Z A,Samuel R M.Phys.State Sol., 1990,120:247-251
[7]FENG Xu(冯旭),HE Xiang-Ming(何向明),PU Wei-Hua(蒲薇华),et al.Progress in Chemistry(化学进展),2008,20(2/ 3):396-404
[8]Ding W,Wang X,Peng H F,et al.Mater.Res.Bull.,2013, 48:4704-4710
[9]Liu S L,Li M M,Li S,et al.Appl.Surf.Sci.,2013,268:213-217
[10]CHEN Qing-Kong(陈晴空),JI Fang-Ying(吉芳英),GUAN Wei(关伟),et al.J.Sichuan University(四川大学学报), 2013,45(5):192-198
[11]Zhou B,Zhao X,Liu H,et al.Appl.Catal.,B,2010,99(1): 214-221
[12]Nair M G,Nirmala M,Rekha K,et al.Mater.Lett.,2011,65 (12):1797-1800
[13]ZHANG Hui(张辉),ZHANG Ren-Gang(张仁刚),WAN Dong-Yun(万冬云),et al.Acta Energiaes Solaris Sinica(太阳能学报),2006,27(5):423-427
[14]Xia J,Lu X H,Gao W,et al.Electrochim.Acta,2011,56: 6932-6939
[15]Han J T,Huang Y H,Huang W.Mater.Lett.,2006,60:1805 -1808
[16]Long F,He J Y,Zhang M Y,et al.J.Mater.Sci.,2015,50: 1848-1854
[17]Baruth A,Manno M,Narasimhan D,et al.J.Appl.Phys., 2012,112(5):054328
[18]Nesbitt H W,Legrand D,Bancroft G M.Phys.Chem.Miner., 2000,27(5):357-366
Ni-Doped FeS2:Solvothermal Synthesis and the Visible-Light Photocatalytic Properties
LONG Fei*,1,2ZHANG Jin2ZHANG Ming-Yue2HE Jin-Yun1,2WU Xiao-Li1,2ZOU Zheng-Guang1,2
(1Key Laboratory of Nonferrous Materials and New Processing Technology of Ministry of Education,Guilin,Guangxi 541004,China) (2School of Materials Science and Engineering,Guilin University of Technology,Guilin,Guangxi 541004,China)
Ni-doped pyrite FeS2were synthesized through a solvothermal method using FeSO4·7H2O,Na2S2O3· 5H2O and NiSO4·6H2O as raw materials.The products were characterized by X-ray diffraction(XRD),X-ray Photoelectron Spectroscopy(XPS),field emission scanning electron microscope(FE-SEM),UV-Vis diffuse reflectance spectra(DRS)and Raman spectroscopy.The results showed that appropriate amount of Ni doping facilitated the transformation of the marcasite to pyrite.After Ni2+doping,the visible-light-driven photocatalytic performance of the FeS2was greatly enhanced.Methylene blue(MB)was decomposed 62.8%within 210 min using Ni0.125Fe0.875S2as photocatalyst,which was 26.2%higher than that of the pristine FeS2.
solvothermal synthesis;FeS2;Ni doping;photocatalytic activity;methylene blue
O614.81+3
A
1001-4861(2015)06-1119-06
10.11862/CJIC.2015.179
2014-11-18。收修改稿日期:2015-04-30。
国家自然科学基金(No.51162005),广西自然科学基金(No.2012GXNSFFA060007)资助项目。
*通讯联系人。E-mail:long.drf@gmail.com
