吡啶硫酮类防污剂对华美盘管虫早期不同发育阶段的毒性效应研究
2015-12-02王超超葛天宇朱秀琴徐利婷
商 群, 陈 新, 王超超, 葛天宇, 曹 瑞, 朱秀琴, 徐利婷, 唐 敏
(1. 海南大学 材料与化工学院, 海南 海口 570228; 2. 海南大学 农学院, 海南 海口 570228; 3. 中国农业大学 动物医学院, 北京 100083)
近年来, 随着人们对海洋资源的开发力度不断加大, 海洋防污问题也越来越严峻。目前化学防污法特别是防污涂料是最常用的防污技术, 但防污涂料中使用的很多防污剂都具有不同程度的生态毒性。如有机锡曾是广泛使用的高效广谱防污剂, 但因有机锡对海洋生态环境造成的严重破坏, 已在2008年被禁止用于海洋防污涂料[1]。吡啶硫酮铜和吡啶硫酮锌具有较好的防污效果, 且在海水中见光易分解,在国内外作为防污助剂已被大量使用[2-3], 但研究发现在光照有限的地方则会明显积累[4], 在越南和日本的船坞沉积物都已检测到吡啶硫酮铜[5-6]。吡啶酮金属的海洋生态毒性方面的研究很少, 以有机锡为前车之鉴, 因此, 有必要对吡啶酮金属的生态毒性进行较深入而系统的研究。
多毛类华美盘管虫(Hydroides elegans)广泛分布于热带和亚热带海域[7-9], 是中国南海近岸海域常见的多毛类。其生活史分为营浮游生活的幼虫期和固着生活的成体期。华美盘管虫具有生长速度快、性成熟早、幼虫阶段短和附着快速等特点[10-12]。在热带海域, 华美盘管虫全年都能进行繁殖, 并且其在实验室的培养及相应实验技术和方法也已经发展成熟, 因此是海洋生态毒理试验研究的理想生物。以往在实验室中对华美盘管虫的研究主要集中在其早期发育[12-13]、海洋酸化对其影响[14-15]、基因和蛋白质的表达[7,16], 并作为一些防污剂及重金属检测的生态毒理研究生物[17-19]。作者采用中国南海常见物种 ——华美盘管虫为生态毒理研究对象, 通过研究吡啶硫酮铜和吡啶硫酮锌对其早期发育阶段的急性毒性效应,以期为这两种吡啶硫酮类防污剂在中国南海的生态毒性风险评价和安全使用剂量提供参考资料。1
1 材料和方法
1.1 材料
华美盘管虫成体采集于海南陵水近岸海域(18°30′N, 110°01′20″E), 常年水温为 24.5~25.5℃, 平均海水盐度为33, pH为8.2。
1.2 方法
1.2.1 华美盘管虫成体的培养
将采集的华美盘管虫放在玻璃水族箱中短期培养, 使用采集地海水。暂养期间连续充气, 每日早晚各投饵 1次, 饵料为牟氏角毛藻(Chaetoceros muelleri), 半量换水, 每天1次。
1.2.2 配子的获取和幼虫的培养
华美盘管虫的石灰质管被破坏后, 产生应激反应, 常在1 min之内就会释放大量配子[19]。用镊子轻轻将华美盘管虫石灰质栖管破坏, 取出成体, 用过滤海水(0.45 μm)润洗后, 于海水中静置数分钟, 即可获得配子。
培养幼虫时, 将获取的卵子和精子按照适宜比例转移到盛有海水的烧杯, 28 ℃条件下培养。每天换水 1次, 投饵 1次, 饵料为球等鞭金藻(Isochrysis galbana)。选取培养24 h的担轮幼虫和72 h的后担轮幼虫进行毒理试验。
1.2.3 毒理试验
以二甲基亚砜(华大试剂)为溶剂, 将吡啶硫酮铜和吡啶硫酮锌(≥ 99%, 上海广拓化学)分别配制成 1000 mg/L的储存液, 再根据需要稀释成相应的工作浓度。所有玻璃仪器及海水都经过高温高压灭菌。试验期间保持温度28 ℃, 无光照。每一处理组设平行样3个, 试验重复3次。本实验选取成熟的卵子和精子、培养24 h的担轮幼虫和72 h的后担轮幼虫进行毒理试验。各处理组浓度根据预试验和等比原则设置相应的毒物浓度范围。
1.2.3.1 精子毒理试验
分别吸取 500 μL 精子溶液(40 000 个/μL), 暴露于不同浓度的待检溶液(5 mL)中, 20 min后分别将处理过的精子溶液1000 μL与200个未处理的正常卵子混合受精, 60 min后加入20%福尔马林终止受精, 之后静置20 min, 然后在显微镜下观察100个卵子, 计数其中卵子受精率。
1.2.3.2 卵子毒理试验
卵子毒理试验过程与精子毒理试验类似。即分别将200个卵子暴露于不同浓度的测试液中, 20 min后向烧杯中加入100 μL未处理的精子溶液(40 000个/μL),混合受精。60 min后加入20%福尔马林终止受精卵继续发育, 静置20 min后, 在显微镜下观察100个卵子, 计数卵子受精率。
1.2.3.3 担轮幼虫和后担轮幼虫毒理试验
通过在实验室培养获得担轮幼虫和后担轮幼虫。分别吸取15只幼虫, 向其中加入4 mL不同浓度的测试液, 分别在暴露24 h和48 h后, 计数各组的幼虫死亡数量和死亡率。
1.2.4 数据分析
利用 SPSS19.0, 通过概率单位回归法分析得到半数抑制浓度(IC50)、半数致死浓度(LC50)及其 95%置信区间。配子受精发育的抑制率P=(Pe-Pc)/(1-Pc)×100%[21], 其中Pe为实验组未成功受精发育卵子比例,Pc为空白组未成功受精发育卵子比例。
2 结果
华美盘管虫成熟卵子直径约为 41 μm。一般在28 ℃, pH 8.1,盐度35的适宜条件下, 卵子受精后大概在30 min内完成第一次分裂, 约50 min完成第二次分裂。受精之后100 min即可达到64细胞阶段,大概2 h达到囊胚期, 12 h左右则能发育到担轮幼虫阶段。
2.1 吡啶硫酮对精子的毒性
以可发生卵裂的受精卵为成功受精的判断依据,其余未受精及受精但未分裂的卵子则都算作异常。试验发现不同浓度处理组之间, 成功发育比例存在差异(图1和图2)。当吡啶硫酮铜质量浓度为5 μg/L时, 即会对精子活性产生抑制作用, 此浓度对受精抑制率为6.25%; 质量浓度为50 μg/L时, 受精抑制率达到96.88%, 其IC50为19.49μg/L; 吡啶硫酮锌质量浓度为 10 μg/L时, 抑制率为 12.63%, 质量浓度为100 μg/L时抑制率为95.79%, 其IC50为36.74 μg/L(表 1)。
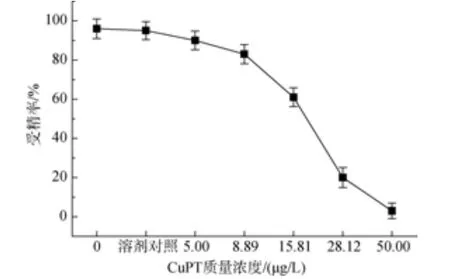
图1 吡啶硫酮铜对华美盘管虫精子的毒性效应Fig. 1 Toxic effect of copper pyrithione on sperm of Hydroides elegans
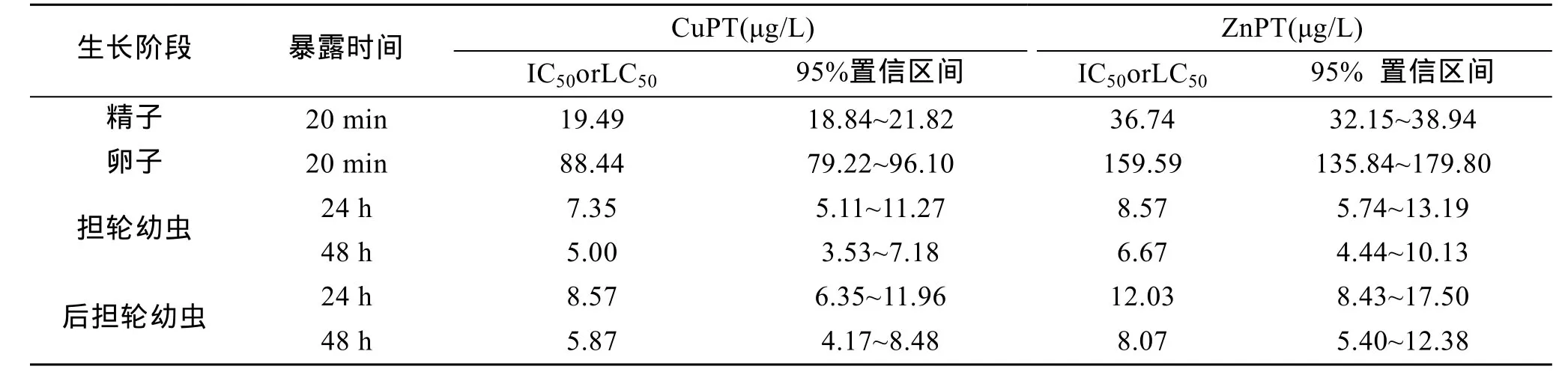
表1 吡啶硫酮类防污剂对华美盘管虫不同时期的IC50、LC50及其95%置信区间Tab.1 IC50, LC50 values and the 95% confidence intervals of metal pyrithione on Hydroides elegans
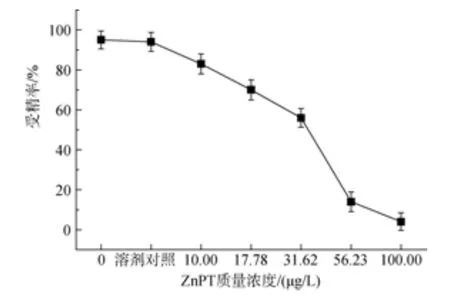
图2 吡啶硫酮锌对华美盘管虫精子的毒性效应Fig. 2 Toxic effect of zinc pyrithione on sperm of Hydroides elegans
2.2 吡啶硫酮对卵子的毒性
试验发现质量浓度为 25 μg/L的吡啶硫酮铜对卵子受精过程会产生抑制作用, 抑制率为2.06%, 当质量浓度为 200 μg/L时, 抑制率达到 98.97%, 其IC50为 88.44 μg/L; 吡啶硫酮锌质量浓度 50 μg/L 时,抑制率为5.32%, 当质量浓度为400 μg/L时, 抑制率为 97.87%, 其 IC50为 159.59 μg/L(图 3 和图 4)。
图3 吡啶硫酮铜对华美盘管虫卵子的毒性效应Fig.3 Toxic effect of copper pyrithione on eggs of Hydroides elegans
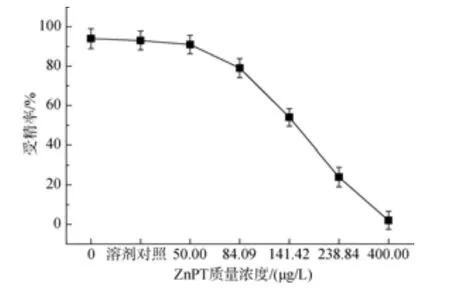
图4 吡啶硫酮锌对华美盘管虫卵子的毒性效应Fig. 4 Toxic effect of zinc pyrithione on eggs of Hydroides elegans
2.3 吡啶硫酮对担轮幼虫的毒性
当担轮幼虫分别暴露于 1.0 μg/L的吡啶硫酮铜和吡啶硫酮锌时, 幼虫死亡率与对照组无明显差异。暴露于25 μg/L吡啶硫酮铜, 24 h和48 h担轮幼虫的死亡率为100%, 24 h和48 h 的LC50分别为7.35 μg/L和5.00 μg/L; 当吡啶硫酮锌质量浓度为50 μg/L时,暴露时间在24 h和48 h的担轮幼虫的死亡率都达到了100%, 24 h和48 h的 LC50分别为8.57 μg/L和6.67 μg/L (图 5 和图 6)。
2.4 吡啶硫酮对后担轮幼虫的毒性
后担轮幼虫分别暴露于 1.0 μg/L吡啶硫酮铜和吡啶硫酮锌时, 幼虫死亡率与对照组无显著差异。吡啶硫酮铜在 25 μg/L时, 后担轮幼虫在暴露时间为24 h和48 h时的死亡率均为100%,24 h 和 48 h 的 LC50分别为 8.57 μg/L 和 5.87 μg/L;吡啶硫酮锌质量浓度在50 μg/L时, 后担轮幼虫在24 h和48 h的死亡率都为100%, 24 h和48 h的 LC50分别为 12.03 μg/L 和 8.07 μg/L(图 7 和图 8)。
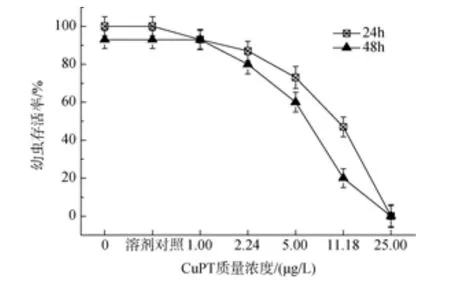
图5 吡啶硫酮铜对华美盘管虫担轮幼虫的毒性效应Fig. 5 Toxic effect of copper pyrithione on trochophore of Hydroides elegans
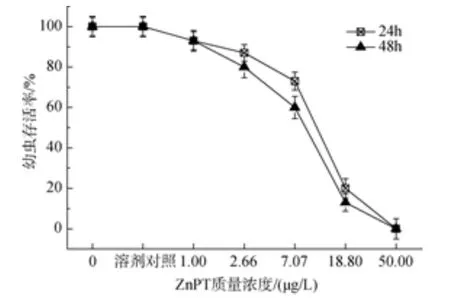
图6 吡啶硫酮锌对华美盘管虫担轮幼虫的毒性效应Fig. 6 Toxic effect of zinc pyrithione on trochophore of Hydroides elegans
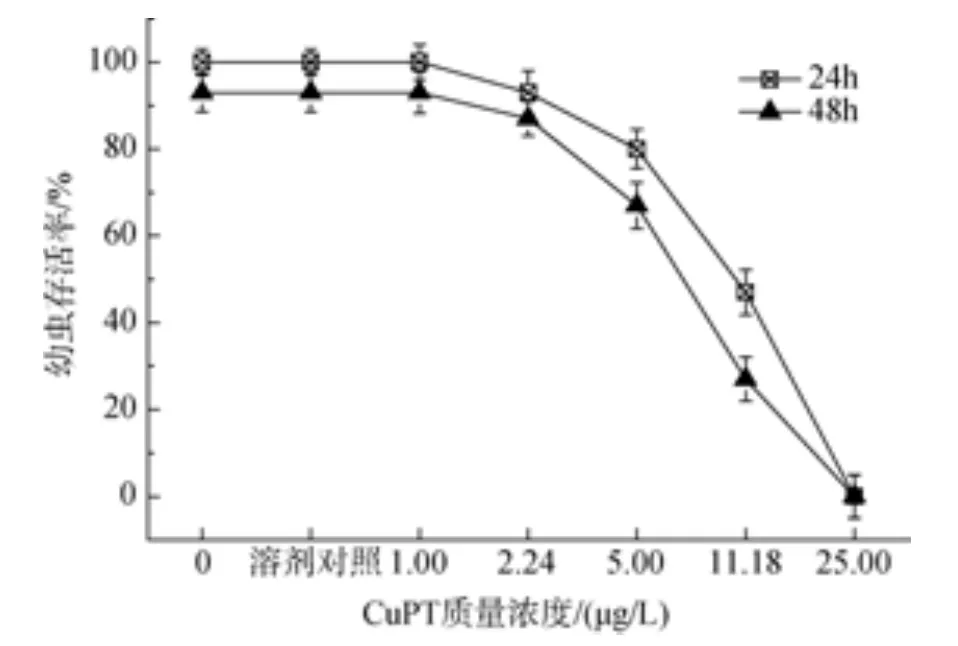
图7 吡啶硫酮铜对华美盘管虫后担轮幼虫的毒性效应Fig. 7 Toxic effect of copper pyrithione on metatroch of Hydroides elegans
3 讨论
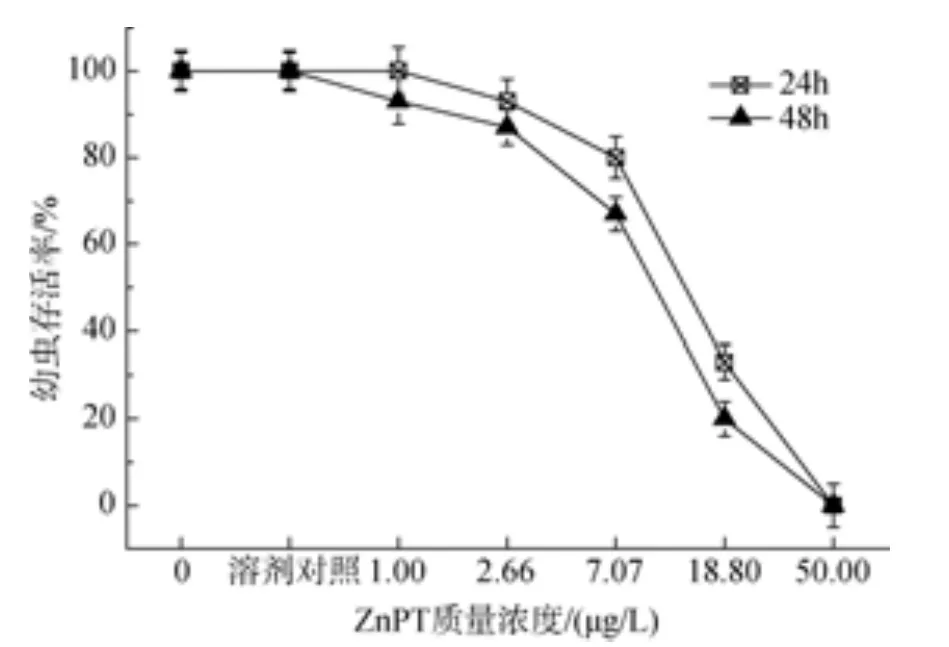
图8 吡啶硫酮锌对华美盘管虫后担轮幼虫的毒性效应Fig. 8 Toxic effect of zinc pyrithione on metatroch of Hydroides elegans
多毛类种类繁多, 分布广泛, 在很多海域的底栖生物群落中约占 30%~80%, 在海洋沉积与水体之间的物质循环和能量转换过程中起着重要作用。此外, 一些多毛类对海洋污染物较敏感, 易在实验室人工培育, 因此被选为生态毒理研究和毒性检测的被检生物[10,20,22]。华美盘管虫的早期生命阶段能对重金属如汞、镉等表现出较高的敏感性[19], 其配子及幼虫在热带和亚热带地区全年都能够获得, 因此在中国南海海洋生态毒理研究方面, 华美盘管虫作为被检生物具有一定优势。
本实验结果表明, 与吡啶硫酮锌相比, 吡啶硫酮铜对华美盘管虫的早期生命阶段普遍表现出更高的毒性。华美盘管虫精子对两种吡啶硫酮类防污剂的毒性的敏感性高于卵子。随着暴露时间的延长, 幼虫对两种毒物的敏感性明显提高。
实验结果还表明华美盘管虫担轮幼虫阶段对吡啶硫酮铜和吡啶硫酮锌毒性作用的敏感性显著(P>0.05)高于后担轮幼虫阶段。可能随着华美盘管虫幼虫发育逐渐成熟, 对吡啶硫酮类防污剂的抗毒或解毒能力也相应提高。
无脊椎动物对吡啶硫酮铜和吡啶硫酮锌毒性的敏感性差异较大, 纹藤壶腺介幼虫 24 h-LC50分别为 11和 29 μg/L, 鬼手海葵96 h-LC50则分别为2000和410 μg/L, 日本虎斑猛水蚤96h-LC50分别为30和170 μg/L[17], 相比较下, 华美盘管虫幼虫的敏感性更高。
吡啶硫酮铜和吡啶硫酮锌对华美盘管虫毒性要高于无机重金属铜(无机铜对担轮幼虫 48 h-LC50为100 μg/L, 而吡啶硫酮铜为 5.00 μg/L)和锌(暴露于无机锌的华美盘管虫精子和卵子的受精 IC50分别为945.31 μg/L和 2025.63 μg/L, 远高于吡啶硫酮锌的36.74 μg/L 和 159.59 μg/L)[17,19]。
研究表明吡啶硫酮铜和吡啶硫酮锌会破坏细菌细胞生物膜和膜两侧的pH梯度, 也能与细胞内的金属离子和蛋白质结合, 从而破坏细胞中ATP的合成,并造成一些金属离子的缺乏[23]。此外, 吡啶硫酮类防污剂会影响无脊椎动物的一些酶体系和相关蛋白表达, 发现暴露于吡啶硫酮铜的多齿维沙蚕(Perinereis nuntia), 在质量浓度为20 mg/L时, 其十六烷酰辅酶A活性在 3 h内急速下降, 之后维持较低水平不变;在质量浓度为32 mg/L时, 二磷酸尿核苷-葡萄糖醛酸转移酶活性在24 h内先急速下降, 之后缓慢降低[24],当吡啶硫酮锌浓度为0.2 μmol/L时即会引起紫贻贝(Mytilus galloprovincialis)鳃部和消化腺热休克蛋白过度表达, 造成基因损伤[25]。相比于这些生物指标,华美盘管虫配子和幼虫对吡啶硫酮铜和吡啶硫酮锌具有更高的敏感性, 而且检测方法经济、简单易行、重复性好, 在海洋生态环境评价和环境监测中具有潜在的应用价值。
可见, 吡啶硫酮铜和吡啶硫酮锌对多种海洋生物具有较明显的毒性作用, 对这两种吡啶硫酮类防污剂的使用量需更加慎重。同时, 吡啶硫酮类防污剂的作用机理以及在食物链中的传递过程都需进一步的研究。
致谢:海南大学分析测试中心。
[1] 王科, 肖玲, 于雪艳, 等. 防污剂对海洋环境的影响探讨[J]. 海洋与重防腐涂料与涂装, 2010, 25(8):24-30.
[2] Konstantinou I, Albanis T. Worldwide occurrence and effects of antifouling paint booster biocides in the aquatic environment: a review [J]. Environment International, 2004, 30(2): 235-248.
[3] 王健. 船舶防污涂料的现状和发展趋势[J]. 中国涂料, 2012, 27(5): 6-10.
[4] Maraldo K, Dahllöf I. Indirect estimation of degradation time for zinc pyrithione and copper pyrithione in seawater [J]. Marine Pollution Bulletin,2004, 48(9): 894-901.
[5] Harino, H. Concentrations of antifouling biocides in sediment and mussel samples collected from Otsuchi Bay, Japan [J]. Archives of environmental contamination and toxicology, 2007, 52(2): 179-188.
[6] Harino H. Concentrations of booster biocides in sediment and clams from Vietnam [J]. Journal of the Marine Biological Association of the United Kingdom,2006, 86(05): 1163-1170.
[7] Chen Z F, Wang H, Qian P Y. Characterization and expression of calmodulin gene during larval settlement and metamorphosis of the polychaeteHydroides elegans[J]. Comp Biochem Physiol B Biochem Mol Biol, 2012, 162(4): 113-119.
[8] Huang Y L. Presence of acyl-homoserine lactone in subtidal biofilm and the implication in larval behavioral response in the polychaeteHydroides elegans[J].Microb Ecol, 2007, 54(2): 384-392.
[9] Shin P K. Hypoxia induces abnormal larval development and affects biofilm-larval interaction in the serpulid polychaeteHydroides elegans[J]. Mar Pollut Bull,2013, 76(1-2): 291-297.
[10] Carpizo-Ituarte, E, Hadfield M G. Stimulation of metamorphosis in the polychaeteHydroides elegansHaswell (Serpulidae) [J]. The Biological Bulletin, 1998,194(1): 14-24.
[11] Unabia C, Hadfield M. Role of bacteria in larval settlement and metamorphosis of the polychaeteHydroides elegans[J]. Marine Biology, 1999, 133(1):55-64.
[12] Nedved B T, Hadfield M G.Hydroides elegans(Annelida: Polychaeta): a model for biofouling research,in Marine and industrial biofouling [J]. Springer, 2009,5: 203-217.
[13] Wisely B. The development and setting of a serpulid worm,Hydroides norvegica Gunnerus(Polychaeta)[J].Marine and Freshwater Research, 1958, 9(3): 351-361.
[14] Chan V B. CO(2)-driven ocean acidification alters and weakens integrity of the calcareous tubes produced by the serpulid tubeworm,Hydroides elegans[J]. PLoS One, 2012, 7(8): 427-438.
[15] Lane A C. Decreased pH does not alter metamorphosis but compromises juvenile calcification of the tube worm[J]. Mar Biol, 2013, 160(8): 1983-1993.
[16] Zhang Y. 2D gel-based multiplexed proteomic analysis during larval development and metamorphosis of the biofouling polychaete tubewormHydroides elegans[J].Journal of proteome research, 2010, 9(9): 4851- 4860.
[17] Bao V W. Acute toxicities of five commonly used antifouling booster biocides to selected subtropical and cosmopolitan marine species [J]. Mar Pollut Bull, 2011,62(5): 1147-1151.
[18] Gopalakrishnan S, Thilagam H, Raja P V. Toxicity of heavy metals on embryogenesis and larvae of the marine sedentary polychaeteHydroides elegans[J].Arch Environ Contam Toxicol, 2007, 52(2): 171-178.
[19] Gopalakrishnan S, Thilagam H, Raja P V. Comparison of heavy metal toxicity in life stages (spermiotoxicity,egg toxicity, embryotoxicity and larval toxicity) ofHydroides elegans[J]. Chemosphere, 2008, 71(3): 515-528.
[20] 周进, 李新正. 中国海多毛纲动物研究现状及展望[J]. 海洋科学, 2011, 6: 82-89.
[21] Gopalakrishnan S, Thilagam H, Raja P V. Toxicity of heavy metals on embryogenesis and larvae of the marine sedentary polychaeteHydroides elegans.Archives of environmental contamination and toxicology,2007, 52(2): 171-178.
[22] 类彦立, 孙瑞平. 黄海多毛环节动物多样性及区系的初步研究[J]. 海洋科学, 2008, 4: 40-51.
[23] Dinning A J, Al-Adham I S I, Eastwood I M, et al.Pyrithione biocides as inhibitors of bacterial ATP synthesis[J]. Journal of Applied Microbiology. 1998, 85: 141-146.
[24] Mochida K. Toxicity and metabolism of copper pyrithione and its degradation product, 2, 2′-dipyridyldisulfide in a marine polychaete [J]. Chemosphere, 2011, 82(3):390-397.
[25] Marcheselli M, Azzoni P, Mauri M. Novel antifouling agent-zinc pyrithione: Stress induction and genotoxicity to the marine musselMytilus galloprovincialis[J].Aquatic Toxicology, 2011, 102(1): 39-47.
