GRP78在蛋白酶体抑制剂诱导卵巢癌细胞凋亡中的作用
2015-12-02隽刘川都伟王
唐 隽刘 川都 伟王 军
1.吉林大学(长春,130021);2.中国医科大学盛京医院;3.沈翔705医院;4.沈阳军区总医院
葡萄糖调节蛋白(GRP)是细胞为了适应内质网应激状态所产生的一类应激蛋白,与热休克蛋白(HSP)有较高同源性[1-2]。研究表明,GRP78在某些肿瘤细胞中高表达,对肿瘤细胞抗传统放化疗治疗具有重要意义[3-5]。蛋白酶体抑制剂是一类新型抗肿瘤制剂,对多种肿瘤具有治疗作用[6-9]。但不同肿瘤细胞对蛋白酶体抑制剂表现出不同敏感性。在前期研究中发现蛋白酶体抑制剂诱导内质网应激,本研究进一步在不同卵巢癌细胞中检测GRP78表达水平,并利用小干扰RNA(siRNA)技术特异性下调GRP78,以探讨GRP78在蛋白酶体抑制剂诱导卵巢癌细胞凋亡中的作用。
1 材料与方法
1.1 人卵巢癌细胞的培养
SKOV3、A2870、CAOV3三种卵巢癌细胞采用DMEM加10%的胎牛血清、100U/mL青霉素和100μg/mL链霉素的培养液,置于37℃的CO2培养箱中培养。2~3d传代1次,选用对数生长期细胞进行实验。
1.2 细胞分组及干预
对3种V细胞系分别设空白对照组和不同蛋白酶体抑制剂处理组。蛋白酶体抑制剂MG132、PSI、EPOX处理浓度为5μmol/L、20nmol/L、10 nmol/L,作用24h。为明确沉默GRP78对MG132抗卵巢癌活性的影响,采用siRNA技术。分别设空白对照、siGRP78组(3种GRP78的特异siRNA组)和随机序列核酸对照siRNA组。
1.3 MTT比色法检测细胞活力
用不同蛋白酶体抑制剂处理细胞24h后,加入0.5mg/ml的MTT继续培养4h,观察蓝紫色沉淀析出;加甲基亚砜(DMSO)后放置于摇床摇15 min,用酶标仪(波长为492nm)检测每孔吸光值(A)来反映细胞活力。
1.4 流式细胞仪检测细胞的凋亡率
收集细胞,以PBS清洗2次,加入膜联蛋白V和碘化丙啶双标记试剂(南京凯基生物科技发展有限公司),按试剂盒说明书对样本进行处理后,通过流式细胞仪检测细胞凋亡,每组至少检测5000个细胞,试验重复3次。
1.5 实时定量(RT)PCR法检测GRP78mRNA
采用Trizol法提取细胞总RNA,参照说明书进行逆转录合成cDNA,利用荧光探针混合物(SYBR Green PCR Master mix)在 ABI 7500RTPCR系统(Biosystems)中进行分析,每个样本重复3次。
1.6 Western Blot法检测GRP78蛋白表达
采用裂解破碎离心提取各组细胞总蛋白,等量蛋白用12%SDS-PAGE电泳分离后,采用电转移法转至硝酸纤维素膜上,以含5%脱脂奶粉的TBST封闭30min后,用小鼠抗人GRP78一抗4℃孵育过夜,辣根过氧化物酶标记的小鼠二抗室温孵育1h,进行ECL化学发光显像。
1.7 统计学方法
数据处理采用SPSS 13.0软件。结果以均值±标准差表示,采用单因素方差分析(one-way ANOVA)及独立样本t检验。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 蛋白酶体抑制剂诱导卵巢癌细胞中GRP78的蛋白和mRNA表达
2.1.1 GRP78的mRNA表达 不同蛋白酶体抑制剂处理SKOV3、A2870、CAOV3细胞,RT-PCR检测结果见图1。与空白对照组比较,蛋白酶体抑制剂 MG132、PSI、EPOX 作用 24h 后,SKOV3、A2870和CAOV3细胞中GRP78mRNA水平均增加,为空白对照组的3~7倍(图1)。3种蛋白酶体抑制剂处理组SKVO3细胞与空白对照组比较的P值分别为0.002、0.008、0.003,差异有统计学意义。3种蛋白酶体抑制剂处理组A2870细胞与空白对照比较的P值分别为0.002、0.004、0.002,差异有统计学意义。3种蛋白酶体抑制剂处理组CAOV3细胞与空白对照比较的P值分别为0.001、0.001、<0.001,差异有统计学意义。

图1 实时定量PCR检测蛋白酶体抑制剂对卵巢癌细胞GRP78mRNA表达的影响
2.1.2 GRP78蛋白的表达 与GRP78的mRNA水平变化一致,蛋白酶体抑制剂作用后,GRP78蛋白水平在SKOV3(图2A)、A2870(图2B)和CAOV3(图2C)细胞系中均显著增高。
2.2 GRP78siRNA(siGRP78)对 GRP78mRNA和蛋白表达的影响
2.2.1 siRNA对GRP78mRNA表达的影响 任意序列对照siRNA及3种不同GRP78特异性siRNA(siGRP78#1、#2、#3)转染细胞24h后,RT-PCR检测结果见图3。与未转染组比较,siGRP78#1和siGRP78#2明显降低GRP78mRNA的表达(P均<0.001);而任意序列对照siRNA和siGRP78#3对GRP78mRNA的表达无明显影响,P值分别为0.110和0.390(图3)。

图2 Western blot解析蛋白酶体抑制剂对SKVO3,A2870,CAOV3细胞GRP78蛋白表达的影响

图3 实时定量PCR解析GRP78siRNA对GRP78mRNA表达的干扰效率
2.2.2 siRNA对GRP78蛋白表达的影响 与mRNA水平变化一致,siGRP78#1和siGRP78#2明显降低GRP78的蛋白表达水平,而任意序列对照siRNA及siGRP78#3对GRP78蛋白表达水平无明显影响(图4)。

图4 Western Blot解析GRP78siRNA对GRP78蛋白表达的干扰效率
2.3 敲低GRP78的表达增加MG1.2 抗卵巢癌活力
MTT检测结果见表1。与未转染组比较,MG132作用后,siGRP78#1和siGRP78#2转染细胞的活力明显降低(P<0.05),而随机序列siRNA及siGRP78#3转染细胞的活力无明显变化(P>0.05)。
表1 各组SKOV3细胞活力变化结果(±s)
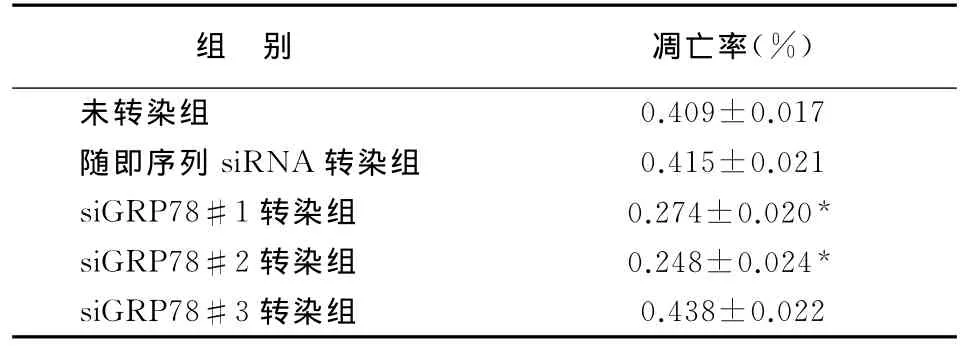
表1 各组SKOV3细胞活力变化结果(±s)
*与空白组比较P<0.05
组 别 凋亡率(%)未转染组 0.409±0.017随即序列siRNA转染组 0.415±0.021 siGRP78#1转染组 0.274±0.020*siGRP78#2转染组 0.248±0.024*siGRP78#3转染组 0.438±0.022
3 讨论
内质网是哺乳动物细胞中蛋白质翻译后修饰、多肽链正确折叠与装配的重要场所。低氧、高血糖、化学毒物等均可导致在内质网腔内未折叠或错误折叠蛋白质的大量蓄积,引起内质网应激和未折叠蛋白应答反应。GRP78的诱导表达是内质网应激和未折叠蛋白应答反应的标志分子,作为一种自我保护性机制维持应激状态下内质网的稳态,有利于细胞存活[10]。研究表明在许多实体肿瘤中GRP78表达增加,在肿瘤细胞发生发展和耐药性产生中发挥重要作用[11-12]。越来越多的证据表明,蛋白酶体抑制剂诱导内质网应激,而内质网应激在蛋白酶体抑制剂抗癌活性中发挥重要作用[13]。内质网应激反应一方面诱导GRP78等分子伴侣的表达,以对抗内质网应激带来的细胞稳态失衡。另一方面,当内质网应激程度严重或持续时间足够长,内质网相关凋亡细胞信号亦被激活[14-16]。本研究发现不同蛋白酶体抑制剂均增加卵巢癌细胞中GRP78的表达,提示在卵巢癌细胞中蛋白酶体抑制剂确实诱导了内质网应激。为了明确GRP78诱导表达在蛋白酶体抑制剂抗卵巢癌活性中是否具有细胞保护作用,本研究利用siRNA封闭了GRP78基因的表达。结果显示,与未转染组比较,2个不同序列的siRNA成功封闭了GRP78基因的表达,重要的是这2个siRNA明显增加了MG132诱导的细胞毒性作用,提示siGRP78在降低GRP78表达的同时,亦相应消弱了应激时GRP78蛋白的细胞保护功能,从而有利于凋亡信号通路的激活。
总之,本研究证实了蛋白酶体抑制剂普遍性诱导卵巢癌细胞内质网应激,并证实了干扰GRP78表达可能增加卵巢癌细胞对蛋白酶体抑制剂的反应性。随着相关研究的深入,相信GRP78小分子抑制剂联合蛋白酶体抑制剂的应用,可能成为卵巢癌治疗的潜在新策略。
[1]Gray PC,Vale W.Cripto/GRP78modulation of the TGF-b pathway in development and oncogenesis[J].FEBS Lett,2012,586(14):1836-1845.
[2]Zhang LH,Zhang X.Roles of GRP78in physiology and cancer[J].J Cell Biochem,2010,110(6):1299-1305.
[3]Cali G,Insabato L,Conza D,et al.GRP78mediates cell growth and invasiveness in endometrial cancer[J].J Cell Physiol,2014,229(10):1417-1426.
[4]Huang LW,Lin CY,Lee CC,et al.Overexpression of GRP78 is associated with malignant transformation in epithelial ovarian tumors[J].Appl Immunohistochem Mol Morphol,2012,20(4):381-385.
[5]Roller C,Maddalo D.The molecular chaperone GRP78/BiP in the development of chemoresistance:mechanism and possible treatment[J].Front Pharmacol,2013,4:10.
[6]Huang Z,Wu Y,Zhou X,et al.Efficacy of therapy with bortezomib in solid tumors:a review based on 32clinical trials[J].Future Oncol,2014,10(10):1795-1807.
[7]Johnson DE.The ubiquitin-proteasome system:opportunities for therapeutic intervention in solid tumors[J].Endocr Relat Cancer,2015,22(1):T1-17.
[8]Shen M,Schmitt S,Buac D,et al.Targeting the ubiquitinproteasome system for cancer therapy[J].Expert Opin Ther Targets,2013,17(9):1091-1108.
[9]Bassermann F,Eichner R,Pagano M.The ubiquitin proteasome system-implications for cell cycle control and the targeted treatment of cancer[J].Biochim Biophys Acta,2014,1843(1):150-162.
[10]Luo B,Lee AS.The critical roles of endoplasmic reticulum chaperones and unfolded protein response in tumorigenesis and anticancer therapies[J].Oncogene,2013,32(7):805-818.
[11]Delie F,Petignat P,Cohen M.GRP78protein expression in ovarian cancer patients and perspectives for a drug-targeting approach[J].J Oncol,2012,468-615.
[12]Li Z,Li Z.Glucose regulated protein 78:a critical link between tumor microenvironment and cancer hallmarks[J].Biochim Biophys Acta,2012,1826(1):13-22.
[13]Schmidt M,Finley D.Regulation of proteasome activity in health and disease[J].Biochim Biophys Acta,2014,1843(1):13-25.
[14]Yadav RK,Chae SW,Kim HR,et al.Endoplasmic reticulum stress and cancer[J].J Cancer Prev,2014,19(2):75-88.
[15]Nagelkerke A,Bussink J,Sweep FC,et al.The unfolded protein response as a target for cancer therapy[J].Biochim Biophys Acta,2014,1846(2):277-284.
[16]Chambers JE,Marciniak SJ.Cellular mechanisms of endoplasmic reticulum stress signaling in health and disease[J].Am J Physiol Cell Physiol,2014,307(8):C657-C670.
