利用PDMS微孔阵列微型反应器设计hADSCs空间堆叠模型
2015-11-28何懿栾杰
何 懿 栾 杰
利用PDMS微孔阵列微型反应器设计hADSCs空间堆叠模型
何 懿 栾 杰
目的利用微尺度技术(Micro-scale technologies)建立人脂肪干细胞(hADSCs)体外三维培养平台,观察空间堆叠状态对种植后的hADSCs增殖和凋亡的影响。方法利用光刻技术在硅晶元表面生成直径60 μm、80 μm、100 μm和150 μm的微柱状结构,经聚二甲基硅氧烷(PDMS)倒模、固化生成同规格的微孔阵列(Micro-well arrays),加装PDMS环形外壁后组成微型反应器,测量、分析此实验平台的加工误差率;第3代hADSCs配制成1×105cells/mL、6×104cells/mL、3×104cells/mL三种浓度单细胞悬液,并各取200 μL分别接种于纯平PDMS微型反应器及直径60 μm、80 μm、100 μm和150 μm微孔微型反应器内,选择种植后24 h、72 h、120 h和168 h为采样点,对各观察组细胞分布状况进行形态学描述、细胞计数及活/死细胞检测。结果各孔径PDMS微孔阵列的微孔口径精度误差率均不超过0.2%;档hADSCs以6×104cells/mL浓度接种时,细胞基本可以实现在150 μm微孔内呈单层平铺、100 μm微孔内呈2层堆叠、80 μm微孔内呈3层堆叠;各微孔内细胞数在7 d内均无明显的数量变化,60 μm组微孔内细胞数最少且微孔外平面残留细胞最多(P<0.05);60 μm组微孔内凋亡细胞比例高于其他组(P<0.05)。结论微加工倒模制作的PDMS微孔阵列培养平台误差率低,可满足高精度设计需要;hADSCs短时间(7 d)接种于微孔内处于增殖静止状态,能够保持三维堆叠状态稳定,便于进行堆叠状态下的细胞学早期研究;hADSCs在不同口径微孔内可以实现不同的堆叠层数,其凋亡比率与堆叠层数有关,堆叠层数少的细胞凋亡比例低于堆叠层数多者。
微孔阵列微尺度技术聚二甲基硅氧烷人脂肪干细胞
将种子细胞种植于多孔支架,是组织工程体外构建的主要方法。近年来,物理因素(包括表面结构、空间结构、硬度刚性及表面剪切力等)对干细胞的行为、转归及分化的影响受到众多关注[1-3]。而细胞培养方法的研究也不断深入:①平面培养不仅与在体及种植培养差异甚大,并且为细胞增殖提供了近乎无限的空间,有增加成瘤、变异的风险;②种子细胞接种支架后,对细胞的直接观察只能停留在支架表面,而内部观察则需借助组织切片,无法即刻、直观的观察;③人工合成支架内部孔隙率均一度不断提高,需在种植前对细胞接种密度、搭配孔隙进行更为细致的衡量。因此,迫切需要一种既能提供精密三维空间立体结构,并可进行直观、实时分析的实验平台。
微晶片加工技术的发展使加工精度日益提高。进入本世纪后,光刻技术可达到的精度更是进入纳米水平[4]。微加工技术制作的芯片,利用简单的印模方法,将精密结构翻印至软性材料表面,通过该技术可对细胞外环境进行高精度设计,包括空间、流体、液相交互等[5],制作精细的细胞培养平台[6],可以不受影响地观察干细胞的生物学特征[7-8]。
前期实验中我们参照文献经验[9],在生物惰性材料聚二甲基硅氧烷(PDMS)表面制作大量排列整齐的等深微米级微孔,证实此微孔阵列对于细胞体外培养是安全的,并发现大鼠脂肪干细胞(rADSCs)接种于这一平台上后,细胞数量在短时间内(4 d)处于增殖静止状态[10]。在此基础上,我们根据人脂肪干细胞(hADSCs)胞体直径[11]制作符合其种植条件的多组不同直径的微孔阵列微型反应器,配合一定的接种密度,以期实现hADSCs模拟接种早期支架孔隙内干细胞的不同空间排列状态(平铺、堆叠)。
1 材料及方法
1.1 实验材料及试剂
hADSCs(Cyagen,美国;HUXMD-01001)。
聚二甲基硅氧烷(PDMS)(Dow Corning,美国),脱模剂原液(奇威化工),hADSCs完全培养基(Cyagen,美国;HUXMD-90011)。
1.2 实验步骤
1.2.1 光刻掩膜加工及光刻
设计硅晶圆,相邻微孔中心点横、纵向间距为200 μm,呈垂直排列,单位面积(1 cm×1 cm)内共有48×48个微孔,合计2 304个微柱,刻蚀深度为50 μm。空白方框为无结构纯平面,为对照组,面积1 cm×1 cm(图1)。
1.2.2 PDMS微孔阵列微型反应器的加工
①硅晶圆表面处理:将经过清洗的硅晶圆浸于1∶100脱模剂稀释液中,取出后图形面向上置于80℃鼓风烘箱内烘干,使硅晶圆表面黏附一薄层脱模剂。
②混胶及初脱泡:取硅胶预聚物的前驱物A剂(基本组分)倒入玻璃器皿中,并按10∶1质量比加入B剂(固化剂),用玻璃棒缓慢、充分搅拌,使A、B剂充分混匀。将PDMS放入负压罐中(0.8 Kg/cm2)30 min,去除气泡。
③底板浇筑及再脱泡:将PDMS(约15 g)倾倒于硅晶圆表面,水平放入负压罐中(0.8 Kg/cm2)30 min,去除胶体与硅晶圆模板微柱间残留的气泡。
④外壁浇筑:将经初脱泡的PDMS浇筑于清洁纯平培养皿内,厚度约2 mm。
⑤固化:将硅晶圆及培养皿水平置入100℃烤箱加温1 h。
⑥起膜及切割:从边缘处轻柔、缓慢掀起固化的PDMS膜,得到具有精细图形的弹性PDMS膜。在超净台上用手术刀沿PDMS板微孔区域间的分割线切割,获微型反应器底板组件,大小约1.2 cm×1.2 cm(图2 A)。再将纯平培养皿内固化的厚PDMS膜切割成大小约1.2 cm×1.2 cm的正方形,在其内切割大小约1 cm×1 cm正方形空槽,为微型反应器外壁组件(图2 B)。
⑦清洗:将底板及外壁组件依次放入95%乙醇、75%乙醇、脱离子水进行超声清洗各3次,每次10 min。
⑧组装:待组件彻底阴干后,在超净台上将底板组件微孔结构面向上与外壁组件套合,以外壁组件的内侧壁刚好不覆盖微孔结构为度。将组装好的微型反应器置入100℃烤箱加温1 h,使两组件彻底黏结(图2 C)。
⑨消毒及分装:微型反应器放入玻璃培养皿中高温高压灭菌(121℃~125℃,0.1~0.15 MPa,30 min)。依据实验分组,在生物安全柜内将灭菌后的微型反应器分装于直径10 cm的培养皿内,每个培养皿内有60 μm板、80 μm板、100 μm板和150 μm板各4个,空白板2个,每皿共18个微型反应器。
⑩PDMS表面预处理:PDMS具有较强蛋白吸附能力,为满足细胞种植需要,需使用含蛋白培养基进行表面预处理。取含10%FBS的hADSCs完全培养基200 μL,注入PDMS微型反应器培养区内,放入负压罐内保持0.8 Kg/cm2负压抽吸约10 min,使微孔内的气体完全被培养基替代,加盖密封后置入37℃孵箱不少于72 h。
1.2.3 细胞种植
①细胞准备:将hADSCs复苏后进行培养,待细胞覆盖率达到70%~80%时进行传代。
②细胞种植:第3代hADSCs制成1×105cells/mL、6×104cells/mL、3×104cells/mL三种浓度的单细胞悬液,为高、中、低密度种植组。各取200 μL单细胞悬液(约含细胞5×103、1.2×104和2×104个)滴注于微型反应器培养区内。将培养皿置于恒温水平摇床内,在37℃下以30 r/mim晃动30 min,使细胞自然沉降分布均匀,随后置入37℃的CO2培养箱中。
1.2.4 样本采集
设置接种后24 h、72 h、120 h和168 h为采样时间点,从培养皿内取微孔阵列微型反应器,每种直径各2个、无结构微型反应器1个,分4次完成。
1.2.5 扫描电镜观察
取未经表面处理及细胞种植的微孔板喷金后进行扫描电镜观察,在高倍(1 600×)视野下垂直于微孔板拍照,并对60 μm、80 μm、100 μm和150 μm微孔板表面微孔直径进行测量,每种孔径测量50个微孔,计算误差率。
1.2.6 荧光染色及激光扫描共聚焦纤维镜观察
①细胞分布、堆叠状态及微孔内/外细胞计数:在每个采样点对无结构组及60 μm、80 μm、100 μm和150 μm微孔组进行FITC-Phalloidin+DAPI荧光染色,扫描平面为微孔外表面细胞层及微孔内细胞密集层,在低倍镜(10×)下对20个独立视野(共320个微孔)进行拍照、观察。结合细胞胞浆分布(FITC)和细胞计数(DAPI)确定微孔内细胞分布、数量及微孔外细胞数量,并绘制柱状图。
②细胞凋亡比率:在每个采样点对60 μm、80 μm、100 μm和150 μm微孔组进行AnnexinⅤ-FITC+ PI荧光染色,设置扫描平面为微孔内细胞最密集层次,在低倍镜(10×)下对20个独立视野(共320个微孔)进行拍照、观察。确定凋亡早期细胞(绿色)及死亡细胞(绿色及红色)数量,根据该组微孔内细胞平均数计算细胞凋亡比率,并绘制柱状图。
1.3 统计学分析
微孔直径测量值以x±s的形式记录,并计算误差率。对微孔内细胞数、活/死细胞比率进行组间及整体均数比较,采用单因素方差分析(q检验,Newman-Keuls法)。使用SPSS 11.0软件对实验结果进行分析,P<0.05认为差异具有统计学意义。
2 结果
2.1 扫描电镜观察结果
根据4种孔径微孔各50个微孔测量结果分析,各孔径微孔误差率均低于0.2%(图3)。
2.2 激光扫描共聚焦显微镜观察结果
2.2.1 微孔内细胞计数
①高密度种植组:微孔内细胞数量无显著性变动;60 μm微孔内细胞数最少(P<0.05);150 μm孔径内细胞数为最多,并以种植后72 h最明显(P<0.05)(图4A及图6A)。
②中密度种植组:微孔内细胞数量无明显变化;60 μm微孔内细胞数显著少于其他组(P<0.05);80 μm、100 μm与150 μm微孔细胞数无显著差异(P>0.05)(图4B及图7A)。
③低密度种植组:细胞数量基本稳定,存在空置微孔;60 μm微孔内细胞数最少(P<0.05);80 μm组细胞数在种植后72 h与100 μm、150 μm组存在显著性差异(P<0.05),其他采样点三种孔径间无显著性差异(P>0.05)(图4C及图8A)。
2.2.2 微孔外表面细胞计数
①高密度种植组:微孔外表面细胞数60 μm组最多,150 μm组最少(P<0.05);微孔外细胞数随培养时间延长不断增多,以60μm组增速最快(P<0.05)(图5A及图6A)。
②中密度种植组:微孔外表面细胞数60 μm组最多,150 μm组最少(P<0.05);微孔外细胞数随培养时间延长不断增多;除60 μm组外其他各组在全部采样点细胞数均未超过1(图5B及图7A)。
③低密度种植组:微孔外表面细胞数60 μm组最多,150 μm组最少(P<0.05);微孔外细胞数随培养时间延长不断增多;除60 μm组外其他各组在全部采样点细胞数均未超过0.5(图5C及图8A)。
2.2.3 微孔内细胞堆叠状态
①高密度种植组:60 μm组以1~2个细胞单层平铺为主;80 μm组呈堆叠排布,多为3~4层(3层占33.6%,4层占34.9%);100 μm组呈堆叠排布,多为2~3层(2层占36.5%,3层占23.6%);150 μm组呈堆叠排布,多为1~2层(1层占65.3%,2层占34.7 %)(图6)。
②中密度种植组:60 μm组几乎均为单个细胞单层平铺(88.3%);80 μm组:呈堆叠排布,多为3层(72.5%);100 μm组呈堆叠排布,多为2层(65.3%);150 μm组中绝大多数呈单层平铺填满微孔底面(95.6%)(图7)。
③低密度种植组:60 μm组的微孔内仅有单个细胞,有较多空置微孔;80 μm组中多数细胞平铺分布(92.1%),有空置微孔;100 μm组呈单层平铺状,胞体不能填满微孔底面,有空置微孔;150 μm组呈单层平铺状,胞体不能填满微孔底面,有空置微孔(图8)。
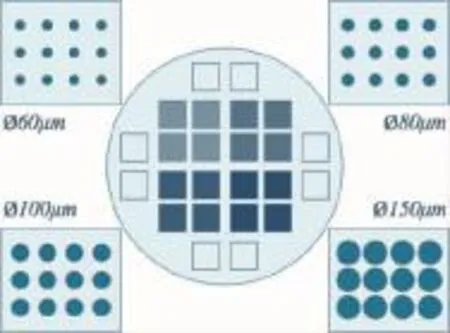
图1 硅晶圆设计模板Fig.1Design template of silicon master

图2 微型反应器Fig.2Micro-reactor
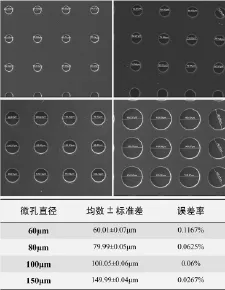
图3 微孔测量结果(扫描电镜,1 600×)及误差率Fig.3Measuring results(scanning electron microscope,1 600×)and error rate of microwells
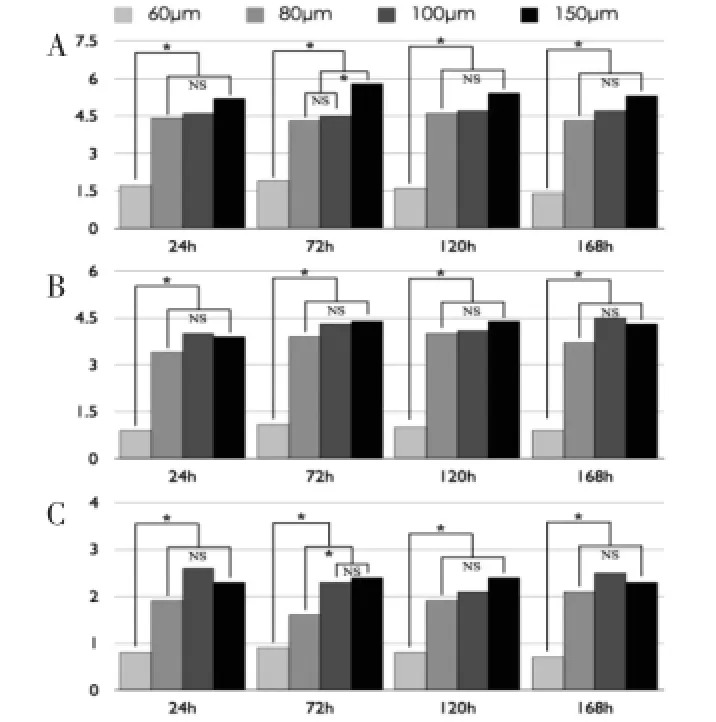
图4 高(A)、中(B)、低(C)密度组微孔内细胞计数Fig.4The average counting number of hADSCs within microwells under higher(A),medium(B)and lower(C)density of single cell suspension mixture
2.2.4 微孔内凋亡细胞比率
①高密度种植组:60 μm孔径内凋亡细胞比例最高(P<0.05)且随培养时间延长而增加;150 μm孔径内凋亡细胞比例最低,但与80 μm、100 μm及150 μm组无显著性差异(P>0.05)(图9A)。
②中密度种植组:除24 h以外,其他取样点中60 μm孔径内凋亡细胞比例均高于其他组(P<0.05),并随培养时间延长而增加;150 μm孔径内细胞凋亡比率在种植后168 h显著低于80 μm、100 μm组(P<0.05),其余采样点80 μm、100 μm及150 μm组凋亡细胞比例无显著性差异(P>0.05)(图9B)。
③低密度种植组:60 μm孔径内凋亡细胞比例最高(P<0.05),且随培养时间延长而增加;150 μm孔径内凋亡细胞比率最低,但与80 μm、100 μm无显著性差异(P>0.05)(图9C)。

图5 高(A)、中(B)、低(C)密度组微孔外细胞计数Fig.5The average counting number of hADSCs out of microwells under higher(A),medium(B)and lower(C)density of single cell suspension mixture

图6 高密度组微孔内外细胞荧光染色(A)及微孔内细胞堆叠层数统计(B)Fig.6The fluorescent staining of hADSCs within and out-of microwells (A)and the counting of stacking layer within microwells(B)under higher density of single cell suspension mixture
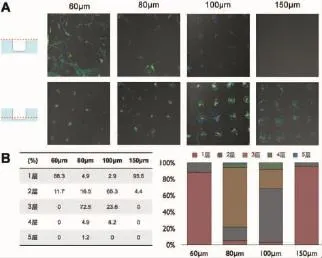
图7 中密度组微孔内外细胞荧光染色(A)及微孔内细胞堆叠层数统计(B)Fig.7The fluorescent staining of hADSCs within and out-of microwells(A)and the counting of stacking layer within microwells(B)under medium density of single cell suspension mixture
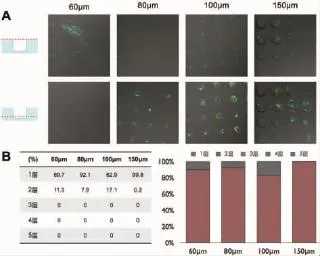
图8 低密度组微孔内外细胞荧光染色(A)及微孔内细胞堆叠层数统计(B)Fig.8The fluorescent staining of hADSCs within and out-of microwells(A)and the counting of stacking layer within microwells(B)under lower density of single cell suspension mixture
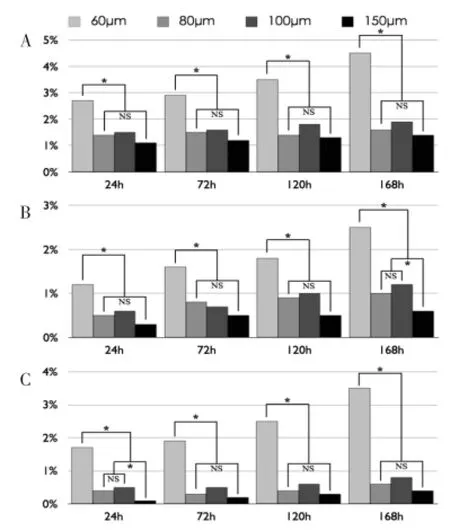
图9 高(A)、中(B)、低(C)密度组微孔内细胞凋亡比例Fig.9The ratio of apoptosis hADSCs within microwells under higher (A),medium(B) and lower(C)density of single cell suspension mixture
3 讨论
3.1 PDMS微型反应器构建的必要性
传统的PDMS微孔阵列大多选择将PDMS膜固定于培养皿底部[12],细胞培养所用培养基也大多在此处与细胞产生接触,并通过弥散方式使营养成分、代谢产物获得更替。虽然简便易行,但种植于其表面的细胞代谢产物会因为相对偏多的培养液用量而稀释,必然使细胞外液中的成分检测陷入困境。
我们所设计的微型反应器是在微孔阵列的基础上,利用浇筑的厚PDMS膜将微孔反应区围筑起来。不仅保证了不同结构微孔阵列反应区的分隔,还可以使细胞种植范围更加固定,不仅降低了细胞所接触的培养液量,使细胞培养所需的成本降低,更重要的是尽可能地将培养液消耗、细胞代谢产物集中,降低因培养空间过大而稀释的外分泌标记物浓度。
3.2 hADSCs细胞选择
微孔阵列实验平台中的种子细胞用量,远小于传统体外细胞培养[13],对细胞的纯度要求较高。传统ADSC的抽提如想获得纯度高的细胞群,大多需要较高的实验技术辅助进行筛选,要求较高。
本实验所选用的hADSCs由Cyagen公司经专业化体外分离、培养后,获得高纯度符合hADSCs表型特征的细胞群。其细胞群单一性超过95%,避免了在微量细胞使用时,细胞混杂因素影响主群细胞行为,基本保证了细胞实验过程的可比性。
实验设计之初,我们也计划在实验终点对细胞表型进行流式细胞学检测,但受制于过多的分组,如果要收集满足流式细胞检测的细胞量,必然需要预先准备大量的细胞进行体外培养。对于这一检测,我们会在未来的实验中进行完善。
3.3 微孔种植对hADSCs的影响
3.3.1 数量
根据实验可知,进入微孔内的细胞并未随培养时间的延长出现数量的增减,这种停滞状态可能与局部代谢减低有关[14]。这种数量的稳定可使我们获得稳定的细胞三维空间堆叠状态[13],在前期的预实验中,微孔内的细胞数量在种植后14 d开始减少,提示此停滞状态仅限种植后早期,故这一平台更适合于在短时间内进行细胞非增殖类型实验。
3.3.2 堆叠
从实验结果可知,种子细胞会依据所给予的空间结构实现立体排列。以相同的细胞种植量,在较小的空间内会实现较多层的堆叠,在较大的空间内会实现较少层的堆叠,甚至是平铺生长。影响微孔内干细胞生发的因素包括:临近的干细胞或成熟细胞、细胞外基质、生长因子及细胞骨架等[15],干细胞会根据空间结构调整自身细胞骨架,以满足形态上的低耗能[16],进而实现细胞行为上的差异。
3.3.3 凋亡
根据实验可知,除60 μm组外其余直径微孔内细胞凋亡比率与平面培养物差异显著。60 μm组微孔内细胞数量最少,但单位细胞量的凋亡比例却是最高的;150 μm微孔内的细胞凋亡比例略低于80 μm和100 μm组。提示较大微孔开口带来了更大的营养、代谢物交换口径,与细胞存活能力有关[17]。当然不能排除由于多细胞层叠造成底层细胞营养缺乏、代谢物堆积。如果未来可以对微孔支架通透能力进行改善,细胞的代谢状态可能会有显著改观。
3.4 细胞种植密度及微孔选择
每块微孔板上共有2 304个微孔,悬浮hADSCs的直径约为7~12 μm[11],如要细胞在不同直径微孔内实现平铺、堆叠状态,以使用200 μL悬液为容量极值,细胞悬液浓度应在(5~7)×104cells/mL的范围。为保证种植浓度的客观性,将理论浓度的0.5~2倍设计于实验中,即3×104cells/mL、6×104cells/mL、1×105cells/mL三种浓度配制单细胞悬液,每200 μL悬液中约含细胞5×103、1.2×104和2×104个。
实验结果示,高密度种植组虽可实现细胞在微孔内的堆叠状态,但会造成微孔外剩余细胞数量过多,影响反应平台均一性;而低密度种植组会造成空置微孔增多,无法实现细胞堆叠状态;中密度种植组可在保证微孔外表面细胞残留尽量少的前提下,满足不同直径微孔内hADSCs实现不同空间排列状态,即在150 μm微孔内呈单层平铺、100 μm微孔内呈1~2层堆叠、80 μm微孔内呈2~3层堆叠。
同时,60 μm组在3种浓度下都有最少的微孔内细胞量及最高的微孔外细胞残留,这与实验设计相去甚远,实验结果是由平铺生长与微孔立体生长两种状态构成,必然造成较大的误差。
综上所述,高密度和低密度种植组由于微孔外细胞残留、微孔内细胞堆叠、空置微孔等原因,并不适合描述微孔空间对细胞簇生发的影响。60 μm微孔由于不能满足实现细胞空间堆叠需要,不适合用作hADSCs三维空间实验平台。
4 结论
微加工倒模制作的PDMS微孔阵列培养平台误差率低,满足高精度设计需要。hADSCs短时间(7 d)接种于微孔内处于增殖静止状态,能够保持三维堆叠状态稳定,便于进行堆叠状态下的细胞学早期研究;hADSCs在不同口径微孔内可以实现不同的堆叠层数,其凋亡比率与堆叠层数有关,堆叠层数少的细胞凋亡比例低于堆叠层数多者。
[1]Yim EK,Sheetz MP.Force-dependent cell signaling in stem cell differentiation[J].Stem Cell Res Ther,2012,3(5):41.
[2]Smalley KS,Lioni M,Herlyn M.Life isn't flat:taking cancer biology to the next dimension[J].In Vitro Cell Dev Biol Anim, 2006,42(8-9):242-247.
[3]Aberle DR,Berg CD,Black WC,et al.The National Lung Screening Trial:overview and study design[J].Radiology,2011,258(1):243-253.
[4]Blackwell PJ,Hill PG,Holmes GK.Autoantibodies to human tissue transglutaminase:superior predictors of coeliac disease[J].Scand J Gastroenterol,2002,37(11):1282-1285.
[5]Choi YY,Chuang BG,Lee DH,et al.Controlled-size embryoid body formation in concave microwell arrays[J].Biomaterials,2010, 31(15):4296-4303.
[6]Nava MM,Raimondi MT,Pietrabissa R.Controlling self-renewal and differentiation of stem cells via mechanical cues[J].J Biomed Biotechnol,2012,2012:797410.
[7]Poellmann MJ,Barton KL,Mishra S,et al.Patterned hydrogel substrates for cell culture with electrohydrodynamic jet printing [J].Macromol Biosci,2011,11(9):1164-1168.
[8]Nakazawa K,Yoshiura Y,Koga H,et al.Characterization of mouse embryoid bodies cultured on microwell chips with different well sizes[J].J Biosci Bioeng,2013,116(5):628-633.
[9]Charnley M,Textor M,Khademhosseini A,et al.Integration column: microwell arrays for mammalian cell culture[J].Integr Biol(Camb), 2009,1(11-12):625-634.
[10]何懿,栾杰.PDMS微孔阵列细胞培养实验平台的初步构建与评测[J].组织工程与重建外科,2011,7(3):121-128.
[11]Ogawa R,Mizuno H,Watanabe A,et al.Osteogenic and chondrogenic differentiation by adipose-derived stem cells har vested from GFP transgenic mice[J].Biochem Biophys Res Commun,2004,313(4):871-877.
[12]王亮,陈红,宋巍,等.有机硅弹性表面生物相容性的研究进展[J].高分子通报,2007(10):21-25.
[13]Walker GM,Zeringue HC,Beebe DJ.Microenvironment design considerations for cellular scale studies[J].Lab Chip,2004,4(2): 91-97.
[14]Lee KB,Kim DJ,Lee ZW,et al.Pattern generation of biological ligands on a biodegradable poly(glycolic acid)film[J].Langmuir, 2004,20(7):2531-2535.
[15]Chang JY,Wang C,Liu J,et al.Fibroblast growth factor signaling is essential for self-renewal of dental epithelial stem cells[J].J Biol Chem,2013,288(40):28952-28961.
[16]van Kooten TG,Whitesides JF,von Recum A.Influence of silicone (PDMS)surface texture on human skin fibroblast proliferation as determined by cell cycle analysis[J].J Biomed Mater Res,1998, 43(1):1-14.
[17]Lin CC,Co CC,Ho CC.Micropatterning proteins and cells on polylactic acid and poly(lactide-co-glycolide)[J].Biomaterials, 2005,26(17):3655-3662.
The Designing of hADSCs Stacking Model by Utilizing PDMS Microwell Micro-reactor
HE Yi,LUAN Jie.
Department of Plastic and Reconstructive Surgery of the Breast,Plastic Surgery Hospital of CAMS,Beijing 100144,China. Corresponding author:LUAN Jie(E-mail:doctorluan@hotmail.com).
ObjectiveTo establish a three-dimensional cultivation platform for human adipose derived stem cells (hADSCs)by utilizing micro-scale technology,and to explore the influence of three-dimensional stacking condition to cell proliferation and apoptosis.MethodsMicro-columnar structure were generated by micro-scale technology on silicon master with diameter of 60 μm,80 μm,100 μm and 150 μm respectively.The same specification micro-well arrays were acquired by reversing mould aperture using polydimethylsiloxane(PDMS),which equipped with PDMS ring on the outer wall to constitute micro-reactor.The error rate of this platform was analyzed.Then the third generation of human adipose-derived stem cells(hADSCs)were selected and mixed into single cell suspension mixture with three kinds of concentration,including 3×104cells/mL,6×104cells/mL and 1×105cells/mL.And 200 μL cell suspension was injected into micro-reactor to establish three-dimensional culture models with different stacked layers.Then 24 hours,72 hours,120 hours and 168 hours were choosed as sample collection time point.The morphology description of cell distribution in each group was analyzed with scanning electron microscopy,the arrangement inside the microwells and the cell distribution outside the microwells were described,and the live/dead cells were counted and tested in each aperture and micro hole by using laser scanning confocal microscope.ResultsThe error rate of diameter and pore diameter were no more than 0.2%.When hADSCs were planted by the density of 6×104cells/mL,the stacking layer condition can be acquired.The number of cell within microwells was at static condition no more than 7 days.The 60 μm group had the highest number of out-of-well cell(P<0.05)and lowestnumber of inside-of-well(P<0.05).The highest apoptosis ratio was also observed in the 60 μm group(P<0.05).Conclusion The application of microscale technique can acquire extremely low error rate,which can satisfy the requirements of high precision design.The static proliferation condition of planted hADSCs can be maintained within microwells,which can stabilize the condition of cells and be designed as a perfect three dimention model for cell research at early stage of plant. The stackable condition of hADSCs can be acquired by planting into microwells with different diameters,which can significant affect the rate of apoptosis under this three dimentional cultivate condition.Thinner layer of stack may reduce the rate of apoptosis.
Micro-well arrays;Micro-scale technology;Polydimethylsiloxane;Human adipose tissue derived stem cells
Q813.1+1
A
1673-0364(2015)04-0239-07
10.3969/j.issn.1673-0364.2015.04.005
2015年4月9日;
2015年6月18日)
100144北京市中国医学科学院整形外科医院乳房整形及再造中心。
栾杰(E-mail:doctorluan@hotmail.com)。
