上皮源性卵巢癌中4种miRNAs的表达及其临床意义
2015-11-18刘佳宇赵妍蕊张丽娜闫晔郑红
刘佳宇,赵妍蕊,张丽娜,3,闫晔,郑红△
临床研究
上皮源性卵巢癌中4种miRNAs的表达及其临床意义
刘佳宇1,2,赵妍蕊1,张丽娜1,3,闫晔4,郑红1△
目的分析上皮源性卵巢癌(EOC)组织中miR-200a、miR-141、miR-205和miR-34a的表达及其临床意义。方法44例EOC患者按FIGO分期分为FIGOⅠ~Ⅱ(FIGO早期组)组15例和FIGOⅢ~Ⅳ(FIGO晚期组)组29例,用实时荧光定量PCR定量比较2组4种miRNAs的表达差异并考察4种miRNAs表达间的关联。以各组miRNAs表达的中位数将EOC患者分为miRNA高表达组和低表达组,比较2组患者间的生存差异。按年龄、FIGO分期、术后是否有残余瘤及术后化疗情况分组,进行Kaplan-Meier生存分析和Cox多因素分析。结果FIGO晚期组miR-141的表达高于早期组(P=0.036)。miR-141的表达与miR-200a、miR-205呈正相关,与miR-34a呈负相关(均P<0.05);miR-200a与miR-205的表达呈正相关(P<0.05)。生存分析显示,miR-200a的表达低,卵巢癌患者无进展生存期短(P=0.035),FIGO早期组生存率高于FIGO晚期组(P<0.05)。miR-200a的表达水平、FIGO分期以及年龄与卵巢癌患者总生存期和无进展生存期有关,miR-141、miR-205和miR-34a的表达水平、术后残余瘤以及化疗与患者生存无关。结论miR-200a的表达与卵巢癌患者预后有关,可能是卵巢癌患者预后预测的独立影响指标。
微RNAs;卵巢肿瘤;上皮-间质转化;上皮源性;miR-200a;miR-141;miR-205;miR-34a
上皮源性卵巢癌(EOC)发病率在女性生殖系统恶性肿瘤中仅次于子宫癌,但其致死率位居妇科肿瘤之首[1]。卵巢位于盆腔深部,不易扪及,缺乏典型的早期临床症状和有效的诊断方法,发现EOC时已多处于肿瘤晚期并发生了腹腔或远处转移。EOC预后不良者较多,进展期患者的5年生存率甚至不到30%[2]。2010年,EOC位于中国城市女性恶性肿瘤发病率第9位,致死率却是妇科肿瘤第1位[3]。因此,EOC发生发展中进行分子标志物的研究对EOC的防治有重要意义。上皮-间质转化(EMT)是上皮源性肿瘤发生发展过程中的一个重要事件[4],是一个有序的基因表达调控过程,多种转录因子和转录后调控因子如microRNAs(miRNAs或miRs)参与其中[5]。笔者前期研究显示,有9种miRNAs在EOC患者血浆中表达高于健康对照组,其中包含miR-205、miR-141、miR-200a、miR-34a 4种与EMT相关的miRNAs[6]。本研究旨在探讨这4种miRNAs在EOC组织中的表达情况,并分析其与患者临床病理特征和预后的关系。
1 资料与方法
1.1 一般资料选取2007年2月—2010年7月于天津市肿瘤医院行手术治疗的44例EOS组织样本,患者平均年龄(57.48±11.77)岁。组织学类型:浆液性癌20(45.5%)例、子宫内膜样癌12(37.3%)例、黏液性5(11.4%)例、透明细胞癌3(6.8%)例及其他病理类型上皮源性癌4(9.0%)例。国际妇产科联盟(FIGO)的分期标准:Ⅰ期5例、Ⅱ期10例、Ⅲ期25例、Ⅳ期4例。所有患者术前均未接受过放、化疗,术后均经病理明确诊断。本研究经天津医科大学伦理委员会认可。
1.2 主要仪器与试剂总RNA提取试剂Trizol、miRNAs特异性逆转录引物、逆转录试剂盒、miRNAs特异性TaqMan MGB探针引物及TaqMan PCR Master Mix(No UDG)均购自美国应用生物系统公司。4种miRNAs及其内参照的名称及检测序列信息,见表1。
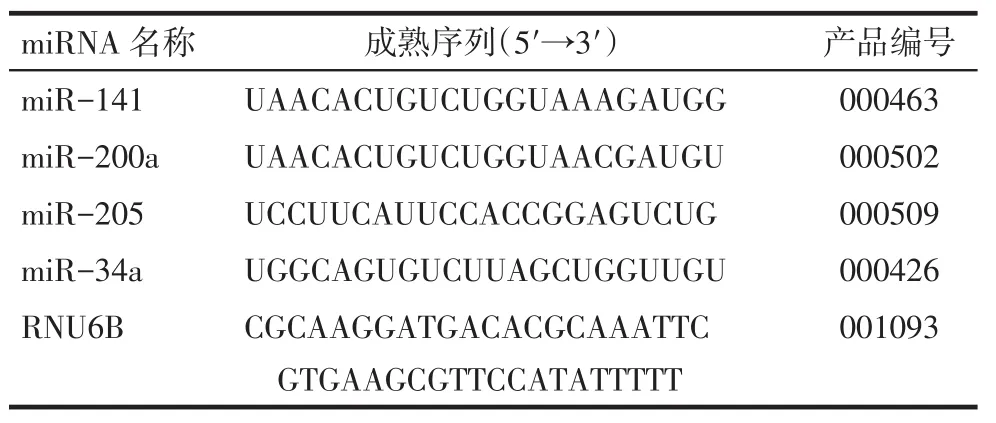
Tab.1 The sequence and assay ID of 4 miRNAs and RNU6B表1 4种miRNAs及其内参照的序列及特异性引物探针产品编号
1.3 方法(1)提取组织总RNA。取冻存的EOC组织样本50 mg在液氮中研磨至粉末状,加1 mL Trizol并按说明书提取总RNA,NanoDrop 2000c(Thermo公司)微量紫外分光光度计检测RNA浓度和纯度,1%琼脂糖凝胶电泳鉴定RNA完整性,稀释至50 mg/L,-80℃保存。(2)cDNA合成。依据试剂盒说明书,采用miRNA茎环结构(stem-loop)特异性逆转录引物和miRNA逆转录试剂盒进行,总反应体系为15 μL,逆转录反应条件:16℃30 min,42℃30 min,85℃5 min。cDNA样本置于-20℃保存。(3)实时荧光定量PCR。每个PCR反应体系为15 μL,每个样本设3个复孔重复检测,用ABI Prism7900HT荧光定量PCR仪进行TaqMan荧光定量检测。反应条件:95℃变性10 min;95℃15 s,60℃60 s;40个循环。以RNU6B作为内参照,以lg2-△△Ct表示miRNA的相对表达量,Ct值为循环阈值,以内参照RNU6B循环阈值进行标准化,△Ct=(CtmiRNA-CtRNU6B),△△Ct=△Ct-△Ctmean。
1.4 观察指标将44例EOC患者按FIGO分期分为FIGOⅠ~Ⅱ(FIGO早期组)组15例和FIGOⅢ~Ⅳ(FIGO晚期组)组29例,比较2组4种miRNAs的表达差异。对44例EOC患者进行定期随访,截止时间为2012年12月,其中2例失访,随访率95.45%。随访时间5~49个月,中位时间26个月,20例出现复发转移,15例在随访期发生肿瘤相关死亡。以各组miRNAs表达的中位数将EOC患者分为miRNA高表达组和低表达组,比较2组患者间的生存差异。临床资料中按年龄、FIGO分期、术后是否有残余瘤及术后化疗情况进行分组纳入生存分析。无进展生存期(PFS)定义为患者接受治疗,到出现EOC局部区域的复发或远处转移或死亡的时间。总生存期(OS)定义为从确诊患EOC到死亡的时间。
1.5 统计学方法采用Graphpad Prism 5.0和SPSS17.0统计软件包进行分析。符合正态分布的计量资料以表示,2组间均值比较行t检验,不符合正态分布的行秩和检验。相关性采用Pearson相关分析,生存分析采用Kaplan-Meier法,用log-rank法检验生存率差异。Cox比例风险回归模型对影响PFS及OS的因素进行多因素分析。以P<0.05为差异有统计学意义。
2 结果
2.14 种miRNAs在EOC组织中的表达情况及其与FIGO分期的关系FIGO晚期组miR-141的表达高于早期组(P<0.05);但2组miR-200a、miR-205和miR-34a表达差异无统计学意义(P>0.05),见表2。
Tab.2 Expressions of 4 miRNAs in EOC tissue and the relationship between them and FIGO stage表2 4种miRNAs在EOC组织中的表达情况及其与FIGO分期的关系
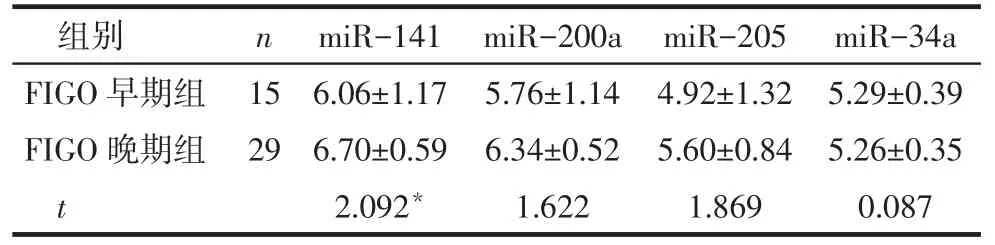
Tab.2 Expressions of 4 miRNAs in EOC tissue and the relationship between them and FIGO stage表2 4种miRNAs在EOC组织中的表达情况及其与FIGO分期的关系
*P<0.05
组别FIGO早期组FIGO晚期组t miR-34a 5.29±0.39 5.26±0.35 0.087 n 15 29 miR-141 6.06±1.17 6.70±0.59 2.092*miR-200a 5.76±1.14 6.34±0.52 1.622 miR-205 4.92±1.32 5.60±0.84 1.869
2.2 EOC组织中4种miRNAs表达量之间的相关性miR-141与miR-200a和miR-205表达量呈正相关,与miR-34a呈负相关(r分别为0.962、0.590及-0.346,均P<0.05);miR-200a与miR-205表达量呈正相关(r=0.619,P<0.05);miR-34a的表达量与miR-200a和miR-205的表达量无关(P>0.05)。
2.34 种miRNAs在EOC组织中的表达以及生存分析结果FIGO早期组生存率高于FIGO晚期组(P<0.05),见表3。miR-200a表达量与EOC预后相关,miR-200a低表达患者PFS更短(P=0.035),与患者OS无明显关系(P>0.05);miR-141、miR-205及miR-34a与患者PFS和OS均无关(P>0.05),见图1、表3。
2.4 miR-200a及临床指标与患者预后的Cox回归分析以年龄(岁,<55=0,≥55=1),FIGO分期(Ⅰ~Ⅱ=0,Ⅲ~Ⅳ=1),减瘤术残余瘤直径(cm,≤2=0,>2=1),化疗(是=0,否=1),4种miRNAs(低表达=0,高表达=1)为自变量,患者PFS或OS为因变量,应用Cox比例风险回归显示,年龄、FIGO分期和miR-200a是EOC患者PFS和OS的独立影响因素,见表4。
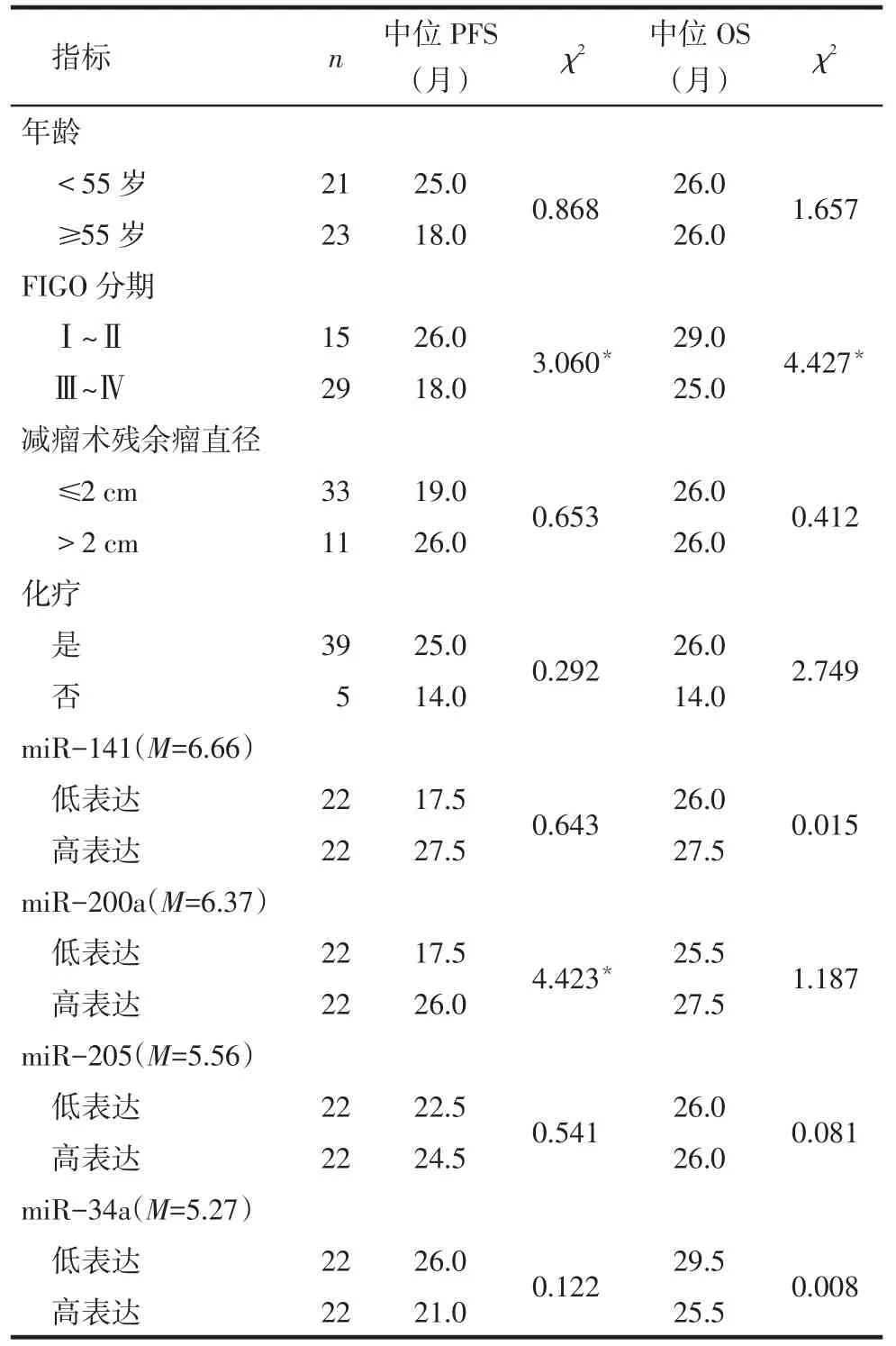
Tab.3 Univariate analysis of prognosis factors in 44 patients with EOS表3 44例EOC患者生存资料的单因素分析
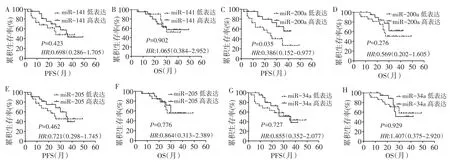
Fig.1 Survival curves of expressions of 4 miRNAs and the relationship between them and prognosis in patients with EOS图1 4种miRNAs表达水平与EOC患者预后关系的生存曲线
3 讨论
miRNAs是一类长约22个单位的核苷酸,通过特异性地与靶基因mRNA的3′端非翻译区(3′-UTR)互补结合,从而降解或抑制mRNA翻译,进而调控靶基因[7]。研究表明,miRNAs可以通过调控EMT相关的转录因子或通路基因从而参与EMT过程[8]。本研究所涉及到的4种miRNAs参与了已经证实的与EMT密切相关的ZEBs/miR-200、miR-205和SNAIL1/miR-34反馈回路[5,8]。
miR-200a和miR-141同属于miR-200家族并有着相同的“种子区”序列,故调控功能相似——通过转录后调控机制抑制ZEB1/ZEB2的表达,增加E-cadherin的表达,从而抑制EMT[9]。本研究结果显示,FIGO晚期组miR-141的表达高于早期组。虽然miR-200a在FIGO早期组和晚期组中的表达差异无统计学意义,但其表达量晚期组高于早期组,且miR-141与miR-200a的表达呈正相关。miR-200a位于1号染色体,而miR-141位于12号染色体[9],故二者表达的相关性不是因为位置相近或有着共同的前体而共表达,而可能是受到同样的上游调控机制。本研究生存分析结果显示,miR-200a表达低EOC患者预后差,考虑原因为:一方面可能因为miR-200家族在EOC发展过程中表现出复杂的时相性,即EOC早期,miR-200低表达有助于细胞获得侵袭性,但已经转移了的细胞需要重新获得上皮表型,有助于肿瘤细胞克隆形成和生长,此时miR-200家族可能重新表达增高[10];另一方面EOC的不同发展阶段miR-200家族的功能不是完全一致,miR-141和miR-200a在未治疗的情况下可以抑制p38α,从而增加肿瘤细胞活力,促进细胞增殖,而癌组织的氧化应激状态诱导miR-200a和miR-141高表达,miR-200a和miR-141高表达又能增加患者对紫杉醇的敏感性,抑制细胞的增殖,促进细胞凋亡[11]。在EOC组织中高表达的miR-200a可能通过增加化疗敏感性和抑制EMT等多种调控方式提示患者预后良好。
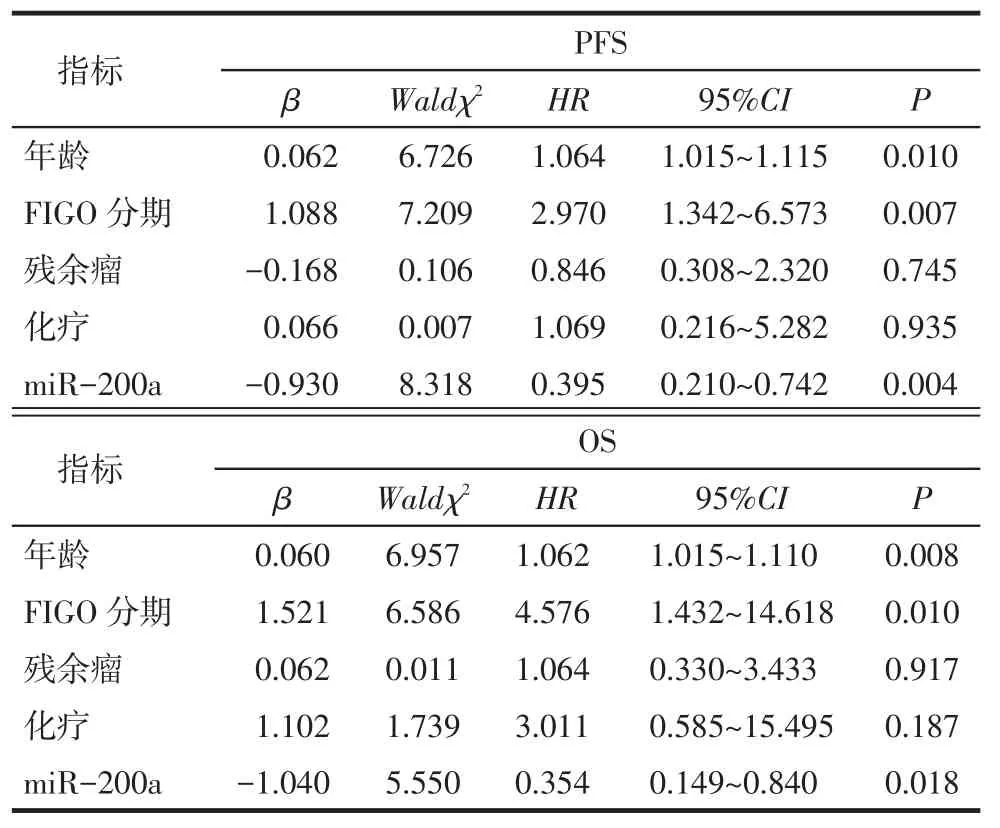
Tab.4 Multivariate analysis of prognosis factors in 44 patients with EOS表4 44例EOS患者生存资料的多因素分析
miR-205是一个功能上与miR-200家族相似,表达与miR-200家族相关的miRNA,同样也可通过抑制ZEB1表达扮演一个EMT的负性抑制因子[12]。本研究显示,miR-205表达与miR-200a和miR-141呈正相关;生存分析显示,随着EOC的进展,miR-205表达升高的趋势,但差异无统计学意义,表明其可能与患者预后无关。不同于在多数肿瘤中低表达,高表达的miR-205在EOC中可能存在另一种调控机制,miR-205能够通过作用于ESRRG、Ez⁃rin和Lamin A/C等靶基因,从而促进细胞增殖和侵袭迁移[13-14]。笔者认为,这可能进一步证实了miR⁃NAs的表达存在组织特异性和功能多样性。
miR-34a是miR-34家族成员之一,而此家族与肿瘤抑制蛋白P53有着正反馈调节关系[15],在EOC以及大多数肿瘤中充当着抑癌基因的角色[16-17]。Siemens等[18]研究显示,miR-34a可以通过下调SNAIL而抑制TGF-β诱导的EMT,从而逆转EMT过程。本研究结果未显示miR-34a与EOC患者FIGO分期和预后有关。
综上所述,miR-141在EOC晚期患者中表达升高,miR-200a低表达提示患者预后差,是EOC的独立预后指标,有望成为指导临床预后的评估指标。
[1]Siegel R,Naishadham D,Jemal A.Cancer statistics,2013[J].CA Cancer J Clin,2013,63(1):11-30.doi:10.3322/caac.21166.
[2]George EM,Herzog TJ,Neugut AI,et al.Carcinosarcoma of the ova⁃ry:natural history,patterns of treatment,and outcome[J].Gynecol Oncol,2013,131(1):42-45.doi:10.1016/j.ygyno.2013.06.034.
[3]Chen W,Zheng R,Zhang S,et al.Annual report on status of cancer in China,2010[J].Chin J Cancer Res,2014,26(1):48-58.doi:10.3978/ j.issn.1000-9604.2014.01.08.
[4]Lee S,Yang Y,Fishman D,et al.Epithelial-mesenchymal transition enhances nanoscale actin filament dynamics of ovarian cancer cells[J]. J Phys Chem B,2013,117(31):9233-9240.doi:10.1021/jp4055186.
[5]Yang D,Sun Y,Hu L,et al.Integrated analyses identify a master mi⁃croRNA regulatory network for the mesenchymal subtype in serous ovarian cancer[J].Cancer Cell,2013,23(2):186-199.doi:10.1016/j. ccr.2012.12.020.
[6]Zheng H,Zhang L,Zhao Y,et al.Plasma miRNAs as diagnostic and prognostic biomarkers for ovarian cancer[J].PloS One,2013,8(11):e77853.doi:10.1371/journal.pone.0077853.
[7]Bartel DP.MicroRNAs:target recognition and regulatory functions[J].Cell,2009,136(2):215-233.doi:10.1016/j.cell.2009.01.002.
[8]Guo F,Parker Kerrigan BC,Yang D,et al.Post-transcriptional regu⁃latory network of epithelial-to-mesenchymal and mesenchymal-toepithelial transitions[J].J Hematol Oncol,2014,7:19.doi:10.1186/ 1756-8722-7-19.
[9]Park SM,Gaur AB,Lengyel E,et al.The miR-200 family determines the epithelial phenotype of cancer cells by targeting the E-cadherin repressors ZEB1 and ZEB2[J].Genes Dev,2008,22(7):894-907. doi:10.1101/gad.1640608.
[10]Dykxhoorn DM.MicroRNAs and metastasis:little RNAs go a long way[J].Cancer Res,2010,70(16):6401-6406.doi:10.1158/0008-5472.CAN-10-1346.
[11]Mateescu B,Batista L,Cardon M,et al.miR-141 and miR-200a act on ovarian tumorigenesis by controlling oxidative stress response[J]. Nat Med,2011,17(12):1627-1635.doi:10.1038/nm.2512.
[12]Zhang P,Wang L,Rodriguez-Aguayo C,et al.miR-205 acts as a tu⁃mour radiosensitizer by targeting ZEB1 and Ubc13[J].Nat Commun,2014,5:5671.doi:10.1038/ncomms6671.
[13]Li J,Li L,Li Z,et al.The role of miR-205 in the VEGF-mediated promotion of human ovarian cancer cell invasion[J].Gynecol Oncol,2015,137(1):125-133.doi:10.1016/j.ygyno.2015.01.531.
[14]Su N,Qiu H,Chen Y,et al.miR-205 promotes tumor proliferation and invasion through targeting ESRRG in endometrial carcinoma[J]. Oncol Rep,2013,29(6):2297-2302.doi:10.3892/or.2013.2400.
[15]Lou G,Liu Y,Wu S,et al.The p53/miR-34a/SIRT1 Positive Feed⁃back Loop in Quercetin-Induced Apoptosis[J].Cell Physiol Bio⁃chem,2015,35(6):2192-2202.
[16]Li R,Shi X,Ling F,et al.MiR-34a suppresses ovarian cancer prolif⁃ eration and motility by targeting AXL[J].Tumour Biol,2015.[Epub ahead of print]
[17]Lai M,Du G,Shi R,et al.MiR-34a inhibits migration and invasion by regulating the SIRT1/p53 pathway in human SW480 cells[J]. Mol Med Rep,2015,11(5):3301-3307.doi:10.3892/mmr.2015.3182.
[18]Siemens H,Jackstadt R,Hunten S,et al.miR-34 and SNAIL form a double-negative feedback loop to regulate epithelial-mesenchymal transitions[J].Cell Cycle,2011,10(24):4256-4271.doi:10.4161/ cc.10.24.18552.
(2015-04-28收稿2015-05-07修回)
(本文编辑陆荣展)
Expression and clinical significance of four miRNAs in epithelial ovarian cancer
LIU Jiayu1,2,ZHAO Yanrui1,ZHANG Lina1,3,YAN Ye4,ZHENG Hong1△
1 Department of Epidemiology and Biostatistics,Tianjin Medical University Cancer Hospital and Institute,National Clinical Research Center of Cancer,Key Laboratory of Breast Cancer Prevention and Therapy,Tianjin 300060,China;2 Gradute School,Tianjin Medical University;3 Department of Breast Surgery,Tianjin Medical University Cancer Hospital and Institute;4 Department of Gynecology and Obstetrics,Tianjin Medical University General Hospital△
ObjectiveTo determine the expressions of miR-200a,miR-141,miR-205 and miR-34a in epithelial ovarian cancer(EOC)samples and to explore their clinical significance.MethodsAccording to FIGO staging,44 EOC pa⁃tients were divided into two groups:early FIGO stage(stageⅠ-Ⅱ,n=15)and late FIGO stage(stageⅢ-Ⅳ,n=29).Expres⁃sions of 4 miRNAs were detected by real time quantitative PCR,and were compared between two groups.The correlation of 4 miRNAs was calculated.EOC patients were divided into high miRNA expression group and low expression group according to the median value of miRNAs expression.Kaplan-Meier survival analysis and Cox multivariate analysis were used to com⁃pare the age,FIGO state,tumor residual after operation and post-operative chemotherapy of ovarian cancer between two groups.ResultsThe expression of miR-141 was elevated in stagesⅢandⅣcompared with that of stagesⅠandⅡ(P= 0.036).There was a positive correlation between expression of miR-141,miR-200a and miR-205,but a negative correlation with miR-34a(P<0.05).There was a positive correlation between miR-200a and miR-205(P<0.05).Lower miR-200a ex⁃pression was associated with shorter progress free survival in ovarian cancer analyzed by log-rank test(P=0.035).The sur⁃vival rate was significantly higher in FIGO stagesⅠandⅡthan that of FIGO stagesⅢandⅣ(P<0.05).Cox regression analysis revealed that miR-200a,FIGO stage and age were influential factors of overall survival time and progress-free sur⁃vival time of ovarian cancer,while miR-141,miR-205,miR-34a and tumor residual after operation and post-operative che⁃motherapy were not influential factors.ConclusionThe expression of miR-200a is closely correlated with the progress and prognosis of ovarian cancer and may be used as an independent indicator for ovarian cancer prognosis.
microRNAs;ovarian neoplasms;epithelial-mesenchymal transition;epithelial;miR-200a;miR-141;miR-205;miR-34a
R737.31;R34-33
A
10.11958/j.issn.0253-9896.2015.09.0010
国家自然科学基金资助项目(81072363)
1天津医科大学肿瘤医院,肿瘤研究所肿瘤分子流行病与生物统计研究室,国家肿瘤临床研究中心,天津市肿瘤防治重点实验室(邮编300060);2天津医科大学研究生院;3天津医科大学肿瘤医院乳腺外科;4天津医科大学总医院妇产科
刘佳宇(1989),女,硕士在读,主要从事肿瘤分子流行病学研究
△通讯作者E-mail:zhengh64@aliyun.com
