乌司他丁联合异甘草酸镁对肺纤维化大鼠肺组织TGF-β1和CTGF表达的影响
2015-11-18刘伟伟聂卫袁玲郑洪崔晓雪沈洪昇刘大卫
刘伟伟,聂卫,袁玲,郑洪,崔晓雪,沈洪昇,刘大卫
实验研究
乌司他丁联合异甘草酸镁对肺纤维化大鼠肺组织TGF-β1和CTGF表达的影响
刘伟伟1,聂卫1,袁玲1,郑洪2,崔晓雪1,沈洪昇1,刘大卫1
目的观察乌司他丁联合异甘草酸镁对博莱霉素(BLM)诱导的肺纤维化大鼠肺组织转化生长因子β1(TGF-β1)和结缔组织生长因子(CTGF)表达的影响。方法90只大鼠随机分为以下5组:BLM组、甲泼尼龙琥珀酸钠(MTH)组、乌司他丁(UTI)组、异甘草酸镁(MgIG)组、乌司他丁联合异甘草酸镁(UTI+MgIG)组,各18只。5组均以气管内注入BLM建立大鼠肺纤维化模型,造模成功24 h后,BLM组大鼠每日腹腔注射生理盐水,其余各组给予相应药物腹腔注射。每组分别于第7、14和28天处死6只,HE染色评价肺组织肺泡炎及纤维化程度,免疫组化测定肺组织TGF-β1和CTGF的表达水平。结果(1)药物干预各组肺泡炎及肺纤维化程度均较BLM组有所减轻,其中UTI+MgIG组第7、14天肺泡炎程度,第14、28天肺纤维化程度与BLM组差异有统计学意义(P<0.05)。(2)药物干预各组TGF-β1和CTGF的表达水平在各时间点均较同期BLM组有所降低;UTI+MgIG组TGF-β1的表达水平在第7、14天时明显低于UTI组和MgIG组,第28天时明显低于MTH组、UTI组和MgIG组(P<0.05);UTI+MgIG组CTGF的表达水平在第7天时明显低于UTI组和MgIG组,第14、28天时明显低于MTH组、UTI组和MgIG组(P<0.05)。结论UTI联合MgIG能减轻BLM诱导的大鼠肺泡炎及纤维化程度,其机制可能与下调TGF-β1和CTGF的表达有关。
肺纤维化;转化生长因子β1;大鼠,Wistar;结缔组织生长因子;乌司他丁;异甘草酸镁
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种原因不明、以进展性的肺纤维化炎症反应为特征的肺间质疾病,其发病率约为10/10万,且呈逐年增长的趋势[1]。IPF可见于各年龄组,预后不良,中位生存期仅3年[2]。由于IPF病因不明,发病机制不详,明确诊断受到限制,缺乏有效的治疗药物,所以预后不佳。乌司他丁(UTI)和异甘草酸镁(MgIG)均有抑制炎症介质过度释放、抗氧化、抗纤维化、稳定细胞膜及免疫调节等作用。转化生长因子β1(TGF-β1)是最重要的致纤维化因子,且结缔组织生长因子(CTGF)是TGF-β1的下游因子,两者关系密切。本研究拟观察UTI联合MgIG注射液对博莱霉素(bleomycin,BLM)诱导的肺纤维化大鼠肺组织病理学变化及肺组织TGF-β1和CTGF表达的影响,探讨UTI联合MgIG治疗肺纤维化的作用机制,为肺纤维化的防治提供新的途径。
1 材料与方法
1.1 材料(1)实验动物。清洁级雌性Wistar大鼠90只,体质量240~260 g,平均(251.4±3.6)g,购自解放军军事医学科学院卫生与医学研究所动物实验中心。许可证号:SCKK-(年)2009-003。合格证号0001654。(2)主要试剂和仪器。注射用盐酸博莱霉素(日本化药株式会社);注射用甲泼尼龙琥珀酸钠(Pfizer Manufacturing Belgium NV);注射用乌司他丁、异甘草酸镁注射液(广东天普生化医药股份有限公司);兔抗大鼠TGF-β1多克隆抗体和兔抗大鼠CTGF多克隆抗体,SABC试剂盒及DAB显色剂(武汉博士德生物工程有限公司);尼康Ci-L图像采集显微镜(Nikon Corporation);IDA-2000高清度数码显微图像分析系统(中科院北京空海科技发展有限公司)。其他试剂均为国产或进口分析纯。
1.2 方法
1.2.1 动物分组将90只SD大鼠用随机数字表法分为BLM组、甲泼尼龙琥珀酸钠组(MTH组)、乌司他丁治疗组(UTI组)、异甘草酸镁治疗组(MgIG组)、乌司他丁联合异甘草酸镁治疗组(UTI+MgIG组),各18只。
1.2.2 动物模型的建立及药物干预10%水合氯醛(3 mL/kg)腹腔注射麻醉大鼠,常规消毒颈部,切开皮肤,钝性分离,暴露气管,缓慢注入BLM 5 mg/kg。注药完毕后立即直立并旋转大鼠,使药液在肺内均匀分布。气管内灌注BLM复制肺纤维化大鼠模型成功24 h后,各组给予药物腹腔注射,BLM组生理盐水1 mL,每日1次。MTH组甲泼尼龙琥珀酸钠4.5 mg/kg,每日1次。UTI组乌司他丁2万U/kg,每日2次。MgIG组每日腹腔注射异甘草酸镁30 mg/kg,每日1次。UTI+MgIG组每日腹腔注射异甘草酸镁30 mg/kg,每日1次和乌司他丁2万U/kg,每日2次。各给药剂量均相当于成人给药量。
1.2.3 肺组织的处理各组手术后第7、14、28天分3批各处死6只。切除右肺,浸入10%中性福尔马林中固定4 h以上,常规脱水、透明、浸蜡、包埋后连续切片,切片厚度为5 μm,并进行HE染色及观察。按Szapiel等提出的方法评价肺泡炎及肺纤维化程度。肺泡炎:0级(0分)无肺泡炎;Ⅰ级(1分)轻度肺泡炎,单核细胞浸润使肺泡间隔增宽,仅局限于局部或胸膜部,面积小于全肺的20%,肺泡结构正常;Ⅱ级(2分)中度肺泡炎,受累面积占全肺的20%~50%,近胸膜部较重;Ⅲ级(3分),重度肺泡炎,面积大于50%。肺纤维化:0级(0分)无明显改变;Ⅰ级(1分)轻度改变,病变范围小于全肺的20%;Ⅱ级(2分)中度改变,病变范围占全肺的20%~50%;Ⅲ级(3分),重度改变,病变范围占全肺的50%以上,肺泡结构紊乱。
1.2.4 免疫组织化学染色TGF-β1和CTGF兔多克隆抗体工作浓度1∶50,用PBS代替第一抗体作为空白对照。切片厚度均为5 μm,常规石蜡切片脱蜡至水;3%H2O2封闭内源性过氧化物酶;微波加热修复抗原;滴加TGF-β1或CTGF抗体;4℃过夜;加入二抗;DAB显色,乙醇脱水,二甲苯透明,中性树胶封片。每张切片在200倍镜下随机读取5个视野,用HMIAS-2000高清晰度彩色医学图文分析系统分析,取平均吸光度值进行统计分析。
1.3 统计学方法采用SPSS17.0进行分析,计量资料用均数±标准差表示。多组间均数比较行方差分析和LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 HE染色BLM组:第7天,肺泡间隔增宽、肺泡腔及肺泡间隔内可见大量淋巴细胞、中性粒细胞及巨噬细胞浸润,少量成纤维细胞及毛细血管增生,病灶内部分肺泡萎陷;第14天肺泡炎性渗出逐渐减轻,肺泡间隔明显增厚,成纤维细胞增多,肺内纤维组织增生;第28天肺泡结构严重破坏、纤维组织大量增生,纤维化明显加重。药物干预各组各时间点炎症细胞渗出及纤维组织增生程度较同期BLM组均有所减轻,其中UTI+MgIG组病变减轻程度较明显,见图1。第7、14天时,药物干预各组大鼠肺泡炎程度均轻于BLM组,其中UTI+MgIG组与BLM组比较差异有统计学意义(P<0.05);第14、28天时药物干预各组大鼠肺纤维化程度均轻于BLM组,其中UTI+MgIG组与BLM组比较差异有统计学意义(P<0.05),见表1。
Tab.1 Comparison of grades and scores of alveolitis and pulmonary fibrosis in five groups表1 各组大鼠肺泡炎和肺纤维化分级计分的比较(n=6,分)
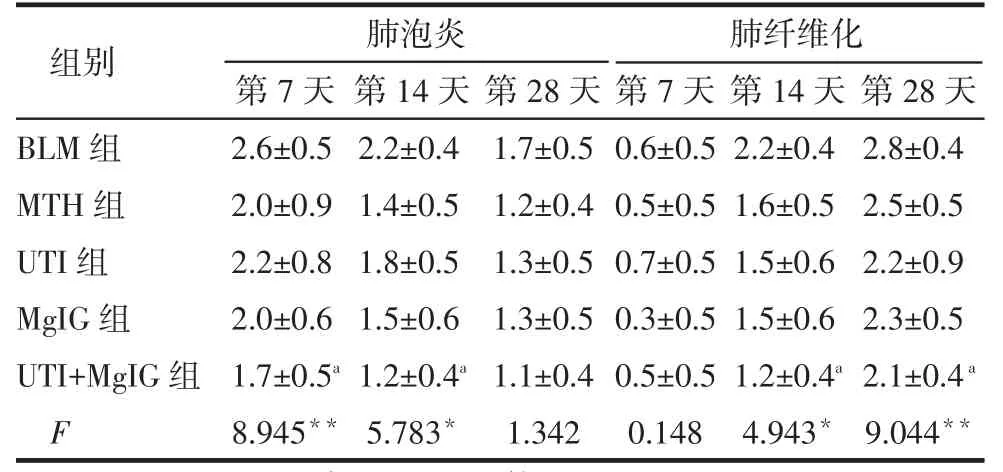
Tab.1 Comparison of grades and scores of alveolitis and pulmonary fibrosis in five groups表1 各组大鼠肺泡炎和肺纤维化分级计分的比较(n=6,分)
*P<0.05,**P<0.01;a与BLM组比较,P<0.05
组别BLM组MTH组UTI组MgIG组UTI+MgIG组F肺泡炎第7天2.6±0.5 2.0±0.9 2.2±0.8 2.0±0.6 1.7±0.5a8.945**第14天2.2±0.4 1.4±0.5 1.8±0.5 1.5±0.6 1.2±0.4a5.783*第28天1.7±0.5 1.2±0.4 1.3±0.5 1.3±0.5 1.1±0.4 1.342肺纤维化第7天0.6±0.5 0.5±0.5 0.7±0.5 0.3±0.5 0.5±0.5 0.148第14天2.2±0.4 1.6±0.5 1.5±0.6 1.5±0.6 1.2±0.4a4.943*第28天2.8±0.4 2.5±0.5 2.2±0.9 2.3±0.5 2.1±0.4a9.044**
2.2 免疫组化结果
2.2.1 TGF-β1胞浆内有黄色或棕黄色的颗粒即为阳性表达部位。第7天时TGF-β1主要表达于肺泡巨噬细胞及少量成纤维细胞;第14天时支气管、细支气管黏膜上皮细胞及成纤维细胞TGF-β1表达明显增强;第28天时TGF-β1在上述细胞浆内表达强度进一步增加。药物干预组各时间点TGF-β1阳性表达强度较同期BLM组有所降低,见图2。
TGF-β1表达水平比较:第7天时各用药组均低于BLM组,UTI+MgIG组低于UTI组和MgIG组(P<0.05);第14天时MTH组、UTI组和UTI+MgIG组低于BLM组,UTI+MgIG组低于UTI组和MgIG组(P<0.05);第28天时MTH组、MgIG组和UTI+ MgIG组低于BLM组,UTI+MgIG组低于MTH组、UTI组和MgIG组(P<0.05),见表2。
Tab.2 Comparison of expression levels of TGF-β1 in lung tissue of five groups表2 不同时间各组大鼠肺组织TGF-β1表达水平比较(n=6,平均吸光度值,)
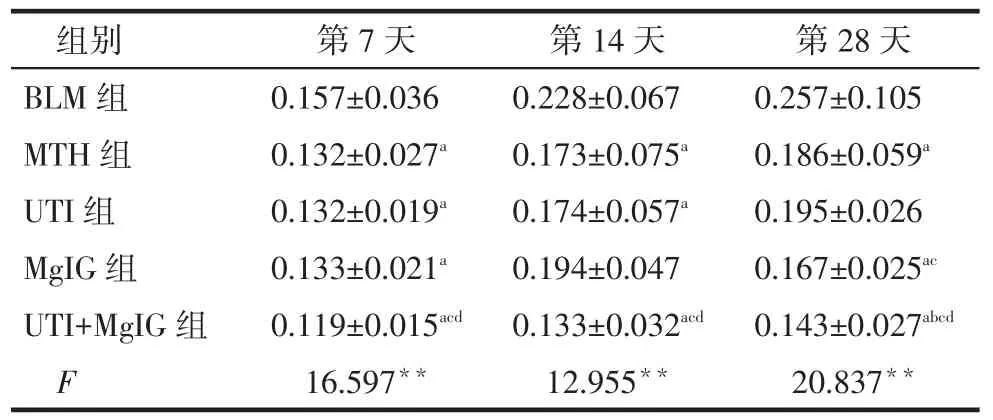
Tab.2 Comparison of expression levels of TGF-β1 in lung tissue of five groups表2 不同时间各组大鼠肺组织TGF-β1表达水平比较(n=6,平均吸光度值,)
**P<0.01;a与BLM组比较,b与MTH组比较,c与UTI组比较,d与MgIG组比较,P<0.05;表3同
组别BLM组MTH组UTI组MgIG组UTI+MgIG组F第7天0.157±0.036 0.132±0.027a0.132±0.019a0.133±0.021a0.119±0.015acd16.597**第14天0.228±0.067 0.173±0.075a0.174±0.057a0.194±0.047 0.133±0.032acd12.955**第28天0.257±0.105 0.186±0.059a0.195±0.026 0.167±0.025ac0.143±0.027abcd20.837**
2.2.2 CTGFCTGF阳性表达为棕黄色或褐色。第7天时主要表达于支气管上皮细胞、肺泡上皮细胞和少量成纤维细胞;第14天时CTGF在成纤维细胞表达明显增加,第28天时CTGF阳性表达进一步增强。药物干预组各时间点CTGF表达强度均低于同期BLM组,见图3。
CTGF表达水平比较:第7天时MTH组、UTI组和UTI+MgIG组低于BLM组,UTI+MgIG组低于UTI组和MgIG组(P<0.05);第14、28天时MTH组、MgIG组和UTI+MgIG组低于BLM组,UTI+MgIG组低于MTH组、UTI组和MgIG组(P<0.05),见表3。
Tab.3 Comparison of expression levels of CTGF in lung tissue of five groups表3 不同时间各组大鼠肺组织CTGF表达水平比较(n=6,平均吸光度值,)
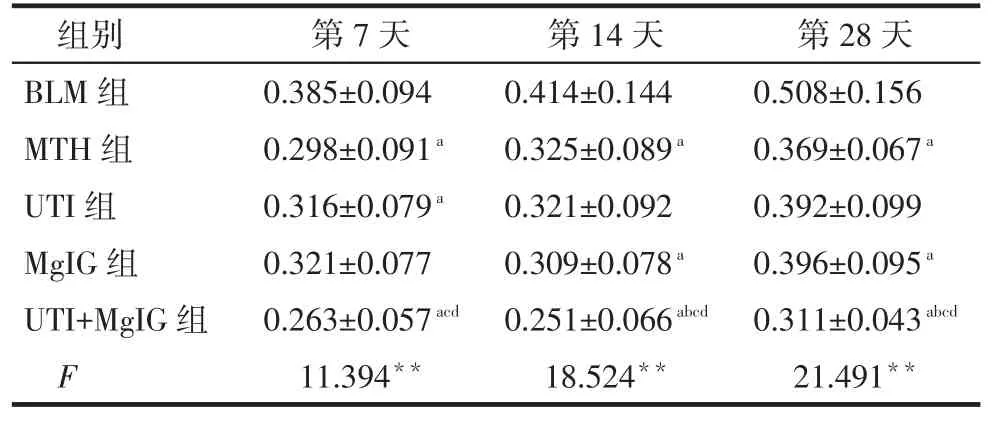
Tab.3 Comparison of expression levels of CTGF in lung tissue of five groups表3 不同时间各组大鼠肺组织CTGF表达水平比较(n=6,平均吸光度值,)
组别BLM组MTH组UTI组MgIG组UTI+MgIG组F第7天0.385±0.094 0.298±0.091a0.316±0.079a0.321±0.077 0.263±0.057acd11.394**第14天0.414±0.144 0.325±0.089a0.321±0.092 0.309±0.078a0.251±0.066abcd18.524**第28天0.508±0.156 0.369±0.067a0.392±0.099 0.396±0.095a0.311±0.043abcd21.491**
3 讨论
IPF是一种病因及发病机制复杂的疾病,其主要病理学改变为肺泡炎及间质纤维化。本研究结果显示,博莱霉素诱导的肺损伤初期以淋巴细胞、中性粒细胞等炎症细胞浸润为主,随着时间推移,成纤维细胞增生逐渐增加,肺纤维化逐步加重。在此过程中,肺组织中的炎症细胞和肺内细胞产生各种细胞因子及其他活性分子,激发成纤维细胞复制、增殖、合成过多胶原为主的细胞外基质(ECM)成分,导致大量胶原堆积[3]。因此,细胞因子是目前IPF的研究热点。TGF-β是一种多功能的细胞因子,是肺纤维化发生过程中最直接作用的细胞因子[4]。实验表明,TGF-β1在肺组织中可以刺激成纤维细胞增殖,同时也促进ECM的合成,另一方面抑制新合成的基质金属蛋白酶(MMP)降解,还具有抑制肺泡上皮细胞增殖的作用[5]。CTGF作为TGF-β的下游因子,是一种新的可刺激成纤维细胞增殖和分泌胶原的生长因子,可能是肺纤维化发生过程中的一个关键调节因子[6]。本实验中BLM组肺组织内TGF-β1和CTGF表达水平随着时间推移逐渐升高,表明两种因子与肺纤维化的发生、发展密切相关。
目前,肺纤维化尚无有效治疗方案。治疗药物以皮质类固醇激素和免疫抑制剂合并应用为主[7-8],但其临床疗效并不明显,且长期使用不良反应较大,迫切需要新的治疗药物及方法。乌司他丁是人尿中分离纯化的尿胰蛋白酶抑制剂,有研究表明其能明显减轻百草枯中毒所致的大鼠肺泡炎及纤维化程度,抑制肺组织中TGF-β1过度表达[9]。异甘草酸镁注射液是甘草酸的第4代新型制剂,有研究表明,MgIG连续治疗能明显降低百草枯染毒大鼠肺组织内的羟脯氨酸及血清细胞黏附分子-1(ICAM-1)、MMP-9,对百草枯中毒肺纤维化有一定的保护或治疗作用[10]。本研究采用上述两者联合应用干预BLM致肺纤维化大鼠,结果显示UTI联合MgIG能明显下调肺组织内TGF-β1和CTGF的表达,明显减轻肺泡炎和肺纤维化程度,效果优于MTH组、UTI组及MgIG干组。因此,UTI联合MgIG可用于临床防治肺纤维化,并值得进一步研究。
(图1~3见插页)
[1]Behr J.The diagnosis and treatment of idiopathic pulmonary fibrosis[J].Dtsch Arztebl Int,2013,110(51-52):875-881.doi:10.3238/arz⁃tebl.2013.0875.
[2]Ahluwalia N,Shea BS,Tager AM,et al.New therapeutic targets in idiopathic pulmonary fibrosis.Aiming to rein in runaway woundhealing responses[J].Am J Respir Crit Care Med,2014,190(8):867-878.doi:10.1164/rccm.201403-0509PP.
[3]Arnab D,Chris JS,Rachel CC.Novel therapeutic approaches for pulmonary fibrosis[J].Br J Pharmacol,2011,163(1):141-172.
[4]Fernandez IE,Eickelberg O.The impact of TGF-β on lung fibrosis:from targeting to biomarkers[J].Proc Am Thorac Soc,2012,9(3):111-116.doi:10.1513/pats.201203-023AW.
[5]Lasky JA,Brody AR.Interstitial fibrosis and growth factors[J].Envi⁃ ron Health Perapect,2000,108(Suppl 4):751-762.
[6]Yan LF,Wei YN,Nan HY,et al.Proliferative phenotype of pulmo⁃nary microvascular endothelial cells plays a critical role in the over⁃expression of CTGF in the bleomycin-injured rat[J].Exp Toxicol Pathol,2014,66(1):61-71.doi:10.1016/j.etp.2013.08.004.
[7]Woodcock HV,Maher TM.The treatment of idiopathic pulmonary fi⁃brosis[J].F1000Prime Rep,2014,6:16.doi:10.12703/P6-16.eCol⁃lection 2014.
[8]Zhao WB,Wan SX,Gu DF,et al.Therapeutic effect of glucocorti⁃coid inhalation for pulmonary fibrosis in ARDS patients[J].Med J Chin PLA,2014,39(9):741-745.[赵文飚,万晟霞,顾德芳,等.糖皮质激素雾化吸入对呼吸窘迫综合征患者肺纤维化的疗效观察[J].解放军医学杂志,2014,39(9):741-745].doi:10.11855/j.issn.057 7-7402.2014.09.13.
[9]Wang YL,Liu KX,Li XM,et al.Experimental study on the therapeu⁃tic effect of ulinary trypsin inhibitor against pulmonary injury[J]. Chin J Clinicians(Electronic Edition),2014,8(10):1900-1905.[王言理,刘克喜,李小民,等.乌司他丁对百草枯中毒大鼠肺损伤的影响[J].中华临床医师杂志(电子版),2014,8(10):1900-1905].doi:10.3877/cma.j.issn.1674-0785.2014.10.024.
[10]Xiao ZW,Qiu ZW.Therapeutic effects of magnesium isoglycyrrhiz⁃inate on pulmonary fibrosis induced by paraquat[J].Chin J Crit Care Med,2010,30(4):326-329.[肖章武,邱泽武.异甘草酸镁对大鼠百草枯中毒肺纤维化治疗作用的研究[J].中国急救医学,2010,30(4):326-329].doi:10.3969/j.issn.1002-1949.2010.04.011.
(2015-03-26收稿2015-04-17修回)
(本文编辑李国琪)
Effects of combination of ulinastatin and magnesium isoglycyrrhizinate on expression of TGF-β1 and CTGF in lung tissue of rats with pulmonary fibrosis
LIU Weiwei1,NIE Wei1,YUAN Ling1,ZHENG Hong2,CUI Xiaoxue1,SHEN Hongsheng1,LIU Dawei1
1 Tianjin Institute of Medical and Pharmaceutical Sciences,Tianjin 300020,China;2 Tianjin First Center Hospital
ObjectiveTo investigate the effects of ulinastatin(UTI)combined with magnesium isoglycyrrhizinate(MgIG)on the expression of transforming growth factor-β1(TGF-β1)and connective tissue growth factor(CTGF)in lung tis⁃sue of rats with pulmonary fibrosis induced by bleomycin(BLM).MethodsNinety Wistar rats were randomly divided into five groups:BLM group,methylprednisolone(MTH)group,UTI group,MgIG group and UTI combined with MgIG(UTI+ MgIG)group,n=18 for each group.The rat model of pulmonary fibrosis was established by injecting bleomycin through tra⁃chea in five groups.Twenty-four hours after treatment with BLM,rats were treated with normal saline every day in BLM group,and rats were treated by corresponding drugs in other groups.Six rats of each group were killed at the 7th,14th and 28th day respectively.The pathological changes of alveolitis and pulmonary fibrosis were evaluated by HE staining,and ex⁃pression levels of TGF-β1 and CTGF in lung tissues were detected by immunohistochemistry method.Results(1)Com⁃pared with BLM group,the degree of alveolitis and pulmonary fibrosis was reduced in other groups.There was significant dif⁃ference in alveolitis at the 7th and 14th day between UTI+MgIG group and BLM group.And there was significant difference in pulmonary fibrosis at the 14th and 28th day between UTI+MgIG group and BLM group(P<0.05).(2)Compared with BLM group,the expression levels of TGF-β1 and CTGF were decreased in other groups.In UTI+MgIG group,the expres⁃sion levels of TGF-β1 were significantly lower at the 7th and 14th day compared with those in UTI group and MgIG group,and which were significantly lower at the 28th day than those in MTH group,UTI group and MgIG group(P<0.05).The ex⁃pression levels of CTGF were significantly lower at the 7th day in UTI+MgIG group than those in UTI group and MgIG group,and which were significantly lower at the 14th and 28th day than those in MTH group,UTI group and MgIG group(P<0.05).ConclusionThe combination of UTI and MgIG can alleviate alveolitis and fibrosis in BLM-induced pulmonaryfibrosis rats,which might related with the down-regulation of TGF-β1 and CTGF expressions.
pulmonary fibrosis;transforming growth factor beta1;rats,Wistar;connective tissue growth factor;ulinastatin;magnesium isoglycyrrhizinate
R563
A
10.11958/j.issn.0253-9896.2015.09.007
天津市卫生局科技基金资助项目(2013KZ030)
1天津市医药科学研究所(邮编300020);2天津市第一中心医院
刘伟伟(1985),女,研究实习员,硕士,主要从事实验病理研究
