一株解烃菌TY22的解烃特性研究
2015-11-17冀黎骏
冀黎骏,唐 赟,谭 佳
(西华师范大学生命科学学院,四川 南充 637009)
随着全球工业化步伐的加快,其对石油的需求量正已几何速度不断增长,随之带来的石油污染也就无法避免,每年全世界都有大量的石油污染物以各种形式进入环境,污染水体、土壤和大气[1]. 目前,世界各国都在致力于研制和开发石油污染修复技术,包括物理方法、化学方法、生物方法等. 其中物理方法为吸附的方式,但收效甚微;化学方法主要为研发消油剂,但其使用又会造成二次污染;生物方法则是通过微生物生长代谢使石油污染物降解,将其彻底矿化.由于生物修复技术具有成本低、效率高、无二次污染、原位降解污染物等优点,现已成为全世界的科研热点[2].
石油的组分非常复杂,包括数百种化合物,如饱和烃、芳香烃、沥青质等,但作为石油最重要的成分之一,烷烃的生物降解向来都是国内外的研究热点[3].至今,已报道的烷烃降解菌主要有Acinetobacter[4]、Rhodococcus[5]、Alcanivorax[6]、Bacillus[7]等,但这只是冰山一角,自然界中依然蕴藏着无数的微生物资源,从中分离筛选高效的解烃菌仍是环境资源微生物学的研究重点之一.
液体石蜡通常称为产液蜡,是一种无色无味的粘稠液体,其主要成分为C16-C20的正构烷烃,由原油中250 -400℃的轻质润滑油馏分得到.笔者从南充炼油厂土壤中驯化筛选出一株液体石蜡降解菌TY22,并根据常见细菌系统鉴定、生理生化测验和16S rRNA 测序分析鉴定其为枯草芽孢杆菌(Bacillus subtilis).通过对其降解能力和生长特性的初步研究,以为该菌株对烷烃的生物修复应用提供理论依据.
1 实验材料与方法
1.1 样品来源
南充炼油厂位于南充市主城区北半部的中心位置,处于城区上风向.样品为被石油污染的土壤,去除表层浮土后取样.
1.2 主要试剂
天津化学试剂研究所生产的C6-C32正构烷烃,其纯度均大于98%;Sigma 公司Tryptone、Yeast Extract、Agar、NaCl、KCl、MgCl2、KH2PO4、K2HPO4.3H2O、MgSO4.7H2O、NaNH4HPO4.4H2O、无水乙醇等;天根细菌基因组DNA 提取试剂盒、天根通用型DNA 纯化回收试剂盒、天根质粒小提试剂盒;Promaga 公司PCR 扩增试剂盒(PCR CoreSystem II);TaKaRa 公司PMD19 -T 载体;青岛海博生物技术有限公司生化鉴定管;杭州天和微生物试剂有限公司药敏试剂盒.
1.3 培养基
1.3.1 E2 无机盐培养基
KH2PO43.6 g,K2HPO4.3H2O 7.5 g,NaNH4HPO4.4H2O 3.5 g 定容至1L,pH 调至7.0,121 ℃高压灭菌20min.固体培养基再加入1.5%的Agar.灭菌后加入1mL 1 mol/L MgSO4和1mL 微量元素溶液[8].
1.3.2 LB 培养基Tryptone 10g,Yeast Extract 5g,NaCl 10g,定容至1L,pH 调至7.0,121℃高压灭菌20min.固体培养基再加入1.5%的Agar[9].
1.3.3 液体石蜡培养基
在无机盐培养基的基础上,加入1%(W/V)液体石蜡;固体培养基再加入1.5%的Agar.
1.4 高效解烃菌的富集、驯化、分离和纯化
取适量土样加入无菌水中,将土样充分打碎摇匀后静置30min,吸取上清液加入装有液体石蜡培养基的锥形瓶中,30℃、180rpm 摇床培养3d;待培养液浑浊后,吸取培养液100μL 转入900μL 无菌水中稀释为10-1倍,再取10-1倍稀释液100μL 转入900μL 无菌水中稀释为10-2倍,以此类推将培养液分别稀释为10-1倍、10-2倍、10-3倍、10-4倍,吸取200μL 以上培养液分别涂布于液体石蜡固体培养基上,30℃恒温培养4d;最后挑取长势最好单菌落以平板三区划线法划线于LB 固体培养基上,连续转接多次后,得到纯化单菌株.挑取单菌株分别接种于液体石蜡固体培养基和液体石蜡液体培养基中,在两种培养基中均能生长的即为液体石蜡降解微生物.分别选取分离的菌株接种到液体石蜡培养基中,测试各菌种在30℃、180 rpm 培养72 h 时对液体石蜡的利用情况,筛选出高效的烷烃降解菌株.
1.5 高效解烃菌株的鉴定
1.5.1 形态、生理生化鉴定
将筛选出的菌株接种到LB 培养基,30℃恒温培养12h,观察菌落特征;采用革兰氏染色、芽孢染色、荚膜染色、抗酸染色等方法对细胞形态进行观察,方法参考《常见细菌系统鉴定手册》[10]. 生理化鉴定采用青岛海博生物技术有限公司生产的生化鉴定管.药敏实验采用杭州天和微生物试剂有限公司生产的药敏试剂盒检测.
1.5.2 菌株16S rRNA 序列测定
采用天根细菌基因组DNA 提取试剂盒提取TY22 菌株基因组DNA 作为模板,按如下体系对菌株16S rRNA 进行PCR 扩增[11].
上游引物fD1:5`-AGAGTTTGATCCTGGCTCAG-3`
下游引物rD1:5`-AAGCAGGTGATCCAGCC-3`
100μLPCR 反应体系:
100 倍稀释DNA 模板4μL;
10μmol/L 上游引物fD1 10μL;
10μmol/L 下游引物rD1 10μL;
2 ×MasterMix 50μL;
ddH2O 加至总体积为100μL.
PCR 反应条件:
94℃预变性5 min;
94℃变性1 min,55 ℃退火45 s,72℃延伸1min,30 个循环;
72℃最后延伸10 min;
4℃保温.
扩增所得DNA 片段与TaKaRa 公司生产的PMD19-T 载体16℃连接过夜,再转化大肠杆菌DH5α.将所得菌液涂布于蓝白斑筛选培养基筛选转化子,并对转化子进行菌落PCR 鉴定[12].将阳性转化子送至北京泰和生物技术有限公司进行DNA 测序.将测序结果提交到GenBank 数据库,与相关序列进行比对分析,利用MEGA5.0 软件进行系统进化分析,利用Kimura2-Parameter Distence 模型计算进化距离,邻位相连法(Neighbor-joining method)构建系统发育树.
1.6 菌株烷烃降解特性的研究
1.6.1 TY22 菌株在LB 液体培养基中生长曲线的测定
接菌于LB 液体培养基中,30℃、180rpm 摇床培养10h,然后取6mL 活化菌液转入600mL 培养基中摇匀,再以每支10mL 的量分装到60 个试管中,于30℃、180rpm 恒温振荡培养,通过连续测定各个时间点的菌液OD600值来反映LB 液体培养基中微生物的生长状况. 每次随机取3 支试管测定,取平均值绘制高效解烃菌TY22 的生长曲线,见图2.
1.6.2 TY22 菌株在液体石蜡中的生长情况
取种子液0.5mL 接入50mL 以液体石蜡为唯一碳源和能源的液体石蜡液体培养基中于30℃、180rpm 振荡培养.观察观察菌体生长情况,测定培养液OD600,见图3.
1.6.3 纯烃底物降解实验
对菌株TY22 的烷烃利用范围进行了测定. 取种子液0.5mL 接入装有50mL 液体培养基,于30℃、180rpm 振荡培养40h.每种底物做3 个重复,观察菌体生长情况,测定培养液OD600,见图4.本实验所用烷烃的灭菌方法参见文献[13].
2 结果与讨论
2.1 高效解烃菌的分离
通过富集培养、驯化、分离和纯化,筛选出两株烷烃降解菌,分别取代号为TY21、TY22.选取对液体石蜡降解率更大的TY22 菌株用于进一步实验.
2.2 菌株鉴定
2.2.1 形态及生理生化特征结果
TY22 菌株革兰氏染色呈阳性,油镜观察细胞呈长杆状,产芽孢,芽孢呈椭圆形,周生鞭毛.在LB 固体培养基上30℃恒温培养12 h 观察菌落特征.单菌落呈类似圆形,有隆起,边缘不规则,颜色为污白色,不透明.液体培养静止时有菌膜形成.菌株生理生化测试结果见表1,结合菌株的形态特征和染色结果,参照参考文献[10],将其归属为芽孢杆菌属(Bacillus).
抗生素实验结果表明,TY22 菌株对克林霉素、链霉素、青霉素G、卡拉霉素、庆大霉素、氯霉素、新霉素、乙酰螺旋霉素、大观霉素、阿米卡星、环丙沙星、氧氟沙星、恩诺沙星、复方新诺明较敏感,对氨苄西林不敏感.

表1 TY22 菌株的生理生化测试结果Tab.1 Characteristics of strain TY22

续表1
2.2.2 16S rRNA 基因序列的系统进化分析
对TY22 菌株16S rRNA 的PCR 扩增产物进行琼脂糖凝胶电泳,150V 电压,待溴酚蓝带迁移至凝胶边缘1 -3cm 时终止电泳,检测其大小约为1.5kb. 测序后,得到1 435 bp 大小的TY22 菌株16S rRNA 核苷酸序列.将序列提交到GenBank 数据库,利用BLAST 软件进行相似性检索比对分析.通过MEGA5.0 软件进行系统进化分析,确定分类地位,构建系统发育树,如图1 所示.
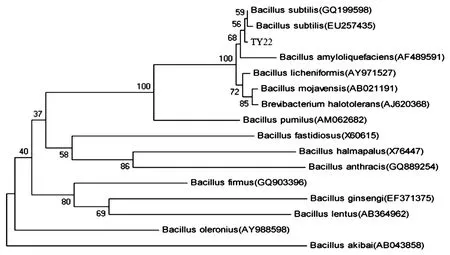
图1 TY22 菌株系统发育树Fig.1 Phylogenetic tree of strain TY22
结果显示TY22 菌株与Bacillus subtilis(GQ199598)和Bacillus subtilis(EU257435)的进化距离最小,相似性分别为99.9%和99.8% .根据形态学观察、生理生化鉴定及系统发育分析,最终将菌株TY22 鉴定枯草芽孢杆菌(Bacillus subtilis).
2.3 高效解烃菌降解特性的研究结果
2.3.1 测定种子液生长曲线
测定TY22 菌株在LB 液体培养基中的生长曲线,以确定种子液的最佳接种时间.取6mL 活化菌液转入600mL 液体培养基中摇匀,再以每支10mL 的量分装到60 个试管中,于30℃、180rpm 恒温震荡培养,连续测定各个时间点的菌液OD600值,每次随机取3 支试管测定,取平均值绘制生长曲线,见图2.
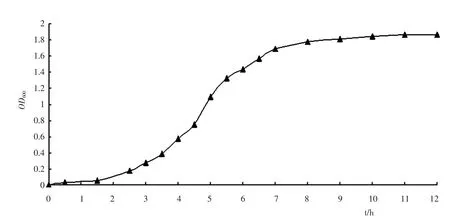
图2 种子液生长曲线Fig.2 Growth curve of seed culture
由图2 知,TY22 菌株在LB 液体培养基中培养1.5h 后,进入对数生长期;培养8h 后开始进入生长稳定期.确定菌株处于对数生长后期的培养时间,选择培养7h 菌液作为种子液,此时菌体浓度可以达到108cells/mL.
2.3.2 TY22 菌株在液体石蜡中的生长情况
取0.5mL 种子液接入50mL 液体石蜡培养基中,于30℃、180rpm 恒温振荡培养,每隔4 h 随机取样测定菌液OD600值,从而确定TY22 的生长情况,结果见图3.如图3 所示,TY22 在液体石蜡培养基中生长良好,延迟期约为2h,随后进入生长对数期,到40h 时进入生长平稳期,此时OD600为0.945.
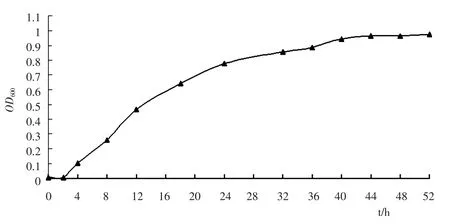
图3 液体石蜡培养基中TY22 菌株生长降解曲线Fig.3 Growth and degrading curve of strain TY22 in the liquid paraffin medium
2.3.3 烷烃降解范围结果
烷烃降解范围实验结果如图4 所示.TY22 菌株能够快速的利用C6-C32链长的直链烷烃作为唯一碳源和能源生长,培养液呈混浊状态.其中以C22最为明显,经过40h 培养的菌液OD600值可达到1.982.TY22 菌株对大于C16链长的烷烃也表现出了明显的降解特性.即使在溶解度非常小的C32中,通过OD600的测定,表明也能够很好的生长.
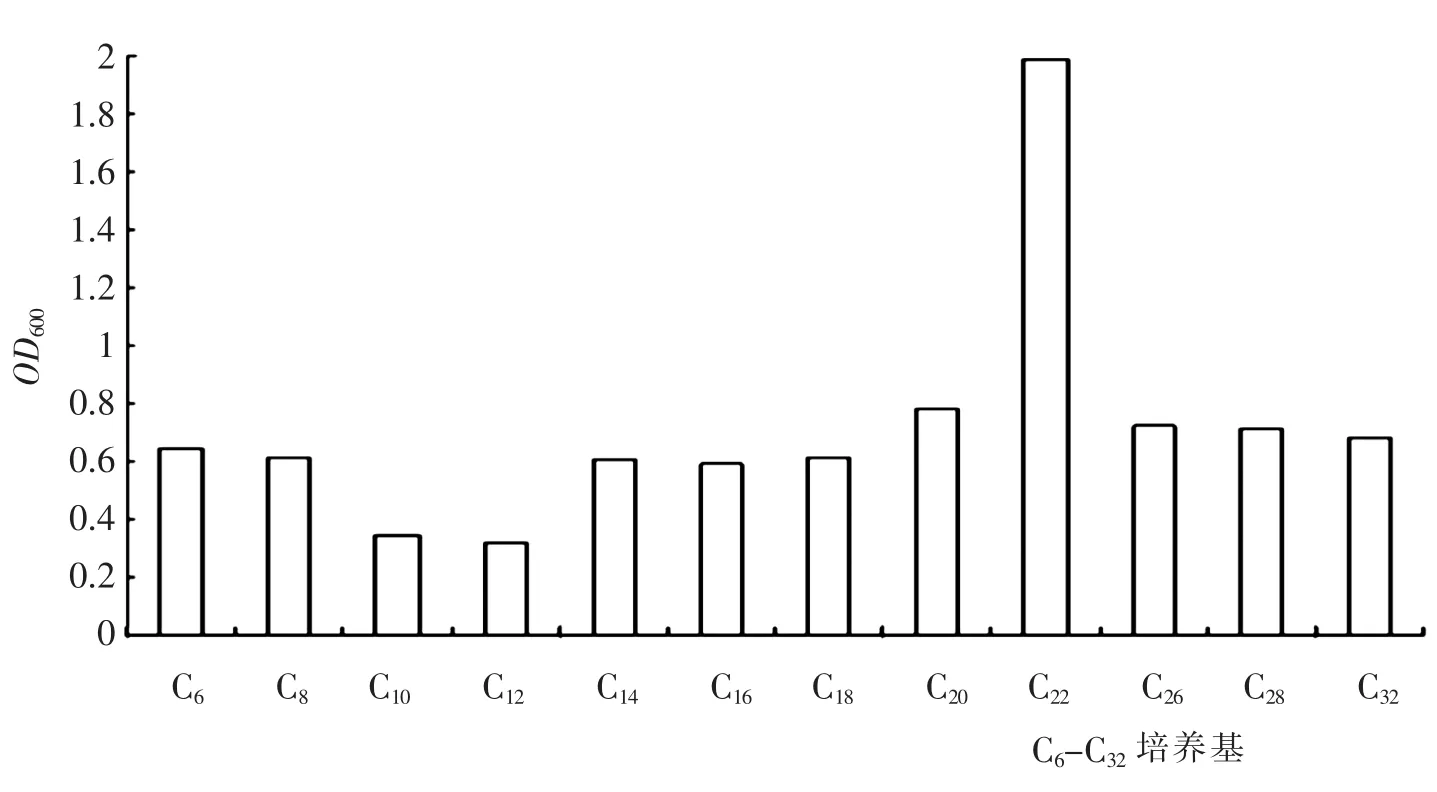
图4 TY22 在C6-C32 培养基中菌体浓度Fig.4 The cell concentration of strain TY22 in the n-alkanes with chain length C6-C32
3 结 论
(1)通过驯化、筛选、分离和纯化得到一株对液体石蜡有较强降解能力的菌株TY22,根据常见细菌系统鉴定、生理生化测验和16S rRNA 测序分析,鉴定其为枯草芽孢杆菌(Bacillus subtilis).(2)对液体石蜡的降解实验表明,1%TY22 菌株种子液接入50mL 以液体石蜡为唯一碳源和能源的液体石蜡液体培养基中,30℃、180rpm 振荡培养40h,生物量OD600可达0.945.说明该菌能够很好的利用液态石蜡作为碳源和能源生长.(3)对于TY22 菌株降解烷烃的底物范围进行了测定:菌株对C6-C32的正构烷烃均有较好的降解作用,尤其是对C22具有特别的降解能力.
[1] 张 璐,赵硕伟,李凤玲,等.石油烃降解菌Rhodococcus sp.15 -3 的分离鉴定及特性研究[J].农业环境科学学报,2008,27(5):1737 -1741.
[2] 刘五星,骆永明,滕应,等.石油污染土壤的生态风险评价和生物修复I.一株具有乳化石油能力的细菌分离鉴定[J].土壤学报,2006,43(3):461 -466.
[3] 王万鹏,邵宗泽.红灯食烷菌(Alcanivorax hongdengensis)黄素结合单加氧酶(AlmA)的基因克隆及其烷烃诱导表达[J].微生物学报,2010,50(8):1051 -1057.
[4] THRONE-HOLST M,WENTZEL A,ELLINGSEN TE,et al. Identification of Novel Genes Involved in Long-Chain n-Alkane Degradation by Acinetobacter Sp.Strain Dsm 17874[J].Appl Environ Microbiol.2007,73(10):3327 -3332.
[5] KUNIHIRO N,HARUKI M,TAKANO K,et al. Isolation and Characterization of Rhodococcus Sp.Strains Tmp2 And t12 that Degrade 2,6,10,14-Tetramethylpentadecane (Pristane)at Mode-rately Low Temperatures[J].J Biotechnol.2005,115:129-136.
[6] SCHNEIKER S,MARTINS DOS SANTOS VA,BARTELS D,et al. Genome Sequence of the Ubiquityous Hydrocarbon-Degrading Marine Bacterium Alcanivorax Borkumensis[J].Nat Biotechnol.2006,24:997 -1004.
[7] CHAERUN SK,TAZAKI K,ASADA R,et al. Bioremediation of Coastal Areas 5 Years After the Nakhodka Oil Spill in the Sea Of Japan:Isolation and Characterization of Hydrocarbon-Degrading Bacteria[J].Environ Int.2004,30:911 -922.
[8] LAGEVEEN R G,HUISMAN G W,PREUSTING H,et al.Formation of Polyesters by Pseudomonas Oleovarans:Effect of Substrates on Formation and Composition of Poly-(r)-3-Hydroyalk-anoates and Poly-(r)-3-Hydroxyalkenoates[J].Appl Environ Microbiol.1988,54:2924 -2932.
[9] NEIDHARDT F C,BLOCH P L,SMITH D F. Culture Medium for Enterobacteria[M].J.Bacterial. 1974,119:736 -747
[10] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:62 -65,353 -398.
[11] WILLIAM G. WEISBURG,SUSAN M.BARNA,DAIE A.PELLETIER,et al.16S Ribosomal DNA Amplific-ation for Phylogenetic Study[J].Journal of bacterialolgy.1991:697 -703.
[12] 陈书霞,王晓武,玉 林.单菌落PCR 法直接快速鉴定重组克隆[J].微生物学通报,2006,33(3):52 -56.
[13] 吴业辉,邵宗泽.海洋烷烃降解菌Alcanivorax sp.A-11 -3 的分离鉴定及其降解酶基因研究,台湾海峡,2007,17(4):428-434.
