TYLCV山东分离物株系分化及侵染性克隆的构建
2015-11-11
TYLCV山东分离物株系分化及侵染性克隆的构建
薛东齐,刘冠,姜景彬,许向阳,李景富
(东北农业大学园艺学院,哈尔滨150030)
摘要:对2012~2014年山东省96份感番茄黄化曲叶病毒(TYLCV)样品进行特异性检测,发现有94份样品感染TYLCV,有2份样品感染番茄卷叶病毒(ToLCV)。对该94份样品进行全序列克隆和序列测定,共分离出13份TYLCV株系,经核苷酸序列相似性分析和系统进化树构建,明确侵染我国山东地区的TYLCV为TYLCV-IL株系,且3年间爆发于山东省内的TYLCV株系的DNA组分并未发生大变异。遂构建山东寿光TYLCV株系侵染性克隆,经致病性验证,具有较好的侵染率,为番茄抗Ty育种提供稳定的毒源筛选压力。
关键词:番茄黄化曲叶病毒;特异性检测;系统进化树;侵染性克隆
网络出版时间2015-1-12 9:53:46
[URL]http://www.cnki.net/kcms/detail/23.1391.S.20150112.0953.011.html
薛东齐,刘冠,姜景彬,等. TYLCV山东分离物株系分化及侵染性克隆的构建[J].东北农业大学学报, 2015, 46(1): 26-33.
近几年,番茄病毒病在山东、浙江、江苏、新疆等全国各主要番茄主产区大面积爆发,严重威胁番茄安全生产和国家蔬菜产业的健康发展。其中尤以双生病毒科(Geminiviridae)菜豆金色花叶病毒属(Begomovirus)番茄黄化曲叶病毒(Tomato yellow leaf curl virus, TYLCV)对番茄危害最为严重,其以B型和Q型烟粉虱(Bemisia tabaci)作为传毒介体[1-3],伴随着烟粉虱迁徙,而季节性危害露地番茄,并可全年危害保护地番茄生产。
TYLCV于20世纪40年代末首先在以色列被发现,随即在以色列以及约旦河流域的中东地区暴发[4],并随着烟粉虱迁徙和番茄带毒种苗运输而逐渐蔓延到北非及地中海沿岸国家,成为TYLCV新温床[5-6]。半个世纪以来,TYLCV已成为世界热带和亚热带国家和地区番茄生产头号病害[7-8]。20世纪90年代初,TYLCV传入我国台湾和广西地区,仅有零星发生[9]。直到2005年,我国广西南宁和百色番茄产区大面积感染TYLCV,造成番茄减产65%以上,有些地区甚至绝产。2006年,TYLCV迅速蔓延到上海、浙江等地[10-12]。2007年至今,我国山东[13]、安徽[13]、江苏[14]、河北[15]、河南[16]、陕西[17]等东南部沿海省份及中部内陆地区的番茄产区均大面积发病,造成番茄严重减产甚至绝收。TYLCV在我国的流行呈现明显的由南向北、由东南部沿海向中西部内陆蔓延的趋势。
由于TYLCV为ssDNA,具有较高突变频率,因此在不同地理区域形成致病力各异的株系,主要有TYLCV-IL、TYLCV-IR、TYLCV- Mld、TYL⁃ CV-Gez等株系[18-19]。因此,为明确我国蔬菜主产区山东省的TYLCV株系分化情况,并为番茄抗TYLCV育种奠定基础,遂对山东多地番茄主产区感染TYLCV病株进行检测和病毒分离物克隆,以期明确山东地区TYLCV的株系分化情况,构建TYLCV山东分离物侵染性克隆,克服烟粉虱自然接种的弊端,为番茄抗Ty育种、研究TYLCV侵染循环及TYLCV病害防控技术等奠定基础。
1 材料与方法
1.1材料
1.1.1病毒样品
2012~2014年分别采集覆盖整个山东省16个地市的96份具黄化、卷叶症状的番茄感病叶片,并于-80℃保存,42份用于进化分析的GenBank数据见表1,包含国内不同地区具有代表性的TYLCV分离物29份,以及国外其他地区代表性的分离物12份和1份外群。
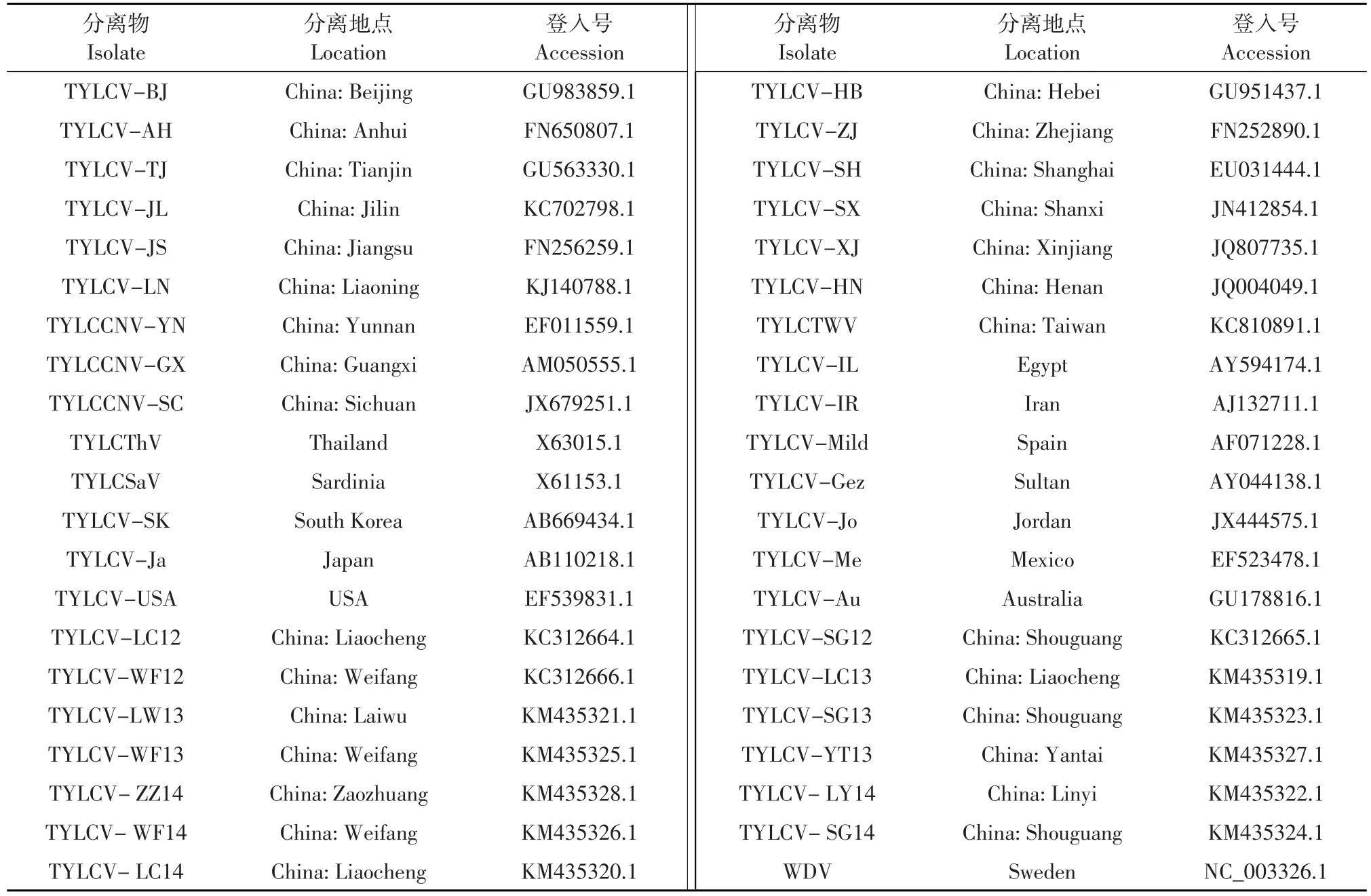
表1 番茄黄化曲叶病毒GenBank登入号Table 1 GenBank accession numbers of TYLCV in this study
1.1.2主要试剂
2×Taq MasterMix、RNase-Free Water(购自康维世纪);pMD19-T Vector(购自TaKaRa公司);DNA快速纯化回收试剂盒(购自TaKaRa公司);Amp、Rif、Kan、YEP、LB、大肠杆菌DH5a、根癌土壤农杆菌EHA105、植物表达载体pBI121等均由课题组自备。
1.2方法
1.2.1 DNA提取
按王伟伟等[20]报道的方法快速提取番茄叶片总
DNA。
1.2.2 TYLCV PCR特异性检测及全序列克隆和序列测定
1.2.2.1 TYLCV PCR特异性检测
利用设计的TYLCV特异引物TY-F/TY-R(见表2)检测鉴定所采集的样品,检测体系为:11 μL 2×Taq MasterMix,11 μL RNase-Free Water,1 μL上游引物TY-F(20 μmol·L-1),1 μL下游引物(20 μmol·L-1),1 μL感病番茄叶片总DNA;PCR检测参数为:94℃预变性4 min,94℃变性40 s,54℃退火45 s,72℃延伸1 min,38次循环后72℃充分延伸10 min。

表2 用于TYLCV DNA序列克隆的引物Table 2 Primers used for cloning DNA of TYLCV
1.2.2.2 TYLCV全序列克隆和序列测定
对特异性检测阳性样品利用TYLCV背靠背引物Full-F/Full-R(见表2)扩增DNA全长序列,检测体系为:10×反应缓冲液2.5 μL,MgCl(225 mmol·L-1)1.5 μL,dNTP(10 mmol·L-1)2 μL,上下游引物各1 μL,DNA模板1 μL,LATaq DNA聚合酶(5 U·μL-1)0.25 μL,加ddH2O至25 μL;PCR检测参数为:94℃预变性4 min,94℃变性45 s,52℃退火45 s,72℃延伸3 min,38次循环后72℃充分延伸10 min。
PCR产物经1.2%琼脂糖凝胶电泳,回收约2 800 bp目的条带,分别经pMD19-T载体连接后转化大肠杆菌,对鉴定有重组质粒的大肠杆菌菌株分别测序。
1.2.3 TYLCV山东分离物株系分化分析
序列相似性利用DNAMAN6.0(Lynnon biosoft,quebec,Canada)进行分析;多序列比对采用Clust⁃alX2软件,系统进化树的构建使用MEGA5中基于Kimura 2-parameter model的邻接法(Neighbor-join⁃ing),并进行1 000次bootstrap检验;同时TYLCV山东省内分离物的遗传距离分析也采用MEGA5软件和DnaSP Version 5软件,以期明确不同地区TY⁃LCV种群遗传多样性及群体变异水平。
1.2.4 TYLCV山东寿光分离物侵染性克隆的构建
对连接到pMD19-T载体上的山东寿光(SD-SG13)分离物进行全序列检测,证实并未发生扩增突变,将该重组载体命名为pMD19T-SG13-1.0A;用SacⅠ和Bam HⅠ对pMD19T-SG13-1.0A重组载体酶切,回收2.2 kb(0.78A)大小的目的片段,将该目的片段插入同样经SacⅠ和Bam HⅠ酶切的植物表达载体pBI121中,命名为pBI121-SG13-0.78A;用Bam HⅠ对pMD19T-SG13-1.0A单酶切,获得约2.8 kb(1.0A)的目的片段,并将其插入同样经Bam HⅠ单酶切的pBI121-SG13-0.78A,从而构建成含有1.78个重复的山东寿光(SD-SG13)分离物侵染性克隆pBI121-SG13-1.78A。利用Bam HⅠ对pBI121-SG13-1.78A进行单酶切,以及利用SacⅠ和Bam HⅠ对pBI121-SG13-1.78A进行双酶切,验证构建的侵染性克隆,并将构建的侵染性克隆pBI121-SG13-1.78A通过电击转化法导入农杆菌EHA105中。
1.2.5侵染性克隆的致病性鉴定
为验证侵染性克隆pBI121-SG13-1.78A的致病性,遂进行农杆菌介导的植物接种鉴定。将含有pBI121-SG13-1.78A的农杆菌接种在含Kan和Rif 的5 mL LB液体培养基中振荡培养24 h(28℃),取500 μL菌液加入含相同抗生素以及含10 mmol·L-1MES、20 μmol·L-1AS的LB液体培养基中振荡培养12 h(28℃),离心收集菌体,并用10 mmol·L-1MES、10 mmol·L-1MgCl2、0.1 mmol·L-1AS混合液悬浮菌体。用1 mL无菌注射器将菌液分别接种于4~6叶期的番茄、辣椒和本氏烟的叶柄处和叶脉处韧皮部,每种植物接种10株,3次重复。接种植株置于防虫光照培养室,于25℃、16 h光照下培养,接种两周后统计发病情况。
2 结果与分析
2.1 TYLCV PCR特异性检测
根据GenBank上已知的TYLCV序列,利用Oli⁃go软件设计特异性引物TY-F/TY-R,对2012~2014年间采集的覆盖整个山东省16个地市的96份具黄化、卷叶、皱缩症状的番茄感病叶片进行初步检测,其中有94份样品检测到400 bp左右的目的条带,而这94份样品覆盖整个山东省的16个地市(见图1),说明山东省内绝大部分番茄生产区已受到TYLCV危害;其余2份未检测出目的条带的样品经初步分析,为番茄卷叶病毒(ToLCV)侵染,从而表现出类似于番茄黄曲叶病毒侵染所致的症状。
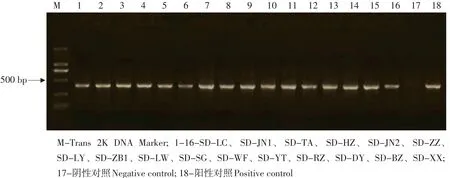
图1 特异性引物TY-F/TY-R对部分感病番茄样品的PCR检测Fig. 1 PCR amplification of some susceptible tomato samples by specific primers TY-F/TY-R
2.2 TYLCV全序列克隆和序列测定
2012年所采集的32份样品,经背靠背引物Full-F/Full-R PCR扩增,均能扩增出2 800 bp目的条带,扩增产物分别与pMD19-T载体连接后进行序列测定,对测序结果利用ClustalX2软件分别进行双序列和多序列比对,将该32份TYLCV分离物分为3个株系,分别为TYLCV-SD-WF12、TYL⁃CV-SD-SG12、TYLCV-SD-LC12。对2013年采集的32份样品,除山东寿光和济南各有1份样品为ToLCV侵染,其余30份样品经PCR扩增,也扩增出2 800 bp目的条带,经序列测定和序列比对,该31份分离物鉴定为5个株系,分别为TYL⁃CV-SD-LC13、TYLCV-SD-LW13、TYLCV-SDSG13、TYLCV-SD-WF13、TYLCV-SD-YT13。对2014年所采集的32份样品,经序列测定和序列比对,也鉴定为5个株系,分别为TYLCV-SDLC14、TYLCV-SD-SG14、TYLCV-SD-WF14、TY⁃LCV- SD-LY14、TYLCV-SD-ZZ14。该13份株系的全序列PCR扩增结果如图2所示。与此同时,将其基因组数据提交到GenBank上,登入号见表1。

图2 TYLCV DNA全长PCR扩增Fig. 2 DNA full length amplification of TYLCV by PCR
2.3 TYLCV山东分离物株系分化分析
对山东省分离出的13份TYLCV株系全基因序列进行分析可知,该13份株系的DNA序列全长均为2 781 bp,经过与GenBank中具代表性的TYLCV不同株系全序列核苷酸一致率比对(登入号见表1),发现该13份病毒株系与TYLCV-IL、TYLCVIR、TYLCV-Mild、TYLCV-Gez核苷酸一致率分别为95.7%~98.5%、90.7%~91.3%、90.6%~92.2%、87.8%~90.3%;与番茄黄化曲叶泰国病毒(TYL⁃ CThV)的核苷酸一致率为69.2%~72.4%;与番茄黄化曲叶撒丁岛病毒(TYLCSaV)核苷酸一致率为71.6%~ 73.4%;与番茄黄化曲叶中国病毒(TYLCCNV)核苷酸一致率为70.3%~73.9%,由此可知,侵染山东的TYLCV与TYLCV-IL株系的核苷酸一致率较高,说明其病毒来源可能是TYLCV-IL株系。
为明确山东TYLCV分离物的系统进化关系,遂对表1中各地具有代表性的Ty分离物构建系统进化树(见图3)。

图3 基于TYLCV全序列构建的系统进化树Fig. 3 Phylognetic tree constructed with complete sequence of TYLCV
从系统进化树可知,除外群(WDV)单独形成一个分支外,其他Ty分离物聚为3个类群。云南、广西、四川的Ty分离物与TYLCThV、TYLCTWV、TYLCSaV聚在ClusterⅢ内,该群与ClusterⅠ、ClusterⅡ内分离物的同源性在73.0%~76.6%,说明ClusterⅢ与其他两群的亲缘关系较远;TYLCVGez、TYLCV-Ja、TYLCV-Mild聚在ClusterⅡ内,该群与ClusterⅠ内分离物的同源性在89.7%~93.6%,说明这两个类群的亲缘关系较近;其余32份覆盖我国东部沿海省份、华北地区和中西部内陆地区的Ty分离物聚在ClusterⅠ内,并与TYL⁃CV-IL、TYLCV-IR株系聚在同一群。由图3可知,ClusterⅠ类群又分为3个亚组,亚组的组内(间)遗传距离见表3,组内遗传距离小于组间遗传距离,说明分组合理,结合核苷酸一致率分析可知,侵染我国山东地区的TYLCV为TYLCV-IL株系在山东省内不同地区适应当地环境后演变出的不同株系,且3年间爆发于山东省内的TYLCV株系的DNA组分并未发生大的变异。
本研究鉴定的13份山东TYLCV株系分别聚在GroupⅠ和GroupⅡ内,利用DnaSP软件计算出亚组Ⅰ、Ⅱ、Ⅲ的|Fst|值分别为0.0475、0.0563和0.0788,均小于0.33,说明亚组Ⅰ、Ⅱ、Ⅲ间的TYLCV各株系基因交流频繁,并处于一种波动发展的状态。
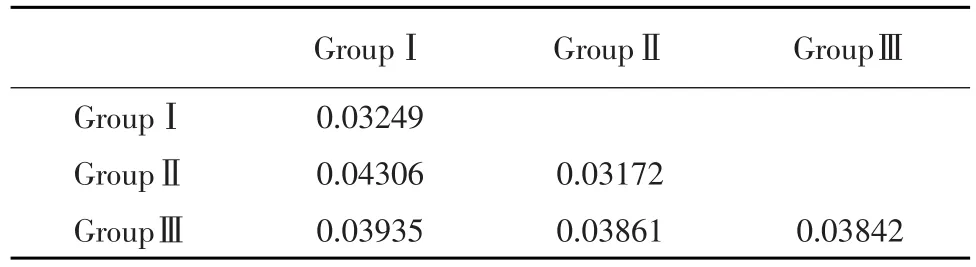
表3 ClusterⅠ亚组内(间)的遗传距离分析Table 3 Genetic distance within andbetween groups of ClusterⅠ
2.4 TYLCV山东寿光分离物侵染性克隆的构建
对2012~2014年山东省分离出的13份TYLCV株系全基因组序列与GenBank上已公布的Ty基因组序列多序列比对分析,以及TYLCV的系统进化树分析可知(见图3),该13份TYLCV株系均与TY⁃LCV-IL株系亲缘关系较近,其基因组相似性达到95.7%~98.5%,因此随机选择山东寿光(SD-SG13)TYLCV株系构建侵染性克隆。
为验证构建的山东寿光(SD-SG13)TYLCV株系侵染性克隆pBI121-SG13-1.78A是否正确,遂利用Bam HⅠ对pBI121-SG13-1.78A质粒进行单酶切,获得大小约为15和2.8 kb的2个目的条带(见图4);以及利用SacⅠ和Bam HⅠ对pBI121-SG13-1.78A质粒进行双酶切,获得大小约为13 kb、2.2 kb和600 bp的3个目的条带(见图4),因此说明构建的侵染性克隆pBI121-SG13-1.78A是正确的。

图4 山东寿光(SD-SG13)TYLCV株系侵染性克隆的酶切鉴定Fig. 4 Enzyme cutting identify of TYLCVShandong-Shouguang isolate
2.5侵染性克隆的致病性鉴定
利用构建的侵染性克隆对6~8叶期的番茄、辣椒和本氏烟分别接种,3周后统计发病情况(见表4)。

表4 TYLCV侵染性克隆诱导的致病率Table 4 Infectivity efficiency of the infectious clone
由表4可知,接种的30株番茄有20株表现出叶片卷曲、皱缩、黄化症状,致病率达66.7%;接种的30株本氏烟均表现出明显的叶片皱缩、叶脉增厚、黄化等症状,接种本氏烟的致病率达100%;接种的30株辣椒,仅有1株表现有叶边缘卷曲的症状,侵染性克隆诱导的症状如图5所示。对表现叶片黄化、皱缩卷曲症状的番茄、本氏烟、辣椒分别提取叶片总DNA,并利用TYLCV特异性引物TY-F/TY-R进行PCR扩增,其中番茄、本氏烟均能扩增到约400 bp的目的片段,而表现为叶边缘卷曲症状的1株辣椒并未能扩增到400 bp的目的片段,说明该株辣椒并未被TYLCV侵染性克隆所侵染,番茄和本氏烟上表现出来的叶片皱缩、曲叶、黄化症状是由TYLCV侵染性克隆pBI121- SG13-1.78A所引起的。因此,本试验构建的山东寿光(SD-SG13)TYLCV侵染性克隆pBI121-SG13- 1.78A具有侵染性。

图5 侵染性克隆诱导的症状Fig. 5 Typical symptom on the plants induced by the infectious clone
3 讨论与结论
从国外番茄产区TYLCV的发病趋势看,番茄黄化曲叶病毒病的严重发生总是烟粉虱大爆发后[21]。近年来,由于烟粉虱在我国诸多省份番茄主产区爆发成灾,无论是露地栽培番茄,还是保护地栽培番茄都长期受害。因此,加强烟粉虱监测和防治、采取合理的栽培模式和田间管理措施、及选育含Ty-1[22]、Ty-2、Ty-3[23]等抗性基因的抗病品种都是防控TYLCV的重要途径。
目前,侵染我国番茄的Ty病毒主要有三种:一种为主要侵染我国西南部省份广西、云南、四川的TYLCCNV;一种为侵染台湾、广东地区的TYLCTWV;另一种为侵染我国东南沿海省份,以及中东部内陆地区和华北地区的TYLCV。通过对山东省所采集的96份感病样品进行特异性检测,发现有94份样品感染TYLCV,有2份样品感染ToLCV,对94样品进行全序列克隆和序列测定,共分离出13份株系,经核苷酸序列相似性分析和系统进化树的构建(见图3),明确侵染我国山东地区的TYLCV为TYLCV-IL株系在山东省内不同地区适应当地环境后所演变出的不同株系,且2012~ 2014年,爆发于山东省内的TYLCV株系的DNA组分并未发生大的变异。从亲缘关系看,本次分离的山东TYLCV分离物与江苏、浙江、上海等地分离物亲缘关系较近,并与韩国、美国的分离物也具有较近亲缘关系,但与侵染我国番茄的其他粉虱传双生病毒亲缘关系较远。因此推断,引起山东地区的TYLCV可能是由于上海、浙江等地进口带毒番茄种苗,由烟粉虱作为传毒介体传播造成。
Lapidot报道表明,番茄抗Ty品种的抗病性鉴定方法主要有烟粉虱接种法、嫁接接种法、农杆菌注射接种法。烟粉虱接种法操作繁琐,容易使周边作物受到危害,由于烟粉虱个体较小,试验结束后如何处理烟粉虱也是一个问题,且该方法使番茄感病率不稳定[24];嫁接接种法虽能够为待鉴定的番茄植株提供大量的Ty病毒[25],但该方法耗时耗力,适合于少量的致病性鉴定[26];农杆菌接种法指将构建的病毒侵染性克隆转入寄主植株[27],与其他两种接种方法相比,农杆菌注射法可有效控制接种病毒数量、接种时期和接种部位。本研究制备的TYLCV山东寿光分离物侵染性克隆pBI121- SG13-1.78A,经致病性验证,具有较好的侵染率,可在番茄抗Ty育种研究中作为毒源使用,为番茄品种抗性筛选提供新的简便、可靠途径。
[参考文献]
[1]Caciagli P, Bosco D, Lina A B. Relationships of the Sardinian iso⁃late of tomato yellow leaf curl geminivrus with its whitefly vector Bemisia tabaci Gen[J]. Eur J Plant Pathol, 1995, 101: 163-170.
[2]Polston J E, Anderson P K. The emergence of whitefly transmitted geminivirus in tomato in the western hemisphere[J]. Plant Dis⁃ease, 1997, 81(12): 1358-1369.
[3]Murad G. A review of the mechanisms and components that deter⁃mine the transmission efficiency of Tomato yellow leaf curl vi⁃rus(Geminiviridae; Begomovirus) by its whitefly vector[J]. Virus Research, 2014, 186: 47-54.
[4]Cohen S, Harpaz L. Periodic rather than continual acquisition of a new tomato virus by its vector, the tobacco whitefly (Bemisia taba⁃ci Gennadius)[J]. Entomologia Exp Appl, 1964, 7(2): 155-166.
[5]Credi R, Betti L, Canova A. Association of a geminivirus with a se⁃vere disease of tomato in Sicily[J]. Phytopath Medit, 1989, 28: 223-226.
[6]Moriones E, Arno J, Accotto G P, et al. First report of tomato yel⁃low leaf curl virus in Spain[J]. Plant Disease, 1993, 77: 953-954.
[7]Varma A, Malath I G. Emerging geminivirus problems, A serious threat to crop production[J]. Annals of Applied Biology, 2003, 142: 145-164.
[8]Czosnek H, Laterrot H. A worldwide survey of tomato yellow leaf curl viruses[J]. Arch Virol, 1997, 142: 1391-1406.
[9]Moshe L, Galit W, Lidya C, et al. Biolistic inoculation of plants with Tomato yellow leaf curl virus DNA[J]. Journal of Virological Methods, 2007, 144: 143-148.
[10]蔡健和,秦碧霞,朱桂宁,等.番茄黄化曲叶病毒在广西爆发的原因和防治策略[J].中国蔬菜, 2006(7): 47-48.
[11]王东生,匡开源,袁永达,等.上海市番茄黄化曲叶病毒在上海发生流行的初步观察[J].上海蔬菜, 2007(4): 61-62.
[12]Gang L, L M Z, Xiang W, et al. New natural host of tomato yellow leaf curl virus identified in and near tomato-growing greenhouses in eastern China[J]. J Gen Plant Pathol, 2014, 80: 449-453.
[13]余文贵,赵统敏,杨玛丽,等.山东、安徽两省栽培番茄烟粉虱传双生病毒的PCR检测及序列分析[J].江苏农业学报, 2009, 25(4): 747-751.
[14]赵统敏,余文贵,杨玛丽,等.番茄黄化曲叶病毒病在江苏的爆发与综合防治[J].江苏农业学报, 2007, 23(6): 654-655.
[15]张爱红,张书敏,刘帅,等. 2009年河北省番茄黄化曲叶病毒病发生危害和分布[J].植物保护, 2010, 36(4): 127-129.
[16]胡京昂,郭竞,崔杏春,等.番茄黄化曲叶病毒郑州分离物外壳蛋白基因的克隆与序列分析[J].河南农业科学, 2013, 42(9): 87-90.
[17]阮涛,杨会房,杨水英,等.分离自陕西泾阳番茄的黄化曲叶病毒(TYLCVD)的分子特征[J].农业生物技术学报, 2013, 21(1): 97-105.
[18]Fauquet C M, Briddon R W, Brown J K, et al. Geminivirus strain demarcation and nomenclature[J]. Arch Virol, 2008, 153: 783-821.
[19]Navot N, Pichersky E, Zeidan M, et al. Tomato yellow leaf curl vi⁃rus: A whitefly-transmitted geminivirus with a single genomic component[J]. Virology, 1991, 185: 151-161.
[20]王伟伟,朱长青,刘小花,等.番茄叶片基因组DNA快速制备技术及其在基于实时荧光定量PCR的转基因检测中的应用[J].遗传, 2011, 33(9): 1017-1022.
[21]Banuelos B H, Mauricio J A, Cardenas Y C, et al. A new strain of tomato severe leaf curl virus and a unique variant of tomato yellow leaf curl virus from Mexico[J]. Arch Virol, 2012, 157: 1835-1841.
[22]姜景彬,彭祥珍,许向阳,等.番茄抗番茄黄化曲叶病基因Ty-1的遗传分析与AFLP标记[J].东北农业大学学报, 2014, 45(3): 34-39.
[23]姜景彬,刘晓东,许向阳,等.番茄抗黄化曲叶病毒基因Ty-3 的AFLP标记[J].东北农业大学学报, 2014, 45(1): 103-107.
[24]Lapidot M, Jane E. Polston Resistance to tomato yellow leaf curl virus in tomato[M]. Natural Resistance Mechanisms of Plant Vi⁃ruses, 2006: 503-520.
[25]Friedmann M, Lapidot M, Cohen S, et al. A novel source of resis⁃tance to tomato yellow leaf curl virus exhibiting a symptomless re⁃action to viral infection[J]. J. Amer Soc Hortic Sci, 1998, 123: 1004-1007.
[26]于力,朱龙英,万延慧,等.上海地区番茄黄化曲叶病毒病的鉴定及嫁接接种法研究[J].基因组学与应用生物学, 2009, 28: 115-118.
[27]Grimsley N, Hohn T, Davis, et al. Agrobacterium-mediated deliv⁃ery of infectious maize streak virus into maize plants[J]. Nature, 1987, 325: 177-179.
Xue Dongqi, Liu Guan, Jiang Jingbin, et al. Strain differentiation and infectious clone construction of tomato yellow leaf curl virus in Shandong Province[J]. Journal of Northeast Agricultural University, 2015, 46(1): 26-33. (in Chinese with English abstract)
Strain differentiation and infectious clone construction of tomato yellow
leaf curl virus in Shandong Province
/XUE Dongqi, LIU Guan, JIANG Jingbin, XUXiangyang, LI Jingfu
(School of Horticulture, Northeast Agricultural University, Harbin 150030, China)
Abstract:There were 96 samples of a sense of tomato yellow leaf curl virus (TYLCV) that were collected in Shandong Province between 2012-2014. After specific detection, 94 samples infected TYLCV and two samples infected ToLCV. The 94 samples that infected TYLCV were cloned and sequenced the whole sequence. The results showed that 13 TYLCV strains were separated. By nucleotide sequence similarity analysis and phylogenetic tree construction, We identified that the TYLCV isolates infected Shandong area belonged TYLCV-IL strains, and TYLCV DNA component of Shandong Province didn't occur large variation between 2012-2014. Then we constructed Shandong Shouguang TYLCV strain infectious clone, By pathogenic verification, It had a better infection rate. Therefore, It provide a stable viral source of selection pressure for anti-Ty tomato breeding.
Key words:tomato yellow leaf curl virus; specific detection; phylogenetic tree; infectious clone
*通讯作者:李景富,教授,博士生导师,研究方向为蔬菜遗传育种与生物技术。E-mail: Ljf_2005@126. com
作者简介:薛东齐(1987-),男,博士研究生,研究方向为蔬菜遗传育种与生物技术。E-mail: xuedongqi2009@hotmail. com
基金项目:“十二五”国家科技计划项目(2012BAD02B02-7)
收稿日期:2014-09-09
文章编号:1005-9369(2015)01-0026-08
文献标志码:A
中图分类号:S436.412.1+1
