己烯雌酚及代谢物在鲤体内的组织分布及药物代谢动力学
2015-11-05徐英江任传博薛敬林田秀慧刘慧慧宫向红
徐英江 任传博 孙 岩 薛敬林 田秀慧 刘慧慧 宫向红
(1. 山东省海洋资源与环境研究院, 山东省海洋生态修复重点实验室, 烟台264006; 2. 烟台山水海产有限公司, 烟台 264006)
己烯雌酚(Diethylstilbestrol, DES)和双烯雌酚(Dienestrol, DS)均是经由人工合成的非甾体类雌激素, 并且双烯雌酚经实验确证为己烯雌酚的代谢物[1—3], 己烯雌酚和双烯雌酚均具有化学结构简单、并且通过化学合成容易获得、合成成本较低的特点[4,5]。在水产养殖中, 己烯雌酚的主要用途是作为添加剂加入鱼类饲料中[6—9],刺激鱼类正常新陈代谢, 增加鱼体内氮停留, 提高鱼体内氨基酸合成蛋白的速度, 最终达到促进鱼类生长的目的[10,11]。其中残留在鱼体内的己烯雌酚和双烯雌酚通过食物链进入人体, 破坏人体正常生理平衡, 两种物质对人类的危害也被逐渐发现, 且己烯雌酚已被证实是一种致癌物质,在体内的长期蓄积必然严重危害人和动物的健康[12—15]。美国和欧盟已经明令禁止使用己烯雌酚。2002年, 我国农业部在第 193号公告中宣布停止己烯雌酚在所有食用动物中使用[16,17]; 并在第 235号公告中规定己烯雌酚在动物性食品中不得检出[18], 但目前的相关法令和标准尚未制定双烯雌酚的测定标准。
鲤作为我国重要的食用鱼类, 因其营养丰富、经济价值高深受消费者喜爱。本试验采用口灌给药的方法对常规养殖的鲤进行给药, 进一步研究了两种物质在鲤体内不同组织中的分布情况以及相关药物代谢参数。本试验可为己烯雌酚在其他水生生物体内的药物代谢提供参考, 并且可以为水产养殖科学规范用药提供依据。
1 材料与方法
1.1 药品与试剂
乙腈、乙酸乙酯、甲醇、正己烷为色谱纯, 所用水为超纯水; 碳酸钠为分析纯, 盐酸为优级纯; 标准品己烯雌酚和标准品双烯雌酚(纯度 99.5%), 内标标准品 D8-己烯雌酚(纯度 99.5%), 上述三种标准品均购自德国Dr. Ehrenstorfer公司; 低分子量肝素钠注射液, 5000 IU,购自杭州九源基因工程有限公司。
1.2 仪器与设备
超高效液相色谱-串联质谱仪(TSQ Vantage, Thermo,USA), 旋转蒸发仪(Laborota 4001, Heidolph, Germany),氮吹仪(N-EVAPTM112, Organomation Associates, USA),超纯水仪(Milli-Q Gradient, Millipore, France), 超声波清洗器(KQ-600E, 江苏, 昆山市超声仪器有限公司), 高速离心机(TGL-10C, 上海, 安亭科学仪器厂), 微孔滤膜(0.22 μm, Millipore, France )。
1.3 试验设计及采样程序
试验用鲤, 试验进行前抽取样品检测体内不含分析物, 体重40—60 g, 富集试验前暂养在长方形玻璃水槽(70 cm×40 cm×50 cm) 3d, 每天换水1次, 期间不喂食。试验中挑选大小均匀、体重正常的鲤进行试验。试验过程中连续充氧, 保持水中溶解氧大于5.0 mg/L, 鲤存活率大于95%。选择经过暂养的健康鲤, 随机分为10个组, 每组约80尾。
准确称量一定量的己烯雌酚标准品, 用冷却的淀粉乳浊液溶解定容至试验所需0.1、1.0和10.0 mg/kg bw 3个质量浓度, 加入少量食用色素, 使乳浊液呈现红色。在整个试验过程中, 记录时间, 做好标签。具体操作方法如下: 在1 mL的注射器上接上约5 cm长度左右的塑料软管,吸取己烯雌酚后, 将软管通到鱼的胃部, 灌药后若鲤没有红色液体吐出, 即可作为试验用, 否则的话弃之不用。在整个试验过程中每天记录水温以及鲤的死亡情况。
血液样品的采集: 将适合试验所用的鲤用抄网捞起,用干净纱布擦干鱼体后, 将1 mL注射器针头插入鳃下心脏取血200—500 μL, 随即放入离心管中(离心管事先要放入少量肝素钠, 防止血凝固), 混合均匀后高速离心, 取上层血浆后, 置于–18℃条件下保存。肝胰脏和肌肉样品的采集: 去除鲤的内脏、皮和骨骼等, 取肌肉部分搅碎,并装入密封袋保存; 将整个肝胰脏取出, 装入离心管备用。肌肉和肝胰脏均须置于–18℃保存, 测定前先将其在室温条件下解冻, 然后再进行分析测定。
1.4 样品前处理及净化
样品前处理及净化方式参见文献[19]。
1.5 超高效液相色谱-串联质谱分析方法
色谱柱: Thermo C18(1.9 μm, 2.1 mm i.d.×100 mm);流动相: 甲醇和水; 流速: 0.25 mL/min; 进样量: 10 μL;柱温: 35℃。
电离方式: HESI-; 离子传输管温度: 350℃; 气化温度: 350℃; 鞘气压力: 40 arb; 辅助气流量: 10 arb; 喷雾电压: 3000 V。己烯雌酚监测离子对: 267>222, 267>251;双烯雌酚监测离子对: 265>93, 265>249; D8-己烯雌酚监测离子对: 275>259。
1.6 数据处理方法
试验过程中对每个时间点进行分析测定, 并且取平行组的平均值, 采用DAS 2.0计算程序, 处理不同浓度口灌给药后鲤体内的己烯雌酚和双烯雌酚的含量-时间数据,并且计算出有关代谢参数。
2 结果与讨论
2.1 己烯雌酚及双烯雌酚的定量分析
配制质量浓度分别为5.0、10.0、25.0、50.0、100和200 ng/mL己烯雌酚及双烯雌酚混标溶液, 流动相定容,内标法定量, 己烯雌酚标准曲线方程为y=0.00618764x–0.0171144, 相关系数R2=0.9994; 双烯雌酚标准曲线方程为y=0.00732259x+0.0103639, 相关系数R2=0.9996。在空白鲤样品中添加己烯雌酚标准溶液, 添加水平为0.5 µg/kg时, 信噪比(S/N)大于10, 表明己烯雌酚检测下限(LOD)可达0.5 µg/kg; 同理双烯雌酚定量下限(LOQ)可达1.0 µg/kg。
2.2 口灌给药后己烯雌酚及其代谢物双烯雌酚在鲤血浆中的分布和消除
在鲤口灌给药后, 血浆中己烯雌酚及代谢物双烯雌酚浓度-时间曲线如图 1所示。自一次口灌给药后, 鲤体内己烯雌酚含量逐渐增大, 均在 2h达到最大值, 随后己烯雌酚含量逐渐减少, 分别在10、12和12h降至检出限以下, 在消除阶段均出现前期消除速率快、后期消除速率相对减缓的趋势, 平均消除速率分别 1.65、12.64和150.2 µg/(L×h)。在给药后 0.25h检测出双烯雌酚, 给药后2h达到最大浓度, 最大浓度分别为5.52、26.5和321 µg/L,并在8、12和12h降至检出限以下, 消除速率趋势与己烯雌酚一致, 其平均消除速率分别0.92、2.65和32.1 µg/(L×h)。
2.3 口灌给药后己烯雌酚及其代谢物双烯雌酚在鲤肌肉中的分布和消除
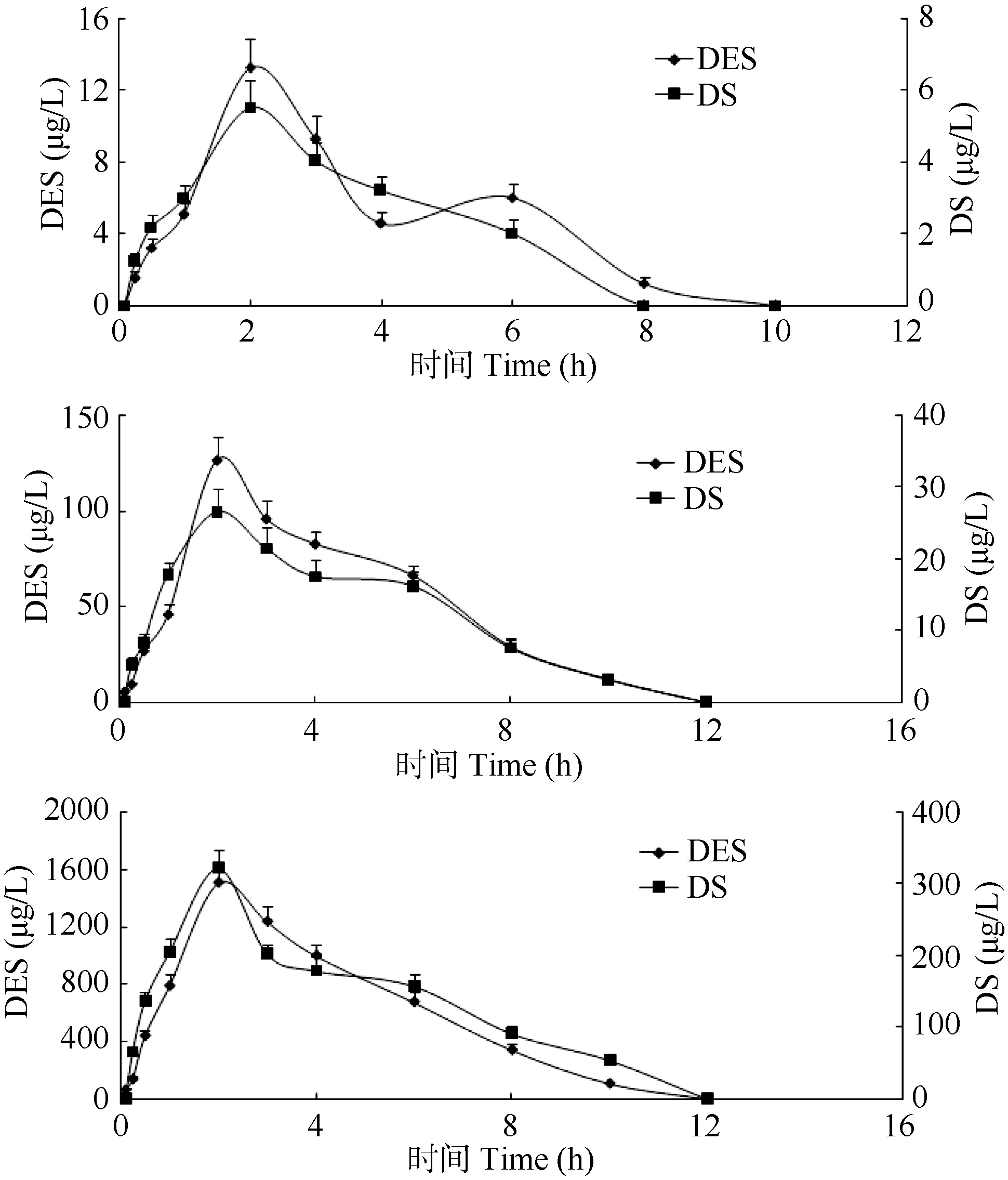
图1 口灌给药后己烯雌酚及其代谢物双烯雌酚在鲤血浆中的浓度-时间图Fig.1 Content of Diethylstilbestrol and its metabolite Dienestrol in plasma versus time
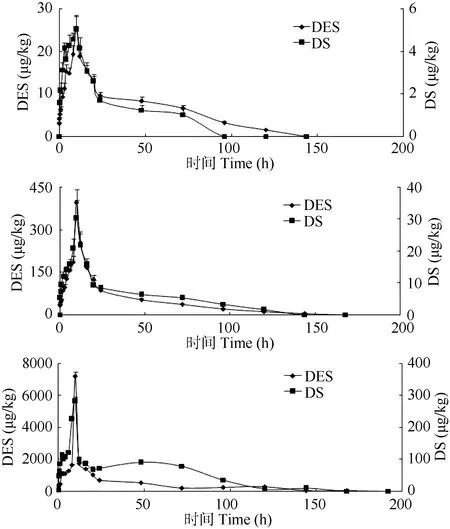
图2 口灌给药后己烯雌酚及其代谢物双烯雌酚在鲤肌肉中的浓度-时间图Fig. 2 Content of Diethylstilbestrol and its metabolite Dienestrol in muscle versus time
在鲤口灌给药后, 肌肉中己烯雌酚及代谢物双烯雌酚浓度-时间曲线如图2所示。肌肉中己烯雌酚含量逐渐增大, 均在10h达到最大浓度, 最大浓度值分别为25.4、395.6和7186 µg/kg; 随后鲤体内己烯雌酚含量逐渐减少,上述3浓度分别在144、168和192h降至检出限以下, 均出现前期消除速率快、后期消除速率相对减缓的趋势; 至试验24h, 己烯雌酚已降至9.52、 85.36和665 µg/kg, 仅为最高浓度的 37.5%、21.6%和 9.25%, 己烯雌酚平均消除速度分别 0.19、2.50和 39.5 µg/(kg×h)。数据表明在高浓度条件下, 己烯雌酚的平均消除速率明显大于低浓度条件下的平均消除速率; 若减少相同百分比的浓度, 高浓度条件下所需的时间更短。双烯雌酚与己烯雌酚变化趋势相似, 分别在给药后0.5、0.25和0.1h检测出双烯雌酚,给药后10h达到最大浓度, 最大浓度值分别为5.02、30.2和280.6 µg/kg, 并在96、14和168h降至检出限以下, 双烯雌酚表现出与己烯雌酚一致的消除速率趋势, 其平均消除速度分别 0.058、0.23 和 1.77 µg/(kg·h)。
2.4 口灌给药后己烯雌酚及其代谢物双烯雌酚在鲤肝胰脏中的分布和消除
在鲤口灌给药后, 肝胰脏中己烯雌酚及代谢物双烯雌酚浓度-时间曲线如图 3所示, 相比较己烯雌酚在血浆及肌肉中的分布和消除, 肝胰脏表现出明显的富集能力。自一次口灌给药后, 肝胰脏中己烯雌酚含量逐渐增大,上述 3浓度均在 8h达到最大值, 最大值分别为 157.9、1589和20000.8 µg/kg; 随后鲤体内己烯雌酚含量逐渐减少, 上述3浓度分别在144、192和216h降至检出限以下,均出现前期消除速率快、后期消除速率相对减缓的趋势;至试验24h, 己烯雌酚已降至25.2、 157.9和529.1 µg/kg,仅为最高浓度的 16.0%、9.94%和 2.65%, 己烯雌酚平均消除速度分别为 1.16、8.64和 96.2 µg/(kg×h)。数据表明在鲤的肝胰脏中, 高浓度条件下己烯雌酚的消除速率明显大于低浓度条件下的消除速率; 若减少相同百分比浓度, 高浓度条件下所需的时间更短。双烯雌酚与己烯雌酚变化趋势相似, 均在给药后 0.25h检测出双烯雌酚, 给药后 8h达到最大浓度, 最大浓度分别为 29.7、358.6和5122.8 µg/kg, 并在96、168和192h降至检出限以下, 消除速率趋势与己烯雌酚一致, 其平均消除速度分别0.34、2.24 和 27.8 µg/(kg·h)。
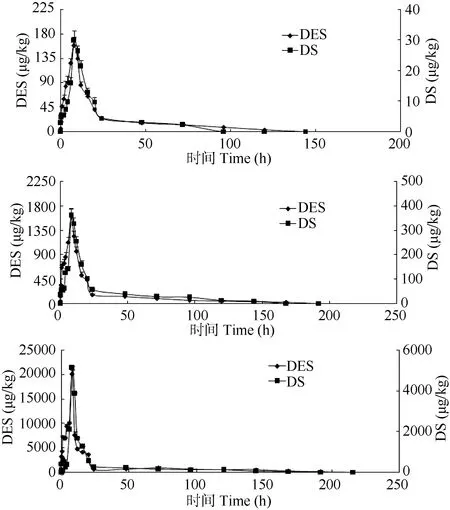
图3 口灌给药后己烯雌酚及其代谢物双烯雌酚在鲤肝胰脏中的浓度-时间图Fig. 3 Content of Diethylstilbestrol and its metabolite Dienestrol in liver versus time
2.5 己烯雌酚在鲤血浆、肌肉和肝胰脏中的药物代谢动力学参数
采用 DAS2.0药物代谢动力学参数计算程序, 计算有关鲤药物代谢动力学参数; 取其中一组己烯雌酚浓度-时间数据, 用对数图进行初步判断, 可见lgC与t呈双指数函数特征, 初步判断该药在鲤体内不是一室模型, 可能为二室模型或三室模型; 相比较三室模型, 二室模型与所测数据有更好的拟合度, 因此本研究采用二室模型。结果见表1。
t1/2β(己烯雌酚的消除相半衰期)在血浆和肝胰脏中,随着口灌给药浓度的增大, t1/2β逐渐增大。但在肌肉中出现相反的规律, 可能是当肌肉体内己烯雌酚含量越高时,可以促进某种酶的生长, 而在这种酶的作用下, 己烯雌酚消除速率增大, 因此其消除相半衰期越短, 此结论有待进一步研究。
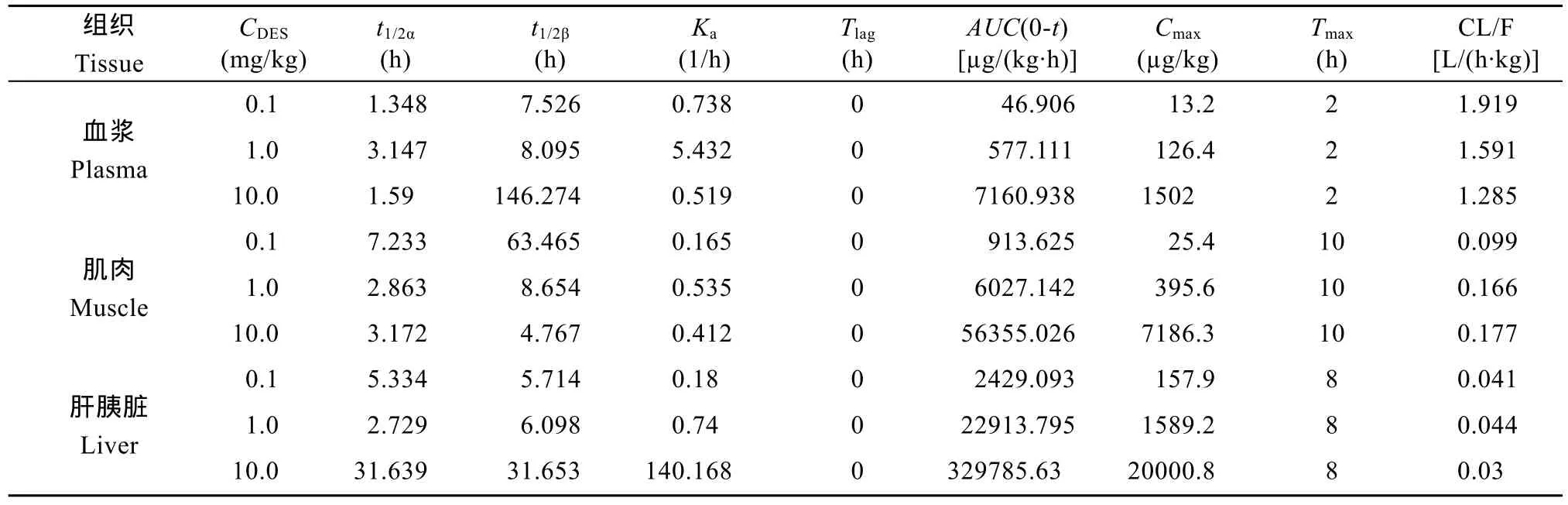
表1 口灌给药后己烯雌酚在鲤血浆、肌肉和肝胰脏中的药物代谢动力学参数Tab. 1 Pharmacokinetic parameters of Diethylstilbestrol in plasma, muscle and liver of Cyprinus carpio
AUC (己烯雌酚浓度-时间曲线下面积)以口灌给药相当于1.0 mg/kg bw己烯雌酚为例, 血浆、肌肉和肝胰脏中AUC 由高到低依次为: 肝胰脏[22913.795 µg/(kg×h)] >肌肉[6027.142 µg/(kg×h)]>血浆[577.111 µg/(L×h)]; 血浆、肌肉和肝胰脏中 AUC值相差很远, 肝胰脏对己烯雌酚的吸收量约是肌肉吸收量的4倍和血浆吸收量的40倍, 说明己烯雌酚的蓄积能力因组织的不同有较大差别。
CL/F与 t1/2β都是衡量己烯雌酚在鲤各组织消除快慢的指标。以鲤血浆为例, 灌药质量浓度越大, CL/F值越小,以口灌给药相当于1.0 mg/kg bw己烯雌酚为例, 血浆、肌肉和肝胰脏的 CL/F值依次为 1.591、0.166和 0.044 L/(h·kg), 在0.1 mg/kg bw和 10.0 mg/kg bw浓度组 CL/F值变化规律与1.0 mg/kg bw一致。
当口灌给药后, 当达到 Cmax后, 其含量逐渐下降, 血浆中己烯雌酚浓度分别在8、10和10h下降了90%以上; 肌肉中己烯雌酚浓度分别在120、72和24h下降了90%以上;肝胰脏中己烯雌酚浓度分别在72、24和24h下降了90%以上; 如己烯雌酚在肝胰脏中消除 90%比肌肉中所用时间短, 但其浓度降至检出限以下比肌肉所用时间长。
双烯雌酚作为代谢物, 部分相关吸收参数无法使用软件计算, 因此本研究仅借鉴使用了消除试验部分的参数 t1/2β和 CL/F, 两参数均可表明双烯雌酚在鲤体内消除速率的快慢。以口灌给药相当于1.0 mg/kg bw己烯雌酚为例, 血浆、肌肉和肝胰脏中t1/2β值分别为2.517、4.028和254.498h, 血浆、肌肉和肝脏中CL/F值分别为6.105、0.962和0.201 L/(h·kg), 说明各组织消除一半己烯雌酚所用时间血浆最短、肌肉次之, 肝脏最长。
2.6 己烯雌酚休药期的规定
目前水产品残留限量标准规定己烯雌酚不得检出。从试验结果看, 己烯雌酚在鲤的肝胰脏内消除所需要的时间最长, 因此本研究将鲤的肝胰脏作为代谢靶组织。在鲤口灌给药后, 鲤肝胰脏内己烯雌酚和双烯雌酚分别在6、8和9d后均降至检出限以下, 因此基于本试验条件, 将己烯雌酚在鲤体内的休药期可定为6、8和9d。但在实际生产及养殖过程中, 一般多次重复给药或者投喂含有己烯雌酚饲料, 并且会一直投喂直至停药期满、鲤起池为止。因此本试验得出的休药期比实际生产、养殖情况要短, 综合考虑各方面的影响因素可适当延长己烯雌酚在鲤体内的休药期。同时影响鲤代谢的影响因素有很多, 研究表明水温的影响最大。在一定的温度范围内, 随着水温升高,己烯雌酚在鲤体内的代谢强度增强; 水温降低, 其代谢强度将会减弱。文献报道: 每当水温升高 1℃, 药物的代谢速度和消除速度一般情况下会提高 10%左右[20], 因此在实际养殖过程中, 应根据外界环境和养殖习惯适当缩短或延长药物的休药期。
3 结论
当鲤口灌给药后, 在相同条件下, 鲤的肝胰脏中药物浓度最大, 其次是肌肉, 血浆最小; 并且肝胰脏的平均消除速率、浓度最高值以相对于灌药浓度的倍数均高于血浆和肌肉; 即使肝胰脏具有最大的药物平均消除速率,但若将药物消除至检出限以下, 肝胰脏所需时间仍最长。根据相关动力学参数, 初步探讨了己烯雌酚在鲤体内的休药期。但试验条件和实际生产过程存在一定差别, 应根据外界环境和养殖习惯适当缩短或延长药物的休药期,而不应该只单纯规定一个休药期, 最终达到保障消费者食用安全的目的。
