基于流动注射光度法的吸光度/留存时间比自动测定过氧化物酶活性方法
2015-11-03李永生郑巍高秀峰
李永生 郑巍 高秀峰
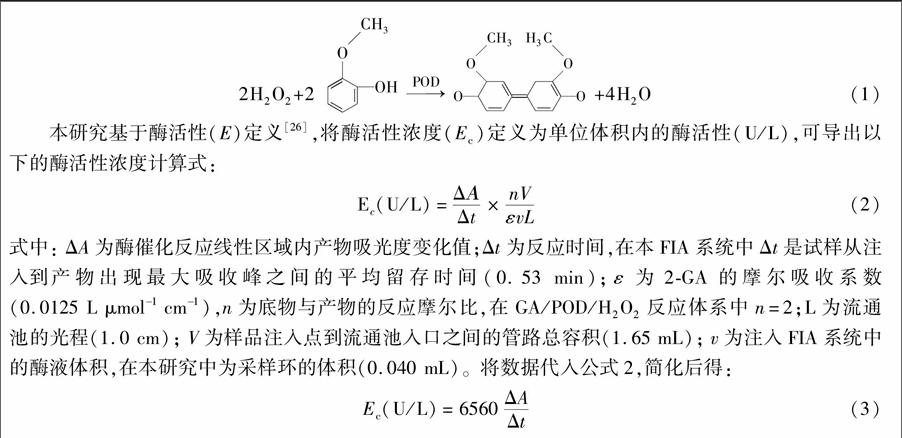
摘 要 本研究给出了流动注射分光光度系统(FI-SP)测定酶活性浓度(Ec)的通用公式Ec=kΔA/Δt; Δt是在酶促反应线性响应区域内试样塞的平均留存时间;ΔA为平均留存时间处对应的吸光度; k=nV/(εvL),V为样品注入点到流通池入口之间的管路总容积,n为酶底物与产物的反应摩尔比,ε为产物的摩尔吸收系数,v为注入的酶液体积,L为流通池光程;FI-SP系统确定后k为常数。在此基础上,将H2O2/过氧化物酶(POD)/愈创木酚(GA)反应体系导入FI-SP系统,建立了一种无需标准曲线的POD活性快速准确测定的新方法。此方法优化后的条件:载流磷酸盐缓冲液浓度为0.05 mol/L(pH 5.5),进样体积为40 μL,反应盘管长度200 cm, 1.5 mmol/L H2O2,3.5 mmol/L GA,0.4 mol/L HCl(清洗液),检测波长470 nm,产物的摩尔吸光系数为0.0125 L(μmol ·cm)。本方法的重现性RSD<0.38%(n=11),分析速度为40样/h,测定范围为450~7260 U/L,检出限为89 U/L。在优化条件及60℃下,用本方法测定了多种白萝卜中POD活性,结果与动力学曲线法完全相同。
关键词 流动注射分析;过氧化物酶;萝卜提取液;愈创木酚;过氧化氢
1 引 言
过氧化物酶(POD, EC 1.11.1.7)是一种广泛存在于植物和动物体内的酶,被应用在临床检验[1]、环境监测[2]、有机合成[3]和食品分析[4]等领域,大多数生化试剂盒都含有POD,其最重要的指标就是酶活性。因此,POD活性的快速准确定量尤为重要。POD能催化酚类或胺类显色试剂与H2O2的反应;常用的显色试剂有邻苯二胺[5]、季胺[6]、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)[7]、邻苯三酚[8]、愈创木酚(GA)[9]、以及胺和酚类的耦合物[1,10]。这些显色剂在POD催化下与H2O2反应生成的产物都可通过比色法进行定量,但最常用的显色剂是低毒性、廉价的GA。早先认为H2O2/POD/GA体系的产物是愈创木酚四聚体(4-GA)[9],但新的研究发现产物是愈创木酚二聚体(2-GA)[11~13]。我们验证了此结果并发现该产物不稳定,会很快分解成其它物质而褪色[14], 这导致采用手工比色法定量POD活性时得到的结果重现性很差。此外,由于该产物不稳定,难以提纯,所以只能通过反应物GA的浓度间接地求得反应体系中产物2-GA的摩尔吸光系数(ε)[15],并用此ε值去计算POD活性;但这又会由于ε差异导致得到的POD活性值产生较大的误差。
测定POD活性方法除比色法外[16], 还有荧光光度法[17,18]和化学发光法[19~21]等。测定POD活性的手工荧光法和化学发光法灵敏度高、线性范围宽;但是,由于POD催化反应的产物激发波长在紫外区,所以被测样品中存在的杂蛋白会对荧光法产生干扰;手工化学发光法的灵敏度虽高但测定结果的重现性较差。流动注射分析(Flow injection analysis, FIA)作为一种自动化分析技术,具有操作简便、分析速度快、精度高等优点[22],它能与各种检测器组合用于酶活性的自动快速测定[23~25]。Holm[7]用ABTS作为供氢体,利用流动注射光度法对发酵样品中微生物POD活性进行了测定;但此方法的不足之处是ABTS试剂的价格昂贵且稳定性也较差。本研究选择价廉、稳定、且被广泛应用的GA作为供氢体,基于FIA光度法建立了一种新的测定POD活性的分析流路(Flow-injection spectrophotometry for POD, FIA-SP-POD),并对萝卜提取液中的POD含量及活性进行了测定。
2 实验部分
2.1 仪器与试剂
安装10 mm光程流通池的UV-1800PC型紫外/可见分光光度计(上海美谱达);AUW120D型电子天平(日本岛津公司);800-1型离心机(常州普天仪器制造有限公司);JYZ-E6型原汁机(九阳股份有限公司);FIA-3100流动注射处理仪(北京吉天仪器有限公司);ASB-200恒温控制器(日本分光株式会社);CP224S分析天平(德国赛多利斯集团);pXJ-1C+离子活度计(成都世纪方舟科技有限公司);SHZ-D循环水式真空泵(郑州金育科贸有限公司);800B台式离心机(上海安亭科学仪器厂)。
GA (国药集团化学试剂有限公司)、HRP(≥250 U/mg, Sigma公司);实验用水为超纯水(电导率0.065 μS/cm);其余试剂均为分析纯。新鲜白萝卜购于本地超市。
2.2 萝卜粗酶液制备
称取50 g新鲜白萝卜,切成小块(约1 cm3),置于榨汁机中榨汁,用真空泵将滤渣进行抽滤,合并两次收集的滤液,然后在4000 r/min下离心10 min;最后用针式过滤器(13 mm/0.45 μm)将离心上清液进行过滤;滤液即为粗酶液, 置于冰箱4℃下保存。
2.3 测定原理
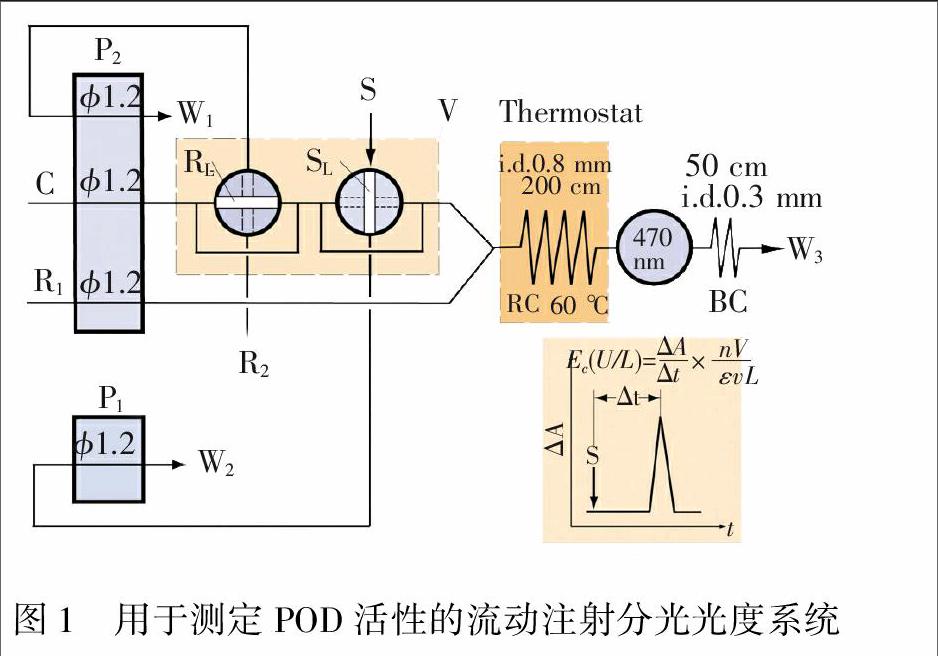
2.4 FIA系统及测定过程
FIA-SP-POD系统见图1。测定过程为:当双通道注入阀(V)转至“采样”位置时,酶试样在P1的抽吸作用下充满样品定量环(SL),多余的样品从W2排出,采用P1抽吸采样,可缩短试样流经途径,达到节省试样目的;当此阀转至“注入”位置时,PBS缓冲液载流(C)推动SL中“酶样品塞”进入反应盘管,与反应试剂(R1)汇合,样品塞中的POD催化H2O2/GA反应生成2-GA,流经流通式检测器,给出吸光度信号(A);试样从注入到产物出现最大吸收峰之间的留存时间为Δt;与此同时,HCl清洗液被P2吸入清洗液定量环(RL),多余的清洗液从W1排出。当此阀再转至“采样”位置时,PBS缓冲液载流(C)推动RL中的HCl清洗液塞,依次进入反应盘管和流通池进行自动清洗,检测器给出基线信号(Ao),两者之差为ΔA(A-Ao)。将此ΔA/Δt代入公式(3)可求得Ec。
3 结果与讨论
3.1 FIA系统参数的优化
基于前期手工法[27]将FIA-SP-POD系统的初始条件设定如下:1.5 mmol/L GA,0.5 mmol/L H2O2,两者等体积混合作为R1; POD样品的注入体积60 μL;0.05 mol/L的磷酸盐缓冲液(pH 5.5)作为载流;0.4 mol/L HCl作为清洗液;P1转速20 r/min (1.73 mL/min),P2转速20 r/min;反应盘管(Φ 0.8 mm)长度为200 cm;背压管(Φ 0.3 mm)长度为50 cm。采用单因素优选法考察了FIA法测定POD活性时的影响因素。
3.1.1 反应盘管最适长度的考察 在FIA-SP-POD系统中,反应盘管长度影响反应进程和分析速度。因此,用白萝卜提取液作为测试样品,考察了RC长度(150, 200, 250, 300和350 cm)对反应产物吸光度的影响。得到的结果表明,RC长度增加,产物吸光度先增大后逐渐减小,RC长度在200 cm 时ΔA最大。其原因是:RC长度较短时反应时间短,导致反应不充分;RC太长时,反应产物的生成速率小于其在管路中被稀释的速率,导致吸光度值缓慢下降。所以本系统的RC选定为200 cm。
3.1.2 试样环最适体积的考察 FIA-SP-POD系统中采样环(SL)的体积即为POD溶液的体积,系统中加入的POD量不同导致酶催化速率不同,进而影响FIA系统的灵敏度,因此,在RC为200 cm的前体下,考察了SL(30, 40, 50, 60和70 μL)对反应产物吸光度的影响。结果表明,SL增加基本上不影响产物吸光度值;
其原因可能是H2O2与GA反应已达到平衡,再增加SL仅仅是酶过量而没有增加反应产物的生成量。考虑到方法灵敏度及节省试样的因素,选定SL为40 μL。
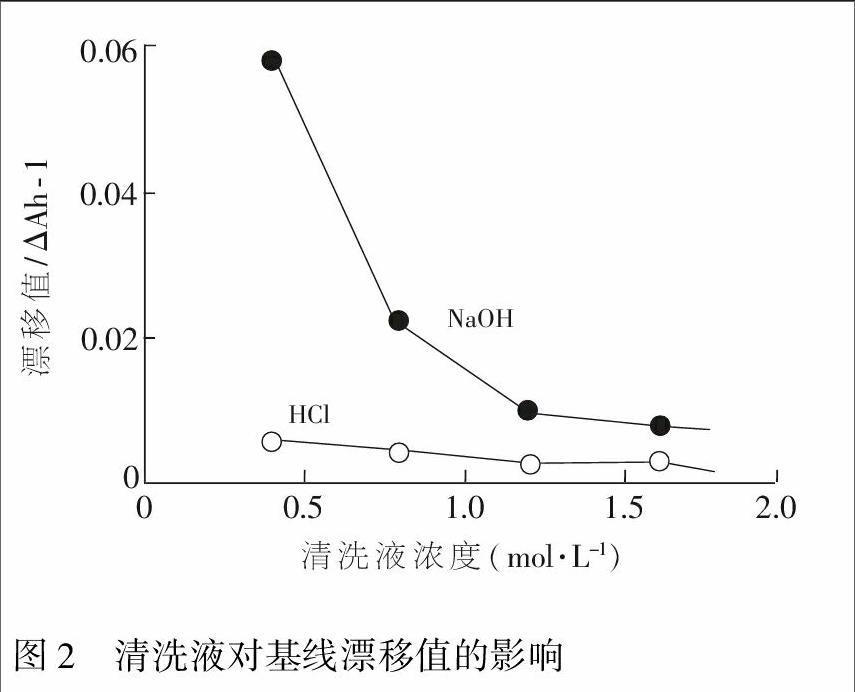
3.1.3 FIA系统基线漂移的消除 研究发现,在FIA-SP-POD系统中H2O2与GA反应所生成的褐色2-GA,容易吸附在流通池中,导致FIA系统的基线漂移。所以,为了减小由于2-GA导致的基线漂移,在FIA系统导入清洗液。即在FIA流路中设计了一个异步注入阀,利用此阀将清洗液在“酶试样塞”之后注入FIA系统(60 μL),以达到对FIA系统自动清洗,减小基线漂移的效果。
为了考察此效果,在FIA系统中分别用HCl和NaOH作为清洗液,萝卜提取液作为测试样品,得到了图2中的两条实测曲线。随着清洗液浓度(HCl和NaOH)增加,基线漂移值减小;在相同浓度下,HCl的清洗效果(基线漂移值)优于NaOH。所以,最后选取0.4 mol/L HCl溶液作为清洗剂。
3.2 反应体系影响因素的考察
3.2.1 POD最适温度 温度是影响POD活性的因素之一。低温使酶活性不能完全显现,高温又会使酶蛋白变性,丧失活性。将FIA-SP-POD系统的RC置于恒温控制器内,先用热电偶对RC出口液的温度进行校正,然后用白萝卜提取液作为测试样品,在不同温度下(25℃~70℃)考察了温度与白萝卜POD活性的相关性。结果见图3a。在60℃时, 酶催化反应产物的ΔA最大(此时FIA系统的平均留存时间Δt都相同,所以ΔA与反应速率ΔA/Δt及Ec成正比关系),当温度大于60℃时, ΔA开始降低,即高温导致POD失活,POD的催化活力下降。由此可知白萝卜POD最适温度为60℃,此结果与文献\[28\]一致。
3.2.2 POD最适pH值 酸度对酶活性的影响,不是酸、碱对酶分子解离状态的影响,而是对酶活性中心或相关基团解离状态的影响。因此本实验用白萝卜提取液作为测试样品,考察了磷酸盐缓冲液(0.05 mol/L)的酸度(pH 3.0~9.0)对反应体系中POD活性的影响。除温度控制在60℃外,其它条件同上。由图3b所示的结果可知,当pH 在3~5.5范围时,pH 增加,ΔA增大,即POD催化生成的产物增多;在pH 5.5~9.0范围时,pH 增加,ΔA反而降低,即POD催化生成的产物减少;在pH 5.5时产物最多即POD活性最强。由此可知萝卜中所含的POD的最适pH 为5.5。
3.2.3 H2O2浓度的考察 在上述优选条件下,考察反应体系中H2O2浓度(0~2.0 mmol/L)对POD催化反应的影响。得到的结果见图3c。可以看出:在给定的Δt值下,H2O2浓度增加,产物ΔA逐渐增大,当此浓度大于1.5 mmol/L时,产物ΔA不再变化,即POD催化产物的生成速率趋于稳定。因此, 将H2O2浓度设定为1.5 mmol/L。在此基础上,以H2O2为底物作Lineweaver-Burk双倒数图,根据双倒数图的截距,计算得到以H2O2为底物的米氏常数(Km)为0.21 mmol/L,酶促反应最大速度(Vmax)为1.155 mmol/(L·min)。
3.2.4 GA浓度的考察 在上述优选条件下,也考察了GA浓度(0~4.0 mmol/L)对POD酶催化反应的影响。得到的结果见图3d。在给定的Δt值下,曲线的变化趋势与H2O2底物相似,即随着GA/POD/H2O2反应体系中GA浓度增大,ΔA先迅速增大后不再变化;当浓度大于3.5 mmol/L时,反应速率(ΔA/Δt)趋于稳定。故本系统选定GA浓度为3.5 mmol/L。同样以GA为底物作Lineweaver-Burk双倒数图,再根据此图计算出以GA为底物的Km′和Vmax′值分别为0.20 mmol/L和0.539 mmol L1·min1。结果表明:白萝卜POD与GA之间的亲和力与H2O2相差不大。
3.3 干扰离子对POD活性测定影响
金属离子可能与POD形成络合物进而影响POD活性,本实验考察了4种盐溶液(FeCl3, CuSO4, ZnSO4, CoSO4)对POD活性测定的影响。实验时,白萝卜POD作为测试样品,在0~0.8 mmol/L范围内改变FIA-SP-POD系统载流中的金属离子浓度,得到的结果见图4。从图4a可知,随着Fe3+, Cu2+, Zn2+, Co2+浓度的增加,在给定的Δt值下,相关的ΔA都有增大的趋势,即Fe3+, Cu2+, Zn2+, Co2+对POD均有一定程度的激活作用;POD激活顺序为Fe3+ > Cu2+ > Zn2+ > Co2+。所以,在提取白萝卜POD时,要避免接触这些金属离子,防止发生酶促褐变。
此外,在载流中分别添加柠檬酸(0~20 mmol/L)、抗坏血酸(0~0.2 mmol/L)和L-半胱氨酸(0~2.0 mmol/L),考察了这些有机酸类对POD活性的影响。从得到的图4b~d 3条曲线可以看出:添加的有机酸浓度增大,在给定的Δt值下吸光度都逐渐降低。这表明这3种有机酸对POD活性有明显的抑制作用,其抑制作用顺序为抗坏血酸>L-半胱氨酸>柠檬酸。由于L-半胱氨酸和柠檬酸都与POD活性中心的Fe3+发生螯合反应,使酶活性中心失去催化功能,因而抑制了POD的活性或减弱了POD与底物的亲和力。
3.4 摩尔吸收系数测定
常规比色法测定POD活性时,是利用H2O2/POD/GA体系反应产物在470 nm处的ΔA值,带入公式(2)计算得到。但本研究发现:ε值是准确定量POD酶活性的最关键因素;当所用仪器(波长分辨率、灵敏度)及方法的测试条件(温度、pH 及溶剂)不同时得到的ε不同。所以,计算POD活性时不能直接将文献或商家给出的ε值代入公式(2)进行计算,须在选定条件下用所选仪器进行测定。
因此,本实验对准确测定ε2-GA方法进行了研究。由于2-GA不稳定、无法提纯,不能通过直接测定其吸光度值得到ε2-GA值,只能利用GA浓度间接求出2-GA的浓度(2H2O+2GA(POD)2-GA+4H2O)。理论上,当H2O2/POD/GA体系中POD过量, 且H2O2浓度远大于GA时,可认为GA完全转化为2-GA。所以, 对所需的POD活性浓度、H2O2/GA浓度比进行了考察。
3.4.1 GA完全转化为产物所需的HRP活性浓度 用商品化的HRP作为测试样品,分别取20 μL的50, 100, 250, 500, 1000和2500 U/L HRP,加入0.5 mmol/L H2O2+1.5 mmol/L GA混合液中[26]测定2-GA的吸光度,结果见图5a。当HRP浓度小于1.0 kU/L时,2-GA的吸光度随HRP活性浓度增加而增大,当HRP浓度大于1.0 kU/L时,2-GA的吸光度不再变化,即此时HRP活性浓度能使GA完全转化为产物。
3.4.2 GA完全转化为产物所需的H2O2的浓度 选定HRP为1.0 kU/L、GA浓度为0.2 mmol/L,使其与不同浓度的H2O2(0.2, 0.4, 0.6, 0.8, 1.0和2.0 mmol/L)按1+1混合,测定其产物2-GA的吸光度,结果见图5b,产物吸光度随H2O2浓度增加呈线性增加趋势,当H2O2浓度大于GA浓度的5倍时,产物吸光度不再随H2O2浓度而变化。由此得出结论:当HRP为1.0 kU/L、H2O2/GA浓度比大于5时,GA能完全转化为产物2-GA。因此,此时可根据已知的GA浓度换算出反应系统中的2-GA浓度,再将其带入朗伯-比尔定律,就求得ε2-GA。在室温(~20℃)下,用手工比色和5点平均数据得到的ε2-GA值为0.0122±0.0031 L/(μmol·cm)。
3.4.3 产物摩尔吸收系数的平均值 为了得到FIA法测定白萝卜POD的ε2-GA,用稀释一倍后的白萝卜粗酶液作为样品(Ec>1.0 kU/L),FIA系统中载流为PBS缓冲液(pH 5.5),R1(H2O2/GA)按1+1混合、且浓度比大于5 (H2O2/GA: 1.5/0.01, 1.5/0.04, 1.5/0.08, 1.5/0.12, 1.5/0.16, 1.5/0.20和1.5/0.24 mmol/L),在60℃下测定了FIA-SP-POD系统中H2O2/POD/GA反应体系形成的产物吸光度,并将换算出的2-GA浓度(1.25, 5, 10, 15, 20, 25和30 μmol/L,c2-GA= 1000×(cGA/4)/2)与其吸光度值进行数学回归,最后得到相关的线性方程:ΔA=0.0125c2-GA+0.050 (r=0.9995);此斜率值0.0125 L (μmol cm)1即为本系统的ε2-GA平均值。
3.5 萝卜POD活性测定
考察了POD的线性响应范围和精密度以及检出限。在优选条件下,一系列HRP标液作为样品,用FIA-SP-POD系统检出它们在Δt下的ΔA值,然后代入公式3,求出对应的POD活性值。结果表明:在给定的Δt(0.53 min)下,在450~7260 U/L范围内HRP活性浓度与ΔA值呈现良好的线性相关(ΔA=0.00013Ec+ 0.0012,r=0.9985)。随后,分别用500 U/L、2500 U/L HRP标液进行11次测定,得到两组标液的RSD分别为0.62%(c=501±3 U/L)、0.31%(c=2530±8 U/L);此结果表明本方法测定POD活性浓度的精度很好;用 500 U/L HRP为样品,计算得到本方法的检出限为7.0 U/L (cL=3SD/K, SD=0.000326, K=0.00013)。
用pH 5.5磷酸盐缓冲液将萝卜提取液按10%, 15%, 20%, 25%, 30%和35%比例稀释成6个样品(Ec10~Ec35),分别注入FIA-SP-POD系统,在给定的Δt下,检测其催化产物的ΔA(0.067, 0.105, 0.135, 0.170, 0.193, 0.220),得到了一条萝卜提取液与ΔA呈良好线性关系的相关曲线(ΔA=0.638c+0.004, r=0.9965), 表明本方法基于平均留存时间(Δt)处的ΔA能快速准确地定量POD活性浓度。
另外,模拟手工酶动力学曲线法在本系统上采用流动注射停留法,对上述稀释的萝卜POD活性进行了测定。操作过程是:注入酶样品32s后停泵(在响应峰的最大值之后停泵),连续记录H2O2/POD/GA体系在后30s期间内的催化反应动力学曲线(ΔA vs Δt),根据此区间曲线的斜率,求得POD活性浓度。得到的数据表明,停留法的结果(Ec10:777±3 U/L,Ec15:1211±13 U/L,Ec20:1470±14 U/L,Ec25:1760±30 U/L, Ec30:2075±20 U/L,Ec35:2268±23 U/L)与上述FIA-SP-POD系统的结果(Ec10:706±8 U/L,Ec15:1105±6 U/L,Ec20:1425±22 U/L,Ec25:1802±6 U/L,Ec30:2034±27 U/L,Ec35:2323±32 U/L)是一致的。
选取4种萝卜的提取液作为酶样品,用FIA-SP-POD系统测定其产物的吸光度,然后代入公式3,得到POD活性值。得到结果为:红皮萝卜(14673 U/L)>青萝卜(14365 U/L)>圆萝卜(13076 U/L)>白萝卜(8309 U/L)。为了考察本方法的可靠性,用HRP标准进行了加标回收率实验(表1)。考虑到HRP自然失活的影响,每次加标实验前先对HRP活性进行了校正。本方法的回收率在95.2%~107.1%之间,结果满意。
4 结 论
本研究基于H2O2/POD/GA反应体系,利用流动注射吸光度/留存时间比值法,建立了一种无需标准曲线的POD活性快速准确测定新方法,分析速度可达40样/h。用本方法测定POD活性,不但减少了手工操作带来的误差,而且具有准确度高、重现性好、分析速度快、自动化程度高的优点。
References
1 Padmarajaiah N, Honnur K, Anantharaman S, Ashwinee K S. Clin. Biochem., 2012, 45: 139-143
2 Azevodo A M, Martins V C, Prazeres D M. Biotech. Annual Review, 2003, 9: 199-247
3 Lopes G R, Pinto D C G A , Silva A M S. RSC Adv., 2014, 4(70): 37244-37265
4 Shekhovtsova T N, Muginova S V, Luchinina J A, Galimova A Z. Anal. Chim. Acta, 2006, 573: 125-132
5 WEI Ran-Fei, GAO Xiu-Feng, LI Yong-Sheng, WANG Heng, FANG Yuan. Chinese J. Anal. Chem., 2009, 37(6): 897-901
魏然飞, 高秀峰, 李永生, 王 恒, 方 园. 分析化学, 2009, 37(6): 897-901
6 LI Jian-Guo, LIU Yin, JU Huang-Xian. Acta Chim. Sin., 2007, 65(15): 1499-1503
李建国, 刘 颖, 鞠熀先. 化学学报, 2007, 65(15): 1499-1503
7 Holm K A. Analyst, 1995, 120(8): 2101-2105
8 Ghadiri M, Kariminia H R, Azad R R. Ecotox. Environ. Safe., 2013, 91: 117-121
9 Vieira I d C, Fatibello-Filho O. Analyst, 1998, 123: 1809-1812.
10 Molaei R A, Ghourchian H, Moosavi-Movahedi A A, Hong J, Nazari K. Anal. Biochem., 2007, 362: 38-43
11 Doerge D R, Divi R L, Mona I. Anal. Biochem., 1997, 250(1): 10-17
12 Tonami H, Uyama H, Nagahata R, Kobayashi S. Chem. Letters, 2004, 33(7): 796-797
13 HwangS P, Lee C H, Ahn I S. J. Ind. Eng. Chem., 2008, 14: 487-492
14 CHENG Ting-Mei, LI Yong-Sheng, GAO Xiu-Feng. Chinese J. Anal. Lab., 2011, 30(8): 6-10
陈婷梅, 李永生, 高秀峰. 分析试验室, 2011, 30(8): 6-10
15 Robert B M, Lawrence W B, Robert W B,Rlchard C K, George N B. Clin. Chem., 1976, 22(2): 141-150
16 WEI Yong-Feng, YAN Hong-Tao. Spectro. Spect. Anal., 2001, 21(5): 704-706
魏永锋, 闫宏涛. 光谱学与光谱分析, 2001, 21(5): 704-706
17 CI Yun-Xiang, CHEN Lie, WEI Shan. Chem. J. Chinese Universities, 1990, 11(1): 81-83
慈云祥, 陈 列, 魏 珊. 高等学校化学学报, 1990, 11(1): 81-83
18 WEI Yong-Feng, YAN Hong-Tao. Chinese J. Anal. Chem., 2000, 28(1): 99-101
魏永锋, 闫宏涛. 分析化学, 2000, 28(1): 99-101
19 Sherman D H. Trends Biotechnology, 1984, 2(1): 1-2
20 YANG Xiu-Cen,WU Li-Ping, CHEN Da-Jin, ZENG Yao. J. West China University of Medical Sci., 1990, 21(3): 293-297
杨秀岑, 伍莉萍, 陈达进, 曾 瑶. 华西医科大学学报, 1990, 21(3): 293-297
21 JI Zheng-Ping, WANG Jun, HAN Jing, HU Xiao-Ya. Chinese J. Anal. Chem, 2011, 39(7): 1100-1103
嵇正平, 王 俊, 韩 静, 胡效亚. 分析化学, 2011, 39(7): 1100-1103
22 Li Y S, Gao X F. Flow Injection Analysis and Application for Chemistry Analysis. The Jilin People′s Publisher, 2002: 1-14
23 Recktenwald A, Kroner K H, Kula M R. Enzyme and Microbial Technology, 1985, 7(12): 607-612
24 Huang H P, Cai R X, Du Y M, Lin Z X, Zeng Y E. Anal. Chim. Acta, 1995, 318: 63-69
25 Van Staden J. F., Mulaudzi L. V. Anal. Chim. Acta, 2000, 421(1): 19-25
26 NC-ICB. Eur. J. Biochem., 1979, 97: 319-320
27 ZHANG Zhao, LI Yong-Sheng, GAO Xiu-Feng. Sci. Tech. Food Industry, 2013, 34(12): 187-191
张 朝, 李永生, 高秀峰. 食品工业科技, 2013, 34(12): 187-191
28 WANG Lin, WANG Lin-Song, MA Jian-Min. J. Henan Normol University (Natural Science), 2004, 32(3): 81-83
王 琳, 王林嵩, 马剑敏. 河南师范大学学报(自然科学版), 2004, 32(3): 81-83
