剑麻皂素提取工艺研究
2015-11-03黄尚顺李华锋覃佑康秦高雄陈钊民
黄尚顺,廖 青,李华锋,,覃佑康,,秦高雄,,王 俊,陈钊民
(1.广西化工研究院,广西 南宁 530001;2.广西众益生物科技有限公司,广西 崇左 532100)
研究与开发
剑麻皂素提取工艺研究
黄尚顺1,廖 青2,李华锋1,2,覃佑康1,2,秦高雄1,2,王 俊1,陈钊民1
(1.广西化工研究院,广西 南宁 530001;2.广西众益生物科技有限公司,广西 崇左 532100)
以剑麻水解物为原料,乙醇为溶剂,对剑麻皂素提取工艺进行研究。考察了乙醇浓度、皂素在乙醇中的浓度、提取时间、皂素/活性炭质量比、脱色时间对剑麻皂素产品收率和质量的影响。以高效液相色谱作为分析手段,通过单因素和正交设计实验,确定了乙醇提取剑麻皂素的最佳工艺条件:乙醇浓度95%,皂素在乙醇中的浓度为7.8g·L-1,提取时间1h,皂素/活性炭=1∶1.8,脱色时间1.5h。在此条件下,皂素含量为92.14%,提取率为81.16%,产品的醇溶度和色泽合格。
剑麻皂素;水解物;提取;脱色
剑麻又名菠萝麻,属龙舌兰科龙舌兰属草本植物[1],含有多种皂苷元、蛋白质、多糖类化学成分,其叶具有神经-肌肉阻滞药理作用[2]。剑麻皂素(剑麻皂甙元、替告吉宁)是从传统的抽取剑麻纤维后的麻汁和麻渣中提取的天然植物皂甙元,具有抗炎、解热、镇痛、增强免疫、减低血糖、抗肿瘤、抗癌、抗菌、降血脂、降血压等作用[3],是合成甾体激素类药物的医药中间体和重要原料,广泛应用于肾上腺皮质激素、性激素及蛋白同化激素三大类200多种药物的制造。以植物皂素为起始原料制备的甾体激素类药物,是世界上仅次于抗生素类 的第二大类药物,素有“医药黄金”和“激素之母”之称[4-6]。
皂甙元生产方法大体可分为两种,第一种先用溶剂提出总皂甙然后水解提取皂甙元;第二种先将植物压出汁液使之发酵,然后水解沉淀物提取皂甙[7]。本文以剑麻汁发酵后的沉淀物经酸水解所得的水解物为原料,采用乙醇提取、活性炭脱色、浓缩、结晶工艺进行剑麻皂素的提取研究,探索最佳生产工艺。
1 实验部分
1.1仪器和原料
Thermo UltiMate 3000高效液相色谱仪,配RID-10A示差折光检测器;HW-2000色谱工作站,FA-2004电子天平,KQ-100B型超声波清洗器,98-C-1型数字显示电子调温电热套,JB300-D强力电动搅拌器,2XZ-1型旋片真空泵配YC7124单相电容电动机,XMTD-8222干燥烘箱。
剑麻水解物(含量9.12%),剑麻皂素标准品(国外产品),无水乙醇(分析纯),工业乙醇(95%),盐酸(31%),活性炭,二次蒸馏水等。
1.2实验步骤
在装有电动搅拌器、温度计、回流冷凝管的2000mL三口烧瓶中加入剑麻水解物60g和工业乙醇,沸腾回流提取一定时间,然后趁热过滤,并用热乙醇(70℃)冲洗滤饼,合并滤液。加入一定量的活性炭回流脱色一定时间,脱色完成趁热过滤,用热乙醇(70℃)冲洗滤饼,合并滤液。浓缩回收乙醇,浓缩液自然放置结晶24h,过滤得剑麻皂素产品,烘干称重,检测分析,计算提取收率。
1.3单因素实验
水解物原料麻膏中的皂素量与麻龄、产地及制作工艺有很大的关系,每批次水解物中皂素量差异较大,乙醇与活性炭用量不能简单地按照水解物量来确定。为提高实验的科学性和精确性,以水解物中皂素的量为基准,提取乙醇用量以水解物中总皂素在乙醇中的浓度为考察因素,活性炭用量以水解物中总皂素与活性炭的质量比为考察对象,分别选择乙醇浓度(A)、皂素在乙醇中的浓度(B)、提取时间(C)、皂素/活性炭比(D)、脱色时间(E)5个因素,考察它们对剑麻皂素提取收率及产品质量的影响。
1.4正交设计实验
将本方法和国标方法的数据进行比较,两组数据的绝对偏差小于1,相对偏差小于5%。国标方法中三氯蔗糖的定量限是2.5 mg/L;本方法的检出限是0.04 mg/L,定量限是0.1 mg/L。结果表明,本方法可以用于白酒中三氯蔗糖的检测。相比液相色谱系统,液相质谱联用仪具有更高的分离度和灵敏度以及更短的检测时间。
在单因素实验基础上,选取上述5个因素进行L25(56)正交设计实验,以剑麻皂素的提取率作为主要评价指标,以剑麻皂素的色泽和醇溶度作为第二评价指标。
1.5产品检测分析
采用高效液相色谱示差法对剑麻皂素进行定量分析,确定产品的含量[8];以醇溶度和色泽对剑麻皂素进行定性检测,确定产品的质量。
2 实验结果与讨论
2.1单因素实验结果
2.1.1乙醇浓度对收率及质量的影响
固定皂素在乙醇中的浓度为7.8g·L-1,提取时间1h,皂素/活性炭1∶1.8,脱色时间1.5h,改变乙醇浓度,考察其对剑麻皂素收率及质量的影响,结果见表1。

表1 乙醇浓度对收率及质量的影响Table 1 Effect of ethanol concentration on yield and quality
从表1可看出,随着乙醇浓度的降低,剑麻皂素的产量和含量都降低,提取收率快速减少。这是由于乙醇浓度降低,相对应的水分增加,剑麻皂素的溶解量减小,造成部分皂甙无法完全提取出来,同时增加了乙醇-水的可溶性有机质的提取,杂质的过多溶解影响了剑麻皂素的含量。因此,选取乙醇浓度为95%。
2.1.2乙醇用量对收率及质量的影响
固定乙醇浓度95%,提取时间1h,皂素/活性炭1∶1.8,脱色时间1.5h,改变乙醇的加入量,考察其对剑麻皂素收率及质量的影响,结果见表2。

表2 乙醇用量对收率及质量的影响Table 2 Effects of ethanol dosage on yield and quality
2.1.3提取时间对收率及质量的影响
固定皂素在乙醇中的浓度为7.8g·L-1,乙醇浓度95%,皂素/活性炭1∶1.8,脱色时间1.5h,改变提取时间,考察其对剑麻皂素收率及质量的影响,结果见表3。

表3 提取时间对收率及质量的影响Table 3 Effects of extraction time on yield and quality
从表3可看出,随着提取时间的增加,剑麻皂素的产量也增加,但含量降低,同时醇溶度和产品色泽也相应变差,提取收率先增后减。这可能是因为时间太短,提取不完全,但随着时间的延长,其它有机质被慢慢溶解,皂素的溶解平衡常数发生改变,造成总收率降低。通过分析,选择提取时间1h为宜。
2.1.4活性炭用量对收率及质量的影响
固定皂素在乙醇中的浓度为7.8g·L-1,乙醇浓度95%,提取时间1h,脱色时间1.5h,改变活性炭的用量,考察其对剑麻皂素收率及质量的影响,结果见表4。
从表4可看出,随着活性炭用量的增加,剑麻皂素的产量逐步减少,但含量提高,同时产品的醇溶度和色泽也逐步变好,提取收率先增后减。其原因可能是:活性炭的主要作用是脱色和吸附除杂,活性炭量少时,脱色不彻底,有机杂质去除不完全;但活性炭量过大时,不仅吸附杂质,过大的孔隙和比表面积也吸附皂素产品。综合考虑,皂素/活性炭为1∶1.8。

表4 活性炭用量对收率及质量的影响Table 4 Effects of activated carbon dosage on yield and quality
2.1.5脱色时间对收率及质量的影响
固定乙醇700mL,乙醇浓度95%,提取时间1h,活性炭10g,改变脱色时间,考察其对剑麻皂素收率及质量的影响,结果见表5。

表5 脱色时间对收率及质量的影响Table 5 Effects of decolorization time on yield and quality
从表5可看出,随着脱色时间的增加,剑麻皂素的产量逐步减少,但含量提高,同时产品的醇溶度和色泽也逐步变好,提取收率先增后减。可能的原因是:时间越长,活性炭脱色越彻底,除杂也越完全,但同时皂素也被吸附。因此,脱色时间选用1.5h为宜。
2.2正交设计实验结果
正交实验因素水平表见表6,正交实验结果见表7。
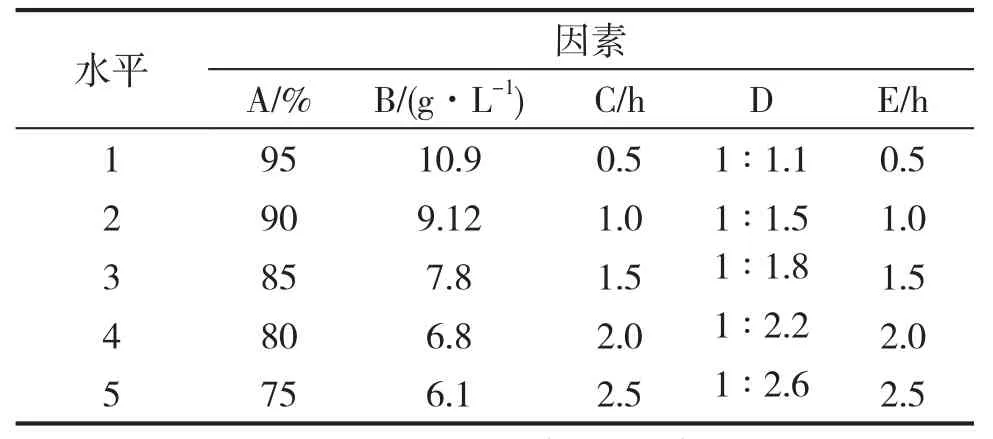
表6 正交实验因素水平表Table 6 Factors of orthogonal experiment
由表7可知,对剑麻皂素提取率的影响大小顺序为A>B>C>E>D,正交实验最优选的方案为A1B3C2D3E3。结合单因素实验结果,确定最佳条件为:乙醇浓度95%,乙醇用量按水解物中总皂素在乙醇中的浓度为7.8g·L-1,提取时间1h,皂素/活性炭为1∶1.8,脱色时间1.5h。

表7 正交实验结果Table 7 Results of orthogonal experiment
3 结论
1)剑麻皂素乙醇法提取工艺的最佳条件为:乙醇浓度95%,皂素在乙醇中的浓度为7.8g·L-1,提取时间1h,皂素/活性炭1∶1.8,脱色时间1.5h。在此条件下,皂素含量为92.14%,提取率为81.16%,产品的醇溶度和色泽合格。
2)在该工艺条件下生产的剑麻皂素含量高、杂质少,且操作工艺简单,成本低,为工业化生产提供了技术参数。
[1] 熊和平.麻类作物育种学[M].北京:中国农业科学技术出 版社,2008.
[2] WoodcockB.G,et al.CA,1982,97:50952k.
[3] 广 西南剑生物科技有限公司.一种从剑麻渣榨汁提取剑麻皂素的方法:中国,103087143A[P].2013-05-08.
[4] 徐礼粲,刘爱茹.皂甙元分析方法的研究Ⅱ. 剑麻皂甙元薄层比色法[J].化学学报,1977(s1):239-241.
[5] KD Goggin, JF Lambert, SW Walinsky, Thermal glycosylations: Reactions of β-cellobiosyl fluoride heptaacetate with tigogenin and its trimethylsilyl ether[J]. Carbohydrate Research, 1997, 303(3): 347-351.
[6] ADS Tigogenin. Tigogenin, a digitalis sapogenin[J].Jour Biol Chem., 1930(88): 545-550.
[7] 李华锋,黄尚顺,廖青,等.剑麻皂甙元生产技术进展[J].广东化工,2014,41(8):91-92.
[8] 李华锋,覃佑康,王俊,等.剑麻皂甙元高效液相色谱分析方法[J].化工技术与开发,2013,42(8):60-62.
Study on Extraction Technology of Tigogenin
HUANG Shang-shun1, LIAO Qing2, LI Hua-feng1,2, QIN You-kang1,2, QIN Gao-xiong1,2, WANG Jun1,CHEN Zhao-min1
(1. Guangxi Research Institute of Chemical Industry, Nanning 530001, China; 2.Guangxi Zhongyi Biology Technology Limited Company, Chongzuo 532100, China)
Applied hydrolysate as materials and ethanol as solvent, the extraction technology of tigogenin was studied. Effects of ethanol concentration, tigogenin concentration in the ethanol, extraction time, tigogenin/activated ratio and decolorization time on the yield and quality of tigogenin were investigated. Through single factor experiments, orthogonal design experiments and HPLC detector, the optimum extraction process of tigogenin was determined: ethanol concentration 95%, the concentration of tigogenin in ethanol 7.8g/L, extraction time 1h, tigogenin to activated carbon ratio 1∶1.8, decolorization time 1.5h. Under the conditions, the content of tigogenin was 92.14%, extraction rate was 81.16%, the ethanol solubility and color of product was qualifi ed.
tigogenin; hydrolysate; extraction; decolorization
TQ 946.83 R 284.2
A
1671-9905(2015)12-0001-03
广西自然科学基金项目(桂科青2015GXNSFBA139036;桂科自2011GXNSFA018047);广西科学研究与技术开发计划项目(桂科转1599002-6;桂科攻1355003-15)
黄尚顺(1963-),男,学士,高级工程师,主要从事化学工程与工艺研究。E-mail:hss1780@163.com
廖青(1985-),男,学士,助理工程师,主要从事植物提取研究。E-mail:381375827@qq.com
2015-10-14
