不同发酵特性的嗜热链球菌与保加利亚乳杆菌共发酵的特性
2015-11-02马成杰徐志平徐爱才华宝珍
李 莎,马成杰*,徐志平,徐爱才,华宝珍
(乳业生物技术国家重点实验室,光明乳业股份有限公司乳业研究院,上海 200436)
不同发酵特性的嗜热链球菌与保加利亚乳杆菌共发酵的特性
李 莎,马成杰*,徐志平,徐爱才,华宝珍
(乳业生物技术国家重点实验室,光明乳业股份有限公司乳业研究院,上海 200436)
为探究具有不同优良性状的嗜热链球菌株与保加利亚乳杆菌株共发酵的特性,用产酸快的嗜热链球菌StCH-1菌株和产黏好的嗜热链球菌StTA040菌株与保加利亚乳杆菌Lb0925B菌株组合,测定其组合菌株的发酵性能。通过实验发现组合菌株发酵速率均比单菌株发酵速率快,其中含有嗜热链球菌StCH-1的组合菌株发酵速率较快,而含有嗜热链球菌StTA040的组合菌株的胞外多糖产量较高,发酵乳的黏度较高,持水力较强;三组分发酵剂的发酵速率快,发酵乳在贮藏期间黏度高,持水力强,通过感官分析得出三组分发酵剂制得的发酵乳的口感和风味最佳。
嗜热链球菌;胞外多糖;共发酵;发酵特性;感官评价
酸奶发酵剂一般由嗜热链球菌(Streptococcus thermophilus)和保加利亚乳杆菌(Lactobacillus delbrueckii subsp. bulgaricus)组成,其中嗜热链球菌在酸奶发酵前期产酸、产多糖等方面发挥着重要作用[1-3]。产酸能力强的嗜热链球菌有助于酸奶产品快速发酵凝乳、缩短发酵时间、提高生产效率、降低酸奶生产成本[4]。嗜热链球菌分泌的胞外多糖对发酵乳质构特性影响最大,乳酸菌胞外多糖不仅可赋予发酵乳特殊的风味,而且赋予发酵乳细腻爽滑的口感,提高发酵乳的稳定性和 持水性,减少发酵乳在生产中稳定剂的使用量[5-9]。Ruas-Madiedo等[10]认为乳酸菌分泌的胞外多糖在发酵乳制品中起到了非常重要的作用,是一种天然生物增稠剂。
然而,单一的嗜热链球菌株难以具备产酸快、产黏好、抗噬菌体、风味浓郁等优良性状。因此,将优良菌株进行组合有利于提升发酵剂的整体性能。Skriver等[4]最早提出将不同发酵性能的乳酸菌进行组合以发挥不同优良菌株的发酵性能。Urshev等[11]认为酸奶发酵剂的发展主要依赖于将一种保加利亚乳杆菌与不同嗜热链球菌进行组合,从而使得发酵剂同时具备发酵速率快、产品黏度好、特征风味浓郁等优良性能。
目前,国内外酸 奶发酵剂的研究主要侧重于优良菌株的选育[12-14]、菌株生产生化性能研究[15-18]、菌株高密度培养与发酵优化[19-20]、发酵剂冷冻干燥技术[21-22]等方面,少有关于具有不同优良性状的嗜热链球菌株组合的研究报道。本实验将产酸快和产黏好的2 株嗜热链球菌与1 株保加利亚乳杆菌组合,测定其组合菌株的发酵性能和对发酵乳贮藏稳定性的影响,并且通过感官评价测定不同组合菌株对发酵乳口感和风味的影响,以期为酸奶发酵剂的优化设计提供理论基础。
1 材料与方法
1.1菌株
嗜热链球菌StCH-1 丹麦Chr. Hansen公司,嗜热链球菌StTA040 丹麦Danisco公司,是从酸奶发酵剂中通过选择性LM17培养基分离,《伯杰氏细菌鉴定手册》方法鉴定;保加利亚乳杆菌Lb 0925B 丹麦Danisco公司,是从发酵剂中通过选择性MRS培养基分离,《伯杰氏细菌鉴定手册》方法鉴定。
1.2材料与培养基
脱脂乳粉 新西兰恒天然公司。
MRS(de Man, Rogosa and Sharpe)培养基、M17培养基(添加0.5%乳糖) 英国Oxoid公司。
1.3仪器与设备
Cinac发酵素酸化监控系统 法国Alliance公司;MIR-253生化培养箱 日本Sanyo公司;Bactron-1厌氧培养箱 美国Shellab公司;GFL1002恒温水浴箱 德国GFL公司;868型pH计 美国Orion公司;冷冻高速离心机 德国Eppendorf公司;UV-1800紫外-可见分光光度计 日本Shimadzu公司;proRheo R180黏度计 德国ProRheo公司。
1.4方法
1.4.1菌种活化与菌悬液制备
将菌种保藏管中的嗜热链球菌和保加利亚乳杆菌分别接种于LM17和MRS液体培养基中,转接活化2 次后,在平板中划线,挑选单菌落培养,经4 000 r/min离心15 min,收集菌体沉淀,经灭菌的生理盐水洗涤去除培养基成分,制得菌悬液(OD560nm= 0.95),于4 ℃保存,12 h内使用。
1.4.2发酵乳制备工艺流程
脱脂乳粉(12%)+白砂糖(8%)+净化水等→40~45 ℃溶解→90~95 ℃杀菌5~10 min→冷却至42 ℃→接种→恒温发酵至pH值为4.5→水浴冷却至20 ℃ →500 r/min搅拌5 min→4 ℃冷藏
接种:分别向灭菌后的脱脂乳中接种保加利亚乳杆菌Lb0925B(简称L)、嗜热链球菌StCH-1(简称CH-1)、嗜热链球菌StTA040(简称040),以及保加利亚乳杆菌与这两种嗜热链球菌组成的两组分发酵剂(L+0 4 0、L+C H-1)和三组分复合发酵剂(L+CH-1+040)。乳酸菌接种量为2%,球菌与杆菌的质量添加比例为1∶1。
1.4.3主要指标的测定
pH值测定:用pH计测定发酵乳的pH值。
酸度的测定:以酚酞为指示剂,用0.100 mol/L的NaOH标准溶液滴定。滴定酸度以吉尔涅尔度(☒T)表示。
酸化曲线的测定:采用Cinac发酵素酸化监控系统对牛乳发酵过程中pH值的变化进行检测。
黏度的测定:样品温度20 ℃时,将黏度计2号转子浸没于样品中进行测定,稳定后读取数值。
胞外多糖的分离与含量测定:取300 g发酵乳样品中加入100 g 16 g/100 mL的三氯乙酸溶液,4 ℃放置2 h后,10 000 r/min离心30 min,取上清液备用;取200 mL上清液,并加入等体积的无水乙醇,4 ℃放置过夜;将混合液10 000 r/min离心30 min,取沉淀,采用苯酚-硫酸法测定多糖的含量[23]。
持水力的测定:取30 g发酵乳样品,于4 ℃离心30 min,转速为3 000 r/min,倾去上清液后将离心管倒置10 min,持水力[24]的计算见下式。

发酵乳感官评价:由10 名接受过专业感官分析培训的食品从业人员分别对样品的酸甜比、黏度、稠度、口感、风味和质地进行感官评价[25]。评价标准见表1。

表1 酸奶感官评价标准Table 1 Standards for sensory evaluation of yogurt quality
1.5数据处理与分析
所有数据均平行测定3 次,使用SAS 9.3软件进行方差显著性分析,Origin 9.0软件作图。
2 结果与分析
2.1酸化曲线
利用Cinac发酵素酸化监控系统对发酵过程pH值变化进行监测,如图1所示。嗜热链球菌和保加利亚乳杆菌单独发酵时,嗜热链球菌StCH-1的发酵速率最快,保加利亚乳杆菌Lb0925B的发酵速率最慢。当嗜热链球菌与保加利亚乳杆菌共发酵时,L+CH-1的发酵速率明显比L+040的发酵速率快,这是因为在发酵过程中嗜热链球菌是主要的产酸菌株,发酵速率主要由嗜热链球菌的发酵速率决定[3]。同时,两组分发酵剂的发酵速率明显比各自的单菌株发酵速率快。这是由于嗜热链球菌与保加利亚乳杆菌之间存在共生关系,在发酵过程中保 加利亚乳杆菌产生的多肽和游离氨基酸能够促进嗜热链球菌的生长繁殖和产酸[26]。当嗜热链球菌StCH-1和StTA040与保加利亚乳杆菌Lb0925B组成三组分发酵剂时,其发酵速率在2 种两组分发酵剂之间。嗜热链球菌StCH-1的发酵速率较快,而嗜热链球菌StTA040的发酵速率较慢,因此三组分发酵剂的发酵速率比L+CH-1的发酵速率慢,而比L+040的发酵速率快。

图1 单菌株和组合菌株在42 ℃条件下发酵脱脂乳的酸化曲线Fig.1 Acidification curves of single strains and combined strains growing in skim milk at 42 ℃
2.2不同菌种组合发酵乳中胞外多糖的含量
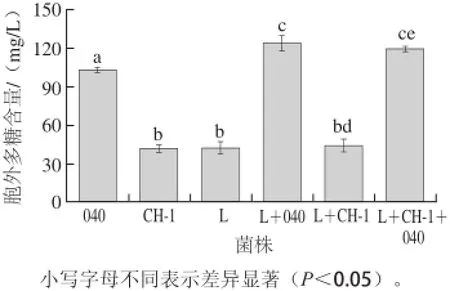
图2 单菌株和组合菌株发酵酸乳中胞外多糖的含量Fig.2 Contents of EPS in fermented yoghurt by single strains and combined strains
酸奶在发酵过程中,乳酸菌会分泌胞外多糖,它能够将乳酸菌和酪蛋白连接在一起,赋予酸奶细腻爽滑的口感[5]。单菌株、两组分发酵剂和三组分发酵剂分泌的胞外多糖含量见图2。3 种单菌株发酵时,嗜热链球菌StTA040分泌的胞外多糖最多,嗜热链球菌StCH-1和保加利亚乳杆菌Lb0925B分泌的胞外多糖含量较低。当嗜热链球菌与保加利亚乳杆菌共发酵时,组合菌株L+040所分泌的胞外多糖比单菌株嗜热链球菌StTA040分泌的胞外多糖多,而组合菌株L+CH-1所分泌的胞外多糖与单菌株嗜热链球菌StCH-1相比没有显著提高。在酸奶发酵过程中,嗜热链球菌是主要的产多糖菌株[2]。虽然保加利亚乳杆菌所分泌的胞外多糖较少,但是保加利亚乳杆菌产生的代谢产物能够促进嗜热链球菌的生长和胞外多糖的分泌[26]。当嗜热链球菌StCH-1和StTA040与保加利亚乳杆菌Lb0925B组成组合菌株时,其分泌的胞外多糖与两组合菌株L+040分泌的胞外多糖相当。
2.3发酵乳的贮藏稳定性
2.3.1贮藏期间发酵乳酸度的变化

图3 贮藏期间发酵乳酸度的变化Fig.3 Change in titratable acidity of fermented milk samples during storage
灭菌后的脱脂乳接种发酵剂,42 ℃发酵至pH值为4.5,然后500 r/min搅拌5 min,4 ℃贮藏。贮藏期间发酵乳酸度的变化见图3。发酵乳4 ℃贮藏14 d后,酸度都升高了,酸度上升值几乎相同。在贮藏过程中,乳酸菌继续生长繁殖消耗残存的乳糖、半乳糖、葡萄糖产生乳酸,导致发酵乳的酸度进一步升高[27]。Ongol等[28]发现酸奶在低温贮藏过程中,保加利亚乳杆菌是主要的产酸菌株,并且其产酸能力与H+-ATPase的活性相关。Wang Xinhui等[29]将保加利亚乳杆菌进行诱变,发现H+-ATPase活性降低的菌株不仅其产酸能力降低,并且其后酸化能力也减弱。所以本实验选择酸化能力较弱的保加利亚乳杆菌,防止发酵乳在贮藏过程中酸度上升过多。由于3 种组合酸奶发酵剂所含有保加利亚乳杆菌的菌种和浓度相同,因此3 种发酵乳的后酸化程度大致相同。
2.3.2贮藏期间发酵乳黏度的变化

图4 贮藏期间发酵乳的黏度变化Fig.4 Change in viscosity values of fermented milk samples during storage
3 种发酵乳4 ℃贮藏,其贮藏黏度的变化见图4。由两组分发酵剂L+040和三组分发酵剂发酵的发酵乳的黏度显著高于两组分发酵剂L+CH-1发酵的发酵乳的黏度。这主要是因为含有嗜热链球菌StTA040的组合菌株所分泌的胞外多糖较多,所以发酵乳的黏度等物理性质更佳。同时,3 种发酵乳在4 ℃贮藏14 d后发酵乳的黏度都变大,这可能是因为发酵乳在贮藏过程中蛋白质分子发生了重组[6]。Tsuda等[7]发现胞外多糖能够将乳酸菌细胞和酪蛋白链接在一起形成网络结构,使得发酵乳的凝胶结构更加稳定。
2.3.3贮藏期间发酵乳持水力变化
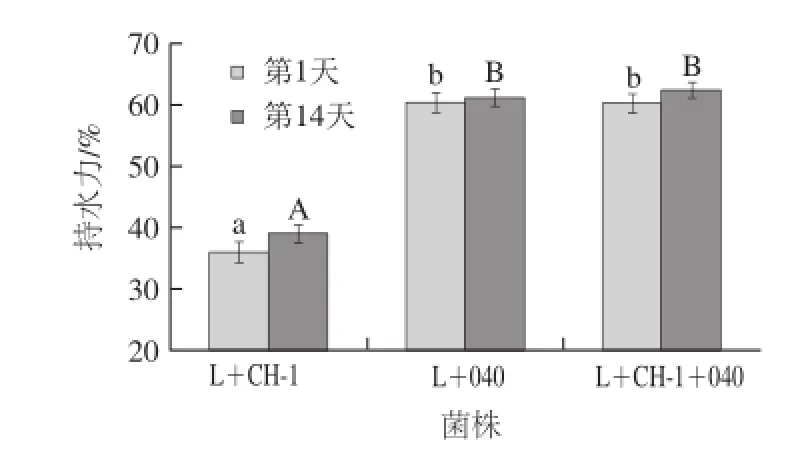
图5 贮藏期间发酵乳持水力变化Fig.5 Change in water-holding capacity of fermented milk samples during storage
3 种发 酵乳4 ℃贮藏过程中持水力的变化见图5。3 种发酵乳在4 ℃贮藏14 d后持水力变大,这说明冷藏有助于增加发酵乳的持水力。同时,由两组分发酵剂L+040和三组分发酵剂发酵的发酵乳的持水力显著高于两组分发酵剂L+CH-1发酵的发酵乳的持水力。这主要是因为含有嗜热链球菌StTA040的组合菌株所分泌的胞外多糖较多,所以发酵乳的持水性能更佳。Guzel-Seydim等[30]也发现嗜热链球菌StCH-1产生的发酵乳持水能力较弱,乳清分离严重。Prasanna等[6]研究发现胞外多糖能够有助于发酵乳形成孔状结构,这种孔状结构有助于提高发酵乳的持水性能,防止乳清的析出,并且它还能防止发酵乳在加工和运输工程中结构的破坏,提高发酵乳的稳定性。
2.4发酵乳样品的感官评价
3 种发酵乳4 ℃贮藏1 d后的感官分析见图6。3 种不同的酸奶发酵剂发酵的发酵乳在感官上差异较大,其中由三组分发酵剂发酵的发酵乳感官分析结果最佳,其次是两组分发酵剂L+040发酵的发酵乳,两组分发酵剂L+CH-1发酵的发酵乳评价结果最差。由于胞外多糖可赋予发酵乳特殊的风味和细腻爽滑的口感,所以含有高产胞外多糖的嗜热链球菌的酸奶发酵剂能够使发酵乳的质量提高。并且三组分发酵剂发酵的发酵乳比两组分发酵剂发酵的发酵乳品质更好,这主要是因为多组分发酵剂含有多个优势菌种,可以使得发酵乳的发酵速率更快,发酵乳的风味和口感更佳。

图6 专业人员对发酵乳的感官评价Fig.6 Sensory evaluation of fermented milks
3 结 论
两株不同胞外多糖产生特性和酸化特性的嗜热链球菌与保加利亚乳杆菌进行组合,不同的组合菌株有不同的发酵性能。嗜热链球菌StCH-1发酵速率最快,胞外多糖产量较少,发酵乳黏度低有颗粒感;嗜热链球菌StTA040发酵速率较慢,胞外多糖产量最多,发酵乳黏度高,凝乳状态均匀。当两株嗜热链球菌与保加利亚乳杆菌Lb0925B组合后,发酵速率均比单菌株发酵速率快,显著缩短了发酵时间。其中含有嗜热链球菌StCH-1的组合菌株的发酵速率较快,而含有嗜热链球菌StTA040的组合菌株的胞外多糖产量较高,发酵乳的黏度较高,持水力较强。三组分发酵剂的发酵速率快,生产的发酵乳黏度好,持水力强,具有3 种菌种的所有优良性能,同时通过感官分析得出三组分发酵剂制得的发酵乳的口感、风味和贮藏稳定性较好,发酵乳的整体质量最佳。
[1] PURWANDARI U, SHAH NP, VASILJEVIC T. Effects of exopolysaccharide producing strains of Streptococcus thermophilus on technological and rheological properties of set-type yoghurt[J]. International Dairy Journal, 2007, 17: 1344-1352.
[2] SETTACHAIMONGKON S, ROBERT NOUT M J, ANTUNES FERNANDES E C, et al. Influence of different proteolytic strains of Streptococcus thermophilus in co-culture with Lactobacillus delbrueckii subsp. bulgaricus on the metabolite profile of set-yoghurt[J]. International Journal of Food Microbiology, 2014, 177: 29-36.
[3] IYER R, TOMAR S K, UMA MAHESWARI T, et al. Streptococcus thermophilus strains: multifunctional lactic acid bacteria[J]. International Dairy Journal, 2010, 20: 133-141.
[4] SKRIVER A, STENBY E, FOLKENBERG D M, et al. Tools in the development of future starter cultures for fermented milk[C]// Proceedings of the IDF Seminar on Aroma and Texture of Fermented Milk. Kolding, Denmark, June 3-5, 2002. International Dairy Federation, Brussels, Belgium, 2003: 55-61.
[5] PHAM P L, DUPONT I, ROY D, et al. Production of exopolysaccharide by Lactobacillu s rhamnosus R and analysis of itseneymaticdegradation during prolonged fermentation[J]. Applied and Environmental Microbiology, 2000, 66(6): 2302-2310.
[6] PRASANNA P H P, GRAND ISON A S, CHARALAMPOPOULOS D. Microbiological, chemical and rheological properties of low fat set yogurt produced with exopolysaccharide (EPS) producing Bifi dobacterium strains[J]. Food Research International, 2013, 51: 15-22.
[7] TSUDA H, MIYAMOTO T. Production of exopolysaccharide by Lactobacillus plantarum and the prebiotic activity of the exopolysaccharide[J]. Food Science and Technology Research, 2010,16: 87-92.
[8] 李全阳. 酸乳质量及其胞外多糖的研究[D]. 无锡: 江南大学, 2004.
[9] LAWS A P, MARSHALL V M. The relevance of exopolysaccharides to the rheological properties in milk fermented with ropy strains of lactic acid bacteria[J]. International Dairy Journal, 2001, 11: 709-721.
[10] RUAS-MADIEDO P, HUGENHOLTZ J, ZOON P. An overview of the functionality of exopolysaccharides produced by lactic acid bacteria[J]. International Dairy Journal, 2002,12: 163-171.
[11] URSHEV Z L, PASHOVA-BALTOVA K N, DIMITROV Z P. Tracing Streptococcus thermophilus strains in three-component yogurt starters[J]. World Journal of Microbiology and Biotechnology, 2006,22: 1223-1228.
[12] 张雪, 李达, 赵玉娟, 等. 内蒙古奶豆腐中产胞外多糖乳酸菌的分离筛选[J]. 食品科学, 2010, 31(1): 141-144.
[13] SOOMRO A H, MASUD T. Selection of yoghurt starter culture from indigenous isolates of Streptococcus thermophilus and on the basis of technological properties[J]. Annals of Microbiology, 2008,58(1): 67-71.
[14] HAN Xue, ZHANG Lanwei, YU Peng, et al. Potential of LAB starter culture isolated from Chinese traditional fermented foods for yoghurt production[J]. International Dairy Journal, 2014, 34: 247-251.
[15] SHENE C, CANQUIL N, BRAVO S, et al. Production of the exopolysacchzrides by Streptococcus thermophilus: effect of growth conditions on fermentation kinetics and intrinsic viscosity[J]. International Journal of Food Microbiology, 2008, 124: 279-284.
[16] PRASANNA P H P, GRANDISON A S, CHARALAMPOPOULOS D. Effec t of dairy-based protein sources and temperature on growth,acidification and exopolysaccharide production of Bifi dobacterium strains in skim milk[J]. Food Research International, 2012, 47: 6-12.
[17] 徐爱才, 马成杰, 华宝珍, 等. 嗜热链球菌与不同乳杆菌组合在脱脂乳中的发酵特性[J]. 食品科学, 2013, 34(15): 158-161. doi: 10.7506/ spkx1002-6630-201315032.
[18] 靳志敏, 通力嘎, 段艳, 等. 1株高效将胆固醇乳酸菌的功能与发酵特性[J]. 食品科学, 2014, 35(11): 120-123. doi: 10.7506/spkx1002-6630-201411024.
[19] DONG Zixing, GU Lei, ZHANG Juan, et al. Optimisation for high cell density cultivation of Lactobacillus salivarius BBE 09-18 with response surface methodology[J]. International Dairy Journal, 2014,34: 230-236.
[20] 华宝珍, 李莎, 徐爱才, 等. 植物乳杆菌ST-Ⅲ脱脂乳的发酵工艺优化[J]. 农业工程学报, 2014, 30(11): 276-284.
[21] SCHWAB C, VOGEL R, G☒NZLE M G. Influence of oligosaccharides o n the viability and membrane properties of Lactobacillus reuteri TMW.106 during freeze-drying[J]. Cryobiology,2007, 55(2): 108-114.
[22] ASCHENBRENNER M, KULOZIK U, F☒RST P. The role of the glassy state in production and storage of freeze-dried starter cultures[J]. Procedia Food Science, 2011, 1: 347-354.
[23] ROBITAILLE G, TREMBLAY A, MOINEAU S, et al. Fat-free yogurt made using a galactose-positiveexopolysaccharide-producing recombinant strain of Streptococcus thermophilus[J]. Journal of Dairy Science, 2009, 92: 477-482.
[24] 马成杰, 杜昭平, 华宝珍, 等. 植物乳杆菌ST-Ⅲ在豆乳中的发酵特性及发酵豆乳的贮藏稳定性[J]. 食品科学, 2013, 34(5): 151-155. doi: 10.7506/spkx1002-6630201305032.
[25] ESCOBAR D, CLARK S, GANESAN V, et al. High-pressure homogenization of raw and pasteurize d milk modifies the yield,composition, and texture of queso fresco cheese[J]. Journal of Dairy Science, 2011, 94: 1201-1210.
[26] SIEUWERTS S, de BOK F A M, HUGENHOLTZ J, et al. Unravelingmicrobial interactions in food fermentations: from classical to genomics approaches[J]. Applied and Environmental Microbiology,2008, 74: 4997-5007.
[27] BEAL C, SKOKANOVA J, LATRILLE E, et al. Combined effects of culture conditions and storage time on acidification and viscosity of stirred yogurt[J]. Journal of Dairy Science, 1999, 82: 673-681.
[28] ONGOL M P, SAWATANI Y, EBINA Y, et al. Yogurt fermented by Lactobacillus delbrueckii subsp. bulgaricus H+-ATPase-defective mutants exhibits enhanced viability of Bifi dobacterium breve during storage[J]. International Journal of Food Microbiology, 2007, 116: 358-366.
[29] WANG Xinhui, REN Hongyang, LIU Dayu, et al. H+-ATPasedefective variants of Lactobacillusdelbrueckii subsp. bulgaricus contribute to inhibition of postacidification of yogurt during chilled storage[J]. Journal of Food Science, 2013, 78: M297-M302.
[30] GUZEL-SEYDIM Z B, SEZGIN E, SEYDIM A C. Influences of exopol ysaccharide producing on the quality of plain set type yogurt[J]. Food Control, 2005, 16: 205-209.
Fermentation Characteristics of Lactobacillus delbrueckii subsp. bulgaricus Co-cultured with Different Streptococcus thermophilus Strains
LI Sha, MA Chengjie*, XU Zhiping, XU Aicai, HUA Baozhen
(State Key Laboratory of Dairy Biotechnology, Technology Center of Bright Dairy and Food Co. Ltd., Shanghai 200436, China)
Streptococcus thermophlius StCH-1, a strain capable of rapidly producing acid and EPS-producing S. thermophlius StTA040, a strain with an improved ability to produce exopolysaccharides (EPS) were individually or togethe r co-cultured with L. bulgaricus strain (Lb0925B) to investigate their fermentation characteristics. The influence of mixed strains on fermentation curves, EPS production, post-acidification, viscosity, water-holding capacity and sensory quality of fermented milk was investigated. The results showed that the fermentation time was significantly shortened by the combined use of the strains especially in the presence of StCH-1. The combined strains containing StTA040 could produce more exopolysaccharides (EPS) and consequently higher viscosity and water-holding capacity in fermented milk. In addition,the combination of all these three strains accelerated the fermentation process and produced fermented milk with higher viscosity and water-holding capacity and the best taste and flavor by sensory evaluation.
Streptococcus thermophilus; exopolysaccharides; co-culture; fermention properties; sensory evaluation
TS252.1
A
1002-6630(2015)15-0123-05
10.7506/spkx 1002-6630-201515023
2014-07-30
“十二五”国家科技支撑计划项目(2013BAD18B01)
李莎(1987—),女,硕士,主要从事发酵乳制品研究与开发。E-mail:lisha@brightdairy.com
马成杰(1976—),男,高级工程师,硕士,主要从事乳品生物技术研究。E-mail:machengjie@brightdairy.com
