茶蜂花粉提取物BPE对LPS诱导的Raw 264.7细胞的体外抗炎症作用
2015-11-02平舜王凯张江临胡福良
平舜,王凯,张江临,胡福良
(浙江大学动物科学学院,浙江杭州310058)
茶蜂花粉提取物BPE对LPS诱导的Raw 264.7细胞的体外抗炎症作用
平舜,王凯,张江临,胡福良*
(浙江大学动物科学学院,浙江杭州310058)
以茶蜂花粉提取物(BPE)为实验材料,研究了其可能的抗炎活性。通过福林酚法和三氯化铝比色法测定BPE中的总酚酸和总黄酮质量分数,ABTS自由基清除实验评价BPE体外自由基清除能力,并采用LPS诱导的小鼠Raw 264.7细胞体外炎症模型,探究BPE对炎症因子和相关基因表达的调控作用。结果显示,BPE的总酚酸及总黄酮质量分数分别为(255.23±21.43)mg/g(绿原酸当量)和(132.85±14.77)mg/g(芦丁当量);BPE的ABTS自由基清除力的IC50值为(53.9± 5.38)μg/mL;在体外抗炎实验中,BPE能显著抑制Raw 264.7细胞NO的释放,显著抑制iNOS、IL-1β和IL-10,增强HO-1基因mRNA水平的表达,并呈一定的剂量相关性。表明,BPE富含黄酮和酚酸类物质并具有很强的自由基清除能力,在体外细胞实验中表现出了良好的抗炎症效果。
茶蜂花粉;自由基清除;抗炎
蜂花粉中含有丰富的营养物质和生物学活性物质[1],具有保护心血管系统、促进机体免疫力、清除自由基、调节肠道功能和治疗前列腺疾病等功能[2-3]。炎症是机体组织受到病原体、受损细胞和其它刺激物等有害刺激所产生的一种自我保护性应答反应[4],目前蜂产品中蜂胶的抗炎症功能及其机制已得到广泛的研究[5],蜂花粉作为重要的蜂产品之一却鲜有抗炎症研究的报导。本研究中通过体外抗氧化实验评价茶(Camellia sinensis)蜂花粉提取物的抗氧化能力,并研究了其对脂多糖(Lipopolysac-charide,LPS)诱导的小鼠单核巨噬细胞(Raw 264.7)体外炎症反应和相关的炎症转录因子mRNA水平的表达作用,探讨了蜂花粉提取物的抗炎症作用及其可能的机制。
1 材料与方法
1.1材料
茶蜂花粉,2013年10月采集自浙江安吉;小鼠巨噬细胞RAW 264.7细胞,由浙江大学生命科学研究院夏总平教授惠赠;脂多糖(LPS),购自美国Sigma公司;PCR引物,合成于上海生工生物工程技术服务有限公司;SYBR○RPremix Ex TaqTM(2×)等RTPCR试剂,购自宝生物工程(大连)有限公司。
1.2茶蜂花粉提取物的制备
新鲜茶蜂花粉经冷冻干燥、机械破壁后置于-20℃贮存备用。将破壁蜂花粉使用正己烷脱脂,待充分提取后过滤,回收残渣,往残渣中加入体积分数50%乙醇溶液,超声辅助提取,待充分提取后过滤,回收滤液,旋转蒸发滤液,浓缩乙醇,再用乙酸乙酯提取,获得乙酸乙酯提取液,干燥制得提取物(Camellia sinensis Bee Pollen Extract,BPE)。将BPE溶于纯乙醇,制成20 mg/mL BPE储备液,经0.22 μm滤膜过滤后,-20℃贮存备用。
1.3总黄酮和总酚酸质量分数的测定
BPE的总黄酮含量测定方法参照分光光度比色法(GB/T 20574-2006),选用岛津UV-2550型紫外分光光度计测定,吸收波长为415 nm。选用福林-酚法测定BPE的总酚酸含量,以没食子酸为对照,方法参照杨磊等的研究[6]。
1.4ABTS自由基清除力测定
评价BPE的抗氧化能力选用ABTS自由基清除力,依据Shi等的方法[7]并作适当调整。将15 mL 7 mmol/mL的ABTS水溶液与264 μL 140 mmol/mL的过硫酸钾溶液混合后室温下避光静置过夜,形成ABTS+储备液,使用前用无水乙醇稀释至在734 nm吸光度为0.70±0.02。反应在96孔酶标板中进行,每孔加入50 μL相应质量浓度的BPE加100 μL的ABTS+反应液,混合后室温黑暗中孵育10 min,734 nm下测定吸光值。BPE清除力以IC50表示,即达到50%的ABTS自由基清除时的BPE质量浓度。
1.5BPE体外抗炎活性
1.5.1细胞培养及细胞活力测定小鼠巨噬细胞系RAW 264.7培养于100 U/mL青霉素、100 μg/mL链霉素和体积分数10%热灭活胎牛血清混合的DMEM高糖培养基中,置于37℃、体积分数5% CO2培养箱中培养。BPE对RAW 264.7细胞的活性与增殖检测采用Cell Counting Kit-8(CCK8)法,选用Dojido的CCK-8试剂盒。10×104/mL的RAW 264.7细胞接种于96孔细胞培养板中,孵育24 h后加入适当质量浓度的BPE,每孔加入100 μL CCK8试剂反应2 h后利用酶标仪在波长450 nm下测定OD值。
1.5.2Greiss反应测定细胞培养液中NO浓度小鼠巨噬细胞RAW 264.7接种于24孔板孵育24 h,再用相应质量浓度BPE预处理1 h,再用1 μg/mL的LPS刺激。经24 h孵育,收集细胞培养液。离心分装后置于-80℃待测。细胞液中NO浓度选用碧云天NO试剂盒,酶标仪波长550 nm下测定OD值。
1.5.3总RNA提取以及反转录选用Omega公司的E.Z.N.A总RNA试剂盒提取小鼠巨噬细胞RAW264.7的RNA,具体步骤参照用户手册。Nano Drop ND-2000型分光光度计测定提取纯化后的RNA浓度和纯度,然后用焦碳酸二乙酯(DEPC)预处理的水稀释后置于-80℃。以RNA为模板高效合成第一链cDNA的反应体系,选用DRR037A Primpscript○R RT reagent kit试剂盒,在25 μL反应体系中使用1μL RNA模板,反转录产物置于-20℃环境备用。
1.5.4实时定量荧光PCR分析实验中的寡核苷酸引物利用Perlprimer软件设计并由上海生工生物技术公司合成,具体引物信息见表1。实时荧光定量PCR选用TaKaRa的SYBR premix EX Taq试剂盒,根据文献[8]方法分析检测。GAPDH为管家基因,作为目标基因表达水平的标准参照物,选用2ΔΔCt法计算表达水平[9]。

表1 qRT-PCR实验中的引物序列Table 1Primer sequences used for qRT-PCR
2 结果与讨论
2.1BPE的总黄酮、总酚酸质量分数及其ABTS清除力
一些植物类天然产物富含酚酸、黄酮和单宁酸等,这些物质具有强抗氧化和抗自由基能力[10]。BPE中总黄酮和总酚酸质量分数测定结果见表2。可见,以芦丁为对照,BPE总黄酮质量占干质量的13.29%;以绿原酸为对照,其总酚酸质量占干质量的25.52%。
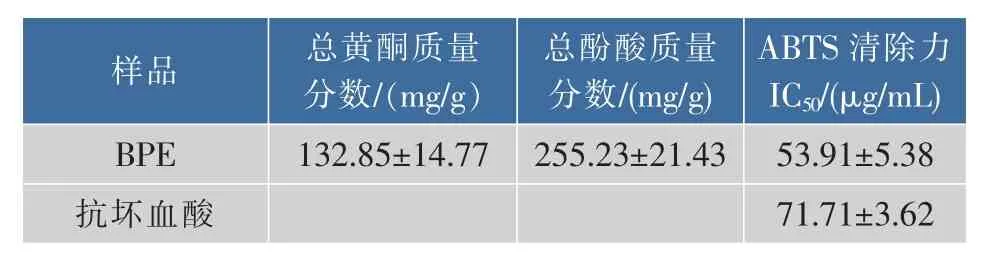
表2 BPE中总黄酮和总酚酸的含量及其ABTS清除能力Table 2Total flavonoid content,total phenolic content and ABTS free-scavenging activities of BPE
在炎症细胞中,多形核白细胞产生并释放活性氧自由基和活性氮自由基,这些自由基包括超氧阴离子、羟基自由基、过氧化氢和一氧化氮等[11]。细胞内产生的过量活性氧自由基会造成核酸、蛋白质、碳水化合物和脂类等生物分子的损伤,恶化炎症程度,对细胞和组织造成严重损伤[12]。因此,清除自由基的能力也是评价抗炎效果的一个重要指标。研究中测得BPE的ABTS自由基清除能力的IC50值为(53.91±5.38)μg/mL,强于维生素C的ABTS自由基清除能力(见表2)。表明BPE具有很强的自由基清除能力,这可能与其富含黄酮和酚酸类物质有关,与前人的研究结果一致[13]。
2.2BPE对RAW264.7细胞活力的影响
为选择合适浓度的BPE,采用了CCK-8法测定不同浓度的BPE对RAW264.7细胞生长的影响,结果见图1。质量浓度为5~100 μg/mL时,RAW264.7细胞活力未出现显著性变化,表明该质量浓度范围内BPE处理无明显细胞毒性。而高于此质量浓度时,RAW264.7细胞的活力显著降低。因此,后续研究将100 μg/mL设为质量浓度实验上限。
2.3BPE对RAW264.7细胞的体外抗炎作用
2.3.1BPE对NO释放的作用NO是由NO合酶(Nitric Oxide Synthase,NOS)催化L-精氨酸(LArgine)而生成。炎症发生过程,NO是一种重要的跨膜信息分子,激活的巨噬细胞可以大量分泌NO,导致周围组织损伤[14]。本研究中评价了不同质量浓度BPE对1 μg/mL LPS刺激的RAW264.7细胞释放NO能力的影响,结果见图2。在刺激的RAW264.7细胞液中NO浓度为(6.52±1.21)μmol/L,在未刺激且以100 μg/mL BPE处理,则其浓度亦处较低水平,为(5.20±0.24)μmol/L,表明在未受LPS刺激的Raw 264.7细胞中,细胞液的NO浓度处于较低水平且BPE并不影响NO释放。LPS刺激24 h后,其浓度增加到(35.70±0.94)μmol/L。而在刺激前1 h加入不同质量浓度BPE预处理Raw 264.7细胞,发现对其NO的释放能力具有一定抑制,并呈质量浓度依赖性。在BPE质量浓度为80、100 μg/mL时对NO释放的抑制作用极显著。由此可推测,BPE可以通过抑制NO的释放来起到抗炎作用。
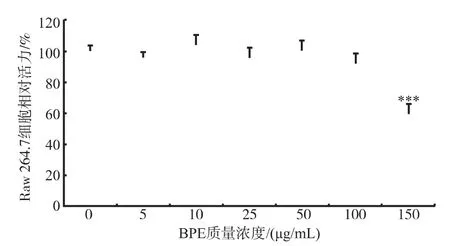
图1 BPE对Raw 264.7细胞活力的影响Fig.1Effects of BPE on the cell viability of Raw 264.7 cells
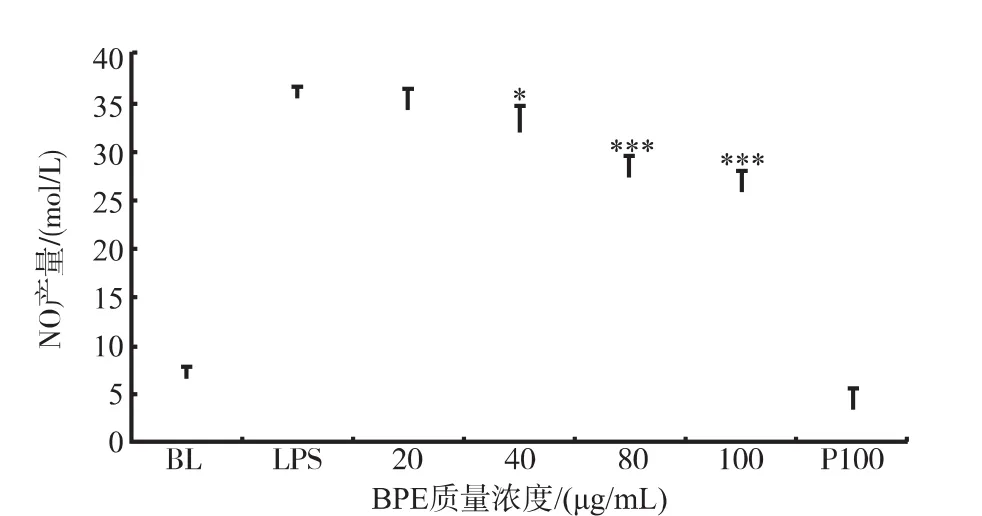
图2 BPE对Raw 264.7细胞释放NO能力的影响Fig.2Effects of BPE on nitric oxide(NO)production in Raw 264.7 cells
2.3.2BPE对炎症调节因子mRNA水平表达的作用在炎症过程中,细胞内诱导型NO合酶(induced Nitric Oxide Synthase,iNOS)会高表达[15]。NO测定结果表明,BPE可抑制炎症过程中NO产生,且呈剂量相关性。已有蜂胶研究表明,巴西绿蜂胶醇提取液能通过影响核因子-κB(NF-κB)信号通路,从而抑制iNOS基因的转录,进而减少iNOS产生,抑制iNOS催化合成NO的能力[16-17]。本研究中,iNOS基因mRNA的水平表达定量结果见图3。4个给药质量浓度均极显著抑制iNOS基因mRNA水平的表达,且也具有质量浓度相关性,与对NO的抑制效果一致,可推测BPE可能存在与巴西绿蜂胶醇提取液相同的作用机制,即抑制NO合成。在剂量上,20μg/mL的BPE对iNOS基因mRNA水平的表达抑制效果非常显著,但此后随着质量浓度的增加抑制效果趋于平缓,这可能与20 μg/mL给药质量浓度后iNOS表达已处于较低水平相关。
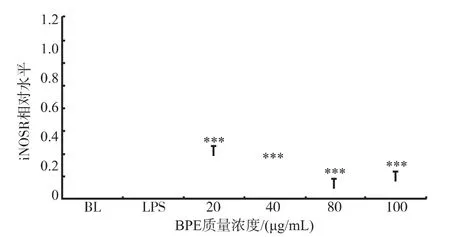
图3 BPE对Raw 264.7细胞中iNOS的mRNA水平表达的影响Fig.3Effects of BPE on the mRNA expression of iNOS in LPS stimulated Raw 264.7 cells
白介素-1β(interleukin-1β,IL-1β)是重要的炎症相关因子,在炎症反应中它会高表达[15]。在激活的巨噬细胞中,IL-1β是一种重要的促炎症因子,它可加剧炎症反应,造成组织和器官的损伤[18]。本研究中,在20 μg/mL的BPE处理并未表现出对IL-1β的抑制作用,而随着质量浓度的升高显著性地抑制IL-1β的表达,结果见图4,但其抑制作用弱于同质量浓度的BPE对iNOS的表达。
IL-10是一种重要的抗炎症因子,陈红光利用含氢培养液试验LPS诱导的小鼠巨噬细胞Raw 264.7的炎症模型,发现LPS刺激可诱导IL-10的高表达,而含氢培养液可以增强IL-10的表达并具有浓度依赖性[19]。而王慧研究了白藤梨多糖对LPS诱导的小鼠巨噬细胞Raw 264.7炎症模型的免疫调控作用,发现LPS刺激同样可诱导IL-10的高表达,但白藤梨多糖处理均抑制了IL-10的表达。在表达量上随着白藤梨多糖剂量增加,IL-10表达量在增强[20]。本研究中LPS刺激同样可诱导IL-10的高表达,但BPE的处理显著性地抑制了IL-10的表达,且具有一定的质量浓度相关性,结果见图5。BPE质量浓度在80、100 μg/mL时,IL-10的表达量已处于较低水平,BPE对IL-10表达的抑制作用趋缓。因此,推测BPE可能是通过缓解炎症反应而抑制了抗炎症因子IL-10的表达。
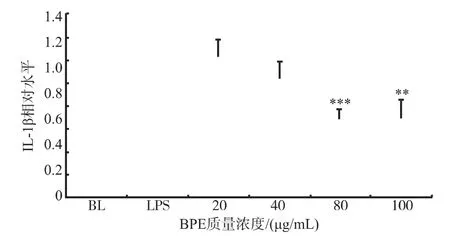
图4 BPE对Raw 264.7细胞中IL-1β的mRNA水平表达的影响Fig.4Effects of BPE on the mRNA expression of IL-1β in LPS stimulated Raw 264.7 cells
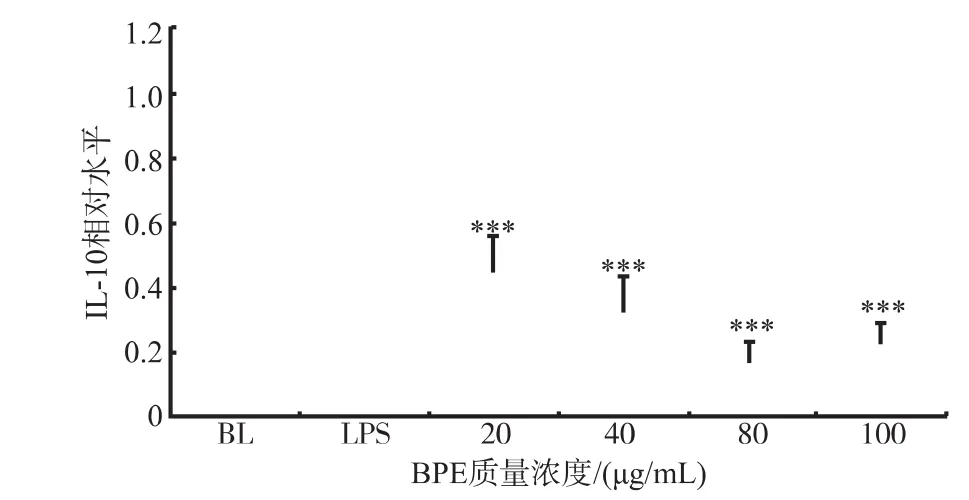
图5 BPE对Raw 264.7细胞中IL-10的mRNA水平表达的影响Fig.5Effects of BPE on the mRNA expression of IL-10 in LPS stimulated Raw 264.7 cells
血红素氧合酶-1(hemeoxygenase-1,HO-1)是一种应激反应蛋白质,可有效调控细胞内的活性氧水平,从而起到抗氧化作用[21]。HO-1的高表达可以增强细胞抵抗凋亡刺激的能力[22]。研究发现,LPS刺激后细胞内增强了HO-1基因mRNA水平的表达,而BPE预处理极显著地增强了HO-1基因mRNA水平的表达,结果见图6,100 μg/mL的BPE处理时HO-1的表达量接近LPS刺激时的4倍,并呈现出随着剂量的增加HO-1的表达也不断增强。因此可以推断,BPE在LPS诱导的小鼠巨噬细胞炎症模型中是一种强有效的抗氧化剂,从而发挥对细胞损伤的保护作用。Park等研究发现,高表达的HO-1可有效抑制TNF-α、IL-6和IL-10的表达[22-25],因此可推测BPE可能是通过增强HO-1的表达来抑制iNOS、IL-1β和IL-10的表达,从而起到抗炎作用。
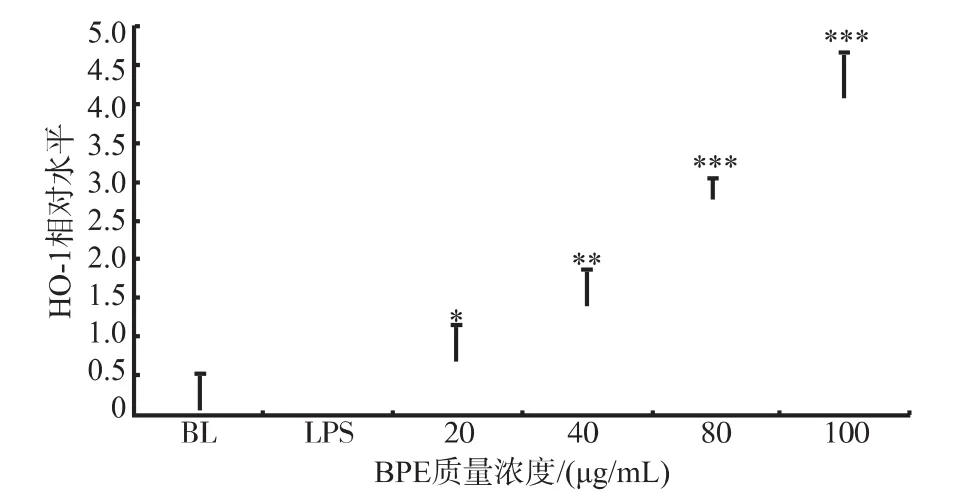
图6 BPE对Raw 264.7细胞中HO-1的mRNA水平表达的影响Fig.6Effects of BPE on the mRNA expression of HO-1 in LPS stimulated Raw 264.7 cells
3 结语
茶蜂花粉提取物BPE含有丰富的酚酸和黄酮类物质,并且具有极强的清除自由基的能力。在细胞实验中,BPE可以有效地抑制NO的产生,同时增强HO-1的表达,抑制iNOS、IL-1β和IL-10炎症相关基因的表达,从而起到良好的体外抗炎症效果。但是,本研究结果只是论证了BPE具有的体外抗炎症功效,仍需有进一步的动物实验进行验证,以便充分开发茶蜂花粉的抗炎症活性。
[1]任乃艳,卢荣,程妮,等.蜂花粉活性成分的研究进展[J].中国蜂业,2011(10-12):76-78.
REN Naiyan,LU Rong,CHEN Ni,et al.Recent advances in active ingredients of bee pollen[J].Apiculture of China,2011(10-12):76-78.(in Chinese)
[2]Llnskens H,Jorde W.Pollen as food and medicine-a review[J].Economic Botany,1997,51(1):78-86.
[3]Silva T M S,Camara C A,da Silva Lins A C,et al.Chemical composition and free radical scavenging activity of pollen loads from stingless bee Melipona subnitida Ducke[J].Journal of Food Composition and Analysis,2006,19(6):507-511.
[4]Coussens L M,Werb Z.Inflammation and cancer[J].Nature,2002,420(6917):860-867.
[5]王凯,张江临,胡福良.蜂胶抗炎活性及其分子机制研究进展[J].中草药,2013,44(16):2321-2329.
WANG Kai,ZHANG Jianglin,HU Fuliang.Research progress in anti-inflammatory activity of propolis and its molecular mechanism[J].Chinese Traditional and Herbal Drugs,2013,44(16):2321-2329.(in Chinese)
[6]杨磊,隋小宇,祖元刚,等.Folin-Ciocalteu法测定迷迭香中总酚酸含量[J].中成药,2009,31(2):272-275.
YANG Lei,SUI Xiaoyu,ZU Yuangang,et al.The Total phenolic content in rosemary determined by the Folin-Ciocalteu method[J].Chinese Traditional PatentMedicine,2009,31(2):272-275.(in Chinese)
[7]Shi H M,Yang H S,Zhang X W,et al.Identification and quantification of phytochemical composition and anti-inflammatory and radical scavenging properties of methanolic extracts of Chinese propolis[J].Journal of Agricultural and Food Chemistry,2012,60(50):12403-12410.
[8]Wang K,Ping S,Huang S,et al.Molecular mechanisms underlying the in vitro anti-inflammatory effects of a flavonoid-rich ethanol extract from chinese propolis(poplar type)[R].Evidence-Based Complementary and Alternative Medicine,2013.
[9]Xie C,Kang J,Li Z,et al.The acai flavonoid velutin is a potent anti-inflammatory agent:blockade of LPS-mediated TNF-alpha and IL-6 production through inhibiting NF-kappa B activation and MAPK pathway[J]. Journal of Nutritional Biochemistry,2012,23(9):1184-1191.
[10]Naczk M,Shahidi F.Extraction and analysis of phenolics in food[J].Journal of Chromatography A,2004,1054(1-2):95-111.[11]Ramos C L,Pou S,Britigan B E,et al.Spin trapping evidence for myeloperoxidase-dependent hydroxyl radical formation by human neutrophils and monocytes[J].Journal of Biological Chemistry,1992,267(12):8307-8312.
[12]Trenam C W,Blake D R,Morris C J.Skin inflammation-reactive oxygen species and the role of iron[J].Journal of Investigative Dermatology,1992,99(6):675-682.
[13]Dudonne S,Vitrac X,Coutiere P,et al.Comparative study of antioxidant properties and total phenolic content of 30 plant extracts of industrial interest using DPPH,ABTS,FRAP,SOD,and ORAC assays[J].Journal of Agricultural and Food Chemistry,2009,57(5):1768-1774.
[14]定天明,陈坚,张正行,等.生物体内一氧化氮的检测方法及其应用[J].药学进展,2005,29(5):221-226.
DING Tianming,CHEN Jian,ZHANG Zhengxing,et al.The methods for determination of nitric oxide in Vivo and their applications[J].Progress in Pharmaceutical Sciences,2005,29(5):221-226.(in Chinese)
[15]Lee K H,Choi E M.Effect of pine pollen extract on experimental chronic arthritis[J].Phytotherapy Research,2009,23(5):651.[16]Song Y S,Park E H,Hur G M,et al.Ethanol extract of propolis inhibits nitric oxide synthase gene expression and enzyme activity[J].Journal of Ethnopharmacology,2002,80(2-3):155-161.
[17]Tan-No K,Nakajima T,Shoji T,et al.Anti-inflammatory effect of propolis through inhibition of nitric oxide production on carrageenin-induced mouse paw edema[J].Biological&Pharmaceutical Bulletin,2006,29(1):96-99.
[18]Bachiega T F,Orsatti C L,Pagliarone A C,et al.The effects of propolis and its isolated compounds on cytokine production by murine macrophages[J].Phytotherapy Research,2012,26(9):1308-1313.
[19]陈红光.含氢培养液对脂多糖致Raw 264.7巨噬细胞炎症反应的影响[D].天津:天津医科大学,2013.
[20]王慧.APES对RAW 264.7细胞的免疫调控作用及其机制研究[D].杭州:浙江大学,2010.
[21]Min K J,Cho K H,Kwon T K.The effect of oxidized low density lipoprotein(oxLDL)-induced heme oxygenase-1 on LPS-induced inflammation in RAW 264.7 macrophage cells[J].Cellular Signalling,2012,24(6):1215-1221.
[22]Liu Z M,Chen G G,Ng E K W,et al.Upregulation of heme oxygenase-1 and p21 confers resistance to apoptosis in human gastric cancer cells[J].Oncogene,2004,23(2):503-513.
[23]Park S Y,Park D J,Kim Y H,et al.Upregulation of heme oxygenase-1 via PI3K/Akt and Nrf-2 signaling pathways mediates the anti-inflammatory activity of Schisandrin in Porphyromonas gingivalis LPS-stimulated macrophages[J].Immunology Letters,2011,139(1-2):93-101.
[24]Chakraborty P,Saraswat G,Kabir S N.Alpha-Dihydroxychalcone-glycoside(alpha-DHC)isolated from the heartwood of Pterocarpus marsupium inhibits LPS induced MAPK activation and up regulates HO-1 expression in murine RAW 264.7 macrophage[J].Toxicology and Applied Pharmacology,2014,277(1):95-107.
[25]Oh Y C,Jeong Y H,Cho W K,et al.Inhibitory effects of palmultang on inflammatory mediator production related to suppression of NF-kappa B and MAPK pathways and induction of HO-1 expression in macrophages[J]. International Journal of Molecular Sciences,2014,15(5):8443-8457.
In Vitro Anti-Flammatory Effects of Camellia Sinensis Bee Pollen Extract(BPE)on LPS-Induced Inflammation in RAW 264.7 Macrophage Cells
PINGShun,WANGKai,ZHANGJianglin,HUFuliang*
(College of Animal Sciences,Zhejiang University,Hangzhou 310058,China)
This study intended to evaluate the anti-inflammatory activity of Camellia sinensis bee pollen extract(BPE).Total phenolic content and total flavonoid content of BPE were determined by the Folin-Ciocalteu method and AlCl3colorimetry,respectively.Meanwhile,ABTS free-radical scavenging methods were used to evaluate its free-radical scavenging capacity.On the other hand,the anti-inflammatory effect of BPE was investigated in vitro by evaluating its modulating effects on the key inflammatory cytokines and the mRNA expression of inflammatory-mediators and cytokine genes in LPS stimulated Raw 264.7 cells.The results showed that the total phenolic content and total flavonoid content of BPE were 255.23±21.43 mg/g and 132.85±14.77 mg/g,respectively.BPE exhibited strong ABTS free-radical scavenging capacity and its IC50value was 53.9±5.38 μg/mL. In vitro,BPE exhibited significantly to inhibit NO release and the mRNA expression of iNOS,IL-1βand IL-10,and to increase the mRNA expression of HO-1.The results indicated BPE was rich in phenolic compounds and had strong free-radical scavenging capacity,and showed a good anti-inflammatory effects in vitro.
Camellia sinensis bee pollen extract,free radical scavenging capacity,anti-inflammation
S 896
A
1673—1689(2015)12—1302—06
2014-11-07
国家蜂产业技术体系专项(CARS-45);浙江省新苗人才计划项目(2013R401287)。
胡福良(1964—),男,浙江东阳人,理学博士,研究员,博士研究生导师,主要从事蜜蜂科学及功能性食品科学的研究。E-mail:flhu@zju.edu.cn
