抗镰刀菌单链抗体在大肠杆菌中可溶性表达条件的研究
2015-10-25胡祖权李和平吴平廖玉才张静柏
胡祖权李和平吴平廖玉才张静柏
(1.贵州医科大学生物与工程学院,贵阳 550004;2.华中农业大学麦类作物分子生物技术实验室,武汉 430070;3.华中农业大学植物科学技术学院,武汉 430070;4.华中农业大学生命科学技术学院,武汉 430070)
抗镰刀菌单链抗体在大肠杆菌中可溶性表达条件的研究
胡祖权1,2,3李和平2,4吴平2,4廖玉才2,3张静柏2,3
(1.贵州医科大学生物与工程学院,贵阳550004;2.华中农业大学麦类作物分子生物技术实验室,武汉430070;3.华中农业大学植物科学技术学院,武汉430070;4.华中农业大学生命科学技术学院,武汉430070)
通过优化诱导表达条件,实现抗镰刀菌单链抗体在大肠杆菌周质中高效可溶性表达。将抗镰刀菌单链抗体FvSG7转化到大肠杆菌XL1-Blue中,确定诱导表达培养基,诱导温度、诱导剂IPTG的浓度和诱导时间条件下培养重组大肠杆菌,通过Western杂交和ELISA检测分析单链抗体的可溶性表达情况以及抗体的活性。重组大肠杆菌培养至OD600nm为0.5时加入终浓度为0.1 mmol/L IPTG,25℃诱导表达2 h可获得最大量的可溶性单链抗体。通过对诱导温度、IPTG浓度和诱导时间等表达条件的优化,可以显著提高FvSG7抗体在大肠杆菌XL1-Blue周质中的表达量。
单链抗体;可溶性表达;大肠杆菌;优化
镰刀菌(Fusarium)是一种世界范围内非常重要的植物病原真菌,能侵染小麦、玉米和水稻等多种作物造成严重病害[1]。镰刀菌不仅能够污染田间作物、仓贮粮食和饲料,还能够引起蔬菜水果以及玉竹、黄芪、三七和半夏等药用植物的根(茎)腐病[2-5]。同时,一些茄腐镰刀菌(F. solani)、尖孢镰刀菌(F. oxysporum)和串珠镰刀菌(F. verticillioides)等还能引起难于根治的人皮肤炎、角膜炎或系统性感染[6]。更严重的是,镰刀菌在侵染过程中会产生大量真菌毒素,包括脱氧雪腐镰刀菌稀醇(Deoxynivalenol,DON)、玉米赤霉烯酮(Zearalenone,ZEN)、伏马菌素(Fumonisin,FB)和T-2毒素等,这些毒素在作物、粮食和饲料中积累,进入食物链,严重危害人、畜健康[1,7]。镰刀菌毒素具有较强的细胞毒性、免疫毒性、神经毒性以及致癌、致畸和致突变等作用,能够引起人和动物急性或慢性中毒,如DON能够引起呕吐、FB可诱导马脑白质软化症(ELEM)和猪肺水肿(PPE)等。我国镰刀菌毒素的污染处于高发生率和高含量的严峻态势[8,9],监控镰刀菌的污染情况有助于在田间病害大面积发生前采取有效的预防措施,也可控制真菌毒素进入食品或饲料中。
免疫学检测方法具有操作简单、价格低廉、灵敏度高和特异性好等特点,已被广泛用于真菌及其毒素的检测分析[10-12]。单链抗体(Single-chain variable fragment,scFv)是具有完整抗原结合位点的最小抗体片段,由VH片段和VL片段通过连接肽(Linker)连接而成,不仅具备良好的亲和力和特异性,还可以在大肠杆菌等表达系统中高效表达,制备过程简单,生产周期短[13,14],在免疫学检测中的应用前景十分广泛。为了发展高效廉价的镰刀菌免疫学检测方法,本课题组在构建鸡源单链抗体基因文库的基础上,通过噬菌体展示技术筛选获得高亲和力的抗镰刀菌单链抗体FvSG7及其编码基因[10],已用于构建抗体融合蛋白及免疫检测,具有良好的开发应用前景。单链抗体表达后由于不需要糖基化修饰过程,可以采用比真核表达系统更为简单的大肠杆菌生产技术制备。但是,包涵体表达的单链抗体复性后的生物活性往往受到影响,而且增加生产成本,限制了单链抗体的应用。因此,高效可溶性表达是其生产应用的前提条件。影响蛋白原核表达的影响因素很多,包括宿主菌、表达载体、目的基因、温度、IPTG浓度和诱导表达时间等,课题组在前期工作中已成功在大肠杆菌XL1-Blue中表达出可溶性FvSG7单链抗体[10],但其表达量需进一步提高。因此,本研究重点对该单链抗体的最适诱导表达温度、IPTG浓度和诱导时间等因素进行优化,以提高重组大肠杆菌周质中可溶性单链抗体的表达量,为后期大规模的表达、纯化和应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 抗镰刀菌单链抗体编码基因FvSG7(GenBank登录号:KC304795)为本实验室筛选获得;重组质粒pHENHi-FvSG7由本实验室构建;大肠杆菌(Escherichia coli)XL1-Blue感受态细胞购于Stratagene公司;重组大肠杆菌XL1-Blue[pHENHi-FvSG7]由本实验室转化重组质粒pHENHi-FvSG7到XL1-Blue感受态细胞中获得。
1.1.2 试剂 胰蛋白胨和酵母提取物购自英国Oxiod公司;碱性磷酸酶(AP)标记羊抗鼠抗体购自美国Sigma公司;抗His单克隆抗体购自天根生化科技(北京)有限公司;BCIP/NBT显色试剂盒购自武汉博士德生物工程有限公司。Ni-NTA蛋白纯化基质购自Qiagen公司;蛋白分子量标准购自Fermentas公司;对硝基苯磷酸二钠(pNPP)购自Amresco公司;氨苄青霉素(Amp)和异丙基-β-D-硫代半乳糖苷(IPTG)购自中国MDBio公司;引物由上海英骏有限公司合成。其余试剂为国产分析纯。
1.1.3 培养基及试剂配制 LB培养基:1%(W/V)胰蛋白胨,0.5%(W/V)酵母提取物,1%(W/V)NaCl,pH 7.0;2× TY培养基:1.6%(w/v)胰蛋白胨,1%(W/V)酵母提取物,0.5%(W/V)NaCl,pH7.0;PBS缓冲液:137 mmol/L NaCl,2.7 mmol/L KCl,10 mmol/L Na2HPO4,1.8 mmol/L KH2PO4,pH7.2-7.4;PBST溶液:含0.1%(V/V)的PBS溶液;TBS缓冲液:20 mmol/L Tris-HCl,150 nmol/L NaCl,pH8.0;TBST溶液:含0.1%(V/V)Tween-20的TBS溶液;PPP溶液:30 mmol/L Tris-HCl,20%(W/V)蔗糖,pH 8.0;Buffer B:50 mmol/L NaH2PO4,300 mmol/L NaCl,20 mmol/L咪唑,pH 8.0;Buffer C:50 mmol/L NaH2PO4,300 mmol/L NaCl,250 mmol/L咪唑,pH 8.0。
1.2 方法
1.2.1 培养基的选择 取5 μL甘油保存的重组大肠杆菌XL1-Blue[pHENHi-FvSG7]接种于20 mL含1%(W/V)葡萄糖和100 μg/mL Amp的LB培养基中,37℃,200 r/min振荡过夜培养12 h。取1 mL菌液分别接种至100 mL含100 μg/mL Amp的LB和2× TY培养基中,37℃,200 r/min振荡培养至OD600nm为0.5,加入终浓度为1 mmol/L的IPTG,30℃诱导表达8 h,收集周质蛋白进行ELISA检测。
1.2.2 单链抗体诱导表达条件优化 甘油保存菌过夜培养后,取2 mL菌液接种至200 mL含100 μg/mL Amp的新鲜培养基中,37℃,200 r/min振荡培养至OD600nm为0.5,按5 mL/管分装至细菌培养管中,对诱导表达条件进行优化。首先,在加入终浓度为1 mmol/L的IPTG条件下,分别在25℃、30℃和37℃条件下诱导表达8 h,确定单链抗体的诱导表达温度;接着,在该温度条件下,分别加入终浓度为0、0.01、0.03、0.05、0.08、0.1、0.3、0.5、0.8、1.0、1.2、1.5、1.8和2.0 mmol/L的IPTG诱导表达8 h,分析IPTG浓度对单链抗体表达量和活性的影响;最后,在确定的最适温度和IPTG浓度条件下,分别诱导表达0、2、4、6、8、10、12 h,并测定菌液OD600nm值。
1.2.3 渗透压休克法提取大肠杆菌周质蛋白 收集4 mL菌液于离心管中,3 000 r/min离心5 min,菌体用300 μL PPP溶液(含1 mmol/L EDTA)重悬,冰上放置15 min后,在4℃条件下6 000 r/min离心15 min,收集上清。沉淀重悬于600 μL终浓度为5 mmol/L的MgCl2溶液(含1 mmol/L EDTA)中,冰浴15 min后,在4℃条件下6 000 r/min离心15 min,收集上清合并后用于Western blot和ELISA检测分析。
1.2.4 Western blot分析 取10 μL提取的周质蛋白经过12% SDS-PAGE电泳后,利用半干转印仪(美国Bio-Rad)将凝胶中的蛋白转印到硝酸纤维素膜(NC膜)上,于封闭液(含5%脱脂奶粉的TBS溶液)中37℃放置2 h。经TBST洗涤3次后,加入10 mL封闭液稀释(1∶5 000)的抗His单克隆抗体,室温平缓摇动2 h。TBST洗涤3次,再用封闭液稀释(1∶5 000)的AP标记羊抗鼠抗体孵育2 h。最后,经TBST和TBS分别洗涤5次后,用BCIP/NBT显色试剂盒显色10-20 min。加入蒸馏水终止显色反应,观察显色情况并用GS-800扫描仪(美国Bio-Rad)扫描。
1.2.5 ELISA检测 在ELISA板孔中加入100 μL SCWPs(20 μg/mL)或PBS(对照),37℃水浴包被2 h,用PBS洗涤3次;加入150 μL封闭液(含2%脱脂奶粉的PBS溶液),37℃水浴封闭2 h,用PBS洗涤3次;加入90 μL封闭液和10 μL周质蛋白,37℃反应1.5 h,用PBST和PBS分别洗涤3次;依次加入100 μL封闭液稀释(1∶5 000)的抗His单克隆抗体和AP标记羊抗鼠抗体,37℃反应1.5 h,用PBST和PBS分别洗涤3次;加入100 μL 0.2%(W/V)pNPP显色液,黑暗条件下反应15-30 min,再加入50 μL 3 mol/L的NaOH溶液终止反应,用酶标仪测OD405nm读值。
2 结果
2.1 培养基的选择
采用常用的LB和2× TY培养基培养重组大肠杆菌,检测其生长速度和单链抗体的表达情况。结果发现重组大肠杆菌培养至OD600nm为0.5时,在LB培养基中需要培养约5 h,而在2× TY培养基中仅需3.5 h左右,说明重组大肠杆菌在2× TY培养基中生长速度更快,这可能与其含有更多的营养物质有关。加入IPTG诱导表达8 h后,ELISA检测显示LB和2× TY培养基培养后收集的菌体周质蛋白的平均值分别为1.019和1.472,后者约为前者的1.5倍。因此,选择2× TY培养基作为FvSG7抗体的诱导表达培养基。
2.2 温度对单链抗体表达的影响
在加入IPTG终浓度为1 mmol/L的情况下,分别在25、30和37℃培养诱导重组E. coli表达8 h,渗透压休克法提取细胞周质蛋白,通过Western blot分析单链抗体的表达情况如图1所示,单链抗体在25℃诱导表达时获得最高的表达量。同时,该温度诱导表达的单链抗体在ELISA检测时也得到相对较高的值(图2)。因此,FvSG7抗体的诱导表达温度确定为25℃。
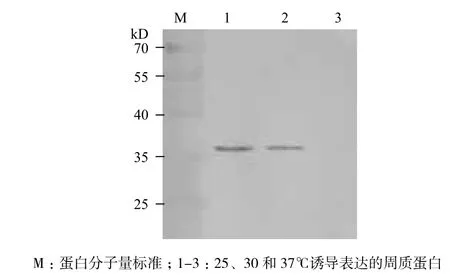
图1 Western blot分析温度对单链抗体表达量的影响
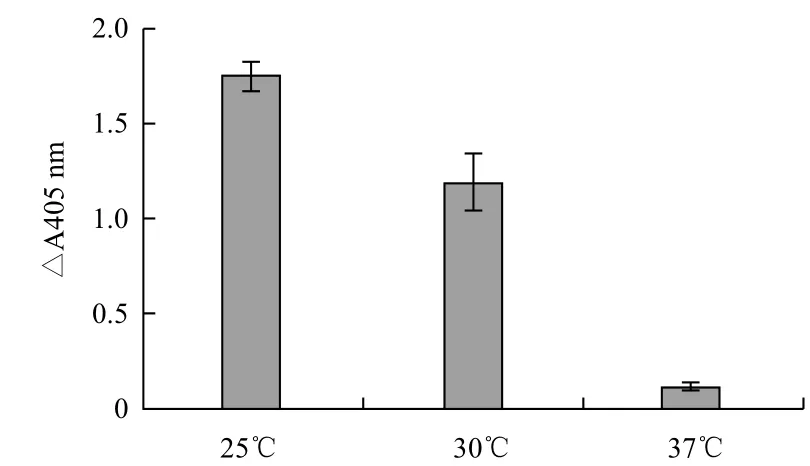
图2 ELISA检测温度对单链抗体活性的影响
2.3 IPTG浓度对单链抗体表达的影响
在25℃培养条件下,分别加入不同终浓度的IPTG诱导表达8 h,渗透压休克法提取细胞周质蛋白,通过Western blot分析单链抗体的表达情况,图3显示IPTG在低于1.0 mmol/L时,浓度对单链抗体的表达量没有太大的影响,更高的IPTG浓度反而得到较少的抗体表达量。同时,ELISA检测结果也显示IPTG浓度对周质蛋白的活性影响不大,与其表达量的影响基本一致(图4)。此外,在没有IPTG的情况下,也有少量单链抗体在周质蛋白中表达。通过对单链抗体的表达量和活性,以及实验操作和成本等方面的考虑,我们认为约0.1 mmol/L的IPTG浓度用于单链抗体的表达比较合适。
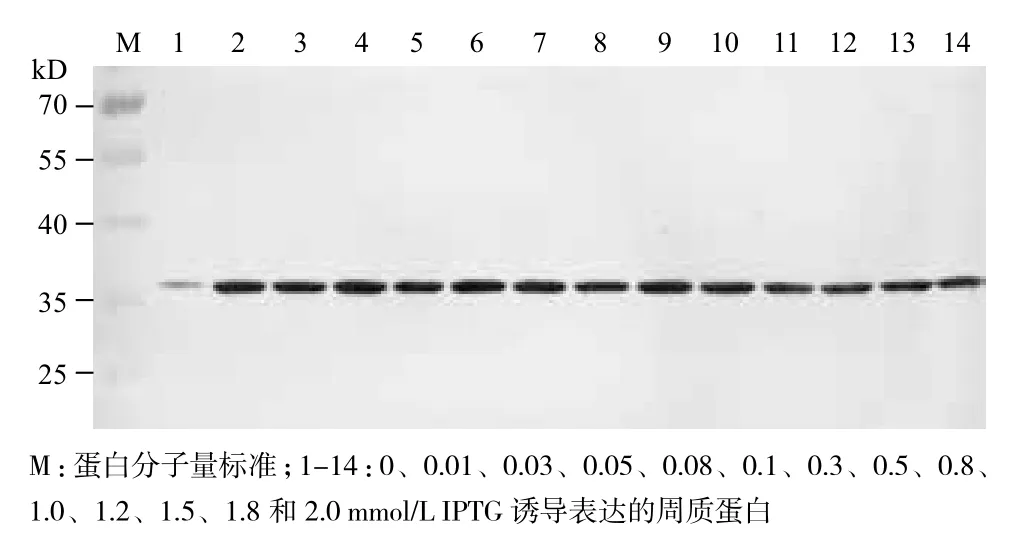
图3 Western blot分析IPTG浓度对单链抗体表达量的影响
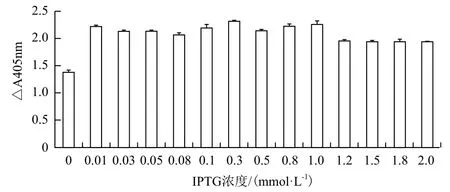
图4 ELISA检测IPTG浓度对单链抗体活性的影响
2.4 诱导时间对单链抗体表达的影响
在25℃和0.1 mmol/L IPTG条件下,分别诱导培养0、2、4、6、8、10和12 h,测定菌液浓度,并且采用渗透压休克法提取细胞周质蛋白,通过Western blot分析单链抗体的表达情况,图5显示在诱导前已有少量抗体表达,加入IPTG诱导培养2 h即可得到最大抗体量。在诱导表达2-12 h内,周质蛋白中的单链抗体积累量逐渐减少,与菌液浓度(图6)呈正相关。通过ELISA检测周质蛋白中单链抗体的活性,结果(图7)表明其活性在诱导培养2 h时达到最大值,与菌液浓度和单链抗体的积累量相一致。
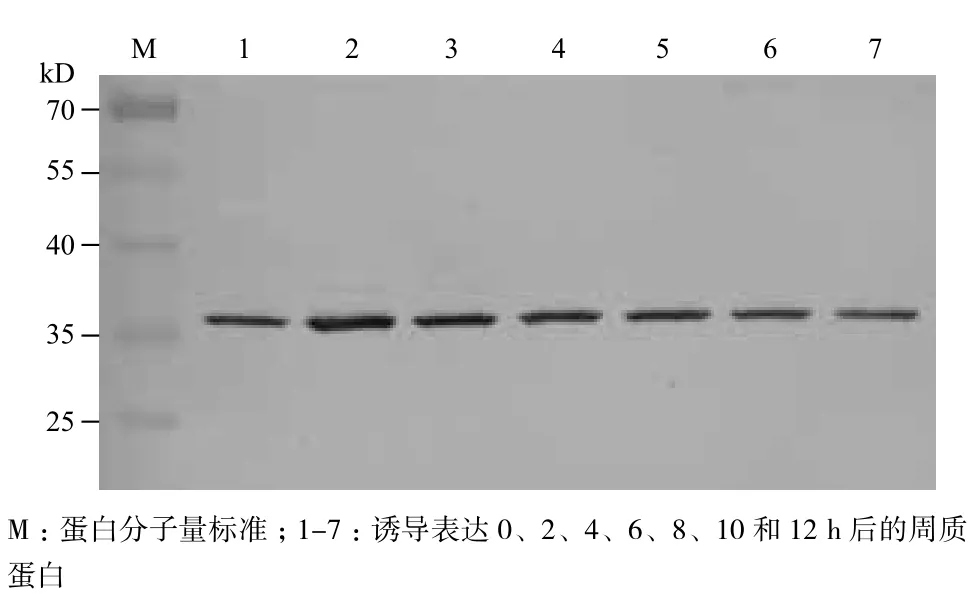
图5 Western blot分析诱导时间对单链抗体表达量的影响
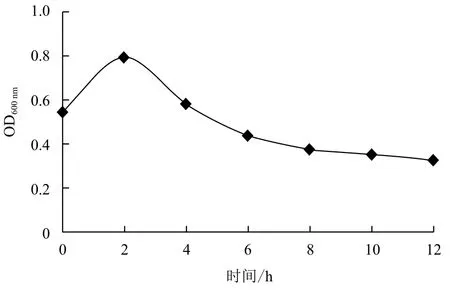
图6 不同诱导培养时间对菌液浓度的影响
2.5 单链抗体超量表达、纯化及检测
通过对FvSG7抗体表达条件的优化,确定在2× TY培养基中加入终浓度为0.1 mmol/L的IPTG,25℃诱导表达2 h即可从重组大肠杆菌周质中获得大量的可溶性抗体。在该条件下表达提取的周质蛋白经Ni-NTA柱纯化后,其产量可达到13 mg/L。在加入200 nmol/L纯化的抗体进行ELISA检测时,显色反应30 min后的OD405nm值达到2.268,表明FvSG7抗体纯化后仍保持很高的亲和力。

图7 ELISA检测不同诱导时间对单链抗体活性的影响
3 讨论
原核表达系统具有生产周期短和简单经济等优势,单链抗体最初构建时即是在E. coli中表达[15,16]。原核生物E. coli也是目前发展最成熟、应用最广泛的表达系统[13]。单链抗体在E. coli中的表达主要有3种形式,即直接在细胞质中以包涵体形式表达、与菌体蛋白融合表达或分泌表达[14]。包涵体通过变复性获得具有生物活性的蛋白仍然是本领域亟待解决的关键技术之一,Skerra和Plückthun[17]最早发展的细胞周质分泌表达体系已成为各种单链抗体最常用的表达途径[13],但其突出的缺点是相对表达量较低[14]。单链抗体在E. coli中诱导表达的影响因素很多,包括氨基酸序列和蛋白结构等抗体的固有特性以及一些外在因素或宿主理化环境,如培养温度、抗体表达加工环境和过程、抗体对细胞的毒性及分子伴侣等辅助分子的存在情况等[14,18,19]。目前,各种抗原的特异单链抗体可以通过直接从杂交瘤细胞中克隆或噬菌体等展示技术筛选获得,可溶性高效表达则是获得单链抗体后需要研究的又一重点和难点[13],大量研究试图通过改造宿主菌、构建融合蛋白、突变抗体基因或优化表达条件等手段来改善抗体的表达量、稳定性或活性[14,20,21]。本研究在优化FvSG7抗体的原核表达条件时,无论是菌液浓度和周质蛋白中的单链抗体积累量,还是周质蛋白中的抗体活性,都没有随着诱导时间的延长而得到更多的积累和提高,分析其原因可能是表达的FvSG7抗体对菌体具有一定的细胞毒性,而菌体量的减少使得周质蛋白中单链抗体总量相应减少。总之,本研究通过对单链抗体表达条件的优化,成功实现抗镰刀菌单链抗体在大肠杆菌中的可溶性高效表达,纯化后的单链抗体仍具有很高的活性,为FvSG7抗体的生产应用奠定了良好的实验基础,同时为大肠杆菌生产小分子重组抗体提供了有价值的参考。
4 结论
相对于LB培养基,重组大肠杆菌在2× TY培养基中表达FvSG7抗体的效率更高。通过比较不同诱导温度、诱导剂IPTG的浓度和诱导时间对可溶性抗体表达的影响,确定FvSG7抗体的优化表达条件为:重组大肠杆菌培养至OD600nm为0.5时,加入终浓度为0.1 mmol/L IPTG,25℃诱导表达2 h。FvSG7抗体在该条件下大量表达纯化后,产量可达到13 mg/L,并保持很高的亲和力。
[1]Binder EM, Tan LM, Chin LJ, et al. Worldwide occurrence of mycotoxins in commodities, feeds and feed ingredients[J]. Anim Feed Sci Technol, 2007, 137(3-4):265-282.
[2]崔蕾, 刘塔斯, 龚力民, 等. 玉竹根腐病病原菌鉴定及抑菌剂筛选试验研究[J]. 中国农学通报, 2013, 29(31):159-162.
[3]邓成贵. 黄芪根腐病病原鉴定研究初报[J]. 中药材, 2005, 28(2):85.
[4]缪作清, 李世东, 刘杏忠, 等. 三七根腐病病原研究[J]. 中国农业科学, 2006, 39(7):1371-1378.
[5]孙新荣, 呼丽萍, 刘艳梅, 等. 半夏块茎腐烂病病原鉴定和药效比较[J]. 中国中药杂志, 2010, 35(7):837-841.
[6]Guarro J. Fusariosis, a complex infection caused by a high diversity of fungal species refractory to treatment[J]. Eur J Clin Microbiol Infect Dis, 2013, 32(12):1491-1500.
[7]Nesic K, Ivanovic S, Nesic V. Fusarial toxins:secondary metabolites of Fusarium fungi[J]. Rev Environ Contam Toxicol, 2014, 228:101-120.
[8]Wang JH, Zhang JB, Li HP, et al. Molecular identification, mycotoxin production and comparative pathogenicity of Fusarium temperatum isolated from maize in China[J]. J Phytopathol, 2014, 162(3):147-157.
[9]Gong HZ, Ji R, Li YX, et al. Occurrence of fumonisin B1in corn from the main corn-producing areas of china[J]. Mycopathologia, 2009,167(1):31-36.
[10]Hu ZQ, Li HP, Zhang JB, et al. A phage-displayed chicken singlechain antibody fused to alkaline phosphatase detects Fusarium pathogens and their presence in cereal grains[J]. Anal Chim Acta, 2013, 764:84-92.
[11]Xue S, Li HP, Zhang JB, et al. Chicken single-chain antibody fused to alkaline phosphatase detects Aspergillus pathogens and their presence in natural samples by direct sandwich enzyme-linked immunosorbent assay[J]. Anal Chem, 2013, 85(22):10992-10999.
[12]Hu ZQ, Li HP, Wu P, et al. An affinity improved single-chain antibody from phage display of a library derived from monoclonal antibodies detects fumonisins by immunoassay[J]. Anal Chim Acta, 2015, 867:74-82.
[13]Ahmad ZA, Yeap SK, Ali AM, et al. scFv antibody:principles and clinical application[J]. Clin Dev Immunol, 2012, 2012:980250.
[14]Arbabi-Ghahroudi M, Tanha J, MacKenzie R. Prokaryotic expression of antibodies[J]. Cancer Metastasis Rev, 2005, 24(4):501-519.
[15]Bird RE, Hardman KD, Jacobson JW, et al. Single-chain antigenbinding proteins[J]. Science, 1988, 242(4877):423-426.
[16]Huston JS, Levinson D, Mudgett-Hunter M, et al. Protein engineering of antibody binding sites:recovery of specific activity in an anti-digoxin single-chain Fv analogue produced in Escherichia coli[J]. Proc Natl Acad Sci U S A, 1988, 85(16):5879-5883.[17]Skerra A, Plückthun A. Assembly of a functional immunoglobulin Fv fragment in Escherichia coli[J]. Science, 1988, 240(4855):1038-1041.
[18] Leong SS, Chen WN. Preparing recombinant single chain antibodies[J]. Chem Eng Sci, 2008, 63(6):1401-1414.
[19]沈宝明, 谭新球, 谭周进, 等. 影响工程菌株目的基因表达的因素[J]. 生物技术通报, 2010, 3:6-12.
[20]刘启刚, 代去见, 张勇侠, 等. 抗IgE单链抗体在大肠杆菌中可溶性高效表达条件的研究[J]. 中国生物工程杂志, 2012,32(11):23-28.
[21]杨涛, 杨利军, 张建林, 等. 抗TNFα单链抗体在大肠杆菌中可溶性表达条件的研究[J]. 药物生物技术, 2010, 17(6):482-486.
(责任编辑 李楠)
A Study on the Optim ization of Condition for Soluble Expression of Fusarium-specific scFv Antibody in Escherichia coli
Hu Zuquan1,2,3Li Heping2,4Wu Ping2,4Liao Yucai2,3Zhang Jingbo2,3
(1. College of Biology and Engineering,Guizhou Medical University,Guiyang550004;2. Molecular Biotechnology Laboratory of Triticeae Crops,Huazhong Agricultural University,Wuhan430070;3. College of Life Science and Technology,Huazhong Agricultural University,Wuhan430070;4. College of Plant Science and Technology,Huazhong Agricultural University,Wuhan430070)
The objectives of the work is to optimize the conditions for inducing expression, and obtain the soluble and high-yield expression of a Fusarium-specific single-chain variable fragment(scFv)antibody in the periplasmic space of Escherichia coli XL1-Blue. The recombinant plasmid containing a Fusarium-specific scFv antibody FvSG7 was transferred into E. coli XL1-Blue. After the culture medium for inducing selected, the soluble expression level and activity of FvSG7 antibody were analyzed by Western blot and ELISA detection for studying the influence of temperature, IPTG concentration and induction time on expression level. The maximum productivity of soluble FvSG7 antibody was obtained after induction at 25℃ for 2 h, with a final concentration of 0.1 mmol/L β-D-thiogalactopyranoside(IPTG)and the cultured bacteria growing to the OD600value of 0.5. In conclusion, the soluble expression of FvSG7 antibody in the periplasm of E. coli XL1-Blue increased significantly by optimizing the expression’s conditions of induction temperature, IPTG concentration and induction time.
single-chain variable fragment antibody;soluble expression;Escherichia coli;optimization
10.13560/j.cnki.biotech.bull.1985.2015.09.034
2015-03-02
国家重点基础研究发展计划项目(2013CB127801),国家自然科学基金项目(31201475)
胡祖权,男,博士,研究方向:抗体基因工程;E-mail:huzuquan@gmc.edu.cn
张静柏,女,博士,研究方向:抗体基因工程;E-mail:jingbozhang@mail.hzau.edu.cn
