滴汞电极法分析锌离子—桑色素络合体系
2015-10-21么丽
么丽
【摘要】采用滴汞电极法研究了Zn2+与桑色素形成络合物的条件及反应机理.在pH7.45的B-R缓冲体系中,桑色素与Zn2+络合并在0.02V(vs,SCE)处产生一个灵敏的极谱波,其峰高与Zn2+浓度在2.00×10-6~1.00×10-5mol·L-1范围内呈现良好的线性关系,r=0.9990,检出限为1.5×10-7mol·L-1。Zn2+与桑色素的配位比为1∶2。
【关键词】滴汞电极;锌离子;桑色素;络合体系
桑色素(Morin)属多羟基黄酮类化合物,可与多种金属离子络合。本文用滴汞电极法研究了Morin与Zn2+的络合作用,建立了测定Zn2+浓度的新方法,可用于环境样品中痕量Zn2+的测定,与目前所报道的Zn2+测定方法[1]相比,具有快速、准确、灵敏度高等特点。
1、实验部分
1.1仪器与试剂
JP-2A型示波极谱仪;pHS-3型酸度计;三电极系统:滴汞电极为工作电极,饱和甘汞电极为参比电极,铂电极为对电极。文中所有电位均是相对参比电极而言。Morin储备液(1.00×10-4mol·L-1),Zn(NO3)2及其余试剂均为分析纯。B-R缓冲溶液体系。实验用水为二次石英蒸馏水。高纯氮气。
1.2实验方法
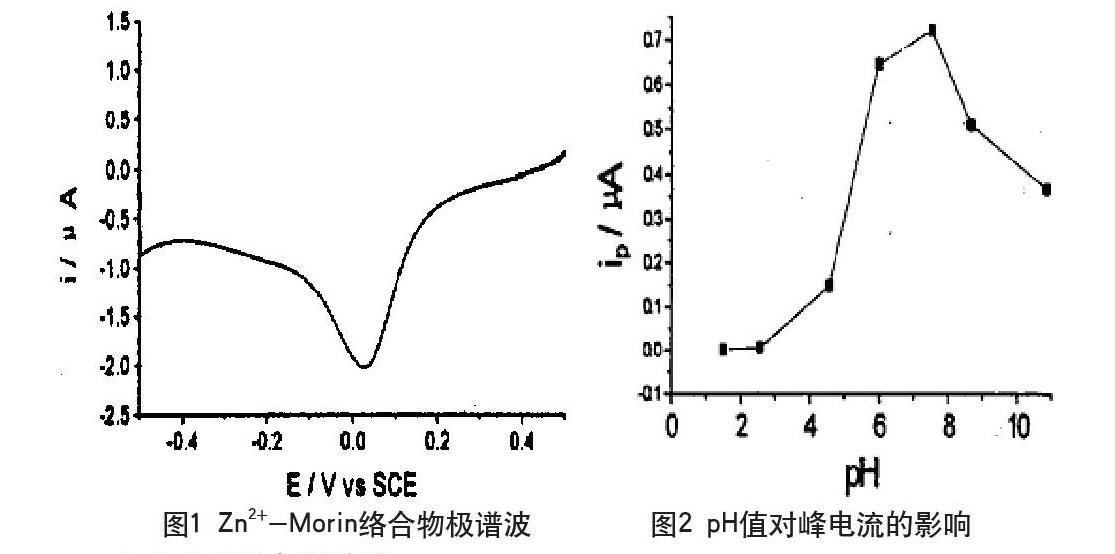
准确移取1.00×10-5mol·L-1Morin2.0mL,1.00×10-5Zn2+mol·L-1溶液1.0mL,pH7.45B-R缓冲溶液5.0mL于10mL容量瓶中,用水定容至刻线,摇匀后转移至电解池中,通氮5min,在+0.5V~-0.5V范围内扫描,记录曲线(图1)。极谱波峰电位为0.02V,据此进行络合物配位机理研究。
2、结果与讨论
2.1络合物形成条件的选择
2.1.1底液选择
分别在B-R、HAc-NaAc、NH3-NH4Cl及HAc-NH4Ac缓冲溶液中测定Zn2+-Morin极谱波,结果表明:在B-R缓冲体系中背景电流无干扰,络合物极谱波波形好,灵敏度高,故用B-R缓冲溶液为底液。
2.1.2底液pH值选择
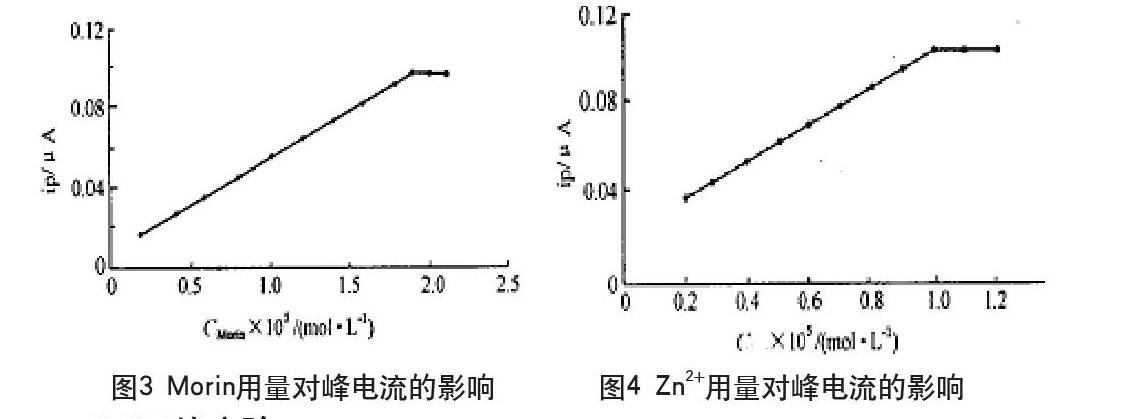
pH5.5~7.5范围内,峰电流随着pH升高而增大;pH>7.5,峰电流随pH升高而减小;pH>11.0时,锌离子产生沉淀,不能准确测定,结果如图2。底液pH值对波形有一定影响,兼顾波形与灵敏度,本实验用pH7.45B-R缓冲溶液为底液。
2.1.3起始电位确定
络合物峰电流与扫描起始电位有关,实验中固定扫描起始电位为0.50V。
2.1.4Morin用量选择
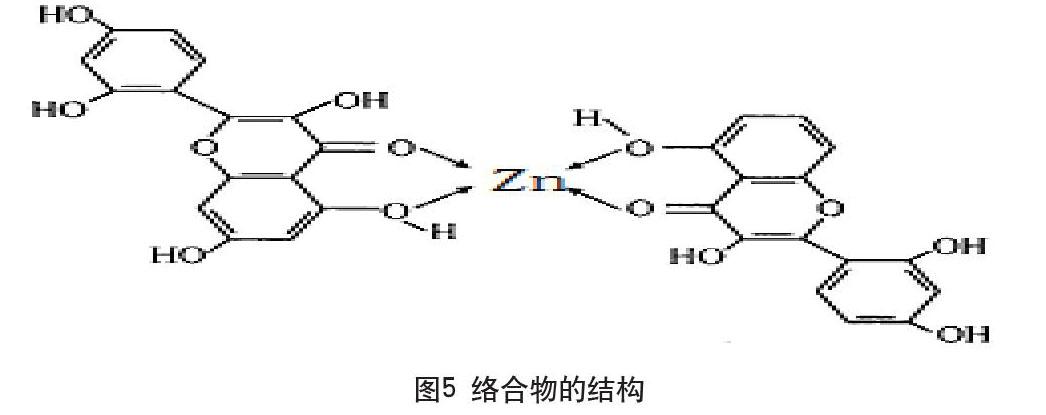
取1.00×10-5mol·L-1Zn2+1.0mL,B-R5.0mL,取不同量的Morin使用液,定容至10mL,测其峰电流,结果表明:Morin在8.00×10-6~1.97×10-5mol·L-1范围内,络合物峰电流随Morin浓度的增大而增大,且成线性关系(图3),r =0.9991,检出限为6.00×10-7mol·L-1,本实验Morin用量为2.0mL。
2.1.5Zn2+用量选择
取Morin2.0mL,B-R溶液5.0mL。改变Zn2+的用量,分别配成10mL溶液,测定各自峰电流。结果表明:Zn2+在2.00×10-6~1.00×10-5mol·L-1浓度范围内,络合物峰电流随Zn2+浓度增大而增大,呈线性关系(图3),本实验取Zn2+溶液用量为1.0mL。
2.2干扰实验
最佳条件下,测定1.0×10-5mol·L-1Zn2+,当相对误差在±5%之内时,同浓度的Ag+、Ca2+、Mg2+存在对Zn2+测定无影响;5倍的Mn2+、Fe2+、Co2+、Ni2+、Fe3+会使Zn2+峰电流分别下降28%、39%、45%、50%、72%。溶液中存在5倍Cu2+时会极大的干扰Zn2+测定。测定前需对干扰离子进行掩蔽或分离。
2.3线性范围与检测限
最佳条件下,Zn2+峰电流与其浓度在2.00×10-6~1.00×10-5mol·L-1范围内有良好的线性关系,其线性方程为:ip=2.75×10-7+0.82CZn2+,r=0.9990,检测限为1.5×10-7mol·L-1。对1.5×10-7mol·L-1、6.0×10-8mol·L-1和3.0×10-8mol·L-1的Zn2+溶液10次测定的相对标准偏差分别为1.8%、2.5%、3.0%。
2.4机理研究
2.4.1络合物的组成研究
摩尔比法:由图3可知,CZn2+/CMorin=1.00∶1.97时峰电流达最大值,即配位比为Zn2+∶Morin=1∶2。根据图4可知,当CZn2+/CMorin=1.00∶2.00时,峰电流达最大值,即配位比为Zn2+∶Morin=1∶2。由此得出结论:络合物组成为Zn2+∶Morin=1∶2。
2.4.2配位机理探讨
通過对桑色素活性基团及结构分析得出结论,桑色素分子中药效主要作用点是中央三碳链的羰基及其对位氧原子,4位上的羰基最活泼,其次为3(或5)位的羟基[2]。从实验结果看,Zn2+∶Morin=1∶2,说明络合发生在4位的羰基和3(或5)位的羟基上,形成一个稳定的六元环。另外,从形成络合物时对配位原子的亲和力看,氧原子的亲合力较大。由此推测,络合物的结构是以Zn2+为中心原子,4个氧原子为配位原子的络合物。其结构示意图如图5。通过荧光试验测得同浓度的Zn2+-Morin比Morin的荧光强度增强,说明推测正确。
参考文献
[1]薛光,丘星初,朱盈权,等.络合物组成的测试方法[M].成都:四川科学技术出社,1985.12228,80
[2]PAN Jing2hao,ZHOU Ge2rong.Polarogrophic and Voltammetric determination of pefloxacin[J ].Anal ChimActa,1995,23(1):42245
