全氟辛烷基磺酸钾(PFOS)和纳米氧化锌(Nano-ZnO)复合暴露对斑马鱼下丘脑-垂体-甲状腺轴功能的影响
2015-10-09杜佳王树涛尤宏
杜佳,王树涛,尤宏,*
1. 哈尔滨工业大学 水资源与环境国家重点实验室,哈尔滨 150090 2. 佳木斯大学 公共卫生学院,佳木斯 154007
全氟辛烷基磺酸钾(PFOS)和纳米氧化锌(Nano-ZnO)复合暴露对斑马鱼下丘脑-垂体-甲状腺轴功能的影响
杜佳1,2,王树涛1,尤宏1,*
1. 哈尔滨工业大学 水资源与环境国家重点实验室,哈尔滨 150090 2. 佳木斯大学 公共卫生学院,佳木斯 154007
全氟辛烷基磺酸钾(PFOS)和纳米氧化锌(Nano-ZnO)广泛存在于环境中,但是它们复合暴露对水生生物的潜在毒性机制尚未明确。本文探讨PFOS和Nano-ZnO复合暴露对斑马鱼下丘脑-垂体-甲状腺轴(HPT轴)毒性的影响。将斑马鱼胚胎从孵化开始暴露于PFOS(0.2、0.4、0.8 mg·L-1)、Nano-ZnO(6.75、12.5、25 mg·L-1)、PFOS+Nano-ZnO(0.2+6.75、0.4+12.5、0.8+25 mg·L-1)溶液中15 d后,分析幼鱼的发育毒性,体内的甲状腺激素(甲状腺素(T4)和三碘甲状腺氨酸(T3)含量和与甲状腺有关基因(CRF、TSH、NIS、TG和TPO)的表达情况。结果发现复合暴露组与单独暴露组相比,前者显著诱导了幼鱼的畸形率,降低了幼鱼的存活率,并抑制了幼鱼的体长。复合暴露组显著增加了幼鱼体内T3含量,同时抑制体内T4的含量。与单独暴露组相比,复合暴露组显著诱导了CRF和NIS基因的表达,同时抑制了TSHβ和TG基因的表达。而TPO基因的表达水平在单独和复合暴露组中没有显著差异。本研究首次证明了PFOS和Nano-ZnO复合暴露对斑马鱼幼鱼甲状腺轴的干扰效果并对其进行了机制探讨。
全氟辛烷磺酸钾(PFOS);纳米氧化锌(Nano-ZnO);斑马鱼;下丘脑-垂体-甲状腺轴;甲状腺激素
全氟类化合物在表面活性剂、农药、润滑油、粘合剂、阻燃剂、推进剂和药物中被广泛应用[1-2]。全氟化合物的广泛使用使其在全球范围内广泛分布[3-4]。全氟辛烷基磺酸钾(PFOS)是许多全氟化合物的环境降解产物。PFOS在野生动物和人体内被广泛检出[5-6],并且其污染在全球范围内均有分布,这引起了人们对其危害的关注[7-10]。PFOS能够诱导斯普拉格-道利小鼠子代肺部的氧化应激和细胞凋亡反应[11]。Keiter等[12](2012)报道了PFOS能导致斑马鱼甲状腺、性腺和肝脏产生病变和生物蓄积。Kim等[13](2010)报道PFOS能够诱导鲫鱼体内产生DNA损伤反应。PFOS还能诱导神经毒性和细胞毒性等[14-15]。纳米技术在过去10年间快速发展并广泛应用于许多领域[16]。纳米氧化锌(Nano-ZnO)是5种纳米金属氧化物之一,在光电、化妆品、催化剂和陶瓷颜料等许多领域被广泛应用[17]。最近一些研究表明Nano-ZnO在河流、土壤和底泥中广泛存在,并且危害人类和动物的健康[18]。Nano-ZnO也可以诱导DNA损伤、炎症反应、氧化应激,导致发育毒性等[19-22]。
甲状腺激素(THs)受下丘脑-垂体-甲状腺轴(HPT)调控,是脊椎动物生长和发育的重要调节激素[23]。THs在胚胎发育和物种蜕变中起着重要的作用[24-26]。甲状腺素(T4)和三碘甲状腺氨酸(T3)是THs的2种主要形式。当血清中T3和T4含量太低时,促甲状腺素释放激素(TRH)能够促进碘的吸收和甲状腺激素的合成。钠碘同向转运体(NIS)是甲状腺激素生产路径的组件,也是转运碘进入甲状腺滤泡细胞的膜蛋白[27-28]。甲状腺球蛋白过氧化物酶(TPO)是一种氧化酶,在碘化离子(I-)转运到甲状腺滤泡细胞后,TPO可将碘化离子氧化成碘(I0)。De Groef等[29](2006)发现促肾上腺皮质激素-释放激素(CRH)可以刺激促甲状腺激素(TSH)分泌,并调节甲状腺激素的合成。PFOS可以诱导啮齿动物,黑头呆鱼和斑马鱼的胚胎发育毒性[30-32]。Zhao等[21](2013)报道Nano-ZnO也能导致斑马鱼胚胎的发育毒性。Du等[33](2009)报道了PFOS长期暴露后会导致斑马鱼胚胎内T3含量的增加。Shi等[32](2009)报道了PFOS暴露改变了斑马鱼幼鱼HPT轴相关的基因表达。Varghese等[34](2001)发现甲状腺内部平衡的破坏可能会影响机体内部的氧化胁迫反应。PFOS和Nano-ZnO单独暴露都能诱导动物机体内的氧化胁迫反应[11, 35]。而PFOS和Nano-ZnO对以上毒性的诱导都与甲状腺功能密不可分。
环境中的污染物正趋于多元化和复杂化,环境污染以各种污染物构成的复合污染为主。在这种状态下,多种污染物共存于同一环境并相互作用。目前,越来越多的科学家开始研究有毒物质的复合暴露毒性[36-38]。单独毒性评价已经不能对污染物进行全面的风险评估。生物体在环境中经常暴露在混合污染物中,所以了解混合污染物的毒性机制并做出正确的环境风险评价已经成为必然趋势。Altenburger等[39](2012)报道称混合污染物的毒性分析应该使用混合毒性模型。Sarigiannis和Hansen[40](2012)利用单独污染物的积累效果来评估混合污染物的风险。PFOS和Nano-ZnO复合暴露的毒性效应研究还很少。虽有Du等[41](2014)报道了PFOS和Nano-ZnO复合暴露可诱导斑马鱼的发育毒性,但PFOS和Nano-ZnO复合暴露的具体毒性机制尚不清晰。本研究将斑马鱼的胚胎暴露在混合的PFOS和Nano-ZnO溶液中,通过分析斑马鱼幼鱼的发育毒性,幼鱼体内的甲状腺激素含量和基因转录等指标的变化情况,研究二者复合引起的甲状腺毒性作用,试图探讨其潜在的毒性机理。
1 材料与方法 (Materials and methods)
1.1实验材料
成年AB品系斑马鱼(Danio rerio)由中国科学院武汉水生生物研究所提供。斑马鱼体长约为3~4 cm,养殖于经活性炭和珊瑚砂过滤的标准化紫外灭菌循环水箱内。斑马鱼(雌雄性比例1:2)饲养在水箱中,水温控制为(28±1) ℃,光照周期明暗比为14 h:10 h,控制饲养1个月左右开始收集鱼卵。饲养水中加入营养盐(294 mg·L-1CaCl2·2H2O、123.3 mg·L-1MgSO4·7H2O、63.0 mg·L-1NaHCO3和5.5 mg·L-1KCl),pH 6.85~7.0,每日喂2次(每次大约10 mL吸管量)丰年虫。
1.2仪器和试剂
水平电泳仪(DYY-6C,北京六一仪器厂),UVP凝胶图像分析仪(Vilber Lourmat),CEX96TM PCR仪(Bio-Rad),定量PCR仪器(American, ABI),电子天平(VIC-412,赛多利斯),台式高速冷冻离心机(Allegra X-22R,德国贝克曼),荧光体式显微镜(SteREO Lumar.V12,德国蔡司),酶标仪(WD-2102A,杭州汇尔仪器设备有限公司)。
全氟辛烷磺酸钾(PFOS,C8HF17KO3S,纯度≥98%,Sigma公司);二甲基亚砜(DMSO,≥99.9%,Sigma公司);纳米氧化锌粒子分散液(CAS no:1314-13-2,<100 nm,Sigma公司);测甲状腺激素含量试剂盒,南京建成科技有限公司;Trizol试剂,PrimeScript RT reagents Kit试剂盒和SYBR Premix Ex TaqTM试剂盒(TaKaRa)。其他试剂均为国产分析纯。
1.3实验方法
1.3.1发育毒性测定
根据预实验结果,PFOS的96 h-LC50为3.502 mg·L-1(95%的置信区间为2.369~5.051 mg·L-1),Nano-ZnO的96 h-LC50为60 mg·L-1(95%的置信区间为44.16~83.35 mg·L-1)。实验结果显示胚胎暴露在1.6 mg·L-1PFOS溶液中与暴露在50 mg·L-1Nano-ZnO溶液中的死亡率相同均为25%。根据1:1等毒性配比,我们选择Nano-ZnO(6.75、12.5、25 mg·L-1)、PFOS(0.2、0.4、0.8 mg·L-1)单独暴露组和PFOS+Nano-ZnO(0.2+6.75、0.4+12.5、0.8+25 mg·L-1)复合暴露组进行实验。暴露时间选择为胚胎产出0 d至15 d。
以斑马鱼培养水为对照溶液,在500 mL烧杯中分别加入上述溶液200 mL,每个烧杯中随机放入发育正常的200个斑马鱼胚胎,每个浓度设置3个重复。暴露试验进行15 d,每天更换一次染毒液。每天观察、记录并挑出死亡个体。暴露结束后,首先在万分之一电子天平上称量2 mL空管重量,然后随机将40条幼鱼收集在离心管中,通过前后重量差计算每条幼鱼的重量,每个浓度重复3次。在荧光体式显微镜上通过标尺测量每条幼鱼的体长。将测完体重的幼鱼储存在-80 ℃冰箱中用于基因表达分析。
1.3.2甲状腺激素测定
甲状腺激素的提取参照Crane等[42]抽提黑头呆鱼(fathead minnow)甲状腺素的方法。每个暴露浓度取50条幼鱼加入预冷的0.5 mL的生理盐水中匀浆。然后将匀浆的样品用超声破碎仪(100 W,10 min)破碎后,4 ℃、5 000 r·min-1离心10 min,收集上清液。在室温下真空干燥过夜。所得样品用0.05 mL甲醇、氯仿和巴比妥重新溶解。将溶解液4 ℃、3 500 r·min-1离心10 min,收集上清液真空干燥过夜。所得样品保存于-80 ℃冰箱中。抽提效率是在样品抽提前加入100 L放射性的I125标记T3和T4,抽提过程完全结束后再次检测样品内的放射性物质的剩余量来确定的。按照南京建成Elisa试剂盒的说明书进行,每个样品3次重复。
教师要摒弃只灌输理论知识的教学方法,学生平时积极参加体育课或者有关的体育活动是因为学生仅有的主动性来自对体育运动的喜爱。所以不能把体育课当成文化课的课程方式教学。教师应当明确确定体育教学方向,必须要让学生明白体育课程设置的价值。促进学生能够主动参与到体育学习和训练过程中来。当代学生课业繁重,体育的作用对于学生有利无弊。

表1 下丘脑-垂体-甲状腺轴(HPT轴)和甲状腺素相关基因引物序列
1.3.3甲状腺基因Real-time PCR测定
用Trizol抽提出斑马鱼的总RNA,利用核酸测定仪测出RNA浓度,UVP凝胶图像分析仪分析RNA图像,利用Prime Script RT reagents Kit试剂盒将总RNA反转录成cDNA;然后用SYBR Premix Ex TaqTM试剂盒进行Real-time PCR。以上实验步骤均按说明书操作。实验结果用2-ΔΔCt方法分析数据,引物序列见表1。
1.4数据统计分析
实验结果均以“平均值±标准误差”即(mean±SD)表示,使用Levene’s进行方差齐性检验。如果数据没有通过测试,进行对数转化,再次进行方差齐性检验。如果满足方差齐性检验,采用SPSS 18.0软件进行统计分析进行单因素方差分析(One Way ANOVA)。进一步进行组间两两比较时,采用Tukey’s检验,以P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析(Results and analysis)
2.1PFOS和Nano-ZnO暴露对斑马鱼的发育毒性
斑马鱼胚胎自受精开始,暴露15 d后,所有暴露组的存活率和畸形率统计结果如图1所示。DMSO处理组与水对照组相比没有显著差异,所以助溶剂DMSO对斑马鱼发育、存活率和畸形率无显著影响。由图1(A)可见,随着PFOS和Nano-ZnO暴露浓度的升高,单一处理组与复合处理组存活率均降低且呈现浓度依赖关系。其中0.8 mg·L-1PFOS单独处理组和所有复合处理组与对照组相比差异显著(P<0.05),复合暴露组的存活率分别由对照组的75.16%±2.64%下降至41.66%±15.17%、42.66%±5.50%和31.33%±3.24%。所有Nano-ZnO单独处理组虽与对照组相比略有降低,但差异不显著,而与复合处理组与对照组相比差异显著(P<0.05)。可见,复合处理能够增加斑马鱼幼鱼的死亡率。由图1(B)可见,单独和复合暴露均能引起幼鱼的形态学异常, (PFOS 0.4 mg·L-1+Nano-ZnO 12.5 mg·L-1,)复合处理组的畸形率较其他2个复合处理组低,可能是由于实验误差造成,需要重复试验次数,但整体呈现上升趋势。(PFOS 0.2 mg·L-1+Nano-ZnO 6.75 mg·L-1)和(PFOS 0.8 mg·L-1+Nano-ZnO 25 mg·L-1)复合处理组的畸形率分别由对照组的4.03%±0.62%上升至21.07%±7.14%和24.16%±6.06% (P<0.05)。复合暴露引起的形态学变化如图2所示。复合处理组引起斑马鱼的畸形率高于2种物质单独暴露引起的畸形率,结果表明在本实验暴露浓度下2种物质复合暴露对幼鱼畸形率的诱导存在协同效应。

图1 PFOS和Nano-ZnO不同浓度处理对斑马鱼幼鱼存活率(A)和畸形率(B)的影响注:P 0.2表示0.2 mg·L-1 PFOS,Z 0.4表示0.4 mg·L-1 Nano-ZnO,P 0.2+Z 6.75表示PFOS 0.2 mg·L-1+Nano-ZnO 6.75 mg·L-1;*P<0.05和**P<0.01表示暴露组与对照组相比差异显著;#P<0.05代表PFOS或Nano-ZnO单独处理组与其相同浓度的复合处理组有显著差异,下同。Fig. 1 The change of (A) surviving rate and (B) malformation rate of zebrafish larvae exposed to single and joint PFOS and Nano-ZnO Note: P 0.2 stands for 0.2 mg·L-1 PFOS, Z 0.4 stands for 0.4 mg·L-1 Nano-ZnO, P 0.2+ Z 6.75 stands for PFOS 0.2 mg·L-1+Nano-ZnO 6.75 mg·L-1; * P<0.05 and ** P<0.01 indicate significant differences between exposure groups and the corresponding control;#P<0.05 indicate significant differences between singe-exposure groups and the corresponding co-exposure groups; the same below.

图3 PFOS和Nano-ZnO不同浓度处理对斑马鱼幼鱼体长(A)和体重(B)的影响Fig. 3 The change of (A) body length and (B) body weight of zebrafish larvae exposed to single and joint PFOS and Nano-ZnO
图3为PFOS和Nano-ZnO单独处理组与复合处理组15 d后斑马鱼幼鱼体长和体重的变化。如图所示,DMSO处理组与水对照组相比没有显著差异。由图3(A)所示,PFOS与Nano-ZnO单独处理组的体长与对照组相比没有显著变化,且不存在剂量效应。但是在PFOS与Nano-ZnO复合处理组幼鱼体长较对照组有下降趋势,且呈现浓度依赖关系,同时(PFOS 0.8 mg·L-1+Nano-ZnO 25 mg·L-1) mg·L-1暴露组幼鱼的体长较对照组显著降低(P<0.05),由对照组的(5.25±0.35) mm降至(4.58±0.05) mm。所有处理组幼鱼的体重与对照组相比略有降低,但是均无显著差异见图3(B)。由实验数据可以看出,PFOS和Nano-ZnO复合暴露对幼鱼的发育毒性,主要表现在对存活率和畸形率的影响。
2.2PFOS和Nano-ZnO暴露对甲状腺激素水平影响
从图4(A)中可以看出,在PFOS单独和复合处理组中T3的含量都呈现剂量浓度效应,在Nano-ZnO单独处理组中T3的含量与对照组相比呈现上升趋势。0.8 mg·L-1PFOS和25 mg·L-1Nano-ZnO单独与复合暴露组与对照组相比都差异显著,由对照组的(0.75±0.02) ng·g-1,分别上升至(1.29±0.01) ng·g-1、(1.19±0.04) ng·g-1和(1.45±0.04) ng·g-1。而在(PFOS 0.8 mg·L-1+Nano-ZnO 25 mg·L-1)复合暴露组中,T3的含量大于对应的单独暴露组。由图4(B)所示,T4的含量在单独处理组中与对照组相比略有减少但无显著差异。并且在PFOS单独暴露组中,不存在剂量效应。在(PFOS 0.4 mg·L-1+Nano-ZnO 12.5 mg·L-1)和(PFOS 0.8 mg·L-1+Nano-ZnO 25 mg·L-1)复合暴露组中,T4的含量分别为(46.48±3.83) ng·g-1和(43.69±1.17) ng·g-1与对照组的(63.76±0.34) ng·g-1、0.4 mg·L-1PFOS单独处理组的(58.67±6.18) ng·g-1和0.8 mg·L-1PFOS单独处理组的(61.96±6.17) ng·g-1组相比差异显著(P<0.05)。由此可知,PFOS和Nano-ZnO复合暴露对斑马鱼幼鱼T3含量的诱导起促进作用,而对T4含量的诱导起抑制作用,而DMSO处理组与水对照组相比没有显著差异。
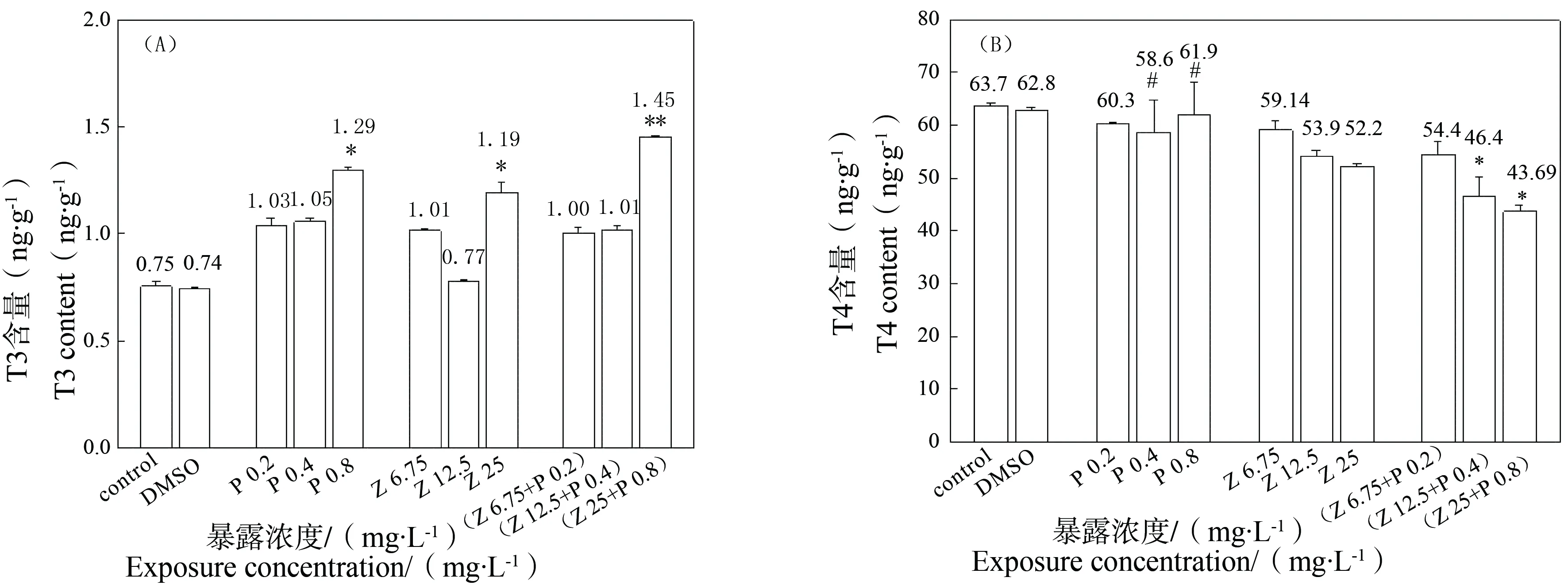
图4 PFOS和Nano-ZnO不同浓度处理对斑马鱼幼鱼体内甲状腺激素T3(A)和T4(B)含量的影响Fig. 4 The whole body content of T3 (A) and T4 (B) of zebrafish larvae exposed to single and joint PFOS and Nano-ZnO

图5 PFOS和Nano-ZnO不同浓度处理对斑马鱼幼鱼CRH(A)和TSHβ(B)基因表达的影响Fig. 5 The transcriptional level of CRH (A) and TSHβ (B) of zebrafish larvae exposed to single and joint PFOS and Nano-ZnO
2.3PFOS和Nano-ZnO暴露对斑马鱼HPT轴相关基因表达影响
图5显示了PFOS和Nano-ZnO暴露15 d对幼鱼体内CRH与TSHβ基因表达的影响。如图5(A)所示,随着暴露浓度的升高,PFOS低浓度处理组与Nano-ZnO单独处理组中CRH基因表达与对照组相比无显著差异。在0.8 mg·L-1PFOS单独处理组中,幼鱼体内CRH基因表达显著上调至对照组的3.54倍(P<0.05)。在(PFOS 0.4 mg·L-1+Nano-ZnO 12.5 mg·L-1)和(P 0.8 mg·L-1+Z 25 mg·L-1)处理组中,幼鱼体内CRH基因表达显著上调分别至对照组的2.56倍和4.15倍(P<0.05)。其中,0.4 mg·L-1PFOS和25 mg·L-1Nano-ZnO单独处理组与其对应的复合处理组相比差异显著(P<0.05)。如图5(B)所示,在Nano-ZnO单独处理组中,TSHβ基因的转录水平与对照组相比略有减少但没有显著差异。在PFOS单独与复合处理组中,随着暴露浓度的升高TSHβ基因的转录水平显著下降(P<0.05)。由此可见,Nano-ZnO单独暴露对TSHβ基因的表达水平没有显著影响,而复合暴露对TSHβ基因表达的抑制作用明显。

图6 PFOS和Nano-ZnO不同浓度处理对斑马鱼幼鱼NIS(A)、TG(B)和TPQ(C)基因表达的影响Fig. 6 The transcriptional level of NIS (A), TG (B) and TPQ (C) of zebrafish larvae exposed to single and joint PFOS and Nano-ZnO
如图6(A)所示,NIS基因表达在PFOS和Nano-ZnO单独处理组中相对于对照组没有显著上调。而在复合暴露组中相对于对照组分别显著上调了2.07、1.78和3.12倍(P<0.05)。NIS基因表达在(PFOS 0.8 mg·L-1+Nano-ZnO 25 mg·L-1)暴露组与单独处理组相比上调差异显著(P<0.05)。如图6(B)所示,在所有PFOS单独处理组中,TG基因表达相对于对照组下调趋势明显。在复合处理组中,随着Nano-ZnO浓度的提高,TG基因表达分别下调至对照组的0.39倍、0.36倍和0.20倍(P<0.05)。在Nano-ZnO单独处理组中,TG基因表达相对于对照组略有下调但不显著。如图6(C)所示,TPO基因表达在所有处理组中,都没有剂量效应,并且与对照组相比差异不显著。可见,2种污染物复合暴露对NIS基因的表达诱导存在相互协同效应。对TG基因的表达存在抑制作用,而对TPO基因的表达没有影响。
3 讨论(Discussion)
PFOS在水环境中具有持久性及内分泌干扰性,这些特性会影响鱼体内的正常甲状腺功能。在本研究中,我们对PFOS和Nano-ZnO联合暴露对斑马鱼甲状腺干扰功能进行了测试和评估。
甲状腺激素在幼鱼的早期发育过程中起着重要作用。Liu等[43](2002)发现甲状腺激素在斑马鱼从胚胎到幼鱼转化阶段中起着至关重要的作用。Zhao等[21](2013)报道了Nano-ZnO对斑马鱼幼鱼发育毒性的诱导和Shi等[32](2009)发现0.4 mg·L-1PFOS能够显著抑制斑马鱼幼鱼的生长,与我们的研究结果相吻合。在本研究中,我们发现PFOS和Nano-ZnO高剂量单独以及两者复合暴露组显著抑制斑马鱼幼鱼的生长发育,并且复合暴露组对斑马鱼幼鱼的发育毒性抑制作用大于单独暴露组。
研究结果表明PFOS和Nano-ZnO复合暴露能显著影响斑马鱼幼鱼体内甲状腺激素的分泌,对其产生甲状腺毒性。Wang等[44](2011)发现PFOS和四溴二苯醚复合暴露导致了阿尔维斯塔小鼠亲本和子代血清中T3和T4含量的变化。在本研究中,T4的含量在单独暴露组中与对照组相比没有发生显著改变,而复合暴露组显著抑制了T4的含量。
在幼鱼的发育过程中,CRH基因的表达上调归因于外界刺激垂体合成促肾上腺皮质激素(ACTH)并调节HPT轴[29]。TSHβ是一种垂体激素,能够刺激甲状腺产生T4。T4进一步转换为三碘甲状腺氨酸(T3)。T3是比较活跃的甲状腺激素,刺激有机体的新陈代谢过程[45]。在本研究中,最高浓度复合暴露组中,CRH基因表达与对照组相比显著上调。而TSHβ基因的转录水平在PFOS暴露组中显著下调。结果说明了PFOS和Nano-ZnO共同暴露可能扰乱了甲状腺激素体内平衡并可增强毒性效果。
NIS能够调节甲状腺卵泡细胞对碘化物的吸收,这个过程是合成甲状腺激素的第一步[27]。TG是一种甲状腺卵泡细胞产生的二聚蛋白,通过这种蛋白可生甲状腺激素T4和T3[46]。TPO是一种甲状腺分泌的胶质化酶,由TSH刺激产生[47],同时催化TG中络氨酸残碘化并耦合成为碘甲腺原氨酸[48]。本研究中,复合暴露组中NIS基因的表达显著上调,而TG基因的表达显著下调。在所有暴露组中,TPO基因的表达没有发生显著的变化,而TG基因在PFOS暴露组中出现了显著的下调。TPO基因受PFOS和Nano-ZnO胁迫的影响较小。Yu等[49](2009)也发现斯普拉格-道利小鼠甲状腺内TPO酶的活性未受PFOS暴露影响。TG基因在幼鱼发育过程中发挥重要的作用。我们发现PFOS和Nano-ZnO暴露都能改变斑马鱼体内TG基因的表达。复合暴露能通过改变与下丘脑-垂体-甲状腺轴相关基因的表达,进而影响斑马鱼幼鱼的甲状腺功能。
结果证明PFOS和Nano-ZnO共同暴露会显著影响斑马鱼幼鱼的发育,干扰甲状腺激素的分泌,改变HPT轴相关基因的表达水平。表面活性剂PFOS能够破坏细胞膜的脂质结构[50],使ZnO纳米粒子更易穿透细胞膜毒害生物。有研究发现PFOS和一些纳米粒子可以形成一种阻力机制,这种机制的产生可以增强细胞毒性[51]。通过这些理论和实验基础,我们认为PFOS和Nano-ZnO在试验浓度范围内对斑马鱼甲状腺的联合毒性作用类型为协同作用。复合污染未来的研究重点应该放在污染物在水中的相互作用机制以及污染物在鱼体内的代谢分解途径。
通讯作者:尤宏(1961-),男,黑龙江省哈尔滨市人,教授,博士,工业废水深度处理与回用技术;近五年来主持和参加包括国家“973计划”课题、国家“863计划”课题、国家科技重大专项课题、省科技攻关项目、国际合作项目课题等10余项。获得黑龙江省科技进步二等奖、环境保护部环保科技二等奖等省部级科研奖3项。发表论文60余篇,获得授权专利5件,软件著作权2件。
[1]Key B D, Howell R D, Criddle C S. Fluorinated organics in the biosphere [J]. Environmental Science & Technology, 1997, 31(9): 2445-2454
[2]Renner R. Growing concern over perfluorinated chemicals [J]. Environmental Science & Technology, 2001, 35(7): 154A-160A
[3]Giesy J P, Kannan K. Global distribution of perfluorooctane sulfonate in wild life [J]. Environmental Science & Technology, 2001, 35(7): 1339-1342
[4]Kannan K, Choi J W, Iseki N, et al. Concentrations of perfluorinated acids in livers of birds from Japan and Korea [J]. Chemosphere, 2002, 49(3): 225-231
[4]Lein N P H, Fujii S, Tanaka S, et al. Contamination of perfluorooctane sulfonate (PFOS) and perfluorooctanoate (PFOA) in surface water of the Yodo River basin (Japan) [J]. Desalination, 2008, 226(1-3): 338-347
[6]Giesy J P, Kannan K. Perfluorochemical surfactants in the environment [J]. Environmental Science & Technology, 2002, 36(7): 146A-152A
[7]So M K, Taniyasu S, Yamashita N, et al. Perfluorinated compounds in coastal waters of Hong Kong, South China, and Korea [J]. Environmental Science & Technology, 2004, 38(15): 4056-4063
[8]Apelberg B J, Goldman L R, Calafat A M, et al. Determinants of fetal exposure to polyfluoroalkyl compounds in Baltimore, Maryland [J]. Environmental Science & Technology, 2007, 41(11): 3891-3897
[9]Inoue K, Okada F, Ito R, et al. Perfluorooctane sulfonate (PFOS) and related perfluorinated compounds in human maternal and cord blood samples: Assessment of PFOS exposure in a susceptible population during pregnancy [J]. Environmental Health Perspectives, 2004, 112(11):1204-1207
[10]Karrman A, Ericson I, van Bavel B, et al. Exposure of perfluorinated chemicals through lactation: Levels of matched human milk and serum and a temporal trend, 1996-2004, in Sweden [J]. Environmental Health Perspectives, 2007, 115(2): 226-230
[11]Chen T, Zhang L, Yue J Q, et al. Prenatal PFOS exposure induces oxidative stress and apoptosis in the lung of rat off-spring [J]. Reproductive Toxicology, 2012, 33(4): 538-545
[12]Keiter S, Baumann L, Farber H, et al. Long-term effects of a binary mixture of perfluorooctane sulfonate (PFOS) and bisphenol A (BPA) in zebrafish (Danio rerio)[J]. Aquatic Toxicology, 2012, 118-119: 116-129
[13]Kim W K, Lee S K, Jung J. Integrated assessment of biomarker responses in common carp (Cyprinus carpio) exposed to perfluorinated organic compounds [J]. Journal Hazardous Materials, 2010, 180(1-3): 395-400
[14]刘晓晖, 胡宏, 李双月, 等. 全氟辛烷磺酸神经发育毒性机制研究进展[J]. 生态毒理学报, 2013, 8(5): 643-649
Liu X H, Hu H, Li S Y, et al. Research progress on mechanisms in the developmental neurotoxicity of PFOS [J]. Asian Journal of Ecotoxicology, 2013, 8(5): 643-649 (in Chinese)
[15]端正花, 王勋功, 王华, 等. 全氟辛烷羧酸(PFOA)与全氟辛烷磺酸(PFOS)的细胞毒性效应[J]. 生态毒理学报, 2014, 9(2): 353-357
Duan Z H, Wang X G, Wang H, et al. The cytotoxic effect of PFOA and PFOS [J]. Asian Journal of Ecotoxicology, 2014, 9(2): 353-357 (in Chinese)
[16]Zhang X, Guo Q, Cui D. Recent advances in nanotechnology applied to biosensors [J]. Sensors (Basel), 2009, 9(2):1033-1053
[17]Lanone S, Boczkowski J. Biomedical applications and potential health risks of nanomaterials:Molecular mechanisms [J]. Current Molecular Medicine, 2006, 6(6): 651-663
[18]Johnston B D, Scown T M, Moger J, et al. Bioavailability of nanoscale metal oxides TiO(2), CeO(2), and ZnO to fish [J]. Environmental Science & Technology, 2010, 44(3): 1144-1151
[19]Sharma V, Anderson D, Dhawan A. Zinc oxide nanoparticles induce oxidative DNA damage and ROS-triggered mitochondria mediated apoptosis in human liver cells (HepG2) [J]. Apoptosis (London), 2012, 17(8): 852-870
[20]Gojova A, Guo B, Kota R S, et al. Induction of inflammation in vascular endothelial cells by metal oxide nanoparticles: Effect of particle composition [J]. Environmental Health Perspectives, 2007, 115(3): 403-409
[21]Zhao X, Wang S, Wu Y, et al. Acute ZnO nanoparticles exposure induces developmental toxicity, oxidative stress and DNA damage in embryo-larval zebrafish [J]. Aquatic Toxicology, 2013, 136-137: 49-59
[22]刘慧, 朱方伟, 尹颖, 等. 纳米ZnO对鲫鱼肝脏的毒性[J]. 生态毒理学报, 2010, 5(5): 698-703
Liu H, Zhu F W, Yi Y, et al. Toxicity of Nano-ZnO onliver of goldfish (Carassius auratus) [J]. Asian Journal of Ecotoxicology, 2010, 5(5): 698-703 (in Chinese)
[23]Erik B, Havitcioglu H, Aktan S, et al. Biomechanical properties of human hair with different parameters [J]. Skin Research Technology, 2008, 14(2): 147-151,.
[24]Kawakami Y, Nozaki J, Seoka M, et al. Characterization of thyroid hormones and thyroid hormone receptors during the early development of Pacific bluefin tuna (Thunnus orientalis)[J]. General and Comparative Endocrinology, 2008, 155(3): 597-606
[25]Marchand O, Duffraisse M, Triqueneaux G, et al. Molecular cloning and developmental expression patterns of thyroid hormone receptors and T3 target genes in the turbot (Scophtalmus maximus) during post-embryonic development [J]. General and Comparative Endocrinology, 2004, 135(3): 345-357
[26]Walpita C N, Van der Geyten S, Rurangwa E, et al. The effect of 3,5,3'-triiodothyronine supplementation on zebrafish (Danio rerio) embryonic development and expression of iodothyronine deiodinases and thyroid hormone receptors [J]. General and Comparative Endocrinology, 2007, 152(2-3): 206-214
[27]Dohan O, De la Vieja A, Paroder V, et al. The sodium/iodide Symporter (NIS): Characterization, regulation, and medical significance [J]. Endocrine Reviews, 2003, 24(1): 48-77
[28]Eskandari S, Loo D D, Dai G, et al. Thyroid Na+/I- symporter. Mechanism, stoichiometry, and specificity [J]. Journal of Biological Chemistry, 1997, 272(43): 27230-27238
[29]De Groef B, Van der Geyten S, Darras V M, et al. Role of corticotropin-releasing hormone as a thyrotropin-releasing factor in non-mammalian vertebrates [J]. General and Comparative Endocrinology, 2006, 146(1): 62-68
[30]Lau C, Thibodeaux J R, Hanson R G, et al. Exposure to perfluorooctane sulfonate during pregnancy in rat and mouse. II: Postnatal evaluation [J]. Toxicological Sciences, 2003, 74(2): 382-392
[31]Ankley G T, Kuehl D W, Kahl M D, et al. Reproductive and developmental toxicity and bioconcentration of perfluorooctanesulfonate in a partial life-cycle test with the fathead minnow (Pimephales promelas) [J]. Environmental Toxicology and Chemistry, 2005, 24(9): 2316-2324
[32]Shi X, Liu C, Wu G, et al. Waterborne exposure to PFOS causes disruption of the hypothalamus-pituitary-thyroid axis in zebrafish larvae [J]. Chemosphere, 2009, 77(7): 1010-1018
[33]Du Y, Shi X, Liu C, et al. Chronic effects of water-borne PFOS exposure on growth, survival and hepatotoxicity in zebrafish: A partial life-cycle test [J]. Chemosphere, 2009, 74(5): 723-729
[34]Varghese S, Shameena B, Oommen O V. Thyroid hormones regulate lipid peroxidation and antioxidant enzyme activities in Anabas testudineus (Bloch) [J]. Comparative Biochemistry and Physiology B-Biochemisty Molecular Biology, 2001, 128(1): 165-171
[35]Wang J, Deng X, Zhang F, et al. ZnO nanoparticle-induced oxidative stress triggers apoptosis by activating JNK signaling pathway in cultured primary astrocytes [J]. Nanoscale Research Letters, 2014, 9(1): 117
[36]Zhang W, Sun X, Chen L, et al. Toxicological effect of joint cadmium selenium quantum dots and copper ion exposure on zebrafish [J]. Environmental Toxicology and Chemistry, 2012, 31(9): 2117-2123
[37]Zhang W, Miao Y, Lin K, et al. Toxic effects of copper ion in zebrafish in the joint presence of CdTe QDs [J]. Environmental Pollution, 2013, 176: 158-164
[38]Thienpont B, Barata C, Raldua D. Modeling mixtures of thyroid gland function disruptors in a vertebrate alternative model, the zebrafish eleuthero embryo [J]. Toxicology and Applied Pharmacology, 2013, 269(2): 169-175
[39]Altenburger R, Scholz S, Schmitt-Jansen M, et al. Mixture toxicity revisited from a toxicogenomic perspective [J]. Environmental Science & Technology, 2012, 46(5): 2508-2522
[40]Sarigiannis D A, Hansen U. Considering the cumulative risk of mixtures of chemicals -A challenge for policy makers [J]. Environmental Health, 2012, 11(S1): S18
[41]Du J, Wang S, You H, et al. Developmental toxicity and DNA damage to zebrafish induced by perfluorooctane sulfonate in the presence of ZnO nanoparticles [J]. Environmental Toxicology, DOI: 10.1002/tox.22050
[42]Crane H M, Pickford D B, Hutchinson T H, et al. Developmental changes of thyroid hormones in the fathead minnow, Pimephales promelas [J]. General and Comparative Endocrinology, 2004, 139(1): 55-60
[43]Liu Y W, Chan W K. Thyroid hormones are important for embryonic to larval transitory phase in zebrafish [J]. Differentiation, 2002, 70(1): 36-45
[44]Wang F, Liu W, Jin Y, et al. Interaction of PFOS and BDE-47 co-exposure on thyroid hormone levels and TH-related gene and protein expression in developing rat brains [J]. Toxicology Sciences, 2011, 121(2): 279-291
[45]Nishiyama R H. Overview of surgical pathology of the thyroid gland [J].World Journal of Surgery, 2000, 24(8): 898-906
[46]Venturi S, Donati F M, Venturi A, et al. Environmental iodine deficiency: A challenge to the evolution of terrestrial life? [J]. Thyroid, 2000, 10(8): 727-729
[47]Ruf J, Carayon P. Structural and functional aspects of thyroid peroxidase [J]. Archives of Biochemistry and Biophysics, 2006, 445(2): 269-277
[48]Dunn J T, Dunn A D. Update on intrathyroidal iodine metabolism [J]. Thyroid, 2001, 11(5): 407-414
[49]Yu W G, Liu W, Jin Y H. Effects of perfluorooctane sulfonate on rat thyroid hormone biosynthesis and metabolism [J]. Environmental Toxicology and Chemistry, 2009, 28(5): 990-996
[50]Wang D, Lin Z, Yao Z, et al. Surfactants present complex joint effects on the toxicities of metal oxide nanoparticles [J]. Chemosphere, 2014, 108: 70-75
[51]Anselmo H M, van den Berg J H, Rietjens I M. Inhibition of cellular efflux pumps involved in multi xenobiotic resistance (MXR) in echinoid larvae as a possible mode of action for increased ecotoxicological risk of mixtures [J]. Ecotoxicology, 2012, 21: 2276-2287
◆
Co-Exposure to PFOS and Nano-ZnO Disrupted the Hypothalamus-Pituitary-Thyroid Axis in Zebrafish Larvae
Du Jia1,2, Wang Shutao1, You Hong1,*
1. State Key Laboratory of Urban Water Resource and Environment, Harbin Institute of Technology, Harbin 150090, China 2. School of Public Health, Jia Mu Si University, Jiamusi 154007, China
11 August 2010accepted 1 October 2010
Perfluorooctanesulphonic acid potassium salt (PFOS) and ZnO nanoparticles (Nano-ZnO) are widely distributed in the environment. However, the potential toxicity of co-exposure to PFOS and Nano-ZnO remains to be fully elucidated. Our present study investigated the effects of co-exposure to PFOS and Nano-ZnO on the hypothalamic-pituitary-thyroid (HPT) axis in zebrafish. The embryos were exposed to PFOS (0.2, 0.4, 0.8 mg·L-1) single solutions, Nano-ZnO (6.75, 12.5, 25 mg·L-1) single solutions and PFOS plus Nano-ZnO (0.2+6.75, 0.4+12.5, 0.8+25 mg·L-1) mixture solutions for 15 days. We analyzed development toxicity, the whole-body content of TH and the expression of genes (corticotropin-releasing factor (CRF), thyroid-stimulating hormone (TSHβ), sodium/iodide symporter (NIS), thyroglobulin (TG), thyroid peroxidase (TPO) related to the HPT axis. Compared with single-exposure groups, the body length and survival rate decreased, the malformation rates increased in co-exposure groups. The triiodothyronine (T3) levels increased and the thyroxine (T4) content decreased in co-exposure groups. Compared with the exposure to PFOS and Nano-ZnO alone, the expression of genes (CRF and NIS) significantly up-regulated and the expression of genes (TSHβ and TG) significantly down-regulated in co-exposure groups. In addition, the expression of TPO gene was unchanged in both the single and co-exposure groups. Our results were the first evidence for the thyroid-disrupting effects of PFOS and Nano-ZnO co-exposure in zebrafish. The results also provide insight into the mechanism of disruption of the thyroid status by PFOS and Nano-ZnO.
perfluorooctanesulphonic acid potassium salt (PFOS); ZnO nanoparticles (Nano-ZnO); zebrafish; hypothalamic-pituitary-thyroid axis; thyroid hormone
哈尔滨工业大学城市水资源与水环境国家重点实验室导向类自主课题(2013DX09)
杜佳(1986-),女,博士,研究方向为环境毒理学,E-mail: dujia532158064@163.com
Corresponding author), E-mail: youhong@hit.edu.cn
10.7524/AJE.1673-5897.20150528004
2015-05-28录用日期:2015-08-25
1673-5897(2015)6-144-10
X171.5
A
杜佳, 王树涛, 尤宏. 全氟辛烷基磺酸钾(PFOS)和纳米氧化锌(Nano-ZnO)复合暴露对斑马鱼下丘脑-垂体-甲状腺轴功能的影响[J]. 生态毒理学报,2015, 10(6): 144-153
Du J, Wang S T, You H. Co-exposure to PFOS and nano-ZnO disrupted the hypothalamus-pituitary-thyroid axis in zebrafish larvae [J]. Asian Journal of Ecotoxicology, 2015, 10(6): 144-153 (in Chinese)
