嗜热脱氮芽孢杆菌产α-半乳糖苷酶影响因素的研究
2015-09-29韦阳道石征宇伍时华广西科技大学生物与化学工程学院广西柳州545006
韦阳道,易 弋,石征宇,邓 春,伍时华,黎 娅*(广西科技大学生物与化学工程学院,广西柳州545006)
嗜热脱氮芽孢杆菌产α-半乳糖苷酶影响因素的研究
韦阳道,易弋,石征宇,邓春,伍时华,黎娅*
(广西科技大学生物与化学工程学院,广西柳州545006)
该文对前期筛选出的嗜热脱氮芽孢杆菌YWX5产α-半乳糖苷酶的影响因素进行了初步的研究,通过测定α-半乳糖苷酶酶活,探究了培养基成分(包括碳源、氮源、无机盐)及培养条件(初始pH值、培养温度、培养时间)对该嗜热脱氮芽孢杆菌产α-半乳糖苷酶能力的影响。实验结果表明,对该菌产酶最有效的碳源为3%豆粕,氮源为0.5%硝酸钾,附加氮源为0.5%酵母浸出物;添加0.5%氯化钠和0.1%磷酸氢二钾有助于该菌产酶。另外,该菌最佳产酶培养温度为60℃,培养基最适初始pH在7.0~8.0,培养时间为65 h。
嗜热脱氮芽孢杆菌;α-半乳糖苷酶;酶活;影响因素
α-半乳糖苷是由一个蔗糖单位(果糖-葡萄糖)与一个或多个α-D-半乳糖分子以α-D-1,6-糖苷键连接构成的低聚糖类物质,主要有三糖棉子糖(raffinose)、四糖水苏糖(stachyose)和五糖毛蕊花糖(verbascose)等。α-半乳糖苷类物质在植物性饲料中广泛存在,其中在豆类饲料中含量最高[1]。由于其不能被动物所利用,间接影响了饲料的利用率,同时会在消化道后端由微生物发酵作用,而引起动物消化不良、气胀等不良的影响,这些都比较大大的降低了饲料的饲用价值[2-5]。α-半乳糖苷酶(α-galactosidase)E.C. 3.2.1.22是一种生物催化剂,它能够特异性催化α-半乳糖苷类物质末端的α-1,6-半乳糖苷键的水解从而释放出半乳糖被动物所利用[6],大大降低豆类饲料引发的幼龄动物腹泻现象,增强动物的免疫功能和抗病能力,减轻了消化器官代偿性增生和肥大,对于提高饲料能量效价有非常大的作用,因此被认为是第三代饲料酶。由于饲料加工过程中有高温工艺,会导致酶失活,因此,热稳定性好的α-半乳糖苷酶因其特殊性逐渐引起了饲料工业的关注。在前期的工作中,课题组分离出一株嗜热脱氮芽孢杆菌YWX5,其具有产α-半乳糖苷酶的特性,并且酶的热稳定性较好[7]。本研究在此基础上,进一步探究了培养基成分(碳源、氮源、无机盐)及培养条件(初始pH值、培养温度、培养时间)对菌株YWX5产α-半乳糖苷酶的影响,为该菌株的工业化应用提供一定的理论基础。
1 材料与方法
1.1材料与试剂
1.1.1菌种
嗜热脱氮芽孢杆菌(Geobacillus thermodenitrificans)YWX5:广西科技大学发酵工程研究室分离并保藏。
1.1.2化学试剂
对硝基酚标准品:科密欧化学试剂有限公司;4-硝基苯基-β-D-吡喃葡萄糖苷(p-nitrophenyl-β-D-glucopyranoside,p-NPG):上海蓝季科技发展有限公司;蛋白胨(99.5%):北京奥博星生物技术有限责任公司;柠檬酸(99.5%):广东达濠精细化学品公司;磷酸氢二钠(99.0%):天津博迪化工股份有限公司。
柠檬酸-磷酸氢二钠缓冲液(pH 7.0):0.2 mol/L磷酸氢二钠溶液16.47 mL和0.1 mol/L柠檬酸溶液3.53 mL混合,稀释至80 mL。
1.1.3培养基
初始发酵培养基参考文献[8]略做修改:2%豆粕加水沸水煮1 h后冷却,4 000 r/min离心除去沉淀得上清,0.5% KNO3,0.1%K2HPO4;使用1mol/L的氢氧化钾溶液和1mol/L的硝酸溶液调pH值为7.0,于121℃灭菌20 min。
LB种子液培养基:1%NaCl,1%蛋白胨,0.5%酵母浸出液,于121℃灭菌20 min。
1.2仪器与设备
UV-1100紫外/可见分光光度计:上海美谱达仪器有限公司;ZFD-5250全自动新型鼓风干燥箱、HWY-2112全温度恒温调速摇床柜:上海智城分析仪器制造有限公司;Micro 220R台式冷冻离心机:德国HETTICH公司;LRH-250生化培养箱:广东省医疗器械厂。
1.3实验方法
1.3.1酶活的测定及标准曲线的绘制
α-半乳糖苷酶的测定采用紫外可见分光光度法。
(1)对硝基酚标准曲线的制作
精确配制一系列浓度梯度(0.05 μmol/L、0.10 μmol/L、0.15μmol/L、0.20μmol/L、0.25μmol/L)的对硝基酚标准品,取0.5 mL标准品加入1.6 mL柠檬酸-磷酸氢二钠缓冲液(pH 7.0),再加入2 mL 1 mol/L的Na2CO3,混合均匀后于波长405 nm处测OD405nm值[9]。
(2)α-半乳糖苷酶酶活的测定方法
将嗜热脱氮芽孢杆菌YWX5培养液于4℃、4 500 r/min离心20 min,上清液即为粗酶液。取粗酶液0.1 mL,加入0.2 mL 5 mmol/L的底物p-NPG,加入1.8 mL柠檬酸-磷酸氢二钠缓冲液(pH 7.0)使反应体系体积为2.1 mL,于65℃精确反应10 min,立即加入2 mL 1 mol/L的Na2CO3溶液中止反应。对照组先加入Na2CO3溶液中止反应再加入底物,其他同实验组。混合均匀冷却至室温于波长405 nm处测OD405nm值[10],再按照对硝基酚标准曲线回归方程计算对硝基酚的量,从而计算酶的活力,其计算公式如下:

式中:A为α-半乳糖苷酶酶活,U/mL;y是根据标准曲线回归方程所得的对硝基苯酚浓度,μmol/L;N为酶液稀释倍数;V为反应所用的酶量,mL;t为反应时间,min。
酶活力单位定义:在标准条件下(pH值为4.5、37℃),每分钟释放出1 μmol产物对硝基酚所需的酶量为一个酶活单位(U)。每个反应设置3个平行样。
1.3.2碳源对嗜热脱氮芽孢杆菌产酶能力的影响
(1)不同种类的碳源对产酶能力的影响
分别以含量为2%的蔗糖、棉子糖、葡萄糖、乳糖、麦芽糖、果糖、木糖、1%葡萄糖+1%的棉子糖为碳源代替初始发酵培养基中2%的豆粕,将菌株(20μL的种子接种于10mLLB培养基中培养18 h)按2%接种量接种于各培养基中于60℃培养2 d,以未接种的培养基为对照测定培养液OD600nm及上清液酶活,考察不同碳源对菌株产酶能力的影响。
(2)豆粕含量对菌株产酶能力影响
将初始发酵培养基中2%的豆粕含量设置为1%~5%,将菌株等量接种于各培养基中于60℃培养2 d,以未接种的培养基为对照测定培养液OD600nm及上清液酶活,考察豆粕质量浓度对菌株产酶能力的影响。
(3)附加碳源对菌株产酶能力影响
在最优豆粕含量培养基中加入0~4%的棉子糖作为附加碳源,其他操作同上,考察附加碳源对菌株产酶能力的影响。
1.3.3氮源对嗜热脱氮芽孢杆菌产酶能力的影响
(1)不同种类的氮源对菌株产酶能力的影响
分别以0.5%蛋白胨、酵母提取物、酪蛋白、大豆蛋白、(NH4)2SO4为氮源代替初始发酵培养基中的0.5%的KNO3,其他组分不变,考察不同氮源对菌株产酶能力的影响。
(2)硝酸钾含量对菌株产酶能力的影响
将初始培养基中的0.5%的KNO3设置为0.3%~1.5%含量范围,其他组分不变,考察不同硝酸钾含量对菌株产酶能力的影响。
(3)附加氮源对菌株产酶能力的影响
在初始发酵培养基中加入含量0~1%的酵母浸出物,其他组分不变,考察不同的酵母提取物对菌株产酶能力的影响。
1.3.4无机盐对嗜热脱氮芽孢杆菌产酶能力的影响
分别以0.5%NaCl、0.1%K2HPO4、0.01%CaCl2、0.01% MgSO4、0.001%MnSO4、0.001%FeSO4代替初始发酵培养基中的磷酸氢二钾(各无机盐含量参考文献[11]),以不加无机盐的初始培养基作为对照组,其他组分不变,考察不同含量无机盐对菌株产酶能力的影响。
1.3.5培养温度对嗜热脱氮芽孢杆菌产酶能力的影响
将菌株按2%的接种量接种于初始发酵培养基中,然后分别于40℃、50℃、55℃、60℃、65℃、70℃培养2 d,以未接种的培养基为对照测定培养液OD600nm及上清液酶活,考察不同培养温度对菌株产酶能力的影响。
1.3.6培养基初始pH值对嗜热脱氮芽孢杆菌产酶能力的影响
将菌株按2%的接种量接种于初始pH值为5、6、7、8、9的初始发酵培养基中于60℃培养2 d,以未接种的培养基为对照测定培养液OD600nm及上清液酶活,考察不同培养初始pH值对菌株产酶能力的影响。
1.3.7培养时间对菌株产酶能力的影响
将菌株按2%的接种量接种于初始发酵培养基中,然后分别在60℃培养5 h、8 h、16 h、22 h、25 h、30 h、32 h、41 h、45 h、50 h、55 h、65 h、70 h、75 h、80 h、90 h,以未接种的培养基为对照测定培养液OD600nm及上清液酶活,考察不同培养时间对菌株产酶的影响。
2 结果与分析
2.1对硝基酚标准曲线的绘制
以对硝基酚标准品浓度(y)为纵坐标,波长405 nm处的吸光度值(x)为横坐标,绘制对硝基酚标准曲线,结果见图1。

图1 对硝基酚标准曲线Fig.1 Standard curve of p-nitrophenol
由图1可知,对硝基酚标准曲线的回归方程为y= 0.227 7x+0.004 6,相关系数R2=0.998 9,表明二者线性关系良好。
2.2碳源对产酶能力的影响
2.2.1不同碳源对产酶能力的影响

图2 不同碳源对菌株产酶及生长的影响Fig.2 Effect of different carbon sources on α-galactosidase production and strain growth
菌株YWX5在相应培养基上培养2 d后测定OD600nm及酶活所得的结果见图2,由图2可知,不同种类的碳源对嗜热脱氮芽孢杆菌的产酶及生长能力的影响有很大差异。该菌在以棉子糖为碳源的培养基上产酶能力较强(0.018U/mL),以蔗糖及葡萄糖为碳源时也能产生一定的α-半乳糖苷酶,分别为0.002 U/mL和0.001 U/mL。其他糖类如乳糖、麦芽糖、果糖、木糖、葡萄糖+棉子糖作为碳源并不能诱导该菌产酶。使用糖类作为唯一碳源即使培养2 d后菌株的最高酶活也仅有0.019U/mL,最高生物量OD600nm值也只有0.112,这说明仅仅利用单一糖类作为碳源并不能满足嗜热脱氮芽孢杆菌生长及产酶的营养需求,故本实验以豆粕(酶活为0.161 U/mL,OD600nm值为0.483)作为碳源的基础成分。
2.2.2不同含量的豆粕对产酶的影响
不同含量的豆粕对产酶的影响见图3,由图3可知,当豆粕含量1%~3%,随着豆粕含量的增加酶活也相应的增加;当豆粕含量为3%时,酶活及生物量达到最高(平均酶活=0.215 U/mL,OD600nm=0.530);当豆粕含量>3%时,生物量随豆粕含量的增加呈现先增加后减少的趋势。故该菌在豆粕含量为3%的培养基上生长和产酶能力最佳。
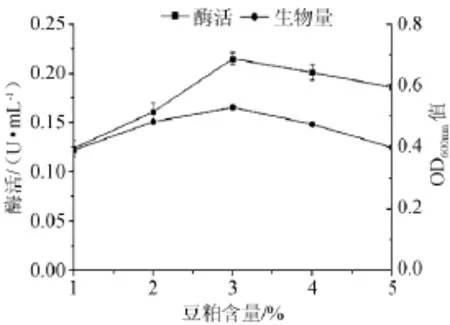
图3 不同豆粕添加量对菌株产酶及生长的影响Fig.3 Effect of different soybean meal addition on the α-galactosidase production and strain growth
2.2.3附加碳源对产酶的影响

图4 不同棉子糖添加量对菌株产酶及生长的影响Fig.4 Effect of different raffinose addition on the α-galactosidase production and strain growth
据报道,在培养基中加入一定质量浓度的棉子糖可以进一步提高α-半乳糖苷酶的产量[9]。许尧兴等[12]在研究中发现在麸皮和豆粕粉(质量比为7∶3)的培养基中加入2%的棉子糖可以进一步使黑曲霉变种α-半乳糖苷酶的的产量提高16%。但是在本实验中,3%豆粕的基础培养基上加入0~4%的棉子糖并不能促进该菌产α-半乳糖苷酶(见图4),反而呈现略微抑制的现象。这可能是因为豆粕中已经含有大量的棉子糖,该菌对棉子糖的需求已经达到饱和,所以再加入棉子糖已经不能再对该菌产酶产生促进作用。因此培养基中不再加入棉子糖。
2.3氮源对产酶能力的影响
2.3.1不同氮源对产酶能力的影响
不同氮源对菌株产酶能力的影响见图5。由图5可知,可以看出氮源对菌株YWX5产酶的促进能力由高到低依次为KNO3(0.161 U/mL)、酵母浸出物(0.099 U/mL)、蛋白胨(0.073 U/mL)、(NH4)2SO4(0.069 U/mL)、大豆蛋白(0.055 U/mL)、酪蛋白(0)。故以KNO3为氮源。从生物量明显可以看出也是KNO3(OD600nm=0.482)的效果最佳,其次是大豆蛋白(OD600nm=0.347)。另外,嗜热脱氮芽胞杆菌在酪蛋白培养基上可以生长(OD600nm=0.198)却不能产生α-半乳糖苷酶。由此可见,以KNO3为氮源最佳。

图5 不同氮源对菌株产酶及生长的影响Fig.5 Effect of different nitrogen sources on the α-galactosidase production and strain growth
2.3.2硝酸钾含量对产酶能力的影响

图6 不同硝酸钾含量对菌株产酶及生长的影响Fig.6 Effect of different KNO3addition on the α-galactosidase production and strain growth
硝酸钾含量对产酶能力的影响见图6。由图6可知,当硝酸钾含量为0.5%时产酶最佳,酶活达到0.153 U/mL,此时菌液OD600nm为0.436,继续增加硝酸钾的含量只有轻微的刺激菌体生长的作用,且产酶量会有所下降。因此0.5%的硝酸钾是最佳含量。
2.3.3附加氮源对产酶能力的影响
在以0.5%硝酸钾为氮源的培养基中加入0~1%的酵母浸出物,随着其添加量增高,菌株产酶能力也相应提高,直至酵母浸出物添加量为0.5%(0.263 U/mL)时,酶活不再升高(见图7)。但是生物量却是先升高后下降,这可能是因为营养增加后菌株的生长加快,以致检测时菌株的生长周期已进入衰亡期。因此培养基中添加0.5%的酵母浸出物有利于菌株产酶能力的提高。

图7 不同酵母浸出物添加量对菌株产酶及生长的影响Fig.7 Effect of different yeast extracts addition on the α-galactosidase production and strain growth
2.4无机盐对产酶能力的影响
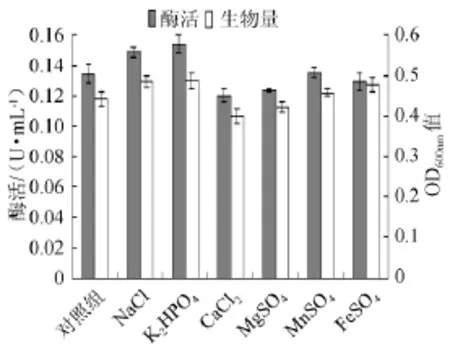
图8 不同无机盐对菌株产酶及生长的影响Fig.8 Effect of different inorganic salts on the α-galactosidase production and strain growth
无机盐对菌株产酶能力的影响见图8。由图8可知,当培养基中加入NaCl和K2HPO4时产酶有所提高,加入其他无机盐(如CaCl2、MgSO4、MnSO4、FeSO4)时对菌株产酶能力作用影响较小,LEE J等[11]在研究芽孢杆菌LX-1产α-半乳糖苷酶时发现培养基中加入一定浓度无机盐几乎都可以在一定程度上加强产酶,尤其加入硫酸锰可以大幅度提高酶产量,但是本实验并未得到类似的结果,这说明不同微生物产α-半乳糖苷酶所需要的无机盐的种类有所差别。因此培养基中加入NaCl和K2HPO4有利于YWX5产酶能力的增强。
2.5培养温度对产酶能力的影响
温度对嗜热脱氮芽孢杆菌YWX5产酶及生长的影响如图9所示。由图9可知,该菌在50~70℃内都能够生长及产酶,并且随着培养温度的改变,菌株产酶及生长的变化趋势几乎一致。40℃时几乎不生长不产酶,随着温度的升高该菌生物量及产酶均增长,当培养温度为60℃时达到最大产酶量0.156 U/mL,最大OD600nm为0.462。继续升高培养温度,产酶量及生物量均有所下降。因此,该菌产酶及生长的最佳温度条件为60℃。

图9 培养温度对菌株酶活及生长的影响Fig.9 Effect of culture temperature on α-galactosidase production and strain growth
2.6培养基初始pH值对嗜热脱氮芽孢杆菌产酶能力的影响
培养基初始pH值对菌株产酶能力的影响见图10。由图10可知,随着pH值的改变,该菌产酶及生物量的变化趋势几乎一致,呈现先增加后减小的趋势,在pH值为7.0~8.0时,该菌产α-半乳糖苷酶的酶活和生物量相差无几,达到最大(pH7.0(0.158 U/mL,OD600nm=0.45)~8.0(0.158 U/mL,OD600nm=0.48)),所以最适初始pH值应在7.0~8.0。

图10 初始pH值对菌株产酶及生长的影响Fig.10 Effect of initial pH on α-galactosidase production and strain growth
2.7培养时间对菌株产酶能力的影响
培养时间对菌株产酶能力的影响见图11,由图11可知,菌株在8~32h生物量迅速增长,之后变得缓慢,在45~55 h基本维持稳定,其中在50h时菌株生物量达到最大。而酶活在8~50 h增长迅速,之后增长变得缓慢,在55~70 h基本维持稳定,其中在65 h时酶活达到最大(0.215 U/mL)。因此,培养时间65 h为菌株产酶的最佳时间。
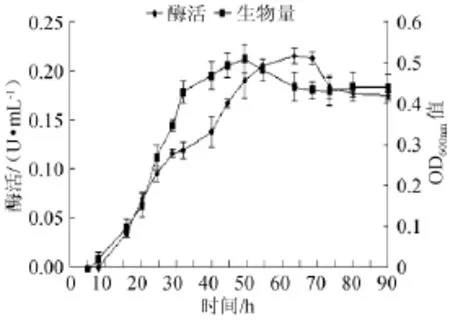
图11 培养时间对菌株产酶及生长的影响Fig.11 Effect of culture time on α-galactosidase production andstrain growth
2.8讨论
α-半乳糖苷酶是一种诱导酶,诱导物通常是底物或底物类似物。目前,国内外对于α-半乳糖苷酶的分子调控机制已有一定的研究[13-14],虽然不同来源的α-半乳糖苷酶的表达及调控模式是不同的,但都是通过一个或多个操纵子(分别)调节一个或多个结构基因来实现的,诱导物通过与阻遏蛋白作用而使阻遏蛋白不能发挥功能,进而使α-半乳糖苷酶结构基因可以正常转录表达。在已报道的研究中葡萄糖对α-半乳糖苷酶的产生有一定的抑制作用[15],研究者认为葡萄糖通过分解代谢物阻遏的方式来抑制α-半乳糖苷酶的产生。本实验利用葡萄糖与另一诱导物(棉子糖)一起作为碳源来培养该嗜热脱氮芽孢杆菌,得到的结果与已报道的研究结果类似,即葡萄糖对α-半乳糖苷酶的的产生有抑制作用,但是其对该酶的抑制程度要比已报道的酶强很多,产酶量甚至不如单一加入葡萄糖的情况。在黑曲霉等真菌中,蔗糖是很好的诱导因子[16],也有报道指出麦芽糖对部分菌种产α-半乳糖苷酶有较好的诱导作用[11],而在本实验中蔗糖和麦芽糖的诱导能力远远比不上棉子糖,这可能是因为微生物差异造成的。在生长方面,蔗糖促进该菌生长的情况相对较优,其次是棉子糖。除了碳源外,氮源对微生物的生长、生理等也是至关重要的。已有报道指出有机和无机混合氮源通常都能在一定程度上提高菌株的产α-半乳糖苷酶能力[11],本实验也得到类似的结果,当KNO3与酵母浸出物混合使用时,菌株YWX5的产酶能力进一步提高。此外,该菌的耐热性较好,在70℃条件下培养仍然能够生长及产酶,最适培养及产酶温度为60℃,这大大降低了细菌培养时杂菌污染的危险。但菌株YWX5在40℃时不生长,高温培养所需的能耗也阻碍了该菌的应用。
3 结论
本文通过对YWX5的产酶能力的研究,得出该菌产酶最有效的碳源为3%豆粕、氮源为0.5%硝酸钾、附加氮源为0.5%酵母浸出物,培养基中添加0.5%氯化钠和0.1%磷酸氢二钾有助于该菌产酶。另外,该菌最佳产酶培养温度为60℃,培养基最适初始pH在7.0~8.0,培养时间为65 h。虽然本研究对于提高该嗜热脱氮芽孢杆菌YWX5的α-半乳糖苷酶产量有一定成效,但是单位体积(1 mL)内的粗酶液活性与其他已报道菌株相比还是偏低[16]。微生物发酵的影响因素众多,要大幅度提高菌株YWX5α-半乳糖苷酶的产量,还需对其发酵条件及调控机制进行深入的研究。此外,考虑到该菌不能在低温条件下生长,不利于工业应用,采用基因工程手段获得α-半乳糖苷酶高效表达的工程菌株可能是该嗜热酶实现应用的有效手段。
[1]张继东,王志祥,丁景华,等.α-半乳糖苷的危害机理及其酶的应用研究[J].中国畜牧兽医,2006,33(12):27-30.
[2]LESKE K L,COON C N.Hydrogen gas production of broiler chicks in response to soybean meal and alpha-galactoside free,ethanol-extracted soybean meal[J].Poultry Sci,1999,78(9):1313-1316.
[3]SIDOEUN B,呙于明,张炳坤,等.豆粕和棉粕日粮总添加α-半乳糖苷酶对肉仔鸡生长性能的影响[J].中国畜牧杂志,2009,45(15):25-28.
[4]顾丰颖.α-半乳糖苷酶碳源诱导机制研究及复合酶制剂的开发[D].杭州:浙江大学博士论文,2013.
[5]钱和,葛向阳.酿酒酵母和米曲霉混合发酵生产α-半乳糖苷酶和转化酶[J].微生物学通报,2009,36(1):9-13.
[6]NAUMOFF D G.Phylogenetic analysis of α-galactosidases of the GH27 family[J].Mol Biol,2004,38(3):388-399.
[7]王佳,易弋,夏杰,等.嗜热微生物的分离及其产酶特性的初步研究[J].食品工业,2014(11):278-281.
[8]刘彩琴.α-半乳糖苷酶发酵工艺、分离纯化及其应用研究[D].杭州:浙江大学博士论文,2007.
[9]许尧兴,姚晓红,许少春,等.两种测定程序对饲用α-半乳糖苷酶活性检测结果的比较[J].浙江农业学报,2004,16(6):349-353.
[10]GOTE M,UMALKAR H,KHAN I,et al.Thermostable α-galactosidase fromBacillus stearothermophilus(NCIM 5146)and its application in the removal of flatulence causing factors from soymilk[J].Process Biochem,2004,39(11):1723-1729.
[11]LEE J,PARK L,CHO J.Production and partial characterization of α-galactosidase activity from an Antarctic bacterial isolate,Bacillussp. LX-1[J].Afr J Biotechnology,2012,11(60):12396-12405.
[12]许尧兴,李艳丽,许少春,等.培养基组成及发酵条件对黑曲霉变种产α-半乳糖苷酶的影响[J].浙江大学学报:农业与生命科学版,2009,35(4):401-408.
[13]BOUCHER I,VADEBONCOEUR C,MOINEAU S.Characterization of genes involved in the metabolism of α-galactosidase byLactococcus raffinolactis[J].Appl Environ Microbiol,2003,69(7):4049-4056.
[14]SILVESTRONI A,CONNES C,SESMA F,et al.Characterization of themelAlocus for α-galactosidase inLactobacillus plantarum[J].Appl Environ Microbiol,2002,68(11):5464-5471.
[15]PATIL A G,PRAVEEN-KUMAR S K,MULIMANI V H,et al. α-galactosidase fromBacillus megateriumVHM1 and its application in removal of flatulence causing factors from soymilk[J].J Microbiol Biotech,2010,20(11):1546-1554.
[16]蔡国林,杨旭,曹钰,等.黑曲霉产α-半乳糖苷酶发酵条件研究[J].中国酿造,2007,26(5):11-14.
Influencing factors ofGeobacillus thermodenitrificanson α-galactosidase-production
WEI Yangdao,YI Yi,SHI Zhengyu,DENG Chun,WU Shihua,LI Ya*
(College of Biological and Chemical Engineering,Guangxi University of Science and Technology,Liuzhou 545006,China)
The influencing factors of the preliminarily screenedGeobacillus thermodenitrificansYWX5 on α-galactosidase production were studied. By the α-galactosidase activity determination,the effect of medium composition(including carbon sources,nitrogen sources and initial pH),culture temperature and time on α-galactosidase production ofG.thermodenitrificansYWX5 was investigated.The results showed the most effective carbon source was soybean meal 3%,the most effective nitrogen source was KNO30.5%,and enzyme production was promoted by supplementation with yeast extracts 0.5%as extra nitrogen source;it was also enhanced by supplementation with NaCl 0.5%and K2HPO40.1%.In addition,the optimal culture temperature,time and initial pH of the medium for the α-galactosidase-producing strain were 60℃,65 h and 7.0-8.0,respectively.
Geobacillus thermodenitrificans;α-galactosidase;enzyme activity;influencing factors
TQ920.1
A
0254-5071(2015)11-0113-06
10.11882/j.issn.0254-5071.2015.11.026
2015-10-03
广西科学基金(2014GXNSFAA118086);广西科学基金(2015GXNSFBA139068)
韦阳道(1989-),男,硕士研究生,研究方向为微生物分子生物学。
黎娅(1980-),女,助理研究员,硕士,研究方向为微生物学。
