间期痫样发放对内侧颞叶癫痫脑网络的影响
2015-09-26吴寒张志强许强张其锐陈光辉杨昉孙康健卢光明
吴寒,张志强,许强,张其锐,陈光辉,杨昉,孙康健,卢光明*
间期痫样发放对内侧颞叶癫痫脑网络的影响
吴寒1,张志强1,许强1,张其锐1,陈光辉2,杨昉2,孙康健3,卢光明1*
投稿日期:2015-07-30
接受日期:2015-09-12
目的 探讨间期痫样发放对内侧颞叶癫痫患者脑静息态网络的影响,揭示间期癫痫活动发放对全脑功能的损害机制。材料与方法 从45例行同步脑电fMRI数据采集单侧颞叶癫痫患者中,挑选35例(左侧颞叶癫痫患者18例、右侧颞叶癫痫患者17例),以同步脑电图监测,每一患者均采集间期痫样发放及无痫样发放状态静息态fMRI数据。采用独立成分分析方法,分别提取患者两种状态的核心网络、背侧注意网络、执行控制网络、默认网络及感觉运动网络等7套内在连接网络。采用配对t检验比较痫样发放及无痫样发放状态mTLE患者脑内在连接网络的差异。结果 相比未发放状态,发放状态下颞叶癫痫患者核心网络的前扣带回功能连接增强,听觉网络的脑岛及颞上回功能连接减低。此外,背侧注意网络的顶上小叶在左侧颞叶癫痫患者表现为功能连接增强,而在右侧表现为连接减弱。前默认网络的额中回在右侧表现为功能连接减弱,而后默认网络颞中回及后扣带回在右侧表现为功能连接增强。执行控制网络的中扣带回和视觉网络枕叶皮层在左侧表现为功能连接增强。相关分析结果显示,左侧组视觉网络及右侧组听觉网络内连接强度的变化与发放状态下IEDs发放次数呈正相关。结论 内侧颞叶癫痫发作间期痫样发放对脑高级认知网络及感知觉网络均产生了广泛影响,尤其是对参与脑高级认知功能网络的损害,这有助于进一步了解海马硬化这一特异性内侧颞叶癫痫在发作间期脑功能受损机制。
癫痫,颞叶;脑电描记术相位同步;磁共振成像;癫痫发作
内侧颞叶癫痫(mesialTemporal lobe epilepsy,mTLE)是最常见的难治性癫痫类型。其主要的病理基础是以海马硬化为主的内侧颞叶病变,长期的癫痫活动传播会造成颞叶外广泛脑区的结构及功能损害[1]。静息态fMRI作为神经及精神疾病病理生理机制研究的强有力的工具[2],以其为主的功能神经影像学研究发现,mTLE存在特异的脑功能网络的改变:主要表现为注意、执行功能及默认模式等高级认知功能网络及听觉、运动感觉的损害[3]。并且近来有研究发现,间期痫样发放活动(Interictal epileptic discharges,IEDs)也会造成特定癫痫类型的脑默认网络功能的受抑制,提示亚临床发作的IEDs对大脑功能也具有明显的影响[4]。但是,IEDs对mTLE脑网络的影响目前尚缺乏研究,尤其是对于不同癫痫源侧的mTLE,其脑网络受IEDs影响的特异改变的研究更具有重要意义。本研究拟采用同步脑电图联合采集的功能MRI技术(simultaneous electroencephalography combined with functional magnetic resonance imaging,EEG-fMRI),结合独立成分分析的脑网络分析方法,观察IEDs对mTLE患者脑内在功能网络的特异影响情况,探讨IEDs对mTLE的脑功能损伤的机制。
1 材料与方法
1.1研究对象
参照2001年国际抗癫痫联盟(ILAE)分类标准,纳入2009年1月至2014年9月在南京军区南京总医院诊断明确的mTLE患者,共计45例,其中左侧颞叶癫痫患者22例,男16例,年龄(28.9±10.7)岁;右侧颞叶癫痫患者23例,男9例,年龄(28.4±9.3)岁。所有患者常规结构MRI显示单侧海马硬化,且无其他部位的结构异常。常规或长程脑电图显示单侧颞叶发作期或发作间期癫痫波。所有患者于检查前均获得知情同意,并签署知情同意书。
1.2研究方法
1.2.1数据采集与处理
所有患者均接受同步EEG-fMRI检查:脑电数据采集采用德国Brain Product公司32导MR兼容EEG设备,Ag/AgCl非磁材料电极,屏蔽的BrainAmp放大器置于MRI扫描孔径外,采集频率为5000 Hz,经放大的信号经光纤从MR扫描时传至控制室的电脑上。fMRI数据收集采用德国Siemens公司3.0T高场强超导 MRI扫描仪,头颅8通道相控阵线圈。采用基于梯度回波的平面回波(GRE-EPI)序列,TR 2000 ms,TE 40 ms,反转角90°,矩阵64×64,扫描视野24 cm×24 cm,层厚和层间距分别为4.0 mm和0.4 mm。每次采集500个时间点,每例患者均采集2次。
1.2.2数据统计分析
(1)数据预处理:①同步EEG数据预处理。将采集的EEG数据采用德国Brain Product公司提供的Brain Vision Analyzer 2.0软件进行MR梯度及心电搏动的滤除;滤过后的EEG结果由1名有经验的脑电图室医师独自读图分析。去除fMRI扫描过程间期IEDs全程发放或无发放6例、头动过大4例患者后,共计35例患者入选[左侧18例,男13例,年龄(28.6±11.3)岁;右侧17例,男7例,年龄(28.3±10.1)岁]。在截取的发放状态数据中,左侧组检测到IEDs数目1~16次,平均(3.1±3.6)次;右侧组IEDs数目1~10次,平均(2.6±2.7)次。②功能MRI数据预处理。利用DPARSF (http://rfmri. org/DPARSF)对入选患者MRI功能数据进行时间和头动校正,按3 mm×3 mm×3 mm体素再采样到标准MNI空间,然后采用8 mm全宽半宽高空间平滑,最后进行0.01~0.08 Hz的带通滤波去除高频噪声成分和低频漂移影响。根据同步EEG癫痫波探测结果,在2段500个时间点的BOLD序列中截取包含尽可能多IEDs发放的数据(发放状态)和无IEDs发放的数据(无发放状态)各一段,时间点长度均为500 s。截取数据时,需保证在无发放状态数据起始点前25 s及末端后9 s内无痫样发放。(2)数据分析:空间ICA分析采用GIFT (http://mialab.mrn. org/software/)软件,依据最小描述长度(minimum description length,MDL)标准选择31个独立成分进行组间独立成分分析,选择空间相关的方式,结合文献提供的模板[5],选取8个兴趣成分,分别为前默认(aDMN)、后默认网络(pDMN)、背侧注意网络(DAN)、核心网络(CN)、中央执行网络(CEN)、感觉运动网络(SMN)、视觉网络(VN)及听觉网络(AN)。提取上述感兴趣成分数据,将每种成分两种状态(含IEDs与不含IEDs状态)进行单样本t检验,然后将其结果的并集作为配对t检验的限制模板,进行配对t检验,比较含IEDs与不含IEDs状态各成分的变化。此外,根据配对t检验结果,选取两种状态下脑内连接改变的区域作为感兴趣区(region of interest,ROI),提取发放状态下ROI内经Fisher Z转换后的平均连接强度,与患者发放状态数据中IEDs次数进行相关分析(Spearman秩相关,P<0.05)。
2 结果
单样本t检验(P<0.01,FWE校正)结果显示:两种状态下,所选择的8个感兴趣成分分别对应前、后默认网络,背侧注意网络,核心网络,执行控制网络,感觉运动网络,视觉网络及听觉网络,每一个成分均可见典型的静息态脑网络空间形态(图1)。
自身配对t检验结果显示,相比未发放状态,发放状态下颞叶癫痫患者核心网络的前扣带皮层功能连接增强,听觉网络功能连接减低。此外,背侧注意网络的顶上回皮层在左侧颞叶癫痫患者表现为功能连接增强,而在右侧表现为连接减弱;执行控制网络和视觉网络在左侧表现为功能连接增强;前默认网络和后默认网络在右侧分别表现为功能连接的减弱和增强(均P<0.01,AlphaSim校正;表1,2;图2)。相关分析结果显示,左侧组视觉网络(Spearman秩相关,r=0.625, P=0.006)及右侧组听觉网络(Spearman秩相关,r=0.516,P=0.034)平均连接强度与IEDs发放次数呈正相关(图3)。
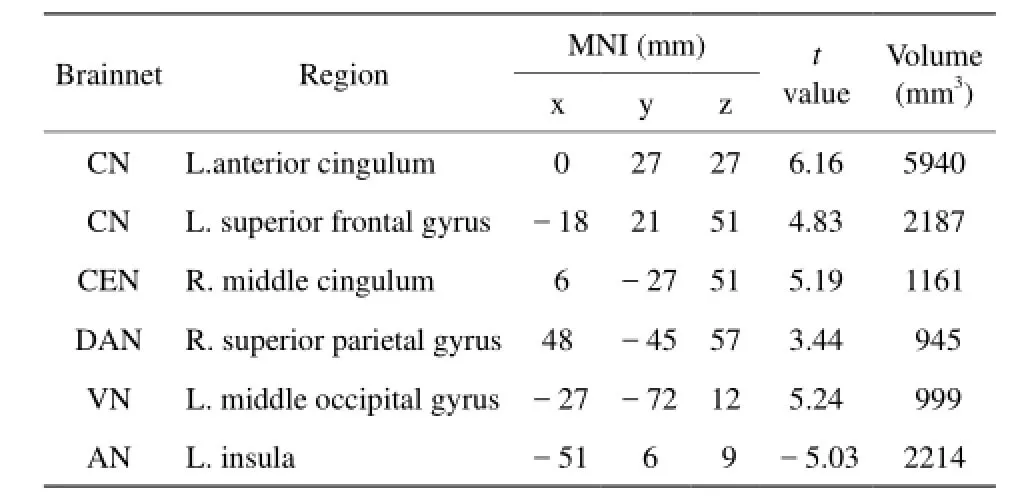
表1 左侧组痫样发放状态与无发放状态配对t检验结果Tab. 1 Regions showThe brain network changes between IEDs state and non-IEDs state using pairedTTest in left mTLE patients
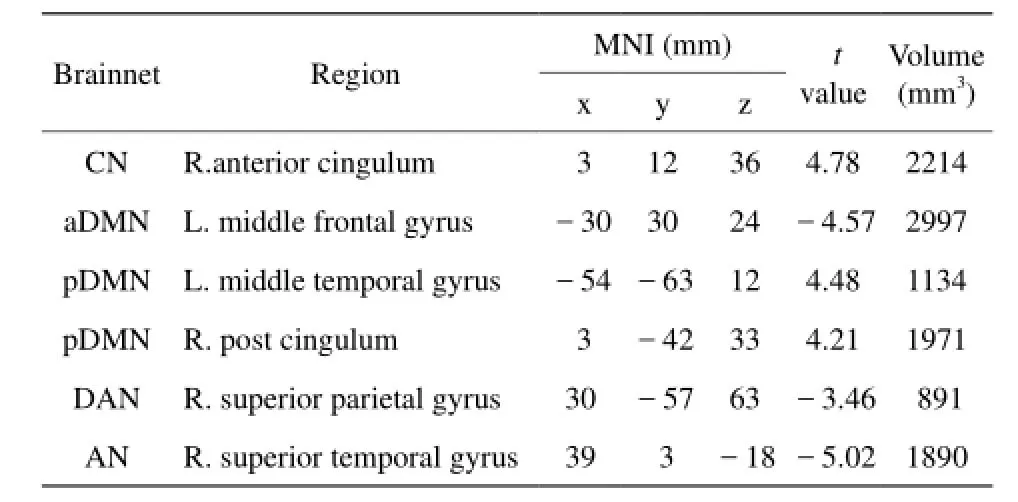
表2 右侧组痫样发放状态与无发放状态配对t检验结果Tab. 2 Regions showThe brain network changes between IEDs state and non-IEDs state using pairedTTest in right mTLE patients
3 讨论
本研究发现IEDs对mTLE众多静息态脑网络产生了广泛影响。在发作间期,脑内神经元可出现发作性去极化偏移电现象,其在脑电图上则表现为相应的位置电极上有IEDs (棘波、尖波或棘慢波)的出现,IEDs可以转化成发作期的高频癫痫放电,但更经常的是在发作间期以缓慢、长期的形式损害注意力及记忆力等。所以研究IEDs产生的影响对癫痫的治疗及改善预后有重要意义。
本研究特异发现相比于无发放状态,在发放状态下左、右侧组核心网络的同侧前扣带回皮层脑电活动同步性均增强。核心网络被认为在默认网络与众多任务网络的连接、转换中扮演重要的角色,其重要组成部分前扣带回皮层(anterior cingulum cortex,ACC)可以对大脑正在接受的刺激进行在线监控[6]。当在接受正确的信号时,ACC对大脑进行认知及情绪的全面性和整合性的调整;此外,fMRI研究表明当大脑接受到冲突或者错误信号时,它也会提供信号及时调整并分配资源[7]。所以本研究中当脑内出现IEDs这一异常自发放电时ACC活动增加,证实了ACC在IEDs的全脑传播过程中扮演着重要的节点作用,同时笔者认为该脑区活动的增加是其对全脑其他脑区进行调整,以此来抑制错误信号传播的结果。
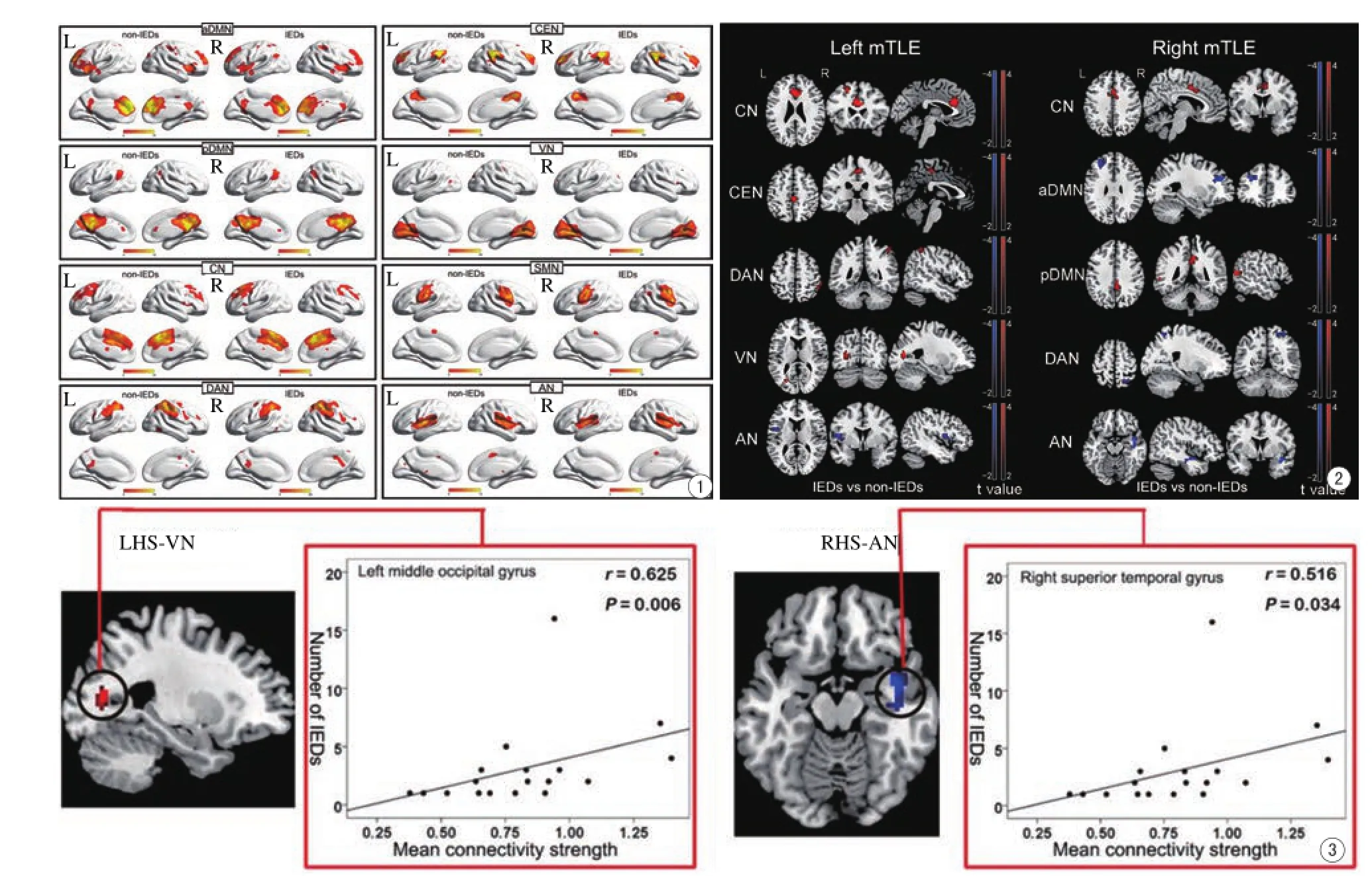
图1 单样本t检验结果显示,8个感兴趣成分均存在典型的空间分布模式(P<0.01,FWE校正)。其中色彩明亮的颜色代表脑电活动同步性增强。IEDs和non-IEDs分别代表发放状态与无发放状态。L和R分别表示左右半球 图2 左、右侧组痫样发放和无发放状态下静息态脑网络配对t检验结果显示左侧组核心网络、执行控制网络、背侧注意网络及视觉网络脑电活动同步性增强(左图红色区域所示),听觉网络脑电活动同步性降低(左图蓝色区域所示);右侧组核心网络和后默认网络脑电活动同步性增强(右图红色区域所示),前默认网络、背侧注意网络及听觉网络脑电活动同步性降低(右图蓝色区域所示) 图3 左、右侧组发放状态活动改变脑区内平均连接强度与发放状态IEDs发放次数的相关分析结果显示,左侧组视觉网络及右侧组听觉网络内连接改变的区域连接强度与IEDs数目均呈正相关(Spearman秩相关,P<0.05)Fig. 1 One-sampleTTest results showed all of eight interest components exist in aTypical spatial distribution pattern, in which bright colors represent increased coherence of brain activity(P<0.01,FWE corrected). IEDs and non-IEDs represent fMRI sessions with IEDs and sessions without IEDs respectively. L and R represent left and right hemisphere respectively. Fig. 2The upper fgure showedThe comparison of coherence of brain activity in networks between IEDs state and non-IEDs state using pairedTTest. In comparison withThe non-IEDs state, mTLE-LHS patients showed increased coherence of brain activity in CN, CEN, DAN and VN (red areas indicate), while coherence of brain activity decreased in AN(blue areas indicate). mTLERHS patients showed increased coherence of brain activity in CN and pDMN (red areas indicate), while coherence of brain activity decreased in aDMN, DAN and AN (blue areas indicate). Fig. 3The upper fgure showed relationship betweenThe mean connectivity strength in ROI andThe number of IEDs.The mean connectivity strength in visual network of mTLE-LHS and auditory network of mTLE-RHS were signifcant positively correlated withThe number of IEDs (Spearman rank correlation, P<0.05 ).
笔者还发现了mTLE存在特异的听觉脑功能网络改变,表现为听觉网络的脑岛及颞上回脑电活动同步性降低,且受IEDs影响的脑区位于病变颞叶同侧,提示了硬化的海马组织与负责听觉功能的脑区间可能存在某种传播IEDs的异常解剖或功能路径。另外笔者观察到右侧组听觉网络内的连接强度的变化与IEDs发放次数呈正向线性相关,这也进一步证实了上述观点,即IEDs的存在是导致内侧颞叶与听觉网络脑区间解剖和功能的受损的重要原因之一。神经生理学研究也证实mTLE患者间期的听觉能力显著低于正常人群,且深入研究表明这种感知觉功能的持续损害可能会导致更为高级的认知功能缺陷[8-9]。
注意能力下降是mTLE患者较为突出的认知功能障碍[10],与之前证实颞叶癫痫患者注意网络存在功能异常的静息态fMRI研究一致[11],笔者发现当发作间期出现IEDs时,不同侧癫痫灶组的背侧注意网络均出现了活动的异常。该结果提示IEDs 与mTLE患者长期疾病所伴随的注意力缺陷中可能具有密不可分的关系。然而在本研究中左、右侧组该网络表现为相反,虽然目前对此现象出现的原因尚不明确,临床研究显示左侧内侧颞叶癫痫人群的注意力损害往往较右侧更为显著,因此我们猜测这可能是因为左、右侧海马组织所负责功能的不同,导致脑网络改变模式存在差异[12],这也提示可能需要对单侧颞叶癫痫疾病进行更为细致的分类研究。
IEDs会造成特定癫痫类型的脑默认网络功能的受抑制。相比于无发放状态,发放状态下右侧组前默认网络呈负向激活,这与笔者前期研究结果一致,提示IEDs作为一种脑内自发的异常放电活动,可以抑制或中断大脑的基础活动状态[13]。此外与其他EEG-fMRI研究一致,笔者发现发放状态下后默认网络的部分脑区出现了正向激活[14]。Gotman等发现颞叶癫痫患者IEDs所致BOLD信号改变主要出现在病灶同侧颞叶,不仅可以表现为正激活,也可出现负激活;且这些改变还可以出现在对侧颞叶甚至颞叶外区域,表明IEDs会引起远距离神经元的异常活动[15]。他还指出BOLD信号可能因IEDs形态不同而出现完全不同的变化[16]。笔者推测正向激活出现的原因可能与IEDs自身特点所致神经元异常活动有关。默认网络的重要节点后扣带回皮层主要参与大脑记忆及空间定向功能[17],而颞中回皮层下存在着众多参与语言理解的纤维通路[18],两者在IEDs的影响下出现异常活动,提示亚临床发作的IEDs对大脑功能也会产生明显影响,而且IEDs的存在可能是导致mTLE患者癫痫疾病发生过程中高级认知功能异常的重要原因。
颞叶癫痫患者往往伴随抽象推理和工作记忆障碍等执行能力的下降,执行控制网络结构异常已被大量研究证实,如前额叶、纹状体及尾状核体积的萎缩[19-20]。尽管海马硬化也会导致类似症状,有学者发现常规头颅MRI阴性的内侧颞叶癫痫患者也会出现上述功能障碍,并发现前额叶体积与功能损害程度相关[21]。PET与SPECT研究发现伴海马硬化的颞叶癫痫间期低代谢与低灌注区主要位于该网络内[22]。静息态fMRI研究显示患者存在执行控制网络内功能连接减低的现象[23]。与上述研究结果不尽一致的是笔者发现左侧组执行控制网络活动在IEDs影响下出现了正向激活,这一结果丰富了对内侧颞叶癫痫执行控制网络及其变化模式的了解,笔者猜测这可能是内源性刺激所致脑内产生的异常激活作用,且这种紊乱的反应可能与相关脑区的解剖及功能异常互为因果、往复循环并最终导致执行功能障碍。本研究也证实mTLE的IEDs对感知觉网络可以产生远距离的影响。除了听觉网络,笔者还发现左侧组视觉网络脑电活动在IEDs影响下呈正激活,前期静息态fMRI研究发现mTLE初级视觉皮层功能连接存在增加的表现[24],所以这可能是大脑自身代偿机制所致功能异常活跃。相关分析结果显示发放状态下感知觉网络与发放次数具有正向相关关系,提示感知觉网络较高级认知网络更容易受到IEDs的瞬时影响。
本研究采用数据驱动的独立成分方法观察析了海马硬化性内侧颞叶癫痫间期痫样发放与无发放状态下脑静息网络的改变。笔者发现IEDs对全脑高级认知网络与感知觉网络存在广泛影响,这有助于进一步了解IEDs这一内源性刺激对脑认知功能受损过程。此外,还发现病灶位于不同侧时,脑网络产生不同的改变,笔者希望这有助于揭示不同侧mTLE的不同病理生理机制。总之,静息态脑网络研究为进一步了解mTLE认知损害以及临床治疗打开了全新的视野。
[
[1] Bonilha L, Edwards JC, Kinsman SL, et al. Extrahippocampal gray matter loss and hippocampal deafferentation in patients withTemporal lobe epilepsy. Epilepsia, 2010, 51(4): 519-528.
[2] Lu G, Zhang ZQ. Progression of multi-modality MRI in epilepsy. Chin J Magn Reson Imaging, 2014, 5(Suppl 1): 43-45.
卢光明, 张志强. 癫痫多模态磁共振成像研究进展. 磁共振成像,2014, 5(增刊1): 43-45.
[3] Cataldi M, Avoli M, Villers-Sidani E. Resting state networks inTemporal lobe epilepsy. Epilepsia, 2013, 54(12): 2048-2059.
[4] Ji GJ, Liao W, Zhang ZQ, et al. Resting-state functional connectivity in patients with generalizedTonic-clonic seizures. Chin J Magn Reson Imaging, 2013, 4(1): 8-12.季公俊, 廖伟, 张志强, 等. 全面强直阵挛癫痫静息态功能连接脑网络研究. 磁共振成像, 2013, 4(1): 8-12 .
[5] Mantini D, Corbetta M, Perrucci MG, et al. Large-scale brain networks account for sustained andTransient activity duringTarget detection. Neuroimage, 2009, 44(1): 265-274.
[6] George B, Phan L, Michael IP. Cognitive and emotional influences in anterior cingulate cortex.Trends Cogn Sci, 2000, 4(6): 215-222.
[7] Sanfey AG, Rilling JK, Aronson JA, et al.The neural basis of economic decision-making inThe ultimatum game. Sciences, 2003, 300(5626): 1755-1758
[8] Ehrle N, Samson S, Baulac M. Processing of rapid auditory information in epileptic patients with leftTemporal lobe damage. Neuropsychologia, 2001, 39(5): 525-531.
[9] Hamberger MJ, McClelland S, McKhann GM, et al. Distribution of auditory and visual naming sites in nonlesionalTemporal lobe epilepsy patients and patients with space-occupyingTemporal lobe lesions. Epilepsia, 2007, 48(3): 531-538.
[10] Corbetta M, Shulman GL. Control of goal-directed and stimulusdriven attention inThe brain. Nature Reviews Neuroscience, 2002, 3(3): 201-215.
[11] Yang ZG, Wang HN, Zhang ZQ, et al. Study based on ICA of "dorsal attention network" in patients withTemporal lobe epilepsy. J Biom Engin, 2010, 27(1): 10-15.
杨志根, 王惠南, 张志强, 等. 基于ICA的颞叶癫痫背侧注意网络的研究. 生物医学工程学杂志, 2010, 27(1): 10-15
[12] Burgess N, Maguire EA, O'Keefe J.The human hippocampus and spatial and episodic memory. Neuron, 2002, 35(4): 625-641.
[13] Zhang ZQ, Lu GM, Zhong Y, et al. Altered spontaneous neuronal activity ofThe default-mode network in mesialTemporal lobe epilepsy. Brain Res, 2010, (1323): 152-160.
[14] Nahla LF, Hana B, Marcus G, et al. Identification of pre-spike network in patients with mesialTemporal lobe epilepsy. Fron Neurol, 2014, (5): 1-8.
[15] Kobayashi E, Bagshaw AP, Benar CG, et al.Temporal and extratemporal BOLD responsesToTemporal lobe interictal spikes. Epilepsia, 2006, 47(2): 343-354.
[16] Pittau F, Fahoum F, Zelmann R, et al. Negative BOLD responseTo interictal epileptic discharges in focal epilepsy. BrainTopogr, 2013, 26(4): 627-640.
[17] Fransson P, Marrelec P.The precuneus/posterior cingulate cortex plays a pivotal role inThe default mode network: evidence from a partial correlation network analysis. Neuroimage, 2008, 42(3): 1178-1184.
[18]Turken AU, Dronkers NF.The neural architecture ofThe language comprehension network: converging evidence from lesion and connectivity analyses. Front Syst Neurosci, 2011, (5): 1.
[19] Bonilha L, Elm JJ, Edwards JC, et al. How common is brain atrophy in patients with medialTemporal lobe epilepsy? Epilepsia, 2010, 51(9): 1774-1779.
[20] Bouilleret V, Semah F, Chassoux F, et al. Basal ganglia involvement inTemporal lobe epilepsy: a functional and morphologic study. Neurology, 2008, 70(3): 177-184.
[21] Keller SS, Baker G, Downes JJ, et al. Quantitative MRI ofThe prefrontal cortex and executive function in patients withTemporal lobe epilepsy. Epilepsy Behav, 2009, 15(2): 186-195.
[22] Nelissen N, Paesschen WV, Baete K, et al. Correlations of interictal FDG-PET metabolism and ictal SPECT perfusion changes in humanTemporal lobe epilepsy with hippocampal sclerosis. Neuroimage, 2006, 32(2): 684-695.
[23] Vlooswijk MC, Jansen JF, Jeukens CR, et al. Memory processes and prefrontal network dysfunction in cryptogenic epilepsy. Epilepsia, 2011, 52(8): 1467-1475.
[24] Zhang Z, Lu G, Zhong Y, et al. Impaired perceptual networks inTemporal lobe epilepsy revealed by resting fMRI. J Neurol, 2009, 256(11): 1705-1713.
The effect caused by interictal epileptic discharges on mesialTemporal lobe epilepsy brain networks
WU Han1, ZHANG Zhi-qiang1, XU Qiang1, ZHANG Qi-rui1, CHEN Guang-hui2, YANG Fang2, SUN Kang-jian3, LU Guang-ming1*
1Department of Medical Imaging, Nanjing General Hospital of Nanjing Military Command, Nanjing University, Nanjing 210002, China
2Department of Neurology, Nanjing General Hospital of Nanjing Military Command, Nanjing University, Nanjing 210002, China
3Department of Neurosurgery, Nanjing General Hospital of Nanjing Military Command, Nanjing University, Nanjing 210002, China
*CorrespondenceTo: Lu GM, E-mail: cjr.luguangming@vip.163.com
30 July 2015, Accepted 12 Sep 2015
Objective:To comprehensively assessThe alterations of resting-state brain networks affected by interictal epileptic discharges (IEDs) in mesialTemporal lobe epilepsy (mTLE), andTo revealThe mechanism of brain function damages caused by IEDs in mTLE. Materials and Methods: Forty-five patients with bilateral mTLE underwent continuous EEG-fMRI during rest. Finally 35 fMRI sessions (left mTLE, n=18) with IEDs and individually paired non-IEDs sessions were acquired. Independent component analysis was usedTo investigateThe alterations in different states of seven resting-state networks includingThe core network, dorsal attention network, executive control network, anterior and posterior default mode network, auditory network, visual network and sensorimotor network. Results: PairedT-test results showed, compared with non-IEDs state,The anterior cingulum cortex in core network showed increased coherence of brain activity andThe auditory network showed decreased activity in both groups of mTLE. Apart fromThis, superior parietal gyrus in dorsal attention network showed reverse performance whenThe epileptic focus located in different sides ofThebrain. While it increased in left mTLE, but decreased in right mTLE.The middleTemporal gyrus and post cingulum in posterior default mode network showed increased activity, whileThe middle frontal gyrus in anterior default mode network showed decreased activity in IEDs state in right mTLE.The middle cingulum in executive control network and middle occipital gyrus in visual network showed increased coherence of brain activity in left mTLE. AndThe changed mean connectivity strength in visual network of left mTLE and auditory network of right mTLE were positively correlated withThe number of IEDs. Conclusions:This study revealed IEDs in mTLE have an extensive impact inThe resting-state brain networks, especially forThe networks damage involved in higher cognitive functions ofThe brain.This study was expectedTo contributeTo further understanding ofThe mechanism of brain functional injury in mTLE.
Epilepsy,Temporal lobe; Electroencephalography phase synchronization; Magnetic resonance imaging; Seizures
国家自然科学基金资助项目(编号:81271553)
作者单位:
1. 南京军区南京总医院 南京大学医学院临床学院医学影像科,南京 210002
2. 南京军区南京总医院 南京大学医学院临床学院神经内科,南京 210002
3. 南京军区南京总医院 南京大学医学院临床学院神经外科,南京 210002
卢光明,E-mail:cjr.luguangming@ vip.163.com
R445.2;R742.1
A
10.3969/j.issn.1674-8034.2015.11.001
吴寒, 张志强, 许强, 等. 间期痫样发放对内侧颞叶癫痫脑网络的影响. 磁共振成像, 2015, 6(11): 801-806.
ACKNOWLEDGMENTSThis article research work obtainedThe National Natural Sciences Foundation of China project subsidization (No. 81271553).
