几种先进的光学纳米探针在光学生物诊疗中的应用
2015-08-25詹求强何赛灵
詹求强,张 欣,李 心,何赛灵
(1.华南师范大学,光及电磁波研究中心,广东广州510006;2.浙江中控太阳能技术有限公司,浙江杭州310053)
·专题论述·
几种先进的光学纳米探针在光学生物诊疗中的应用
詹求强1,张欣1,李心2,何赛灵1
(1.华南师范大学,光及电磁波研究中心,广东广州510006;2.浙江中控太阳能技术有限公司,浙江杭州310053)
先进的光学纳米探针对于生物组织的光学成像、疾病的诊断和治疗具有巨大的促进作用,尤其是对于生物体分子水平活动的动态信息的深入了解。新型的光学探针如纳米金棒、上转换纳米颗粒和氧化石墨烯等,能克服传统探针的一些不足,具有较高的对比度、稳定性和生物兼容性,而且还拥有深层组织成像和实时动态成像的能力。本文对这些纳米光学探针的光学性质和优点进行了简要的介绍,并通过综述作者及其他研究者在过去几年的研究成果,总结这些先进的纳米探针在生物成像和医学诊断、治疗方面的应用,并展望其应用前景。
光学探针;纳米颗粒;生物光学成像
在过去的几十年里,生物医学成像技术经历了一轮快速的革新。X射线成像、计算机辅助层析、超声成像、核磁共振成像、正电子发射断层扫描已成功运用到临床医学中,成为了重要的诊断和治疗工具[1]。然而,这些生物医学成像技术尚存一些缺陷[2],在某些方面已经不能满足现代生物医学的发展。光学成像以光-物质相互作用(如吸收、反射、散射和荧光)为机理,通过获取空间、时间、光谱等信息实现成像,能克服传统成像技术所遇到的一些问题[2]。细胞活动过程和组织的化学信息可以通过光谱和动态成像得到,光学成像还能选择性的对一些分子活动进行探测。目前,光学成像技术经过发展和革新,已经形成了透射成像、荧光成像、暗场散射成像、激光共聚焦扫描成像[3]、多光子荧光成像[4]、光学相干层析[5]、漫射光层析[6]、全内反射荧光成像[7]、近场光学成像[8]、荧光寿命成像[9]和光声成像[10]等不同的方法。其中,光学相干层析、荧光成像等技术已成功运用到临床医学应用中。
随着生命科学研究的深入,研究者们迫切需要从单细胞和单分子尺度上活体、实时、动态地了解各生命物质之间的相互作用及生命活动的细微过程。现代光学生物成像与诊疗技术,很多需要依靠光学探针(Optical probe)标记以观察生物细胞的各种生物化学成分,光学探针在光学成像中扮演着重要的角色。作为一种光学成像的工具,光学探针能将所要成像的生物样本部分与背景区分开来,极大的提高了成像对比度,为科学研究提供许多有用信息。理想的光学探针应具有以下特征:信号较强,探测效率高;稳定性好,不易发生物理或化学变化;体积较小,细胞毒性小,生物兼容性好。目前,有机荧光染料是一种普遍使用的光学探针,但其光稳定性差,光致漂白和光致分解是限制它们在单分子检测中的应用的重要因素。近年来,合成简易且高度可控的纳米颗粒因具有优异的光学性能,在光学生物成像和临床诊断领域引起了人们的广泛关注,利用这些纳米粒子作为生物光学探针能够较好地解决有机荧光染料探针存在的一些问题。纳米颗粒,如量子点、纳米金颗粒和上转换纳米颗粒等,具有许多特殊的物理和化学性质,非常适合作为光学成像的探针[11]。这些纳米颗粒水溶性、稳定性和生物兼容性较好,同时具有一些特殊的性质,而且还可以进行表面修饰实现其功能化,以便在生物医学中的得到应用[12-15]。不仅如此,这些光学探针还可能在光的刺激下产生一些效应(如热效应),有望实现可视化的治疗。随着这些纳米尺度的光学探针的不断出现,非侵入式的实时观测细胞、组织或生物活体的光学成像与诊疗技术迅速发展。
本文将简要地介绍一些纳米颗粒的性质和构造,如纳米金棒(Gold nanorods,GNRs)、上转换纳米颗粒(Upconversion nanoparticles,UCNPs)和氧化石墨烯(Graphene oxide,GO),并展示这些纳米颗粒在光学生物成像、诊断和治疗方面的一些应用。
1 纳米金棒
在过去的一些年,许多关于GNRs的研究集中在其独特的光学和化学性质。由于GNRs表面存在大量自由电子,在激发光作用下能引起自由电子集体振荡而产生电磁表面波,GNRs具有显著的局域表面等离子共振(Localized surface p lasmon resonance,LSPR)特性,广泛应用于生物成像和治疗中[16-20]。GNRs有两种不同的LSPR模式,即长轴LSPR和短轴LSPR模式,分别对应于沿其长轴和短轴消光(光的吸收和散射)。短轴LSPR消光峰位于520 nm附近,相对较弱;长轴LSPR消光峰相对较强,其峰值位置和GNRs的大小、形状等因素密切相关,通过改变GNRs的长度和直径的比值,可以将峰值在可见光到近红外光范围(600-1 200 nm)内调节[21-23]。这对于GNRs的生物和光学应用是非常重要的,因为700-900 nm是人体组织的一个光学透明窗口,光吸收和散射相对较弱,这样就增加了光穿透组织的能力[24]。GNRs的长轴LSPR模式导致强烈地光吸收和散射,使它本身能够应用于单光子成像、双光子成像和暗场散射成像;GNRs的等离子共振性质使它具有强大地汇聚光的能力,因而在它的周围会形成一个极强的局域光场,能够对一些光学过程进行调制,如荧光信号增强[25,26]、拉曼散射增强[27]和光动力疗效增强[28];GNRs吸收截面大,具有很高的光热转换效率,使其成为一种很好的纳米光热剂用于光热治疗;GNRs本身在特定波长激发下能够产生活性氧,因此成为一种优良的光敏剂,有望取代常用的有机光敏剂用于光动力治疗;GNRs的长轴LSPR消光峰的一些特性(如强度、峰值位置等)对颗粒尺寸、形状、环境和颗粒间距非常敏感,有望成为优良的生物传感器。
1.1生物成像应用
暗场成像技术具有灵敏度高、成本低廉等优势,GNRs对光的散射作用使其能够应用于暗场散射成像,修饰了的生物分子的GNRs可以用来进行癌细胞的特异性标记暗场散射成像。Li等人将牛血清蛋白和生物素连接到经修饰的GNRs上并固定在玻璃载玻片上,清晰的观测到发出红色散射光的GNRs[29]。利用连接有anti-CEA 8(carcinoembryonic antibody)抗体的GNRs作为探针标记在HeLa细胞上进行暗场显微成像,发现只有anti-CEA 8抗体修饰的介孔二氧化硅包覆的GNRs,才能有效地连接在HeLa细胞表面,暗场成像图中才能显示红色散射光[30]。Zhan等人将HER2抗体连接的介孔二氧化硅包覆的GNRs用于MCF-7癌细胞的特异性暗场成像,发现只有含an- ti-HER 2抗体连接的介孔二氧化硅包覆的GNRs的癌细胞中有显著的红色散射光,这种散射光与纳米金棒本身的暗场散射图非常一致。
有报道表明,GNRs在紫外光激发下能够发出可见的荧光[31],而紫外光激发不利于生物应用。Huang等报道了GNRs能够在单光子激发下发出荧光用于标记细胞,并且其荧光光谱和激发光的波长息息相关[32]。激发光波长越长,荧光波长也越长。因此,改变激发光波长,我们能探测到不同波长的荧光,这使得利用GNRs实现多色多通道成像成为可能,如图1所示。GNRs具有非常大的双光子吸收截面,使它非常适合用于双光子荧光成像和治疗[33]。Xu等人将生物修饰后的GNRs导入进癌细胞中,在飞秒激光激发下得到清晰的细胞成像图[34,35]。

图1 (a)GNRs的吸收光谱(实线)和活性氧的激发光谱(虚线);(b)不同波长光激发下GNRs的发光光谱;(c)HeLa细胞内吞GNRs后分别在488、533和600 nm光激发下的共聚焦荧光成像图[32]Fig.1 (a)The absorption spectra(solid lines)of GNRsand the excitation spectra(dashed lines)of sin-glet oxygen phosphorescence;(b)Excitation wavelength dependent em ission spectra of GNRs;(c)Confo-cal fluorescence images for Au NRs in HeLa cells by 488,533 and 600 nm light[32]
1.2局域等离子共振增强光信号的应用
GNRs的LSPR效应可以对其表面附近的荧光剂进行荧光增强,荧光剂与纳米金棒间的距离则决定了其荧光被增强效果[36]。Li等人将GNRs和SiO2包覆的GNRs分别与量子点(Quantum dots,QDs)相连接,并修饰anti-CEA 8抗体,研究了这些复合纳米颗粒在双光子荧光寿命成像中的应用[30]。当QDs与GNRs距离大于10 nm时,GNRs的荧光增强效应占主导,并在距离15 nm左右达到最大值。与GNRs-QDs相比,通过包覆SiO2壳层控制GNRs与QDs间距在15 nm左右,SiO2-GNRs-QDs的荧光在单光子和双光子激发下都很强,QDs的荧光因GNRs的LSPR增强作用而产生了荧光增强;在双光子荧光成像中,GNRs自身可以发出强烈的双光子辐射光,用于细胞成像。虽然QDs和GNRs的双光子辐射光谱出现重合现象,难以通过荧光光谱区分,但由于GNRs的双光子荧光寿命极短,因此可以在荧光寿命成像中清晰地将其与QDs的双光子荧光及细胞自发荧光等荧光区分开来,具有很高的荧光寿命特异性和良好的信噪比。
金属的LSPR效应可以对其吸附表面或附近的分子的拉曼信号进行增强,进而催生了表面增强拉曼散射这一研究领域[37]。其中,GNRs由于具有极大地局域场增强效应,是一种优良的增强拉曼信号的金属纳米颗粒。Zhang等人合成了DTTC-SiO2@ GNRs,具有Fluorescence-SERS双模式成像功能,如图2所示[38]。首先,将染料分子DTTC(荧光峰在780 nm附近)掺杂在包覆介孔二氧化硅的GNRs中,然后利用带有1,2-二硬酯酰-SN-甘油-3-磷酰乙醇胺(1,2-distearoyl-sn-glycero-3-phosphoethanolamine,DSPE)的PEG进一步修饰它,这种复合材料在强酸、强碱、动物血清以及活体环境中,结构以及光学稳定性均非常好。染料1和染料2与GNRs的间距不同,染料1具有高效的SERS成像能力,染料2具有高效的荧光成像能力,可以通过控制SiO2的厚度来实现荧光成像和SERS成像通道的切换。实验发现,通过静脉注射进入患瘤小鼠体内的这种复合纳米颗粒可以靶向性地聚集在肿瘤内部,从而实现SERS-荧光相配合的肿瘤检测。这种多功能化的GNRs在多模式肿瘤探测方面有巨大的前景。

图2 (a)Fluorescence-SERS双模式成像的GNRs合成过程;(b)-(d):不同厚度二氧化硅包覆的纳米金棒的TEM图;(e):患肿瘤的老鼠照片(绿色圆圈)与3个不同部位荧光成像图(红色箭头);(g)三个不同部位荧光光谱图;(h)三个不同部位荧光光谱与SERS光谱中508 cm-1处光强[38]Fig.2 (a)The synthetic process of this functional GNRs(Fluorescence-SERS);(b)-(d)TEM images of this functional GNRs;(e)The photo of themouse bearing a tumor(green circle);(g)Fluorescence image with three locations(red arrows);(h)The fluorescence spectra and the SERS intensities(508 cm-1)from the three locations[38]
GNRs的LSPR效应导致的局域光场能极大地增强附近光敏剂的吸收截面,从而增强其释放活性氧的效率,达到增强光动力治疗的效果[39]。Xu等人将光敏剂(T-790)连接到SiO2包覆的GNRs(吸收峰为820 nm)上,研究这种复合纳米颗粒释放活性氧和杀死癌细胞的效率[40]。研究发现,通过调控SiO2的厚度,在双光子(800 nm)激发下,这种复合纳米颗粒的活性氧释放效率要远高于在单光子(420 nm)的效率。无论是单光子还是双光子激发下,复合纳米颗粒的活性氧释放效率均高于纯光敏剂的释放效率。细胞实验中,在上述三种条件下,HepG2细胞的存活率也有相同的规律,这表明GNRs能有效地增强光动力疗效,特别是在双光子激发下。Li等人设计了ICG掺到介孔硅包覆的GNRs里的纳米治疗平台,在单光子的近红外光激发下实现了对ICG光动力治疗效果的增强,如图3所示[28]。GNRs的LSPR峰(810 nm)与ICG的吸收峰(780 nm)良好的光谱重叠使激发光强度被极大地增强,这直接增强了活性氧的释放效率,使这种纳米平台在杀死乳腺癌细胞实验中比单纯的ICG具有更佳的表现。
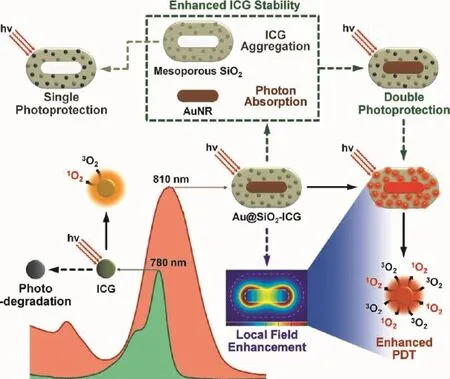
图3 GNRs近红外单光子增强ICG光动力疗效的纳米治疗平台的设计示意图[28]Fig.3 Design of enhanced photodynam ic therapy by utilizing the GNR to simultaneously increase the ab-sorption and reduce photo-induced degradation of the photosensitizers ICG[28]
1.3光动力治疗应用
GNRs在光动力治疗领域的应用不仅仅局限于增强光敏剂的活性氧释放效率,其本身在特定波长的光激发下也能产生活性氧,因而单独的GNRs也能用于光动力治疗[41]。GNRs极大地光吸收截面和可调的吸收峰使增加了激发光穿透深度,使其在活体光动力治疗上优于传统的有机光敏剂。Hwang等人研究表明,GNRs在长轴LSPR峰激发下能产生活性氧,而短轴LSPR峰激发下无活性氧产生。而且,不同共振峰的GNRs的活性氧激发光谱非常类似,且均与它们的吸收谱存在一定程度的不匹配[42]。Xu等人发现在近红外的双光子激发下,三种不同吸收峰的GNRs的活性氧释放效率远高于一些常用的有机光敏剂[34]。Huang等人报道了吸收峰为808 nm的GNRs在875-1 100 nm的光激发下能产生活性氧,并能够很好地应用于光动力治疗,如图4所示。离体的癌细胞实验表明,相较于GNRs的光热治疗,活性氧导致的光动力治疗能更高效地杀死癌细胞;活体的小鼠肿瘤实验表明,相比光热治疗和化疗,GNRs的导致的光动力治疗不仅效率高,而且肿瘤不会再复发[43]。
1.4生物传感应用
生物传感主要借助生物分子间的特异性识别过程,当待测的生物分子与识别分子探针特异性结合时,识别分子性质或周围环境的物理、化学等性质会发现相应的改变,通过对识别分子进行激励,将这些状态的改变转化为某种信号并检测此信号,从而定性或定量地判断生物分子识别过程的发生[44]。酶联免疫吸附测试(ELISA)是一种通过生物分子间的相互作用而改变颜色实现传感的应用,而这种方法要求被测分子的浓度较高。最近,Rica等人报道了一种等离子ELISA方法裸眼精确探测病毒,利用反应溶液中合成的金纳米颗粒的聚集或不聚集的颜色变化,探测浓度低至10-18g/mL[45]。GNRs比纳米金颗粒对环境变化更敏感,因而更适合用于生物传感。

图4 GNRs光热和光动力治疗的机制示意图(a)活体光治疗摧毁肿瘤;(b)离体杀死癌细胞[43]Fig.4 Schematic of photothermal and photodynamic therapy effects by GNRs(a)in vivo photo-destruc-tion ofmalignant tumors;(b)in vitro PDT and PTT-induced cellular deaths[43]
GNRs长轴消光峰对表面微环境折射率的改变非常敏感,其峰值强度或波长位置会随颗粒聚集或者折射率改变而发生变化,这种特性使得GNRs成为非常灵敏的生物传感器。Li等人利用包覆了聚(3,4-亚乙二氧基噻吩)-聚(苯乙烯磺酸)(poly(3,4-ethylenedioxythiophene)-poly(styrenesulfonate),PSS)和聚二烯丙基二甲基氯化铵(polydiallyldimethylam-monium chioride,PDADMAC)的GNRs来进行生物素(biotin)与链霉亲和素(streptavidin)分子之间的识别传感,生物素和链霉亲和素之间的选择性分子识别确保了对链霉亲和素传感探测的特异性[29]。在链霉亲和素的作用下,每四个纳米金棒会相互靠近。缩小纳米金棒的距离,由近场耦合效应而会在纳米金棒表面产生耦合的表面等离子体波,并使纳米金棒的LSPR消光峰产生红移、展宽等变化。通过高精度的光谱测量以及溶液颜色观察,发现其吸收光谱随加入的不同浓度的链霉亲和素而有不同的变化,纳米金棒峰漂移以及展宽的程度也很有规律,溶液的颜色及清澈度等状态也相应发生变化。这种直观的颜色变化使我们对链霉亲和素的定性传感探测更加快捷、方便。
GNRs不仅能增强其周围分子的荧光,在一定条件下也能使其焠灭,其荧光猝灭能力对荧光剂与颗粒间空间距离十分敏感。Li等人利用GNRs对QDs的荧光猝灭效应进行寡核苷酸序列传感,实现了对未经标记的单链DNA的传感检测[46]。未经标记的寡核苷酸ssDNA可以直接通过静电力吸附作用连接于表面强正电性的CTAB作为表面活性剂的纳米金棒表面,当GNRs上的寡核苷酸ssDNA序列中含有与QDs标记的ssDNA互补的碱基片段时,发生DNA分子杂交反应,连有ssDNA的QDs因DNA的杂交与GNRs相互靠近,QDs受激发出的荧光被GNRs猝灭;反之,DNA分子不会杂交反应,其荧光不会出现明显猝灭。这种传感探测的方法可以特异地探测未知单链DNA序列中是否含有某一特定的碱基片段,而不用事先将未知的单链DNA进行标记或修饰,这种传感方法具有非常高的特异性和光学灵敏度,高效快捷。
2 上转换纳米颗粒
2.1光学性质与优势
上转换纳米颗粒是一种在纳米晶体中掺杂不同稀土离子(如Er3+,Tm3+,Ho3+和Yb3+等)的复合型纳米材料。在一般情况下,Yb3+往往充当敏化离子(sensitizer)角色,而其他的稀土离子充当活化离子(activator)角色。整个上转换发光过程包含了敏化离子的光吸收过程、敏化离子与活化离子之间的能量传递和活化离子的发光过程,如图5所示[47]。这些能量转移过程中会有双光子和三光子过程,在近红外光激发下分别发出绿光、红光和蓝光,上转换的发光波长几乎涵盖了从紫外光到近红外光区域[48,49]。与传统的荧光标记物不同,UCNPs可以用近红外光激发,明显的减小了生物样品的光热损伤,同时极大增加了激发光的穿透深度。上转换激发所采用的反斯托克斯机制可以消除生物体的自发荧光干扰,从而使生物光学成像具有非常好的信噪比。同时,上转换过程存在真实的实能级,具有比普通的双光子过程更高效率,低功率密度照射下也能产生适用于生物研究的稳定适中的光强。UCNPs在连续照射下不会产生闪烁、光漂白和光化学降解[50-52],其发射峰(半高线宽,FWHM<12 nm)窄而清晰的,荧光寿命较长(μs~ms)[53,54],以上这些优势都使UC-NPs在生物光子学领域有巨大的应用可能。
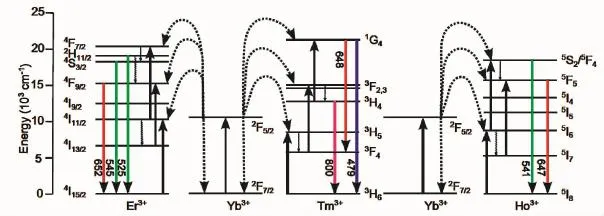
图5 敏化离子Yb3+与活化离子Er3+,Tm3+,Ho3+的能级结构以及他们之间通过能量转移实现上转换发光过程的能级跃迁机制[47]Fig.5 Energy level structure and proposed UC mechanisms of the Yb3+,Er3+/Tm3+/Ho3+co-doped UCNPs[47]
2.2上转换纳米颗粒的光学优化及生物成像应用
尽管它具有无自发荧光、无漂白、无闪烁及超高的时空分辨率等明显的优势,相对较低的量子产率、扫描时间长和组织对激发光强烈的吸收始终是限制UCNPs在生物医学及光学成像中更广泛应用的症结所在[55-60]。UCNPs发光效率优化主要可以从材料合成优化、表面等离子增强优化、激发光波长优化和成像技术的优化[60,61]。
UCNPs的发光效率与纳米颗粒晶体的大小成反比关系,还与纳米颗粒的晶型有关,六角相晶体UC-NPs比立方相的具有更高的发光效率。因此,效率较高的上转换纳米颗粒尺寸相对更大,而颗粒尺寸太大却不利于其生物应用[62]。通过掺杂Gd3+元素可以实现NaYF4纳米颗粒的大小、晶型以及发光特性的控制[63],该方法能够简单有效地制备六角相上转换发光纳米棒、小尺寸六角相UCNPs等。
UCNPs一般选择波长为980 nm的激光作为激发光,因为Yb3+在980 nm附近具有很大的吸收率。然而,水(在生物组织中含量很大)在930-1 030 nm波段具有很强的吸收,特别是在980 nm附近具有一个很大的吸收峰[59]。因此,使用980 nm的光激发UCNPs具有两个明显的弊端[64]:(1)明显的热效应可能会损伤生物细胞或组织,(2)强烈的光吸收会限制成像深度。UCNPs溶液的吸收光谱显示,在900-1 000 nm范围内虽然最大吸收峰出现在980 nm附近,但920 nm附近也有一个明显的吸收峰,且附近水的吸收系数很小。Zhan等人在国际上首次提出了利用915 nm光作为上转换材料的新激发光源波长,并证实这是一种更具有优势的激发方式[59]。分别用980 nm和915 nm的激光照射老鼠背部,约5 min后,前者最大温度达到49.2℃且明显出现疤痕,而后者只有31.5℃且无明显疤痕;对细胞显微成像中PBS溶液中的光场和温度模拟计算显示,980 nm的激光照射5分钟后,溶液温度达到44℃,而915 nm的激光照射相同时间,温度只有38.1℃,而且915 nm的光可以渗透到更大的深度(模式人工组织实验发现1.85 cm深度时依然可以激发上转换发光)。通过模拟计算和实验,比较980 nm和915 nm在细胞和组织中的热分布和成像深度,均表明915 nm的激发光在生物(细胞、组织和动物活体)成像中具有更深的成像深度和更低的热损伤,如图6所示。
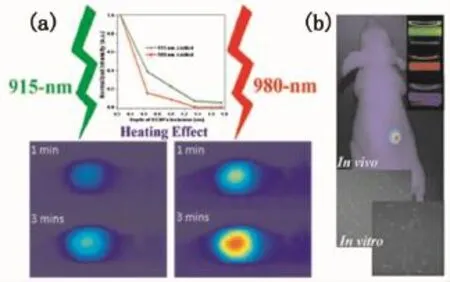
图6 (a)915 nm和980 nm的激光照射老鼠活体表皮在1分钟和3分钟时的温度空间分布情况,插图为上转换信号强度随深度衰减图;(b)915 nm激光激发下注射NaYbF4:Yb3+/Tm3+后老鼠活体成像图(上),分别用anti-CEA8-PAH-MSA-NaYbF4:Yb3+/Ho3+,anti-CEA8-PAH-MSA-NaYbF4:Yb3+/ Er3+处理的癌细胞的成像图(下)[59]Fig.6 (a)Temperature distributions after different ir-radiation times for 915 nm laser irradiated mouse skin and 980 nm laser irradiated mouse skin,the inset shows the intensity of the UC signal as a function of the depth of the UCNP inclusion;(b)in vivo whole body image of a NaYbF4:Yb3+/Tm3+injected nude mouse using 915 nm laserexcited(upper),in vitro cancer cell imaging of anti-CEA8-PAH-MSA-NaYbF4:Yb3+/ Ho3+,anti-CEA8-PAH-MSA-NaYbF4:Yb3+/Er3+u-sing 915 nm laser excited,respectively(bottom)[59]
大多数基于UCNPs的光学成像技术都采用激光共聚焦扫描模式,但扫描成像耗时长,时间分辨率很低[57,58]。上转换纳米颗粒发光寿命长(100μs~ms),单位时间内单个稀土离子发出的光子数较少,从而导致在激光扫描成像过程需要较长的扫描时间,难以做到快速成像和高效时间分辨跟踪[58]。普通宽场成像在借助高灵敏的CCD的情况下可以实现较快速的成像,但纵向上的杂散光很明显,严重影响成像的对比度和空间分辨率,明显没有扫描显微镜的成像效果好[56]。Zhan等人提出一种新颖的倏逝波(Evanescentwave,EW)激励的上转换发光纳米探针的模式,用于快速成像和UCNPs示踪[60]。全内反射荧光显微术(Total internal reflection microscopy,TIRM)是一种典型的基于倏逝波的荧光成像工具。基于倏逝场迅速衰减的特性,只有标记在系统表面的荧光材料才会被强电磁场激发,而远处的荧光剂由于处在一个较弱的电磁环境,其光学特性并不能有效地表现出来,这不仅提高了样品表面成像的纵向分辨率,还大大降低了空间杂散光。利用倏逝波激发,UCNPs的非线性发光特性与TIRM的结合可以得到非常好的纵向、横向分辨率,不会对样品造成损伤,非常适合应用于单分子或细胞膜成像。实验证明,这种成像方法可以在大范围内以350帧每秒的速度同时追踪数个粒子,实现超快速的成像、粒子追踪和细胞成像,如图7所示。

图7 水溶液中快速粒子示踪:(a)粒子的快速运动;(b)高成像速率记录下的纳米颗粒踪迹图[60]Fig.7 Rapid particle tracking inwater solution(a)the fastmovingof nanoparticles;(b)tracks of nano-particles in water solution with a very high imaging rate[60]
低的量子效率极大地阻碍的UCNPs的应用,特别是在低功率激发下[65]。提高激发光功率在一定程度上能提高其量子效率[66],但也带来了更高的热效应等副作用。Liu等人采用高峰值功率的毫秒脉冲激光,增加了UCNPs的量子效率,即达到了理想的成像深度,又将数据采集速度提高了一个数量级,且有效地避免了高的热效应[67]。这种激发技术拓展了UCNPs在光学成像和治疗领域的应用。
3 氧化石墨烯
3.1光学性质与优势
石墨烯自被发现以来,其独特的电子学、光学和力学等特性一直被广大研究者所关注[68,69]。然而,石墨烯不能很好地分散在水溶剂中,限制了其在生物光子学中的研究。GO,作为石墨烯的一种衍生物,逐渐受到研究者的关注。GO主要由碳元素组成,表面带有羧基、羟基等含氧基团,从而表现为亲水性,能够很好的分散在水溶液中,为生物应用提供了必不可少的条件。无细胞毒性,有较好的生物兼容性,此外由于羧基、羟基等基团的存在,使得GO易于表面修饰、功能化等,大的比表面积使其具有较高的药物和生物分子运载能力,在药物运输、生物治疗等方面的具有一定的应用潜力[70,71]。更值得一提的是,相比石墨烯本身,GO不同的是表面存在一些缺陷和含氧基团,在量子限域效应下使得GO产生了带隙,因此GO材料能够产生荧光现象用于生物成像研究,同时它还具有类似贵金属纳米颗粒的光热效应[70,72]。因此,GO作为一种光学探针被广泛应用于生物成像,作为一种运载工具应用于药物运输,作为一种光热转换器应用于光热治疗[73]。
3.2生物成像和光热治疗应用
Li等人研究了双光子激发下的转铁蛋白和PEG修饰的GO在细胞成像、人工组织成像和光热治疗中应用[74]。GO的双光子荧光激发带较宽,降低了对激光器的要求。研究发现,在双光子激发下,GO所需的功率仅仅是7 mW,低于细胞自发荧光和荧光素异硫氰酸所需功率(分别为35 mW和30 mW)。在此功率激发下,GO的成像深度达到0.1 mm,高于30 mW激发下的异硫氰酸成像深度(0.03 mm)。GO在双光子激发下能用于光热治疗,仅需4 mW的激发功率就足矣产生明显的疗效,而没有GO的细胞在35 mW激光激发下没有明显的细胞死亡。因此,GO有望成为一种适用于低功率的兼具深度成像和光热治疗的纳米颗粒。
Qian等人利用飞秒激光激励系统研究了GO的双光子、三光子等非线性光学特性,并利用它作为荧光探针进行了活体双光子深层成像[75]。多光子荧光成像技术能减小光致漂白、提高成像分辨率和提高成像深度。飞秒脉冲激光具有较低的平均功率、巨大的峰值功率和相对较短的重复周期,在产生非线性效应的同时最大限度地降低热效应,是一种理想的激发光源。实验结果表明,GO的双光子、三光子荧光光谱与单光子激发具有相似的荧光峰,但长波长多光子激发能有效减小组织的吸收和散射,能实现较深层的成像。利用PEG修饰GO,使其能够在生物环境中稳定存在,合成的PEG-GO分别被运用于细胞、老鼠血管和大脑的活体成像。离体细胞双光子成像观察到了其在细胞内的分布情况,实现了非特异性的癌细胞成像。活体老鼠双光子荧光成像可追踪到其在血管中的流动、分布和外排等动态信息(如图8所示),并观察到其在鼠脑中深达300微米的分布情况并3D重构其分布图。这些实验研究为于人们认识GO的光学特性及其进一步在生物光子学中应用提供了非常有意义的参考依据。

图8 静脉注射GO纳米颗粒后,老鼠耳血管区域双光子扫描和单光子共聚焦荧光成像图[75]Fig.8 In vivo two-photon scanning and one-photon confocal lum inescence imaging of intravenously injec-ted GO nanoparticles in a blood vessel of amice ear at various time points after samp le treatment[75]
4 总结与展望
纳米金棒的LSPR光学特性使其广泛应用于生物传感、暗场散射成像、荧光成像和表面增强拉曼散射、光动力治疗和生物传感等技术中;上转换纳米颗粒具有无自发荧光、无漂白、无闪烁及超高的时空分辨率等明显的优势,并且从材料合成、激发波长和激励方式选择等方面优化实现了深度更大、损伤更小、时空分辨率更高、量子效率更大的光学生物成像;氧化石墨烯具有无细胞毒性、大的比表面积、光致发光等特性,应用于生物双光子、三光子荧光成像和活体双光子深层成像。
尽管这些作为光学探针的纳米颗粒具有许多优势和应用领域,但要应用到实际的临床诊断和治疗上仍有许多困难需要一一克服:(1)纳米颗粒的毒性,(2)光稳定性和生物稳定性较低,(3)对健康组织的损伤,(4)靶向标记效率和探测能力不够,(5)深层成像和探测能力不够。制备不同结构的纳米颗粒可以改变其光学性质,表面修饰聚合物电解质可以缓解其毒性、增加稳定性和生物兼容性,表面修饰可以实现其靶向成像和治疗,采用不同的激发方式可以减小对样品的损伤和得到更好的成像效果。随着纳米科技、探测技术和生物技术的发展,越来越多的多功能化纳米颗粒将成为光学探针,应用到光学生物成像、临床疾病的诊断和治疗中。
[1] SHARMA P,BROWN S,WALTER G,et al.Nanoparticles for bioimaging[J].Advances in Colloid and Interface Science,2006,123-126:471-485.
[2]PRASAD PN.Introduction to biophotonics[M].John W iley& Sons,2004.
[3]BKAILY G,POTHIER P,D'ORL ANS-JUSTE P,et al.The use of confocal microscopy in the investigation of cell structure and function in the heart,vascular endothelium and smoothmus-cle cells[M].PIERCE G,CLAYCOMBW.Novel Methods in Molecular and Cellular Biochemistry of Muscle.Springer US. 1997:171-194.
[4]BHARALID J,LUCEY DW,JAYAKUMAR H,et al.Folate-receptor-mediated delivery of InP quantum dots for bioimaging u-sing confocal and two-photonmicroscopy[J].Journal of the A-merican Chemical Society,2005,127(32):11364-11371.
[5]SCHMITT JM.Optical coherence tomography(OCT):A review[J].IEEE Journal of Selected Topics in Quantum Electronics,1999,5(4):1205-1215.
[6]BOAS D A,BROOKSD H,MILLER E L,et al.Imaging the body with diffuse optical tomography[J].IEEE Signal Process-ing Magazine,2001,18(6):57-75.
[7]AXELROD D.Total internal reflection fluorescence microscopy in cell biology[J].Traffic,2001,2(11):764-774.
[8]HECHT B,SICK B,W ILD U P,et al.Scanning near-field opti-calmicroscopy with aperture probes:Fundamentals and applica-tions[J].The Journal of Chemical Physics,2000,112(18):7761-7774.
[9]TADROUSP J.Methods for imaging the structure and function of living tissues and cells:2.Fluorescence lifetime imaging[J].
The Journal of Pathology,2000,191(3):229-234.
[10] XU M,WANG L V.Photoacoustic imaging in biomedicine[J].Review of Scientific Instruments,2006,77(4):041101-041122.
[11]PRASAD P N.Nanophoton ics[M].John W iley& Sons,2004.
[12]MURPHY C J,SAU T K,GOLE A M,et al.Anisotropicmet-al nanoparticles:?synthesis,assembly,and optical app lica-tions[J].The Journal of Physical Chemistry B,2005,109(29):13857-13870.
[13]TANW,WANG K,HE X,etal.Bionanotechnology based on silica nanoparticles[J].Medicinal Research Reviews,2004,24(5):621-638.
[14]HAN M,GAO X,SU J Z,et al.Quantum-dot-tagged mi-crobeads formultiplexed optical coding of biomolecules[J]. Nat Biotech,2001,19(7):631-635.
[15]XING Y,CHAUDRY Q,SHEN C,et al.Bioconjugated quantum dots for multiplexed and quantitative immunohisto-chemistry[J].Nat Protocols,2007,2(5):1152-1165.
[16]YANG P H,SUN X,CHIU JF,et al.Transferrin-mediated gold nanoparticle cellular uptake[J].Bioconjugate Chemis-try,2005,16(3):494-496.
[17]EL-SAYED IH,HUANG X,EL-SAYED M A.Surface plas-mon resonance scattering and absorption of anti-EGFR antibody conjugated gold nanoparticles in cancer diagnostics:?App lica-tions in Oral Cancer[J].Nano Letters,2005,5(5):829-834.
[18]MIRKIN C A,LETSINGER R L,MUCICR C,et al.A DNA-based method for rationally assembling nanoparticles into mac-roscopic materials[J].Nature,1996,382(6592):607-609.
[19]DANIEL M C,ASTRUCD.Gold nanoparticles:assembly,su-pramolecular chemistry,quantum-size-related properties,and applications toward biology,catalysis,and nanotechnology[J].Chemical Reviews,2004,104(1):293-346.
[20]CHEN H,SHAO L,LIQ,et al.Gold nanorods and their p lasmonic properties[J].Chemical Society Reviews,2013,42(7):2679-2724.
[21]INK S,MOHAMED M B,EL-SAYED M A.Simulation of the optical absorption spectra of gold nanorods as a function of their aspect ratio and the effect of the medium dielectric constant[J].The Journal of Physical Chemistry B,1999,103(16):3073-3077.
[22]HUANG X,EL-SAYED IH,QIANW,etal.Cancer cell im-aging and photothermal therapy in the near-infrared region by using gold nanorods[J].Journal of the American Chemical Society,2006,128(6):2115-2120.
[23]YE X,ZHENG C,CHEN J,et al.Using binary surfactant mixtures to simultaneously improve the dimensional tunability and monodispersity in the seeded grow th ofgold nanorods[J]. Nano Letters,2013,13(2):765-771.
[24]YODH A,CHANCE B.Spectroscopy and imaging with diffu-sing light[J].Physics Today,1995,48(3):34-40.
[25]NEPAL D,DRUMMY L F,BISWASS,etal.Large scale so-lution assembly of quantum dot-gold nanorod architectureswith plasmon enhanced fluorescence[J].ACS Nano,2013,7(10):9064-9074.
[26]YUAN H,KHATUA S,ZIJLSTRA P,et al.Thousand-fold enhancement of single-molecule fluorescence near a single gold nanorod[J].Angewandte Chemie International Edition,2013,52(4):1217-1221.
[27]ZHANG C L,LV K P,CONG H P,et al.Controlled assem-blies ofgold nanorods in PVA nanofibermatrix as flexible free-standing sERS substrates by electrospinning[J].Small,2011,8(5):648-653.
[28]LI Y,WEN T,ZHAO R,et al.Localized electric field of plasmonic nanoplatform enhanced photodynamic tumor therapy[J].ACS Nano,2014,8(11):11529-11542.
[29]LIX,QIAN J,HE S.Impactof the self-assembly ofmultilayer polyelectrolyte functionalized gold nanorods and its application to biosensing[J].Nanotechnology,2008,19(35):355501.
[30]LIX,KAO F J,CHUANG C C,et al.Enhancing fluores-cence of quantum dots by silica-coated gold nanorods under one-and two-photon excitation[J].Opt Express,2010,18(11):11335-11346.
[31]DREADEN E C,EL-SAYED M A.Detecting and destroying cancer cells in more than oneway with noblemetals and differ-ent confinement properties on the nanoscale[J].Accounts of Chemical Research,2012,45(11):1854-1865.
[32]VANKAYALA R,HUANG Y K,KALLURU P,et al.First demonstration of gold nanorods-mediated photodynamic thera-peutic destruction of tumors via near infra-red light activation[J].Small,2014,10(8):1612-1622.
[33]HU K W,LIU T M,CHUNG K Y,et al.Efficient near-IR hyperthermia and intense nonlinear optical imaging contrast on the gold nanorod-in-shellnanostructures[J].Journalof the A-merican Chemical Society,2009,131(40):14186-14187.
[34]ZHAO T,SHEN X,LIL,etal.Gold nanorods as dual photo-sensitizing and imaging agents for two-photon photodynamic therapy[J].Nanoscale,2012,4(24):7712-7719.
[35]ZHAO T,YU K,LI L,et al.Gold nanorod enhanced two-photon excitation fluorescence of photosensitizers for two-photon imaging and photodynamic therapy[J].ACSApplied Materi-als&Interfaces,2014,6(4):2700-2708.
[36]ABADEER N S,BRENNAN M R,W ILSONW L,etal.Dis-tance and p lasmon wavelength dependent fluorescence ofmole-cules bound to silica-coated gold nanorods[J].ACS Nano,2014,8(8):8392-8406.
[37]FLEISCHMANN M,HENDRA P J,MCQUILLAN A J.Ra-man spectra of pyridine adsorbed at a silver electrode[J]. Chemical Physics Letters,1974,26(2):163-166.
[38]ZHANG Y,QIAN J,WANG D,et al.Multifunctional gold nanorods with ultrahigh stability and tunability for in vivo fluo-rescence imaging,SERS detection,and photodynamic therapy[J].Angewandte Chemie International Edition,2013,52(4):1148-1151.
[39]JANG B,PARK JY,TUNG CH,et al.Gold Nanorod?pho-tosensitizer complex for near-infrared fluorescence imaging and photodynamic/photothermal therapy in vivo[J].ACS Nano,2011,5(2):1086-1094.
[40]ZHAO T,YU K,LI L,et al.Gold nanorod enhanced two-photon excitation fluorescence of photosensitizers for two-photon imaging and photodynamic therapy[J].ACSApplied Materi-als&Interfaces,2014,6(4):2700-2708.
[41]VANKAYALA R,SAGADEVAN A,VIJAYARAGHAVAN P,et al.Metal nanoparticles sensitize the formation of singletoxy-gen[J].Angewandte Chemie International Edition,2011,50(45):10640-10644.
[42]VANKAYALA R,KUO C L,SAGADEVAN A,et al.Mor-phology dependent photosensitization and formation of singlet oxygen(1Δg)by gold and silver nanoparticles and its appli-cation in cancer treatment[J].Journal of Materials Chemistry B,2013,1(35):4379-4387.
[43]VANKAYALA R,HUANG Y K,KALLURU P,et al.First demonstration of gold nanorods-mediated photodynamic thera-peutic destruction of tumors via near infra-red light activation[J].Small,2014,10(8):1612-1622.
[44]李心.纳米金颗粒在生物光学传感及成像中的一些应用研究[D].杭州:浙江大学,2010. LIXin.Optical bio-sensing and imaging assisted with gold nanoparticles[D]:Hangzhou:Zhejiang University,2010.
[45]DE LA RICA R,STEVENSM M.Plasmonic ELISA for the ul-trasensitive detection of disease biomarkers with the naked eye[J].Nature nanotechnology,2012,7(12):821-824.
[46]LIX,QIAN J,JIANG L,et al.Fluorescence quenching of quantum dots by gold nanorods and its application to DNA de-tection[J].App lied Physics Letters,2009,94(6):063111-063113.
[47]XU C T,ZHAN Q,LIU H,et al.Upconverting nanoparticles for pre-clinical diffuse optical imaging,microscopy and sens-ing:Current trends and future challenges[J].Laser&Pho-tonics Reviews,2013,7(5):663-697.
[48]DIEKE G H.Spectra and energy levels of rare earth ions in crystals[M].1968.
[49]WANG F,LIU X.Recentadvances in the chemistry of lantha-nide-doped upconversion nanocrystals[J].Chemical Society Reviews,2009,38(4):976-989.
[50]WANG F,FAN X,WANGM,et al.Multicolour PEI/NaGdF 4:Ce3+,Ln3+nanocrystals by single-wavelength excitation[J].Nanotechnology,2007,18(2):025701.
[51]YU M,LI F,CHEN Z,et al.Laser scanning up-conversion luminescence microscopy for imaging cells labeled with rare-earth nanophosphors[J].Analytical Chemistry,2009,81(3):930-935.
[52]WU S,HAN G,MILLIRON D J,et al.Non-blinking and photostable upconverted luminescence from single lanthanide-doped nanocrystals[J].Proceedings of the National Academy of Sciences,2009,106(27):10917-10921.
[53]NIKOOBAKHT B,BURDA C,BRAUN M,et al.The quenching of CdSe quantum dots photoluminescence by gold nanoparticles in solution[J].Photochemistry and Photobiolo-gy,2002,75(6):591-597.
[54]CHEN C L,KUO L R,CHANG C L,et al.In situ real-time investigation of cancer cell photothermolysismediated by excit-ed gold nanorod surface plasmons[J].Biomaterials,2010,31(14):4104-4112.
[55]BOYER JC,VAN VEGGEL FC JM.Absolute quantum yield measurements of colloidal NaYF4:Er3+,Yb3+upconverting nanoparticles[J].Nanoscale,2010,2(8):1417-1419.
[56]XU C T,SVENMARKER P,LIU H,et al.High-resolution fluorescence diffuse optical tomography developed with nonlin-ear upconverting nanoparticles[J].ACS Nano,2012,6(6):4788-4795.
[57]PICHAANDI J,BOYER J C,DELANEY K R,et al.Two-photon upconversion laser(scanning and wide-Field)micros-copy using Ln3+-doped NaYF4 upconverting nanocrystals:a critical evaluation of their performance and potential in bioim-aging[J].The Journal of Physical Chemistry C,2011,115(39):19054-19064.
[58]GAINER C F,UTZINGER U,ROMANOWSKIM.Scanning two-photon microscopy with upconverting lanthanide nanoparti-cles via Richardson-Lucy deconvolution[J].Journal of Bio-medical Optics,2012,17(7):076003-076001.
[59]ZHAN Q,QIAN J,LIANG H,et al.Using 915 nm laser ex-cited Tm3+/Er3+/Ho3+-doped NaYbF4upconversion nanop-articles for in vitro and deeper in vivo bioimaging without over-heating irradiation[J].ACS Nano,2011,5(5):3744-3757.
[60]ZHAN Q,HE S,QIAN J,et al.Optimization of optical exci-tation of upconversion nanoparticles for rapid microscopy and deeper tissue imaging with higher quantum yield[J].Ther-anostics,2013,3(5):306-316.
[61]詹求强,刘静,赵宇翔,等.多光子发光的稀土上转换纳米颗粒在生物光子学中的研究进展[J].激光生物学报,
2013,22(1):13-25. ZHAN Qiuqiang,LIU Jing,ZHAO Yuxiang,et al.Research progress in nonlinear upconversion luminescence of rare-earth nanoparticles in biomedical optics[J].Acta Laser Biology Sinica,2013,22(1):13-25.
[62]ZHOU J,LIU Z,LIF.Upconversion nanophosphors for small-animal imaging[J].Chemical Society Reviews,2012,41(3):1323-1349.
[63]WANG F,HAN Y,LIM C S,et al.Simultaneous phase and size controlofupconversion nanocrystals through lanthanide do-ping[J].Nature,2010,463(7284):1061-1065.
[64]詹求强.几种基于高信噪比探测技术的光学生物成像方法的研究[D].杭州:浙江大学,2012. ZHAN Qiuqiang.The study of some high signal-noise-ratio de-tecting techniques based optical bioimaging methods[D]. Hangzhou:Zhejiang University,2012.
[65]SUN Q C,MUNDOOR H,RIBOT JC,et al.Plasmon-en-hanced energy transfer for improved upconversion of infrared radiation in doped-lanthanide nanocrystals[J].Nano Letters,2013,14(1):101-106.
[66]ZHAO J,JIN D,SCHARTNER E P,et al.Single-nanocrystal sensitivity achieved by enhanced upconversion luminescence[J].Nat Nano,2013,8(10):729-734.
[67]LIU H,XU C T,DUMLUPINAR G,et al.Deep tissue optical imaging of upconverting nanoparticles enabled by exploiting higher intrinsic quantum yield through use ofmillisecond single pulse excitation with high peak power[J].Nanoscale,2013,5(20):10034-10040.
[68]NOVOSELOV K S,GEIM A K,MOROZOV SV,et al.Elec-tric field effect in atomically thin carbon films[J].Science,2004,306(5696):666-669.
[69]LEEC,WEIX,KYSAR JW,et al.Measurement of the elas-tic properties and intrinsic strength of monolayer graphene[J].Science,2008,321(5887):385-388.
[70]LOH K P,BAO Q,EDA G,et al.Graphene oxide as a chem-ically tunable platform for optical applications[J].Nat Chem,2010,2(12):1015-1024.
[71]ZHANG X,YIN J,PENG C,et al.Distribution and biocom-patibility studies of graphene oxide in mice after intravenous administration[J].Carbon,2011,49(3):986-995.
[72]SHUKLA S,SAXENA S.Spectroscopic investigation of con-finement effects on optical properties of graphene oxide[J]. App lied Physics Letters,2011,98(7):073104-073102.
[73]YANG K,ZHANG S,ZHANG G,et al.Graphene in mice:ultrahigh in vivo tumor uptake and efficient photothermal thera-py[J].Nano Letters,2010,10(9):3318-3323.
[74]LIJL,BAO H C,HOU X L,et al.Graphene oxide nanopar-ticles as a nonbleaching optical probe for two-photon lumi-nescence imaging and cell therapy[J].Angewandte Chemie International Edition,2012,51(8):1830-1834.
[75]QIAN J,WANG D,CAIF H,et al.Observation ofmultipho-ton-induced fluorescence from graphene oxide nanoparticles and app lications in in vivo functional bioimaging[J].Ange-wandte Chemie International Edition,2012,51(42):10570-10575.
Using Som e Nanoparticles as Optical Probes for Optical Bioim aging
ZHAN Qiuqiang1,ZHANG Xin1,Li Xin2,HE Sailing1
(1.Centre for Optical and Electromagnetic Research,South China Normal University,Guangzhou 510006,Guangdong,China;2.Zhejiang Central Solar Technology Co.,Ltd.Hangzhou 310053,Zhejiang,China))
The employment of nanometric optical probes is powerful for bioimaging,disease diagnosis and therapy,es-pecially for the deep understanding of some dynamic biological processes at themolecular level.Optical probes such as gold nanorods(GNRs),upconversion nanoparticles(UCNPs)and graphene oxide(GO)can overcome many draw-backs of conventional optical agents.These nanoparticles possess high imaging contrast,stability and biocompatibility. Furthermor,they provide optical approaches for deep-tissue imaging and real-time dynam ic imaging.In this review pa-per,the optical properties and advantages of these nanoparticles are briefly introduced,and some of their applications in optical bioimaging,diagnosis and therapy are summarized based on some of the research progressmade by the authors and others.The prospects of their application are also discussed.
optical probes;nanoparticles;bioimaging
Q631
A
1007-7146(2015)03-0207-13
10.3969/j.issn.1007-7146.2015.03.001
2015-03-02;
2015-04-18
国家自然科学基金(61405062);广东省自然科学基金(S2013040014211,2014A030313445);中国博士后科学基金(2013M530368,2014T70818);广东高校学科建设专项基金科研项目(2013LYM_0017);华南师范大学青年教师培育基金(2012KJ017);共青团华南师范大学2013-2014年度学生课外科研重点课题科研项目(13GDKC02)
詹求强(1984-),男,博士,讲师,研究方向为生物光子学。(电子邮箱)qiuqiang.zhan@coer-scnu.org
