缩胆囊素分子印迹整体柱的制备及固相微萃取—高效液相色谱分析研究
2015-08-13李桦等
李桦等


摘 要 采用抗原决定簇法,开展了对缩胆囊素(CCK)神经肽具有特异性识别和富集作用的新的分子印迹聚合物(MIP)整体柱合成与制备的研究。对MIP整体柱合成条件进行了系统的选择和优化,以缩胆囊素五肽(CCK5)为模板分子,在小移液器吸头中原位聚合制备了可以特异性识别和富集CCK神经肽的MIP整体柱。用扫描电镜和红外光谱对该分子印迹聚合物进行了表征。将此MIP整体柱作为固相微萃取小柱,研究并优化了固相微萃取条件,结合高效液相色谱紫外检测法,建立了脑脊液中CCK5和CCK8的分析检测方法; 本方法成功应用于加标脑脊液中CCK 神经肽的分离富集,CCK5和CCK8的检测限分别为4.38和15.95 ng/mL,平均加标回收率分别为90.2%和87.6%,相对标准偏差分别为3.2%和3.9%。此CCKMIP整体柱具有特异性强、经久耐用的特点。
关键词 缩胆囊素; 分子印迹聚合物整体柱; 固相微萃取; 抗原决定簇
1 引 言
缩胆囊素 (Cholecystokinin, CCK) 是一种广泛分布于中枢神经系统的多型性神经肽,在中枢神经系统中CCK大部分以八肽CCK8 (AspTyrMetGlyTrpMetAspPheNH2)形式存在;也有部分以五肽CCK5 (GlyTrpMetAspPheNH2)形式存在,这两种CCK型体具有相同的C端结构[1]。CCK对摄食、体温调节、学习和记忆等生理功能有重要的调控作用[2,3],并且与多种神经和精神性疾病发病紧密相关[4]。研究建立生物体液中缩胆囊素特异性和高灵敏的分析检测方法具有重要的生物医学意义。由于CCK在脑脊液和脑组织中含量低,目前报道的CCK定量检测方法大多采用高灵敏度的放射免疫法 (RIA)[5,6]。但RIA方法需要昂贵的高特异性的抗体,且有交叉反应的缺点;而且RIA无法实现对中枢神经系统中多型性CCK的同时定量检测。
建立高效和特异性强的CCK神经肽样品富集方法是实现CCK液相色谱分析的重要前提。分子印迹聚合物 (Molecularly imprinted polymer, MIP) 是以目标分子为模板合成的具有分子识别能力的聚合物[7]。整体柱是由单体、交联剂、致孔剂等混合物通过原位聚合而成的棒状整体[8~10]。MIP整体柱不仅具有分子印迹聚合物优异的识别能力,而且具有整体柱的高效、通透性好、传质速度快等特点[11],可结合固相微萃取 (Solid phase microextraction, SPME),应用于复杂基质中痕量分析物的分离与富集[12,13]。抗原决定簇法分子印迹技术是以多肽或蛋白质中一个特异性的裸露短肽作为模板分子制备MIP来特异性识别整个多肽或蛋白质[14], 大大降低了印迹成本,已在蛋白质印迹材料的合成中得以应用,如合成能识别血管紧张素[15]、酪氨酸磷蛋白的分子印迹材料[16]。Papaioannou等[17]以CCK5为模板分子,以本体聚合法制备出了可以识别CCK8的MIP,但该报道仅研究了该MIP的选择性和吸附性能,未将其应用于固相微萃取或色谱分析。目前制备蛋白质或肽MIP的报道绝大部分使用本体聚合法,用该方法所制备的块状MIP需要经干燥、研磨和筛分等复杂过程,且在研磨时会破坏印迹位点。至今尚无原位聚合法制备CCK神经肽分子印迹整体柱的相关报道。本研究采用抗原决定簇法,以缩胆囊素五肽CCK5为模板,首次以原位聚合法在移液器吸头中合成了CCK神经肽MIP整体柱,以此整体柱作为固相微萃取小柱,纯化并富集脑脊液中的CCK神经肽,结合高效液相色谱紫外检测法(HPLCUV)检测,建立了MIPSPME对脑脊液中痕量CCK5及CCK8同时特异性富集和分析检测的方法,获得满意结果。
2 实验部分
2.1 仪器与试剂
1100型高效液相色谱仪(美国Aglient公司), 配G1315B光电二极管阵列检测器; Quant 200扫描电子显微镜 (荷兰FEI公司); Nicolet 5700 红外光谱仪 (美国Nicolet公司); LSP011A型注射泵 (保定兰格恒流泵有限公司)。
CCK5五肽和CCK8八肽、亮啡肽、甲啡肽以及四肽YPLG(纯度>98%)购于上海吉尔生化有限公司;甲基丙烯酸 (Methacrylic acid, MAA)、三氟乙酸 (Trifluoracetic acid, TFA, 化学纯, 上海国药集团有限公司);乙二醇二甲基丙烯酸酯 (Ethylene dimethacrylate, EDMA, 98%, 比利时Acros公司);偶氮二异丁腈 (AIBN, 化学纯, 上海试四赫维化工有限公司);异辛烷 (Isooctane, >99.0%, 东京化成工业株式会社TCI);人工脑脊液的配制: 145.0 mmol/L NaCl, 2.7 mmol/L KCl, 1.0 mmol/L MgCl2, 1.2 mmol/L CaCl2, 0.45 mmol/L NaH2PO4, 2.33 mmol/L Na2HPO4, pH 7.4,于4℃保存备用。其它试剂均为分析纯。以0.1% TFA 溶液配制10.0 μg/mL CCK5和CCK8标准储备液,4℃保存备用。
2.2 实验方法
2.2.1 分子印迹整体柱的制备 将一定量的模板CCK5,溶解于甲醇和异辛烷的混合溶液中,依次加入单体MAA、交联剂EDMA和引发剂AIBN。超声混合均匀后,通入氮气10 min,移取反应混合液于移液器吸头中,吸头的另一端用保鲜膜封口后于60℃反应16 h。制得的MIP整体柱依次用甲醇、水及乙腈水(4∶6, V/V)混合溶液清洗,收集洗脱液进行HPLC分析直至无模板。非印迹聚合物 (Nonimprinted polymers, NIP) 整体柱除不加模板分子外,其它步骤同上。
2.2.2 固相微萃取 (SPME) 过程 将MIP整体柱连接在注射器上,依次用1 mL乙腈水(1∶1, V/V)混合溶液和1 mL 0.1% TFA溶液平衡整体柱10 min,流速100 μL/min;将2 mL CCK5标准溶液以100 μL/min流速通过MIP整体柱; 用0.5 mL 含0.1% TFA的溶液清洗整体柱,流速100 μL/min;最后用100 μL乙腈水(1∶1, V/V))的混合溶液洗脱,流速为50 μL/min。收集洗脱液直接进行HPLC分析,以考察MIP整体柱的富集效果。CCK8的萃取富集同上述过程。按照上述相同的方法考察NIP整体柱对CCK的富集效果。每次萃取实验在相同的条件下重复3次,计算平均富集因子及回收率。
2.2.3 人脑脊液样品处理
取1.5 mL正常男性受试者的脑脊液 (武汉协和医院) 于离心管中,加入6 mL氯仿,振荡,以3000 r/min离心10 min,取0.8 mL上清液,分别加入10 μg/mL CCK5、CCK8标准溶液26 μL和100 μL,用0.1% TFA溶液稀释至2 mL,得到CCK5和CCK8加标浓度分别为0.13和0.50 μg/mL的脑脊液,置于4℃备用。
2.2.4 色谱条件 色谱柱为Hypersil BDS C18 (250 mm×4.6 mm i.d., 5 μm, 大连依利特分析仪器有限公司);流动相:乙腈水(3∶7, V/V),含0.1% TFA;流速:1 mL/min;柱温:28℃;检测波长:280 nm;进样量:20 μL。
3 结果与讨论
本研究采用富集因子(Enrichment factor, EF)衡量整体柱对CCK的富集效果,用印迹因子(Imprinted Factor,IF)考察整体柱对CCK的特异性识别能力。EF和IF的定义如下:
EF=C1C0(1)
IF=EFMIPEFNIP(2)
式中, C0 是指上样前溶液中CCK的浓度; C1是指过柱后洗脱液中CCK的浓度; EFMIP和EFNIP分别指MIP整体柱和NIP整体柱的富集因子。
3.1 分子印迹整体柱的制备及性能考察
3.1.1 MIP整体柱制备条件的选择及优化 为了得到对CCK具有特异性识别能力且通透性良好的MIP整体柱,分别对单体与交联剂的比例、单体与模板的比例、聚合反应溶剂的种类及比例进行了系统的选择及优化。实验结果见图1,如图1A和图1B所示:单体与交联剂和模板与单体的比例最佳比例分别为1∶4和1∶13。由于CCK5在甲醇中溶解性良好,但是仅用甲醇作为溶剂制备的MIP整体柱通透性差,因此本实验在甲醇为主的溶剂体系中分别加入乙腈、十二醇以及异辛烷作为发泡剂,通过考察混合溶液中甲醇与各种发泡剂之间不同比例对通透性及富集效果的影响,实验表明, 以含4.5%异辛烷甲醇混合溶液作为溶剂制备所得的MIP整体柱,不仅具有良好的通透性且有较高的富集因子(EF) (图1C),而选用其他溶剂制备所得的整体柱通透性较差。因此,制备MIP整体柱采用含4.5%异辛烷甲醇混合溶液为反应溶剂,模板CCK5、单体MAA及交联剂EDMA的比例为1∶13∶52。
3.1.2 分子印迹整体柱的表征 实验对所制备的MIP整体柱进行了表征,图2为MIP整体柱截面的扫描电镜图(SEM)。可以看出,此MIP整体柱为多孔的交联状聚合物,结构致密,孔径均匀,机械强度稳定,为传质提供了良好的场所和通道。图3为MIP整体柱(a), NIP(b)整体柱和单体甲基丙烯酸MAA(c)的红外光谱图。比较图3a和3b可见, MIP和NIP具有相似的特征吸收峰位置和强度。3445.1和3444.1 cm
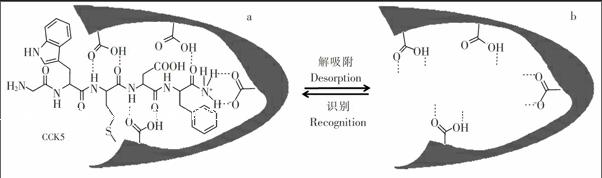
3.1.3 MIP整体柱特异性考察及识别机理 本研究用含有1 μmol/L CCK5 (GlyTrpMetAspPheNH2),1 μmol/L CCK8 (AspTyrMetGlyTrpMetAspPheNH2),2 μmol/L 四肽YPLG (TyrProLeuGlyNH2),2 μmol/L甲啡肽 (TyrGlyGlyPheMet)及2 μmol/L亮啡肽 (TyrGlyGlyPheLeu)的混合多肽溶液,按照2.2.2节进行固相微萃取实验,考察MIP整体柱对CCK的特异性识别效果。结果表明,MIP整体柱对CCK5和CCK8具有明显的富集效果,印迹因子分别为4.5和4.2,而对YPLG、甲啡肽及亮啡肽没有富集作用。此结果证明所制备的MIP整体柱对CCK神经肽的识别具有高度的特异性,这种特异性识别机制可从抗原决定簇法制备得到的分子印迹聚合物识别目标分子的原理得以解释,即如图4a所示,聚合过程中功能单体MAA与模板分子CCK5通过非共价作用(氢键,静电引力)自组装,加入交联剂与致孔剂后, 整个混合物固化形成一种在形状和官能团上与模板CCK5互补的多孔材料;模板通过溶剂冲洗后,合成得到的大孔MIP留下空的印迹位点(图4b),该MIP即可以特异性地识别CCK5。由于CCK8的C端含有与CCK5相同的5个氨基酸序列,因此,此MIP整体柱也可识别与富集CCK8。
3.2 MIP整体柱固相微萃取 (SPME) 条件优化
为了获得较高的富集效果,本研究分别对洗脱液的种类、上样溶液pH值、上样体积、洗脱液体积及流速进行了选择和优化。如图5所示,当上样溶液pH=1.8,上样体积为2 mL,用100 μL乙腈水(1∶1, V/V) 混合溶液以0.05 mL/min的流速洗脱,MIP整体柱对CCK5及CCK8的富集效果分别可以达到19和18倍。取CCK5和CCK8加标浓度均为1 μmol/L的人工脑脊液,在优化的条件下经过MIP整体柱萃取后,进行HPLC分析,图6b为其色谱图,与不经萃取直接分析的色谱图(图6a)相比,CCK5和CCK8信号强度得到大幅度提高。
3.3 分析方法评价
3.3.1 线性范围及检出限 取10.0 μg/mL 的CCK5和CCK8标准储备液,用人工脑脊液分别稀释成一系列标准溶液,在最佳萃取条件下,按照2.2.2节进行SPME实验,洗脱液直接进行HPLC分析。以色谱峰面积对上样前浓度进行线性回归,以3倍信噪比计算检出限(LOD),结果见表1。CCK在较宽的浓度范围内线性良好(R2>0.99)。经过MIP整体柱萃取富集之后,CCK5和CCK8检出限分别达到4.4和16 ng/mL。
3.3.2 脑脊液样品分析 脑脊液中含有大量的蛋白、糖类及无机盐等,基质干扰效应较大。以CCK5和CCK8加标浓度分别为0.13和0.50 μg/mL的脑脊液,未经萃取直接用HPLC 分析,未见CCK峰(图7b)。图7a为以上加标脑脊液经过MIP整体柱固相微萃取后的HPLC图谱,可以检测到CCK5和CCK8。
为了考察该萃取方法的重现性和准确性,对该加标浓度的脑脊液进行了重复分析检测(n=3),测得CCK5和CCK8的平均加标回收率分别为90.2%和87.6%,相对标准偏差分别为3.2%和3.9%,说明方法的重现性好。此整体柱经过上百次萃取实验后,富集因子无明显降低,证明此MIP整体柱具有优异的稳定性和耐用性。
4 结 论
本研究采用抗原决定簇法的基本原理,在移液器吸头中合成制备了缩胆囊素分子印迹聚合物整体柱,研究结果表明,此MIP整体柱对缩胆囊素类神经肽具有特异性识别和富集能力。将此MIP整体柱作为固相微萃取小柱,研究并优化了固相微萃取条件,结合高效液相色谱紫外检测法,建立了脑脊液中CCK5和CCK8同时分析检测的方法,本方法成功应用于对加标脑脊液中缩胆囊素的富集和检测。该CCKMIP整体柱具有特异性强、经久耐用的特点,具有良好的应用价值。
References
1 Rehfeld J F. Best Pract. Res. Clin. Endoc. Metab., 2004, 18(4): 569-586
2 Hebb A L O, Poulin J F, Roach S P, Drolet G. Prog. NeuroPsychopharmacol. Biol. Psychiatry, 2005, 29(8): 1225-1238
3 Szelényi Z. Clin. Chim. Acta., 2010, 411(56): 329-335
4 Sun C S, Sun J L, Erisir A, Kapur J. Neurobiol. Dis., 2014, 62: 44-55
5 RojasGarcía C R, Morais S, Rnnestad I. Comp. Biochem. Physiol. A Mol. Integr. Physiol., 2011, 158(4): 455-460
6 JIANG YuanXu, WANG Yun, LUO Fei,LIU HongXiang, HAN JiSheng. J. Peking Univ. Health Sci., 2001, 33(4): 351-353
蒋袁絮, 王 韵, 罗 非, 刘红香, 韩济生. 北京大学学报(医学版), 2001, 33(4): 351-353
7 Szatkowska P, Koba M, Kos'lin'ski P, Szablewski M. MiniRev. Org. Chem., 2013, 10(4): 400-408
8 LIU XiangJun, LIU JiZong, ZHAO Rui, LIU GuoQuan, Cheng Yi. Chem. J. Chinese Universities, 2007, 28(10): 1878-1880
刘祥军 刘吉众 赵 睿 刘国诠 陈 义. 高等学校化学学报, 2007, 28(10): 1878-1880
9 Nema T, Chan E C Y, Ho P C. J. Pharm. Biomed. Anal., 2014, 87(18): 130-141
10 JIANG LinBo, XIONG XiYue, CHEN YingZhuang, CHEN Bo. Chinese J. Anal. Chem., 2013, 41(10): 1526-1530
姜琳博,熊喜悦,陈应庄,陈 波. 分析化学, 2013, 41(10): 1526-1530
11 Tan J, Jiang Z T, Li R and Yan X P. TRACTrend Anal. Chem., 2012, 39: 207-217
12 Zhang W P, Chen Z L. Talanta, 2013, 103(15): 103-109.
13 ZHANG HongWu, GUO JianWen, LI Kang, WANG WeiSheng, WU YuPing, LU QiWen, QU HaiYun. Chinese J. Anal. Chem., 2012, 40(5): 699-704
张红武, 郭建文, 李 康, 王伟声, 吴玉萍, 卢琦雯, 翟海云. 分析化学, 2012, 40(5): 699-704
14 Rachkov A, Minoura N. J. Chromatogr. A, 2000, 889(12): 111-118
15 Rachkov A, Hu M J, Bulgarevich E, Matsumoto T and Minoura N. Anal. Chim. Acta, 2004, 504(1): 191197
16 Li Q S, Shen F, Zhang X, Hu Y F, Zhang Q X, Xu L, Ren X Q. Anal. Chim. Acta, 2013, 795(17): 82-87
17 Papaioannou E H, Kyriakides M L, Papi R M, Kyriakidis D A. Macromol. Chem. Phys., 2007, 208(24): 2621-2627
ract The synthesis and preparation of molecularly imprinted polymer (MIP) monolith for selective recognition of cholecystokinin were carried out by epitope imprinting technique. The MIP was synthesized by using CCK5 as template in a micropipette tip, and the polymerization conditions were investigated and optimized. The synthesized MIPs were characterized by scanning electron microscope (SEM) and infrared spectroscopy. By using this MIP monolith as solid phase microextraction (SPME) column and coupling to high performance liquid chromatographyultraviolet (HPLC/UV) detection, an analytical method was developed for the determination of CCK, and the parameters affecting SPME were optimized. The proposed method was successfully applied to determination of CCK5 and CCK8 in spiked cerebrospinal fluid (CSF) simultaneously. The detection limit of CCK5 and CCK8 were 4.38 ng/mL and 15.95 ng/mL, respectively; the mean recoveries were 90.2% and 87.6% with the relative standard deviations of 3.2% and 3.9%. This CCKMIP monolith showed high specificity, excellent reusability.
