阴道毛滴虫不同引物PCR检测结果比较
2015-07-19江海强魏帅帅吴腊梅陈盛霞
江海强,魏帅帅,吴腊梅,吴 亮,陈盛霞
(1.江阴市中医院检验科,江苏214400;2.江苏大学医学院,江苏镇江212013)
阴道毛滴虫不同引物PCR检测结果比较
江海强1,2,魏帅帅2,吴腊梅2,吴 亮2,陈盛霞2
(1.江阴市中医院检验科,江苏214400;2.江苏大学医学院,江苏镇江212013)
目的 比较使用不同引物进行阴道毛滴虫PCR的检出率。方法 分别应用3对引物(TVK3-TVK7、BTUB9-BTUB2、TV1-TV2)检测72例阴道毛滴虫阳性的阴道分泌物标本,比较其检出率的差异。结果 引物1检出率[68.1%(49/72)]与引物2[86.1%(62/72)]比较,差异有统计学意义(P<0.05);引物1、2与引物3检出率[76.4%(55/72)]比较,差异均无统计学意义(P>0.05)。结论 引物2具有较高的检出率,引物的选择是影响PCR检出率的重要因素之一。
毛滴虫,阴道; 聚合酶链反应; 阴道
阴道毛滴虫是临床较为常见的一种寄生虫,主要寄生于人体的阴道、尿道和前列腺,主要引起妇女的阴道毛滴虫病。有报道称,阴道毛滴虫感染可以使孕妇胎盘破裂、早产、新生儿体质量过轻的概率增加[1-3],阴道毛滴虫也可引起男性非淋菌性尿道炎、前列腺炎、不育等疾病,最近有研究结果显示,阴道毛滴虫感染增加人类免疫缺陷病毒感染的机会[4]。阴道毛滴虫病作为一种常见的性传播疾病,严重影响着人类的健康。目前,临床上常规使用的检测方法是生理盐水湿片镜检法,其敏感度较低,Pattullo等[5]对345名妇女的阴道标本用湿片法进行检测,其敏感度为58.5%。
PCR是一种广泛使用的检测技术,目前逐渐被应用于阴道毛滴虫的检测中。Wendel等[6]用PCR检测337例女性的阴道分泌物标本,其敏感度和特异度分别为84%和94%,明显高于湿片镜检法。本文旨在研究使用不同引物进行PCR时,其阴道毛滴虫检出率的差异。
1 材料与方法
1.1 材料
1.1.1 主要仪器与试剂 全自动凝胶图像分析系统(美国SynGene公司),SG-20干式恒温仪(金坛市虹盛仪器厂),超低温冰箱(Thermo公司),超净工作台(苏州尚田洁净技术有限公司),梯度PCR仪(德国Eppendorf公司),垂直电泳仪(美国Bio-Rad公司),低温高速离心机(德国Heraeus公司),电子天平(赛多利斯北京有限公司),PCR预混液(美国promega公司),琼脂糖(Speeifieations公司),酚氯仿(南京诺唯赞公司)。
1.1.2 实验标本来源 收集妇科门诊阴道毛滴虫湿片镜检法为阳性的阴道分泌物标本72例,3 000 r/min离心10min,弃去上清液,取其沉渣,保存于-70℃低温冰箱。
1.2 方法
1.2.1 PCR标本的前处理 将保存于-70℃的标本放于室温复融,加入300 μL的1×PBS(pH7.4),颠倒混匀,3 000 r/min,离心10 min,弃其上清液,得细胞沉淀。再次加入300 μL的1×PBS,颠倒混匀,3 000 r/min,离心10 min,弃其上清液,得细胞沉淀。
1.2.2 酚氯仿法提取阴道毛滴虫DNA 步骤如下:(1)在上述处理后的标本中分别加入三羟甲基氨基甲烷-乙二胺四乙酸(TE)500 μL、RNAse(10 mg/μL)1 μL、10%十二烷基硫酸钠(SDS)10 μL、蛋白酶 K(20 mg/μL)20 μL,55℃裂解10 min。(2)加入500 μL酚氯仿,颠倒混匀数次,12 000 r/min离心,吸取上层水相400 μL于另一EP管中。(3)向EP管中加入40 μL的3 mol/L醋酸钠和1 000 μL冰无水乙醇,置于-20℃冰箱中20 min,沉淀DNA。(4)用低温高速离心机以4℃最高速离心10min,弃上清液,加入1 000 μL 75%乙醇洗涤。(5)以4℃最高速离心10 min,吸弃可见的乙醇液滴,置于37℃中干燥。(6)待乙醇挥发充分后,将沉淀溶于50 μL的TE中。
1.2.3 PCR引物的设计与合成 根据美国国立生物技术信息中心(NCBI)数据库中阴道毛滴虫标准株基因组的基因序列,在保证开放阅读框正确的前提下,参照文献[7-9]合成3对引物(表1),所有引物与NCBI数据库比对确认正确后,送至上海生物工程有限公司进行合成。

表1 3对引物序列
1.2.4 PCR的反应扩增体系 总反应体系25 μL,包括PCR Green Mix 12.5 μL,上游引物1 μL,下游引物1μL,模板DNA 4 μL,灭菌蒸馏水6.5 μL。循环参数:95℃预变性10 min,94℃1 min,(55±5)℃20 s,72℃30 s。设置退火温度为55℃,上下5℃,摸索阴道毛滴虫PCR的最佳退火温度,总共反应35个循环后,72℃延伸10min使反应完全。扩增完成后,取5 μL的PCR产物用1.5%琼脂糖凝胶电泳。电泳结束后取出凝胶,将凝胶于凝胶图像分析仪下观察并拍照。同时,选取最佳退火温度对所有标本进行PCR。
1.3 统计学处理 应用SPSS13.0统计软件进行数据处理,计数资料以率表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 PCR条件的优化结果 梯度PCR扩增,1.5%琼脂糖凝胶电泳后检测10个温度下3对引物扩增效率,结果显示,10个退火温度下均能扩增出单一条带,大小分别为300、120、312 bp,与预期大小一致(图1、2、3)。本研究选取55℃作为最佳退火温度进行后续实验。

图1 引物1梯度PCR结果

图2 引物2梯度PCR结果

图3 引物3梯度PCR结果
2.2 PCR检测阴道毛滴虫结果 3对引物对所有用碱裂解法提取的DNA标本进行PCR,反应结束后用1.5%琼脂糖凝胶电泳,结果见图4、5、6。

图4 1~12号标本引物1 PCR结果
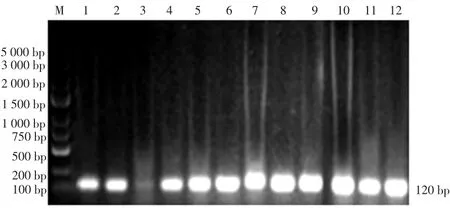
图5 1~12号标本引物1 PCR结果
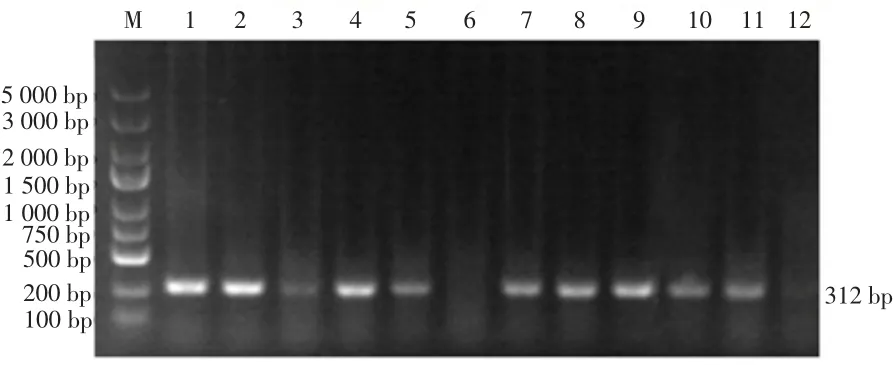
图6 1~12号标本引物3 PCR结果
2.3 PCR扩增结果 72例阳性标本中引物1阳性49例,检出率为68.1%;引物2阳性62例,检出率为86.1%;引物3阳性55例,检出率为76.4%。引物1与引物2检出率比较,差异有统计学意义(P<0.05);引物1、2与引物3比较,差异无统计学意义(P>0.05)。
3 讨 论
近年来,人们对泌尿生殖系统感染病原体的研究日益深入,阴道毛滴虫作为一种人体常见的寄生虫越来越受到人们的重视。阴道毛滴虫不仅能引起女性阴道炎,还能引起不育和许多围生期并发症。最近有研究显示,阴道毛滴虫感染与人类免疫缺陷病毒感染和宫颈癌的发生有关。
目前,我国临床所使用的阴道毛滴虫检测方法主要是湿片镜检法,该法与培养法相比,其敏感度和特异度都比较低,而且很容易受到标本保存和运输、实验前处理及检验者操作经验等诸多因素的影响,容易引起漏诊和误诊。因此,有学者认为,阴道毛滴虫检测不能以湿片镜检法作为确诊试验[10]。PCR作为一种常用的分子生物学检测方法,已逐渐被用于阴道毛滴虫检测中。
在PCR技术临床运用中,引物的选择是关键因素,其直接关系到检测的灵敏度和特异度。在此次研究中,以酚氯仿法提取的DNA为模板,分别用3对引物扩增,其阳性率分别是68.1%、86.1%和76.4%,引物2 PCR的检出率较高。本实验结果表明,PCR引物的设计直接关系到标本的阳性检出率,所以PCR实验引物的选择优化非常重要。
[1]宋印娥,林昭春.阴道毛滴虫病的流行现状及诊治研究进展[J].实用医院临床杂志,2010,7(6):139-141.
[2]van Der Schee C,van Belkum A,Zwijgers L,et al.Improved diagnosis of Trichomonas vaginalis infection by PCR using vaginal swabs and urinespecimenscompared to diagnosis by wet mount microscopy,culture,and fluorescent staining[J].J Clin Microbiol,1999,37(12):4127-4130.
[3]Cotch MF,Pastorek JG 2nd,Nugent RP,et al.Trichomonas vaginalis associated with low birth weight and preterm delivery.The Vaginal Infections andPrematurity Study Group[J].Sex Transm Dis,1997,24(6):353-360.
[4]Kissinger P,Adamski A.Trichomoniasis and HIV interactions:a review[J]. Sex Transm Infect,2013,89(6):426-433.
[5]Pattullo L,Griffeth S,Ding L,et al.Stepwise diagnosis of Trichomonas vaginalis infection in adolescent women[J].J Clin Microbiol,2009,47(1):59-63.
[6]Wendel KA,Erbelding EJ,Gaydos CA,et al.Trichomonas vaginalis polymerase chain reaction compared with standard diagnostic and therapeutic protocolsfor detection and treatment of vaginal trichomoniasis[J].Clin Infect Dis,2002,35(5):576-580.
[7]Kengne P,Veas F,Vidal N,et al.Trichomonas vaginalis:repeated DNA target for highly sensitive and specific polymerase chain reactiondiagnosis[J]. Cell Mol Biol:Noisy-le-grand,1994,40(6):819-831.
[8]Madico G,Quinn TC,Rompalo A,et al.Diagnosis of Trichomonas vaginalis infection by PCR using vaginal swab samples[J].J Clin Microbiol,1998,36(11):3205-3210.
[9]Mayta H,Gilman RH,Calderon MM,et al.18S ribosomal DNA-based PCR for diagnosis of Trichomonas vaginalis[J].J Clin Microbiol,2000,38(7):2683-2687.
[10]时祝帅,王德霞,朱进,等.泌尿生殖道中阴道毛滴虫的检测[J].临床皮肤科杂志,2004,33(9):538-539.
10.3969/j.issn.1009-5519.2015.22.033
B
1009-5519(2015)22-3448-03
2015-09-06)
江海强(1979-),男,江苏江阴人,硕士研究生,主管技师,主要从事临床检验工作;E-mail:573312027@qq.com。
