姜黄素对胰腺癌细胞PANC—1体外侵袭转移的影响
2015-07-15陈龙佩等
陈龙佩等

[摘 要] 目的:探讨姜黄素对胰腺癌PANC-1细胞侵袭转移的影响。方法:以10μmol/mL、 20μmol/mL、30μmol/mL和60 μmol/mL姜黄素处理胰腺癌PANC-1细胞,MTT 法检测其对PANC-1细胞的生长和抑制作用。应用Transwell小室进行人工重组基底膜(Matrigel)侵袭和运动实验,观察姜黄素对PANC-1细胞侵袭和转移的影响。结果:应用姜黄素处理后胰腺癌细胞生长受到抑制且作用呈时效、量效依赖关系;非致死浓度姜黄素处理后胰腺癌PANC-1细胞侵袭和转移明显降低。结论:姜黄素能够减弱胰腺癌细胞PANC-1的侵袭和转移。
[关键词] 胰腺癌;姜黄素;侵袭;转移
中图分类号:R 735.9 文献标识码: A 文章编号:2095-5200(2015)04-001-03
[Abstract] Objective: To explore the effects of curcumin on invasion and metastasis of the human pancreatic cancer cells PANC-1. Method: PANC-1 were treated with 10, 20,30 and 60μmol/ml curcumin,respectively. Proliferation of PANC-1 cells was measured with MTT assay. Invasion and metastasis of PANC-1 cells were evaluated with Transwell chamber. Result: After being treated with curcumin, the proliferation of Pancreatic cells was inhibited in a time and dose-depending manner. The invasion and metastasis of Pancreatic cells were also inhibited. Conclusion: Curcumin could restrain the invasion and metastasis of the human pancreatic cancer cells PANC-1.
[Key words] pancreatic cancer;curcumin;invasion;metastasis
胰腺癌是较常见的消化系恶性肿瘤,该疾病的早期诊断十分困难,多数新发病例已存在周围器官侵犯和/或远处转移 [1]。因此,探索有效的抗胰腺癌药物对降低胰腺癌死亡率极其重要。近年来,研究发现姜黄素(curcumin)具有较强的抗炎、抗氧化和抗肿瘤特性[2-6]。但姜黄素对胰腺癌细胞侵袭转移能力的影响尚未明确。本研究拟探讨姜黄素对胰腺癌PANC-1细胞体外侵袭和转移的影响,为姜黄素的进一步应用提供实验借鉴。
1 材料与方法
1.1 材料
细胞株及实验试剂人胰腺癌细胞系PANC-1购自上海细胞生物学研究所,细胞培养采用含10%胎牛血清(杭州四季青生物有限公司)的DMEM(赛默飞世尔生物化学制品有限公司)高糖培养基( 内含1%的青霉素和链霉素) 。姜黄素、四甲基偶氮唑蓝( MTT) 购于Sigma 公司。Transwell小室及聚碳酸酯购自Corning公司。
1.2 方法
1.2.1 细胞培养及处理 胰腺癌PANC-1细胞培养于含10%FBS的DMEM高糖培养基中,置于37℃,5% CO2潮湿空气的培养箱中培养, 每48 h换液传代1次,倍增时间约24 h。取2代生长良好,细胞活性大于98%的细胞进行实验。用不同浓度的姜黄素(10μmol/mL、 20μmol/mL、30μmol/mL和60 μmol/mL)作用后收集细胞进行相关检测。
1.2.2 MTT法(比色实验)测定细胞增殖 取对数生长期的PANC-1细胞,调整细胞浓度为2×104个/mL。取3块96孔培养板每孔接种细胞悬液200μL,设未加药细胞组、姜黄素组(设10 μmol/mL、20 μmol/mL、30 μmol/mL、60 μmol/mL 4个浓度于细胞80%处于融合状态后加药),每组设5个平行孔。置37 ℃、体积分数5%CO2饱和湿度孵箱内培养。分别培养24h、48h和72 h后弃上清,每孔加入MTT 20μL(5 mg/mL)及无血清DMEM 200 μL继续培养4 h, 取出后2 000 r/min(r =15 cm)离心10 min,弃上清,每孔加200 μL DMSO 震荡10 min,用酶标仪测定波长570 nm 的吸光值(A)。实验重复3次,取平均值。计算药物在不同浓度、不同作用时间对PANC-1细胞的抑制率。细胞生长抑制率=1-( A实验组-A空白) /( A对照组-A空白) ×100%。
1.2.3 Transwell小室检测细胞体外侵袭能力 在Transwell小室上下室之间置8μm聚碳酸醋滤膜,上室底部涂上Matrigel 50μg/孔(Matrigel:serum-free DMEM=1:3)后,置于37 ℃,5% CO2潮湿空气的培养箱中24h,取出制胶完成的Transwell侵袭小室。因20μmol/mL姜黄素处理后细胞活力与10μmol/mL没有显著的差别,为证明姜黄素对胰腺癌PANC-1具有剂量-效应关系,故选用10μmol/mL的姜黄素浓度与30μmol/mL的姜黄素浓度处理后进行比较;而60μmol/mL的姜黄素浓度处理后胰腺癌PANC-1本身的抑制率已经超过50%。Transwll实验结果是累计数目的结果,24h后一般细胞还有可以穿透胶的活力,而超过48h后PANC-1细胞活力大部分丧失。侵袭实验与细胞本身活力有关,故一般超过20%致死率浓度不采用,超过48h的时间点不采用。因此取对照组和实验组10μmol/mL、30μmol/mL浓度姜黄素处理48h细胞,消化离心后调整细胞密度为3× 105个/mL,分别取200 μL接种至上室,置于24孔板内,同时在下室中加入含10% FBS的DMEM高糖培养基600 μL,培养48 h后,取出小室,用棉签头擦掉 Matrigel胶,PBS液洗3次,800 μL的冰冻甲醇中固定。常规甲紫染色,完整取下小室膜反面贴在载玻片上。结果判定:200 倍光镜下,计数每膜5个随机不同视野的穿膜细胞数,取均值,每组平行设3个小室。实验重复3次。
1.2.4 统计处理 计量数据资料用x±s 表示,用t检验和方差分析。P<0.05为差异具有统计学意义。
2 结果
2.1 姜黄素对胰腺癌PANC-1细胞增殖能力的影响
分别采用10μmol/mL、 20μmol/mL、30μmol/mL和60 μmol/mL的姜黄素浓度处理胰腺癌PANC-1细胞。结果显示姜黄素对胰腺癌PANC-1细胞增殖有抑制作用,差异具有统计学意义(P<0.05),见表1。并随时间延长和药物浓度加大而增强,即呈时效、量效依赖关系(P<0.05),见图1。
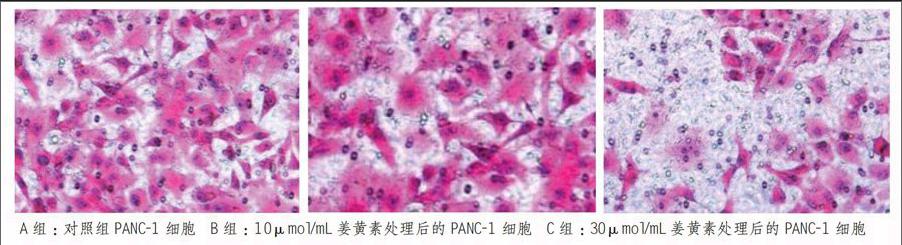
2.2 Transwell侵袭实验
如下图所示, 10μmol/mL姜黄素处理组(B组)、30μmol/mL姜黄素处理组(C组),PANC-1细胞穿过侵袭小室的侵袭细胞数与对照组(A组)侵袭细胞数相比较,较高浓度的姜黄素处理后的胰腺癌PANC-1细胞穿过的数目明显减少(A组穿透细胞数约:300;B组穿透细胞数约:237;C组穿透细胞数约:132),差异有统计学意义(P<0.05)。
3 讨论
胰腺癌具有恶性程度高、进展快、转移早、预后差等特点,号称“癌中之王”。虽然近年来胰腺癌的发病率和死亡率在缓慢下降,但胰腺癌仍是癌症相关死亡的第四大原因。目前胰腺癌的5年生存率仅为4%,而1年生存率也只有21%[7],主要原因为大多数患者就诊时已经发生了远处转移。因此,抑制胰腺癌侵袭转移的治疗策略一直是肿瘤研究的热点。近年来,癌症的多学科综合治疗得到了极大发展。我国传统医药在肿瘤治疗中地位愈发受到重视。姜黄素已被证实对包括乳腺癌、胃癌、结肠癌、肺癌、胰腺癌、前列腺癌等多种肿瘤细胞具有抑制作用 [8-10]。但姜黄素对PANC-1细胞侵袭的影响至今尚未有文献报道,本研究采用Transwell方法探讨姜黄素在体外对PANC-1细胞侵袭能力的影响。我们的实验结果表明,姜黄素可抑制胰腺癌细胞增殖、生存,并证实了姜黄素对抑制胰腺癌PANC-1细胞的增殖具有时效、量效的关系,这与既往研究结果相一致[11-12]。为排除药物对细胞活性的影响,本次实验采用了低于20%的非致死浓度姜黄素处理PANC-1细胞,观察药物处理前后细胞侵袭能力的变化。肿瘤细胞分泌蛋白降解酶等降解细胞外基质是肿瘤细胞侵袭转移的重要步骤,侵袭小室实验即模拟了细胞外基质的环境,降解基质的肿瘤细胞要得以从低营养培养基迁移至高营养培养基中,通过检测穿过膜的细胞数可间接反映肿瘤细胞侵袭能力。本实验结果表明,姜黄素可显著抑制PANC-1细胞侵袭能力,有望用于抗PANC-1治疗,但其具体作用机制尚需进一步实验证明。在本实验基础上,可考虑在后续研究中探讨姜黄素在胰腺癌的动物模型中作用,观测其对转移、侵袭相关基因或信号通路影响,进一步揭示姜黄素抑制PANC-1细胞的机制,为胰腺癌综合治疗提供新思路。
参 考 文 献
[1] Jemal A, Siegel R, Ward E el at. Cancer statistics, 2009[J]CA Cancer J Clin, 2008, 58(2):71-96
[2] Balasubramanian S, Eckert RL. Keratinocyte proliferation, differentiation,and apoptosis-differential mechanisms of regulation by curcumin, EGCG and apigenin[J].Toxicol Appl Pharmacol, 2007,224(3):214-219.
[3] Goel A, Aggarwal BB. Curcumin, the golden spice from Indian saffron, is a chemosensitizer and radiosensitizer for tumors and chemoprotector and radioprotector for normal organs[J] .Nutr Cancer, 2010,62 (1): 919-930.
[4] Reuter S, Eifes S, Dicato M el at. Modulation of anti-apoptotic and survival pathways by curcumin as a strategy to induce apoptosis in cancer cells[J] .Biochem Pharmacol, 2008,76 (1): 1340- 1351.
[5] Tharakan ST, Inamoto T, Sung B el at. Curcumin potentiates the antitumor effects of gemcitabine in an orthotopic model of human bladder cancer through suppression of proliferative and angiogenic biomarkers[J].Biochem Pharmacol, 2010,79 (2): 218-228.
[6] Cheng CY, Lin YH, Su CC. Curcumin inhibits the proliferation of human hepatocellular carcinoma J5 cells by inducing endoplasmic reticulum stress and mitochondrial dysfunction[J]. Int J Mol Med 2010, 26 (1):673-678.
[7] Siegel R, Naishadham D, Jemal A. Cancer statistics[J], CA Cancer J Clin. 2013,63 (2):11-30.
[8] Mimeault M,Batra SK. Potential application of curcumin and its novel synthetic analogs and nanotechnology-based formulations in cancer prevention and therapy[J]. Chin Med, 2011,23 (1):31-37.
[9] Nautiyal J, Banerjee S, Kanwar SS et al. Curcumin enhances dasatinib-induced inhibition of growth and transformation of colon cancer cells[J]. Int J Cancer, 2011,128(2):951–961.
[10] Teiten MH, Gaascht F, Cronauer M et al.Anti-proliferative potential of curcumin in androgen-dependent prostate cancer cells occurs through modulation of the Wingless signaling pathway[J]. Int J Oncol, 2011,38(1):603-611.
[11] Sabrina Bimonte,Antonio Barbieri, Giuseppe Palma et al.Curcumin Inhibits Tumor Growth and Angiogenesis in an Orthotopic Mouse Model of Human Pancreatic Cancer[J].Biomed Res Int, 2013,122 (4): 810423.
[12] Bhandarkar SS, Arbiser JL.Curcumin as an inhibitor of angiogenesis [J].Adv Exp Med Biol,2007,595(5):185-195.
