肝靶向干扰素对HBV转基因小鼠JAK-STAT信号通路基因表达的影响
2015-07-07卢雪梅汪洁金小宝朱家勇
卢雪梅,汪洁,金小宝,朱家勇Δ
(1. 广东药学院 基础学院 药用生物活性物质研究所,广东 广州 510006;2.广东省生物活性药物研究重点实验室,广东 广州 510006)
肝靶向干扰素对HBV转基因小鼠JAK-STAT信号通路基因表达的影响
卢雪梅1,2,汪洁1,2,金小宝1,2,朱家勇1,2Δ
(1. 广东药学院 基础学院 药用生物活性物质研究所,广东 广州 510006;2.广东省生物活性药物研究重点实验室,广东 广州 510006)
目的 研究肝靶向干扰素(interferon-circumsporozoite protein,IFN-CSP)在HBV转基因小鼠中的抗HBV分子机制。方法 Balb/c-HBV转基因小鼠随机分为3组:Control组(给予生理盐水),IFNα2b组(给予普通干扰素IFN α2b 103U/g),IFN-CSP组(给予IFN-CSP 102U/g),另设普通正常Balb/C小鼠组(Normal)。小鼠经肌肉注射给药4周后,抽提肝组织总RNA,Real-time PCR检测小鼠肝组织中STAT1、STAT2、IRF-9、OAS1基因相对表达量。结果 与正常小鼠对照组和模型组比较,IFN-CSP组和IFN α2b组STAT1,STAT2,IRF-9,OAS1基因表达均显著上调(P<0.01),IFN-CSP的诱导效果明显强于IFN α2b(P<0.05)。结论 IFN-CSP在HBV转基因小鼠中的抗HBV作用可能与其影响JAK-STAT信号通路中STAT1、STAT2、IRF-9、OAS1基因的表达有关,为其进一步的应用开发提供了实验依据。
IFN-CSP;HBV转基因小鼠;JAK-STAT信号通路;Real-time PCR
乙型肝炎病毒 (hepatitis B virus, HBV) 主要在肝细胞内寄生和复制,导致急慢性乙型肝炎发生,甚至引起肝硬化和肝癌[1]。干扰素(interferon,IFN)具有抗病毒和免疫调节双重活性,为抗HBV的首选药物之一[2]。但干扰素在临床治疗中需长期大剂量给药,患者不仅生理上痛苦、治疗费用高,并且常常引发明显的不良反应,如骨髓抑制、消化道反应、生殖系统损害等,严重制约着干扰素的临床应用[3]。提高干扰素的靶向性可能是较好的策略,利用导向分子选择性地将干扰素运送到肝脏,既能提高药物的疗效、减少用药量,又可明显降低不良反应[4]。
前期研究中,本课题组利用基因工程术将源于寄生虫的肝靶向肽分子与干扰素进行融合,并利用原核表达系统成功制备了新型肝靶向干扰素(interferon-circumsporozite protein,IFN-CSP)[5-8]。结果证实IFN-CSP可在肝脏得到明显富集[5],并具有显著的体内外抗HBV活性[9],但其在HBV转基因小鼠中抗HBV的分子机制不明确。本文以HBV转基因小鼠为实验模型,采用Real-time PCR技术检测蛋白酪氨酸激酶(Janus kinase,JAK)-信号转导和转录激活因子(signaltransducers and activators of transcription,STATs)通路中STAT1、STAT2、interferon regulatory factor 9 (IRF-9)、oligoadenylate synthetase (OAS1) 基因的表达变化,进一步探讨新型肝靶向干扰素IFN-CSP抗HBV作用的分子机制,为其应用开发奠定基础。
1 材料与方法
1.1 实验动物 SPF级Balb/c-HBV转基因小鼠18只,体质量18~22 g,雌雄各半,购自中国人民解放军第458医院全军肝病中心,许可证号:SCXK-(军)。SPF级Balb/C小鼠6只,6~8周,雄性,体质量18~22 g,购自广东省医学实验动物中心,许可证号:SCXK(粤)2008-0002。相关动物实验均在SPF级动物实验室进行,严格无菌操作。
1.2 药物及主要试剂 重组人干扰素IFN α2b为北京凯因科技股份有限公司产品,重组新型肝靶向干扰素(IFN-CSP)由广东省生物活性药物研究重点实验室制备。总RNA快速抽提试剂盒(离心柱型)购自天根生化公司,DEPC购至上海生工有限公司,SuperScript III First-Strand Synthesis System为Invitrogen公司产品,DNA分子量标准、TaKaRa Taq DNA Polymerase、Real-time PCR试剂盒为宝生物工程(大连)有限公司产品,其他常用试剂均为进口或国产分析纯。
1.3 实验仪器 AB2700 PCR基因扩增仪(美国AB公司),Gel 100凝胶成像系统(美国Bio-Rad公司),Real-time PCR仪Mini Option(美国Bio-Rad公司),SW-CJ-1F型净化工作台(苏州净化设备有限公司),高速冷冻离心机Centrifuge 5810R (德国Eppendorf 公司)。
1.4 实验动物分组及给药 Balb/c-HBV转基因小鼠随机分为3组,每组6只:① Control组(给予生理盐水),②IFN α2b组(给予普通干扰素IFN α2b 103U/g),③ IFN-CSP组(给予肝靶向干扰素IFN-CSP 102U/g)。另取普通正常Balb/C小鼠6只为Normal组。每只小鼠给予50 μL肌肉注射,每天1次,连续4周,于最后一次给药后处死动物,取肝脏备用。
1.5 引物设计 参照Genbank公布的小鼠STAT1、STAT2、IRF-9、OAS1、Actin基因的核酸序列,分别设计用于Real-time PCR的目的基因和内参基因的特异性引物 (见表1)。

表1 Real-time PCR引物序列Tab. 1 Primers for Real-time PCR
1.6 总RNA提取和cDNA合成 取上述Normal组、Control组、IFN α2b 组和IFN-CSP组小鼠肝组织,液氮中快速研磨,粉碎后,按照高纯度总RNA快速抽提试剂盒(离心柱型)(DP419)的使用说明抽提肝组织总RNA。用 UV-4802H紫外可见分光光度计测量吸光值,通过 OD260/280判断总 RNA 纯度,用 1.5%的琼脂糖凝胶电泳鉴定其完整性,-80 ℃保存备用。以提取的RNA为模板,使用SuperScript III First-Strand Synthesis System进行反转录获得 cDNA。
1.7 普通PCR检测 以上述cDNA为模板,PCR体系如下:5.0 μL cDNA模板,2.0 μL Forward Primer (20 μmol/L),2.0 μL Reverse Primer (20 μmol/L), 4.0 μL dNTP(2.5 mmol/L),0.5 μL PCR Taq 酶 (5 U/uL),加3 d H2O至总体积50.0 μL。PCR条件为:94 ℃预变性 5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,23~28个循环;72 ℃延伸10 min,2%琼脂糖凝胶电泳检测PCR产物。
1.8 Real-time PCR检测基因表达 以上述cDNA为模板,按照Real-time PCR试剂盒进行PCR扩增。PCR体系如下:5.0 μL cDNA模板,2.0 μL Forward Primer (20 μmol/L),2.0 μL Reverse Primer(20 μmol/L),25.0 μL THUNDERBIRD SYBR®Green qPCR Mix,加3 d H2O至总体积50.0 μL。将上步的PCR管放入Real-time PCR仪中,进行PCR反应。PCR条件为:95 ℃ 预变性 60 s后进行40个循环,每个循环95 ℃ 变性 5 s,60 ℃ 退火30 s,72 ℃ 延伸30 s。对各组反应的溶解曲线进行分析,并根据各基因的Ct值,按照下列公式计算小鼠肝组织中STAT1、STAT2、IRF-9、OAS1基因相对表达量。F比率=2-[待测组目的基因平均Ct值-待测管家基因平均Ct值]-[对照组目的基因平均Ct值-对照管家基因平均Ct值]
2 结果
2.1 普通PCR结果 常规PCR反应后,取10 μL PCR扩增产物用2%琼脂糖凝胶电泳检测,结果显示电泳呈单一条带,STAT1、STAT2、IRF-9、OAS1、Actin电泳条带分别位于200、100、100、 150、150 bp左右,且无其他杂带,表明无非特异性扩增(见图1)。
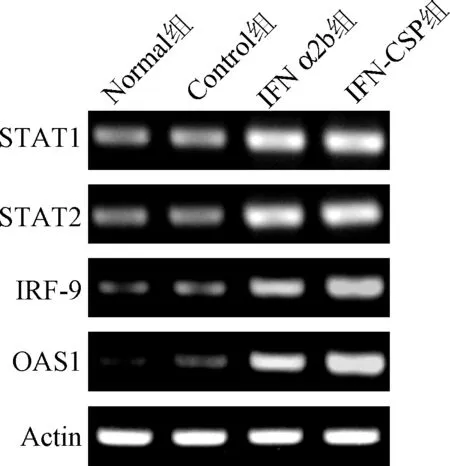
图1 常规PCR检测IFN α2b和IFN-CSP对STAT1, STAT2, IRF-9和OAS1基因表达影响Fig.1 Effect of IFN α2b and IFN-CSP on the gene expression of STAT1, STAT2, IRF-9 and OAS1 by RT-PCR
2.2 Real-time PCR特异性 采用Real-time PCR方法对HBV转基因小鼠肝脏局部Actin、STAT1、STAT2、IRF-9、OAS1基因分别进行扩增,显示扩增曲线均呈现典型的S型曲线(图2左图),溶解曲线分析显示只有一个峰值,没有杂峰(图2右图),显示扩增产物为单一产物,无非特异性扩增。

图2 荧光定量PCR的扩增曲线图(左)及溶解曲线图(右)Fig.2 Amplification curves(left)and melting curves(right)of Real-time PCR
2.3 IFN-CSP对STAT1、STAT2、IRF-9、OAS1基因的影响 为了进一步探寻IFN α2b与IFN-CSP在体内抗HBV作用的分子机制, 采用Real-time PCR方法检测肝脏局部JAK-STAT信号通路中STAT1、STAT2、IRF-9、OAS1基因表达。结果显示,与Normal组和Control组比较,IFN-CSP组和IFN α2b组各基因表达均显著上调(见表2和图3),且IFN-CSP组各基因表达明显高于IFN-α2b组,说明IFN-CSP的诱导效果明显强于普通干扰素IFN-α2b(P<0.01)。
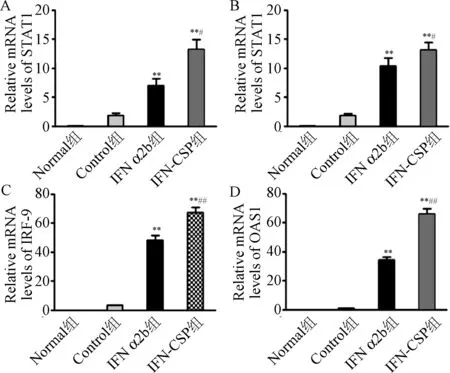
图3 IFN α2b和IFN-CSP对抗病毒蛋白STAT1, STAT2, IRF-9,OAS1基因表达的影响**P<0.01, 与对照组相比;#P<0.05, ##P<0.01,与IFN-CSP相比Fig. 3 Effect of IFN α2b and IFN-CSP on the expression of STAT1, STAT2, IRF-9, OAS1**P<0.001, compared with control group; #P<0.05, ##P<0.001, compared with IFN-CSP
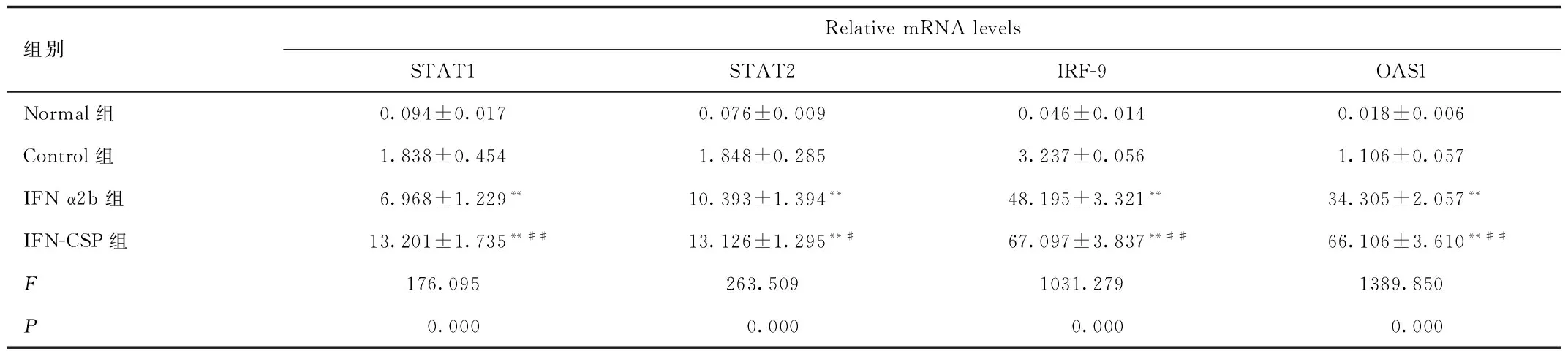
组别RelativemRNAlevelsSTAT1STAT2IRF-9OAS1Normal组0.094±0.0170.076±0.0090.046±0.0140.018±0.006Control组1.838±0.4541.848±0.2853.237±0.0561.106±0.057IFNα2b组6.968±1.229**10.393±1.394**48.195±3.321**34.305±2.057**IFN-CSP组13.201±1.735**##13.126±1.295**#67.097±3.837**##66.106±3.610**##F176.095263.5091031.2791389.850P0.0000.0000.0000.000
**P<0.01, 与对照组相比,compared with control group;#P<0.05,##P<0.01, 与 IFN-CSP相比,compared with IFN-CSP group
3 讨论
小鼠遗传背景清楚,基因组全序列已完全确定,免疫系统研究深入透彻并且易于饲养,这些特点决定了小鼠是实验室研究常用且比较理想的动物模型。虽然小鼠无法感染人HBV,但是通过分子生物学手段将HBV基因转入小鼠胚胎,可以构建HBV转基因小鼠模型,HBV可以在转基因小鼠的肝脏和肾脏中进行有效的复制,并产生HBV病毒颗粒,该病毒颗粒在形态学上与人血清HBV颗粒没有区别,因此常作为评价细胞因子以及核苷类似物的抗HBV效果动物模型[10-12]。本课题组在前期研究中已经证实IFN-CSP可显著降低HBV转基因小鼠血清中HBsAg、HBV-DNA水平和肝脏中HBcAg的表达[13],但其分子机制不清楚。
JAK-STAT通路是激素、生长因子和细胞因子等广泛涉及的信号转导通路,在所有的细胞中几乎均有JAK表达,它可与多种细胞因子和生长因子受体结合并选择性地激活其下游底物STATs,介导这些因子的细胞内信号转导过程,活化相应靶基因,从而产生生物学效应[14]。
实时荧光定量PCR (Real-time PCR) 技术以其特异性强、重复性好、定量准确、速度快等优点成为了分子生物学领域中的重要技术工具,已广泛应用于检测各基因在组织细胞中的表达丰度、mRNA的表达模式、基因的表达调控等方面研究[15]。Real-time PCR通过在普通PCR反应体系中加入荧光基团,利用荧光信号的变化实时监测整个PCR进程,最后通过标准曲线和Ct值的分析,对未知模板进行定量分析,其检测灵敏度远远高于ELISA法[16]。
本研究利用Real-time PCR技术检测给药后HBV转基因小鼠肝脏JAK-STATs通路中STAT1、STAT2、IRF-9、OAS1基因表达变化,结果显示IFN α2b和IFN-CSP均能显著上调JAK-STAT信号通路中STAT1、STAT2、IRF-9、OAS1基因的表达(均P<0.01),同时IFN-CSP诱导上述各基因的表达量显著高于普通干扰素IFN α2b(均P<0.05),且与前期研究结果中IFN-CSP抑制病毒学指标相对应,进一步证实肝靶向干扰素的作用效果明显优于普通干扰素,且其抗HBV作用分子机制可能与影响JAK-STAT信号通路中STAT1、STAT2、IRF-9、OAS1基因的表达有关。
[1] Xu C ZW, Wang Y, Qiao L. Hepatitis B virus induced hepatocellular carcinoma[J]. Cancer Lett, 2014, 345(2):216-222.
[2] Zhang Q, Wang Y, Wei L, et al. Role of ISGF3 in modulating the anti-hepatitis B virus activity of interferon-alpha in vitro[J]. J Gastroenterol Hepatol, 2008, 23(11):1747-1761.
[3] Sonneveld MJ, Rijckborst V, Cakaloglu Y, et al. Durable hepatitis B surface antigen decline in hepatitis B e antigen-positive chronic hepatitis B patients treated with pegylated interferon-alpha2b: relation to response and HBV genotype[J]. Antivir Ther, 2012, 17(1):9-17.
[4] Yang F, Shu YJ, Yang YQ, et al. The pharmacokinetics of recombinant human interferon-alpha-2b poly (lactic-co-glycolic acid) microspheres in rats[J]. J Microencapsul, 2011, 28(6):483-489.
[5] Lu X, Jin X, Huang Y,et al. Construction of a novel liver-targeting fusion interferon by incorporation of a Plasmodium region I-plus peptide[J]. Bio Med Research, 2014:e261431.
[6] 黄演婷, 卢雪梅, 汪洁,等. 肝靶向干扰素(IFN-CSP)融合基因原核表达条件的优化[J]. 生物医学工程学杂志,2014,31(2):432-438.
[7] 卢雪梅, 黄演婷, 汪洁,等. 重组肝靶向干扰素工程菌菌种遗传稳定性研究[J].生物学杂志, 2013,30(3):14-16.
[8] 汪洁, 卢雪梅, 黄演婷,等. 地高辛探针检测重组肝靶向干扰素宿主DNA残留量的研究[J]. 生物技术, 2014,24(5):80-83.
[9] Lu X, Wang J, Jin X, et al. IFN-CSP Inhibiting Hepatitis B Virus in HepG2.2.15 Cells Involves JAK-STAT Signal Pathway[J]. BioMed Research, 2015:e959684.
[10] Cobleigh MA, Wei X, Robek MD. A vesicular stomatitis virus-based therapeutic vaccine generates a functional CD8 T cell response to hepatitis B virus in transgenic mice[J]. J Virol, 2013, 87(5):2969-2973.
[11] Tang Y, Chen X, Zhang Y, et al. Fusion protein of tapasin and hepatitis B core antigen 1827 enhances T helper cell type 1/2 cytokine ratio and antiviral immunity by inhibiting suppressors of cytokine signaling family members 1/3 in hepatitis B virus transgenic mice[J]. Mol Med Rep, 2014, 9(4):1171-1178.
[12] Morrey JD, Motter NE, Chang S, et al. Breaking B and T cell tolerance using cationic lipid-DNA complexes (CLDC) as a vaccine adjuvant with hepatitis B virus (HBV) surface antigen in transgenic mice expressing HBV[J]. Antiviral Res, 2011, 90(3):227-230.
[13] Lu X, Wang J, Jin X,et al. High-level expression of a novel liver-targeting fusion interferon with preferred Escherichia coli codon preference and its anti-hepatitis B virus activity in vivo[J]. BMC Biotechnol, 2015, DOI: 10.1186/s12896-015-0177-1.
[14] Ayala-Camargo A, Anderson A, Amoyel M, et al. JAK/STAT signaling is required for hinge growth and patterning in the Drosophila wing disc[J]. Dev Biol, 2013, 382(2):413-426.
[15] 许黎黎, 鲍琳琳, 谷松至,等. 埃博拉病毒莱斯顿亚型实时荧光定量PCR检测方法的建立[J]. 病毒学报, 2015,31(3):276-281.
[16] 周成江, 周立社, 吴刚,等. 实时荧光定量PCR的研究进展及其应用[J]. 包头医学院学报,2007, 23(2):204-207.
(编校:谭玲)
Effect of IFN-CSP on gene of JAK-STAT signaling pathway in HBV transgenic mice
LU Xue-mei1,2, WANG Jie1,2, JIN Xiao-bao1,2, ZHU Jia-yong1,2Δ
(1. Institution of Pharmaceutical Bioactive Substances, School of Basic Courses, Guangdong Pharmaceutical University, Guangzhou 510006, China; 2.Guangdong Key Laboratory of Pharmaceutical Bioactive Substances, Guangzhou 510006, China)
ObjectiveTo investigate the anti-HBV molecular mechanisms of liver targeting interferon (IFN-CSP) in Balb/c-HBV transgenic mice. MethodsBalb/c-HBV transgenic mice were randomly divided into 3 groups. Control group (treated with physiological saline), IFN α2b group (treated with 103U/g IFN α2b), IFN-CSP group (treated with 102U/g IFN-CSP). Another group of the non-transgenic mice were used as the Normal group. Each mouse was intramuscular injected with 50 μL dose once a day for 4 weeks. Total RNA of mice liver were extracted, and STAT1, STAT2, IRF-9, OAS1 gene expression of JAK-STAT signaling pathway were analyzed by real-time PCR. ResultsIFN α2b and IFN-CSP can significantly up regulate the expression of STAT1, STAT2, IRF-9, OAS1 gene of JAK-STAT signaling pathway (P<0.01). The induce effects of IFN-CSP on STAT1, STAT2, IRF-9, OAS1 were significantly better than that of IFN α2b (P<0.05). ConclusionThe anti-HBV molecular mechanisms of liver targeting interferon (IFN-CSP) in Balb/c-HBV transgenic mice maybe related to regulate the expression of STAT1, STAT2, IRF-9, OAS1 gene of JAK-STAT signaling pathway. These results will lay a basis for the application of recombinant liver-targeting interferon.
IFN-CSP; HBV transgenic mice; JAK-STAT signal pathway; Real-time PCR
国家科技部新药创制重大专项项目(2013ZX09103003-003)
卢雪梅,女,博士,副研究员,研究方向:药用生物活性物质结构、功能与应用研究,E-mail: luxuemei605@163.com;朱家勇,通讯作者,男,博士,教授、博士生导师,研究方向:药用生物活性物质结构、功能与应用研究,E-mail: zhujiayong1020@163.com。
Q819
A
1005-1678(2015)06-0013-04
