黄龙山白桦桦木醇与桦木酸含量研究
2015-07-05樊蓉蓉张文辉
樊蓉蓉,张文辉,何 婷,李 罡,邓 磊
(西北农林科技大学西部环境与生态教育部重点实验室,陕西杨陵712100)
白桦(Betula platyphylla)为桦木科桦木属的一种落叶乔木,耐寒、耐低温,耐贫瘠。其适应性强,在沼泽地、干旱的阳坡及湿润的阴坡均能生长[1]。白桦分布范围广,自喜马拉雅山脉东端,经青藏高原、秦岭山脉向中国东北延伸到大兴安岭、长白山等地,在中国分布于14个省区[2],在分布区内,天然更新良好,常形成纯林或与其他针阔叶树种组成混交林[3]。研究发现,白桦树皮提取物桦木醇、桦木酸具有抗肿瘤、抗病毒活性[4]。黄龙山林区森林分布集中,植物资源丰富[5],因此,对这里的白桦积累桦木醇与桦木酸的研究具有非常重要的意义。
桦木醇与桦木酸都是五环三萜类化合物[6]。《本草纲目》中记载,桦树皮可用于黄疸、乳痈、疥疮等疾病的治疗[7]。一些药理实验表明,桦木醇及其衍生物具有消炎、抗病毒等活性[8],桦木酸更是具有抗肿瘤、抗HIV、抗炎、抗菌、抗疟疾等多种生物活性[9-10],与目前所使用的抗HIV 药物相比,桦木酸类化合物针对性更强,许多桦木酸及其衍生物制剂已用于临床试验[11-12]。萜类化合物作为次生代谢产物,其积累受多种因素影响,如光照、植物器官、树龄等[13]。目前,对桦木醇、桦木酸的研究主要集中在医学领域,主要研究其抗肿瘤、抗炎活性,但对培育白桦立地条件选择及什么时机提取桦木醇、桦木酸少有报道[14]。
本研究区域选在陕北黄土高原黄龙山林区,通过调查将白桦林分为阳坡、阴坡、林缘、孤立木4种生境,测定比较了白桦各器官桦木醇、桦木酸含量以及分不同径级比较了各器官桦木醇与桦木酸含量,以期选出有利于桦木醇、桦木酸积累的白桦生境以及为白桦资源的合理利用提供理论依据。
1 研究区概况及研究方法
1.1 研究区概况
本研究区选在陕北黄土高原黄龙山林区,位于黄土高原东南部,地理位置109°52′57″~110°17′11″E,35°47′25″~36°01′11″N。东临黄河,属于暖温带半湿润与半干旱气候的过渡地带,年平均气温8.6℃,年均降水量611.8 mm,年无霜期126~186d,地带性植被为暖温带落叶阔叶林,土壤类型主要为褐土。主要成林树种是油松(Pinus tabulaefomis)、辽 东 栎(Quercus liaotungensis)、白 桦(Betula platyphylla)等[15]。
1.2 试验材料
1.2.1 不同生境白桦不同器官采样 于2013 年10月在陕北黄土高原黄龙山林区蔡家川林场,分别选择白桦林林内阳坡、阴坡、林缘和孤立生长的白桦4种生境,分不同生境分别取样。选择林相均一,树干较为通直,生长良好,平均胸径为20cm,无机械损伤的个体为对象,在不同生境中选好标准株后按器官分别进行采样。树皮采样:在距离地面1.3 m高度处采集5cm×5cm 的树皮样品。树枝采样:采集树冠上部基部直径≤2cm 的枝条。树叶采样:采集树冠上部的新鲜树叶。每个生境选择3棵标准株重复采样,将采集好的材料放入封口塑料袋,标号带回实验室备用。
1.2.2 不同胸径白桦不同器官采样 在上述4种生境下,按胸径大小将白桦个体划分为4个径级:胸径小于10cm 为第Ⅰ径级,10.1~20.0cm 为第Ⅱ径级,20.1~30.0cm 为第Ⅲ径级,30.1~40cm 为第Ⅳ径级,每个径级各选3株取样,按1.2.1方法在不同生境下对白桦分径级分器官进行采样。
1.3 试验方法
1.3.1 仪器与试剂 仪器:101-2AB电热鼓风干燥箱、FW135植物粉碎机、筛网(40目)、SB-5200超声波清洗机、AUY220电子分析天平、Waters 600E 高效液相色谱仪、Waters 2487紫外检测器、TG16-W微量高速离心机、布氏漏斗、0.22 mm 有机滤器,1mL一次性注射器。
试剂:桦木酸标准品、桦木醇标准品均购自美国Sigma-Adrich公司。无水乙醇(分析纯)、超纯水、乙腈(色谱纯)。
1.3.2 样品处理与提取 将1.2中采集到的白桦不同器官、不同径级样品洗净去杂,放入恒温干燥箱中40℃条件下烘干至恒重,粉碎后过40目筛网,密闭保存于冰箱中备用 。
精确称取白桦各器官样品各1.0g于50mL离心管中,加入80%乙醇40 mL,在400W 超声波功率下超声50min,冷却,抽滤,转移至150 mL 容量瓶,重复提取3次,转移至容量瓶并定容、摇匀。用移液管吸取10mL定容后的溶液于10mL 离心管中,13 000r/min离心10min,取上清液过0.22mL有机滤膜,等待进样[17-18]。
1.3.3 桦木醇、桦木酸含量的测定 测定桦木醇、桦木酸含量测定方法参照李春雪的研究,采用高效液相色谱法同时测定桦木醇、桦木酸含量[19]。
桦木醇、桦木酸标准溶液的配制:准确称取桦木醇标准品20mg于5mL 容量瓶中,用80%无水乙醇溶解并定容配制成4mg/mL桦木醇标准品母液;精密称取2mg桦木酸标准品于50 mL 容量瓶中,加80% 无水乙醇50 mL 并定容,配制成0.04 mg/mL桦木酸标准品母液。
桦木醇、桦木酸混合标曲的配制:精密吸取桦木醇标准母液200μL、桦木酸标准母液600μL 于2 mL离心管中,混匀得混合标准母液,此时混合标品母液中桦木醇浓度为1mg/mL,桦木酸浓度为0.03 mg/mL。
精密吸取混合标品母液60、50、50、50、20μL于2mL 离心管中,分别加入80%无水乙醇40、50、450、950和980μL,混合标品中桦木醇浓度分别为:600、500、100、50和20μg/mL,桦木酸浓度分别为:18、15、3、1.5和0.6μg/mL,按照选定的色谱条件,分别对不同浓度的标准溶液样品进行分析,以桦木醇、桦木酸的质量浓度(μg/mL)为横坐标,峰面积为纵坐标进行计算得桦木醇标准曲线为y=9872.2x+24 924,R2=0.999 3,桦木酸标准曲线为y=11 761x+44 142,R2=0.999 4。
桦木醇、桦木酸高效液相色谱条件为:色谱柱:Diamonsil C18(2)5μ150mm×4.6mm,流动相为乙腈∶水=80∶20,紫外检测波长为210nm,柱温25 ℃,流速为1.0mL/min,进样量10μL。
精密度试验:精密量取标准品溶液10μL,连续进样5次测桦木醇与桦木酸含量,结果显示桦木醇与桦木酸标准品的峰面积积分值的相对标准偏差(RSD)分别为1.06%和0.08%,试验结果精密度良好。
稳定性试验:取林内阴坡20cm 标准株树皮制备的样品溶液,在样品制备后的0、4、8、12 和16h精密吸取10μL,高效液相色谱分析,桦木醇与桦木酸峰面积积分值的RSD 分别为1.33%和1.67%,表明样品稳定性良好。
回收率试验:精密称取林内阴坡20cm 标准株白桦树皮粉末6份,每份0.1g,3份分别加入桦木醇标准品2 mg,另3 份分别加入桦木酸标准品1 mg,按照样品制备及测定方法进行测定分析,得加标回收率分别为101.45%和99.92%。
1.4 数据处理
采用Excel进行数据的初步处理和计算,采用Shapiro-Wilk 方 法 检 验 数 据 的 正 态 性,采 用SPSS17.0 软 件 进 行 单 因 素 方 差 分 析(One-way ANOVE),最小显著差异法(LSD)和Duncan多重比较法,分析比较白桦不同径级不同器官桦木醇、桦木酸含量差异(α=0.05),运用ORIGIN8.5进行图像处理,并用Pearson相关系数评价生境和径级对桦木醇与桦木酸含量的相关作用关系并作回归分析。
2 结果与分析
2.1 桦木醇与桦木酸混合标品及白桦样品液相色谱图
由图1 可知,桦木醇和桦木酸有良好的分离度,用上述色谱条件,分析可在25min之内完成,峰形较好,桦木醇和桦木酸的保留时间分别为17.08和13.55min。
2.2 不同生境下白桦不同器官中桦木醇和桦木酸含量比较
对4种生境下平均胸径为20cm 的白桦植株树皮中桦木醇、桦木酸含量进行分析表明,4种生境下白桦 树 皮 中 桦 木 醇 含 量 为3.48% ~8.5%,即34.8~85mg/g,桦木酸含量为0.08%~0.17%,即0.8~1.7mg/g。由图2可知,4种生境下白桦树皮中桦木醇、桦木酸含量表现为阴坡>孤立木>林缘>阳坡。单因素方差分析表明阴坡与阳坡、林缘、孤立木生境下白桦树皮中桦木醇与桦木酸含量均存在极显著差异(P<0.01),进一步计算发现阴坡生境下白桦树皮中桦木醇含量分别是阳坡、林缘、孤立木生境下的2.34、1.81和1.71倍,桦木酸含量分别是阳坡、林缘、孤立木生境下的1.71、1.45和1.37倍。

图1 桦木醇与桦木酸的液相色谱图A.白桦桦木醇与桦木酸混合标品液相色谱图;B.白桦样品液相色谱图;峰1为桦木酸,峰2为桦木醇Fig.1 Representative HPLC chromatograms of betulin and betulinic acid detected A.Chromatograms of betulin and betulinic of standard sample;B.Chromatograms of betulin and betulinic of extracted sample;Peak 1for betulinic acid and Peak 2for betulin
对4种生境下平均胸径为20cm 的白桦植株树枝中桦木醇、桦木酸含量进行分析表明,4种生境下白桦树枝中桦木醇含量为0.36%~0.82%,桦木酸含量为0.015%~0.072%。白桦树枝中桦木醇含量表现为阴坡>林缘>孤立木>阳坡,白桦树枝中桦木酸含量表现为阴坡>孤立木>林缘>阳坡。单因素方差分析表明,阳坡和孤立木生境下白桦树枝中桦木醇差异不显著(P>0.05),阴坡与阳坡、林缘、孤立木生境下白桦树枝中桦木醇含量均存在极显著差异(P<0.01),阴坡与阳坡、林缘、孤立木生境下白桦树枝中桦木酸含量也均存在极显著差异(P<0.01)。进一步分析发现阴坡生境下白桦树枝中桦木醇含量比阳坡、林缘、孤立木生境下桦木酸含量分别高109.57%、50.63%和104.24%,阴坡生境下白桦树枝中桦木酸含量比阳坡、林缘、孤立木生境下分别高90.17%、46.89%和33.12%。
对4种生境下平均胸径为20cm 的白桦植株树叶中桦木醇、桦木酸含量进行分析表明,4种生境下白桦树叶中桦木醇含量为0.31%~0.59%,桦木酸含量为0.004%~0.009 5%。白桦树叶中桦木醇、桦木酸含量均表现为阴坡>林缘>孤立木>阳坡。阴坡树叶中桦木醇、桦木酸均与其他3种生境下树叶中桦木醇、桦木酸存在极显著差异(P<0.01)。阴坡生境下白桦树叶中桦木醇含量分别是阳坡、林缘、孤立木生境下树叶中桦木醇含量的1.79、1.22和1.39倍,阴坡生境下白桦树叶中桦木酸含量分别比阳坡、林缘、孤立木生境下树叶中桦木酸含量高103.63%、14.69%和24.89%。
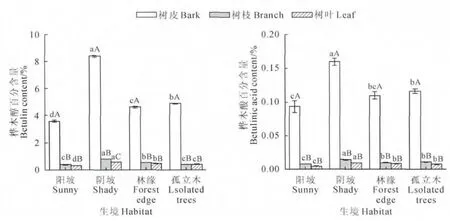
图2 不同生境下白桦不同器官桦木醇和桦木酸含量不同小写字母表示同一器官中桦木醇、桦木酸含量在不同生境间差异显著(P<0.05),不同大写字母表示同一生境下桦木醇、桦木酸含量在不同器官间差异显著(P<0.05)Fig.2 The contents of betulin and betulinic acid in different organs of Betula platyphyllain different habitats Different normal letters represented significant differences of the betulin and betulinic acid contents among the same organ in different habitats at 0.05level,different capital letters represented significant differences of the betulin and betulinic acid contents among the same habitat in different organs at 0.05level
由以上分析可知,阴坡生境下白桦树皮、树枝、树叶各器官中桦木醇与桦木酸含量均极显著高于阳坡、林缘和孤立木生境,因此,在培育以桦木醇、桦木酸提取利用为主要用途的白桦宜选在林内阴坡生境下更有利于其积累,或者合理分配植株密度,注意适当遮阴等。
2.3 白桦不同器官桦木醇、桦木酸含量比较
对同一生境下平均胸径为20cm 的白桦植株各器官桦木醇与桦木酸含量进行分析表明,同一生境下白桦不同器官桦木醇、桦木酸含量差异非常大(图2),单因素方差分析表明4种生境下白桦各器官中桦木醇、桦木酸含量均表现为树皮>树枝>树叶,4种生境下白桦树皮与树枝、树叶中桦木醇、桦木酸含量均存在极显著差异(P<0.01),阴坡生境下白桦树枝与树叶中桦木醇含量也存在极显著差异(P<0.01),阳坡、林缘和孤立木生境下白桦树枝与树叶中桦木醇含量差异不显著(P>0.05)。4种生境下白桦树枝与树叶中桦木酸含量均没有显著差异(P>0.05)。4种生境下白桦树皮桦木醇、桦木酸含量均极显著高于白桦树枝、树叶,因此,在白桦生长过程中应注意保护白桦树皮免受损伤。
目前,桦木酸及其衍生物已进入临床应用阶段,由以上分析可知,白桦树皮、树枝、树叶各器官中桦木酸含量均比较低,4种生境下白桦树皮中桦木酸含量均不到0.2%,树枝、树叶中桦木酸含量更低,均不到0.02%,对从白桦中提取天然桦木酸不利,但白桦树皮、树枝、树叶中桦木醇含量都比较丰富,且树枝、树叶可以多次采收,对树木伤害较小可以重复利用,这也为近年来兴起的用桦木醇半合成制备桦木酸提供了依据[19]。
2.4 不同生境下不同径级白桦植株各器官桦木醇和桦木酸含量比较
4 种生境下,随着胸径的增大,白桦各器官桦木醇含量均呈现先增大后减小的趋势,桦木醇含量均在第Ⅱ径级达到最大,随后逐渐下降(图3)。4种生境下白桦树皮中第Ⅱ径级桦木醇含量均极显著高于第Ⅰ、Ⅲ、Ⅳ径级(P<0.01),阳坡生境下第Ⅱ径级白桦树皮中桦木醇含量比第Ⅰ径级增加了10.09%,第Ⅲ径级比第Ⅱ径级下降了62.02%,第Ⅳ径级比第Ⅲ径级下降了18.62%。阴坡生境下第Ⅱ径级白桦树皮中桦木醇含量比第Ⅰ径级增加了127.93%,第Ⅲ、Ⅳ径级含量比第Ⅱ径级分别下降了29.90%和56.13%。林缘生境下第Ⅱ径级白桦树皮中桦木醇含量比第Ⅰ、Ⅲ、Ⅳ径级分别高21.70%、299.10%和421.18%。孤立木生境下第Ⅱ径级白桦树皮中桦木醇含量比第Ⅰ径级增加了64.93%,第Ⅲ径级含量比第Ⅱ径级下降了36.42%,第Ⅳ径级比Ⅲ径级下降了23.42%。
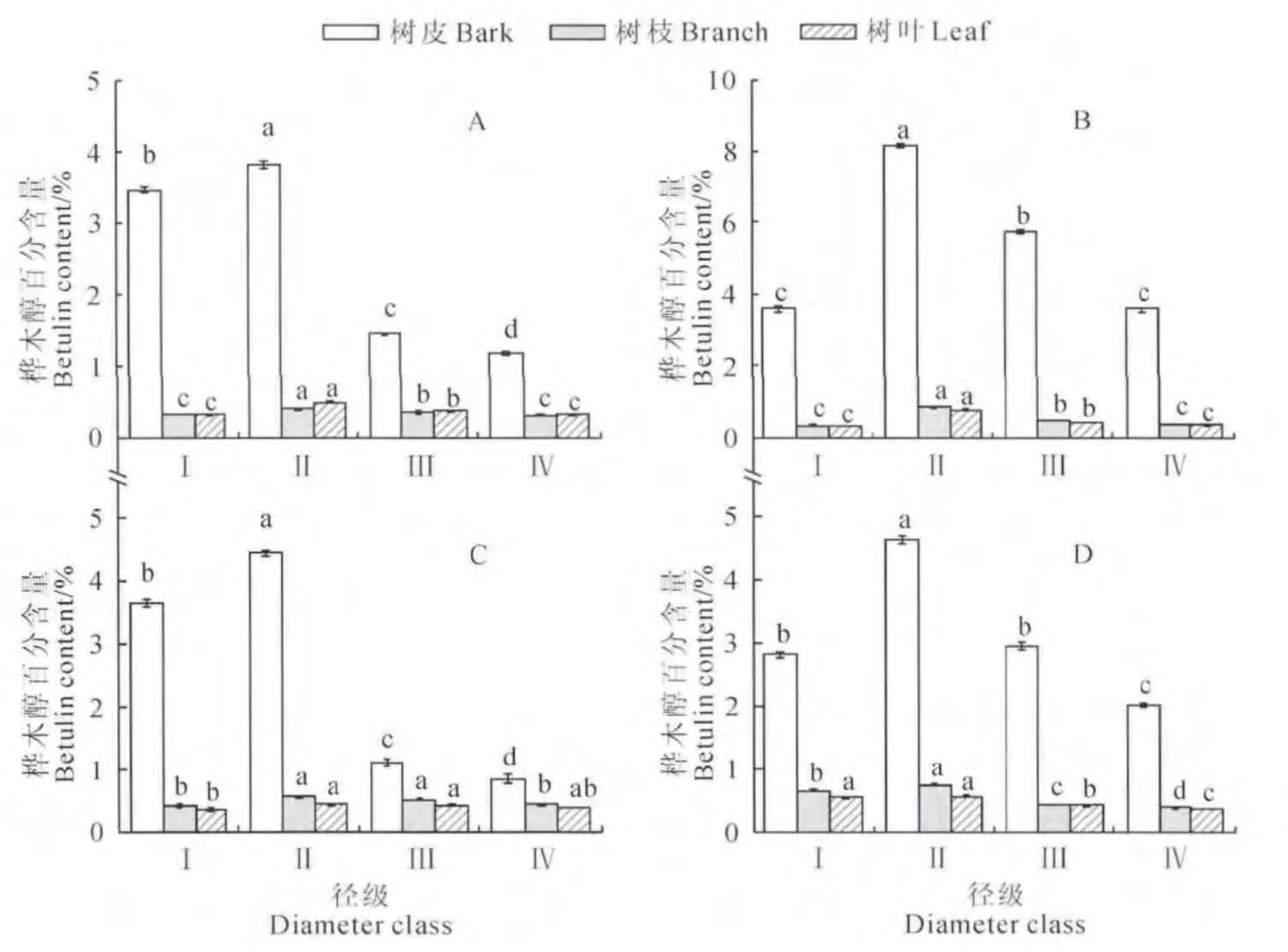
图3 不同生境不同径级白桦各器官桦木醇含量A.阳坡;B.阴坡;C.林缘;D.孤立木Fig.3 Betulin content in different organs of B.platyphyllain different habitats with different diameters at breast height A.Sunny slope;B.Shady slope;C.Forest edge;D.Isolated trees
阳坡生境下第Ⅱ径级白桦树枝中桦木醇含量与第Ⅰ、Ⅲ、Ⅳ径级有显著差异(P<0.05),阳坡生境下第Ⅱ径级白桦树枝中桦木醇含量比第Ⅰ径级增加了25%,第Ⅲ径级比第Ⅱ径级下降了10%,第Ⅳ径级比第Ⅲ径级下降了22.5%。阴坡和孤立木生境下第Ⅱ径级白桦树枝中桦木醇含量与第Ⅰ、Ⅲ、Ⅳ径级均存在极显著差异(P<0.01),阴坡生境下第Ⅱ径级白桦树枝中桦木醇含量比第Ⅰ径级增加了127.93%,第Ⅲ、Ⅳ径级含量比第Ⅱ径级分别下降了29.90%和56.13%。孤立木生境下第Ⅱ径级白桦树枝中桦木醇含量比第Ⅰ径级增加了14.93%,第Ⅲ、Ⅳ径级比第Ⅱ径级分别下降了42.86% 和49.35%。林缘生境下第Ⅱ径级白桦树枝中桦木醇含量与第Ⅲ径级差异不显著(P>0.05),与第Ⅰ、Ⅳ径级存在极显著差异(P<0.01),第Ⅱ径级含量比第Ⅰ、Ⅲ、Ⅳ径 级 分 别 高31.15%、7.69% 和27.27%。
阳坡、阴坡生境下第Ⅱ径级白桦树叶中桦木醇含量与第Ⅰ、Ⅲ、Ⅳ径级均存在极显著差异(P<0.01)。阳坡生境下第Ⅱ径级白桦树叶中桦木醇含量比第Ⅰ径级增加了53.13%,第Ⅲ径级比第Ⅱ径级下降了22.45%,第Ⅳ径级比第Ⅲ径级下降了15.79%。阴坡生境下第Ⅱ径级白桦树叶桦木醇含量比第Ⅰ径级增加了151.61%,第Ⅲ、Ⅳ径级比第Ⅱ径级分别下降了46.15%和53.85%。林缘生境下第Ⅱ径级白桦树叶中桦木醇含量与第Ⅲ、Ⅳ径级没有显著差异(P>0.05),与第Ⅰ径级有显著差异(P<0.05),第Ⅱ径级含量比第Ⅰ、Ⅲ、Ⅳ径级含量分别高64.93%、57.28%和129.47%。孤立木生境下第Ⅱ径级白桦树叶中桦木醇含量与第Ⅰ径级没有显著差异(P>0.05),第Ⅱ径级与第Ⅲ、Ⅳ径级有极显著差异(P<0.01),第Ⅱ径级含量分别是第Ⅰ、Ⅲ、Ⅳ的1.04倍、1.36倍和1.54倍。
由以上知,白桦树皮、树枝、树叶中桦木醇均在白桦胸径生长到第Ⅱ径级时含量达到最高,因此,在利用白桦提取桦木醇时要注意把握最佳采收时机,着重采收胸径生长到10.1~20cm 的白桦各器官提取效果较理想。
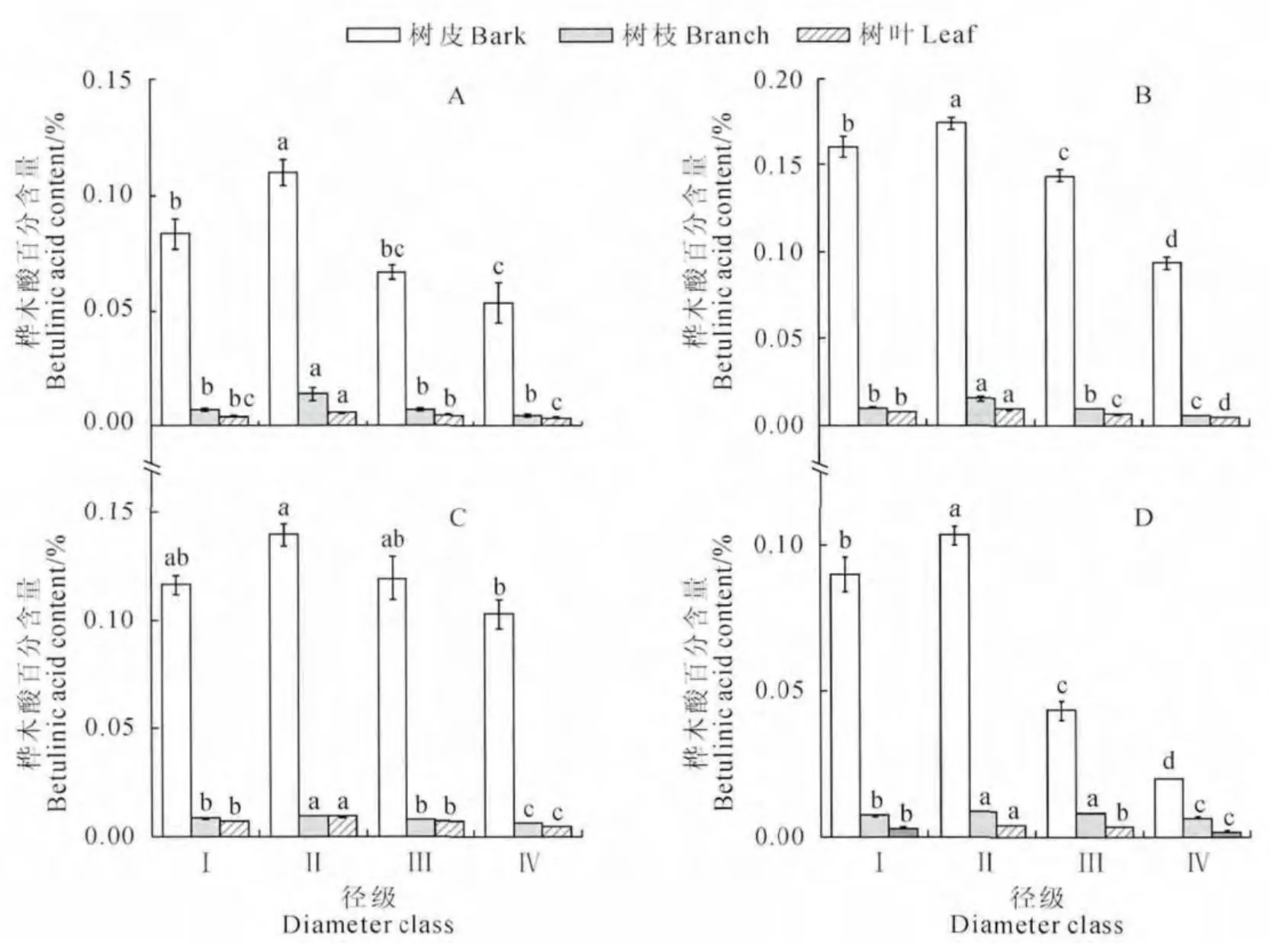
图4 不同生境不同径级白桦各器官桦木酸含量A.阳坡;B.阴坡;C.林缘;D.孤立木Fig.4 Betulinic acid content in different organs of B.platyphyllain different habitats with different diameters at breast height A.Sunny slope;B.Shady slope;C.Forest edge;D.Isolated trees
图4 显示,4 种生境下,随着胸径的增大,白桦各器官桦木酸含量均呈现先增大后减小的趋势,且均在第Ⅱ径级达到最大,与桦木醇相同。阳坡生境下第Ⅱ径级白桦树皮中桦木酸含量与第Ⅰ径级存在显著差异(P<0.05),与第Ⅲ、Ⅳ径级存在极显著差异(P<0.01),第Ⅱ径级桦木酸含量比第Ⅰ、Ⅲ、Ⅳ径级分别高32.00%、65.00%和106.25%。阴坡生境下第Ⅱ径级白桦树皮中桦木酸含量与第Ⅰ、Ⅲ、Ⅳ径级均存在极显著差异(P<0.01),第Ⅱ径级桦木酸含量比第Ⅰ径级增大了8.3%,第Ⅲ、Ⅳ径级比第Ⅱ径级分别减小了17.31%和46.15%。林缘生境下第Ⅱ径级白桦树皮中桦木酸含量与第Ⅲ径级差异不显著(P>0.05),与第Ⅰ径级有显著差异(P<0.05),与第Ⅳ径级存在极显著差异(P<0.01),第Ⅱ径级含量比第Ⅰ径级增大了19.89%,第Ⅲ径级比第Ⅱ径级下降了14.32%,第Ⅳ径级比第Ⅲ径级下降了13.65%。孤立木生境下第Ⅱ径级白桦树皮中桦木酸含量与第Ⅰ径级存在显著差异(P<0.05),与第Ⅲ、Ⅳ径级均存在极显著差异(P<0.01),第Ⅱ径级桦木酸含量比第Ⅰ径级增大了14.81%,第Ⅲ、Ⅳ径级分别比第Ⅱ径级减小了58.06%和80.65%。
阳坡生境下第Ⅱ径级白桦树枝中桦木酸含量与第Ⅰ、Ⅲ径级均存显著差异(P<0.05),与第Ⅳ径级存在极显著差异(P<0.01),第Ⅱ径级桦木酸含量比第Ⅰ、Ⅲ、Ⅳ径级含量分别高97.13%、99.89%和212.96%。阴坡和林缘生境下第Ⅱ径级白桦树枝中桦木酸含量与第Ⅰ、Ⅲ、Ⅳ径级均存在极显著差异(P<0.01),阴坡生境下第Ⅱ径级白桦树枝中桦木酸含量比第Ⅰ、Ⅲ、Ⅳ径级分别高48.37%、59.22%和59.96%,林缘生境下第Ⅱ径级白桦树枝中桦木酸含量比第Ⅰ、Ⅲ、Ⅳ径级分别高12.56%、21.61%和48.72%。孤立木生境下第Ⅱ径级白桦树枝中桦木酸含量与Ⅲ径级存在显著差异(P<0.05),与第Ⅰ、Ⅳ径级存在极显著差异(P<0.01)。第Ⅱ径级桦木酸含量比第Ⅰ径级增大了18.19%,第Ⅲ、Ⅳ径级分别比第Ⅱ径级下降了5.39%和25.00%。
4种生境下第Ⅱ径级白桦树叶中桦木酸含量与第Ⅰ、Ⅲ、Ⅳ径级均存在极显著差异(P<0.01),阳坡生境下第Ⅱ径级桦木酸含量比第Ⅰ、Ⅲ、Ⅳ径级分别高32.56%、21.28%和56.89%。阴坡生境下第Ⅱ径级白桦树叶中桦木酸含量比第Ⅰ、Ⅲ、Ⅳ径级分别高16.12%、31.43%和84.89%。林缘生境下第Ⅱ径级白桦树叶中桦木酸含量比第Ⅰ径级增大了25.36%,第Ⅲ、Ⅳ径级分别比第Ⅱ径级下降了22.43%和46.32%,孤立木生境下第Ⅱ径级白桦树叶中桦木酸含量比第Ⅰ径级增大了33%,第Ⅲ径级比第Ⅱ径级下降了20.57%,第Ⅳ径级比第Ⅲ径级下降了41.69%。
白桦树皮、树枝、树叶中桦木酸含量均随着胸径的增大在第Ⅱ径级达到最大,与桦木醇相同,在从白桦中提取桦木酸时要注意把握采收各器官的最佳时机,着重采收胸径在10.1~20cm 的白桦植株各器官(图4)。白桦各器官桦木醇与桦木酸含量均在胸径处于第Ⅱ径级时最高,因此,一次合理的采收可以同时提取各器官桦木醇与桦木酸(图3,图4)。
2.5 生境与径级的交互作用
表1表明,生境因素对白桦树皮桦木醇、树皮桦木酸、树叶桦木酸含量的影响大于径级,且生境与径级的交互作用对其含量影响有所下降。径级因素对白桦树枝桦木醇、树枝桦木酸、树叶桦木醇含量的影响大于生境,且生境与径级的交互作用对白桦树枝桦木酸和树叶桦木醇的影响也下降,但交互作用对白桦树枝桦木醇的影响增大。生境与径级都是影响白桦各器官积累桦木醇与桦木酸的重要因素,在培育及采收时要注意生境及径级对桦木醇与桦木酸积累的影响,选择更适宜的培育白桦的生境及抓住采收的最佳时机进行采收。
2.6 白桦各器官桦木醇与桦木酸Pearson 相关分析
表2中Pearson相关系数反映不同生境下、不同径级白桦各器官中桦木醇与桦木酸含量均呈正相关。对树皮、树枝、树叶各器官中桦木醇与桦木酸含量比较发现,树叶桦木酸与树枝桦木醇、树叶桦木醇呈弱相关性,其他各项两个均呈现较强的相关性。不同生境下,不同径级各器官桦木醇与桦木酸含量变化一致,均呈现正相关性。不同生境、不同径级下白桦各器官桦木醇、桦木酸的积累不相互影响,选择培育白桦的生境及选择采收时间都较为简单,也较准确。
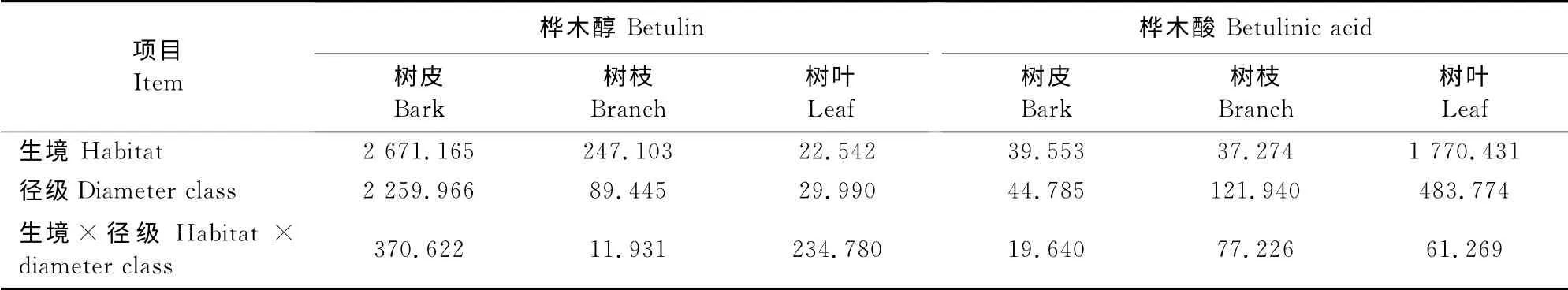
表1 生境与径级的交互作用(F 值)Table 1 The interaction of habitat and size diameter(Fvalue)
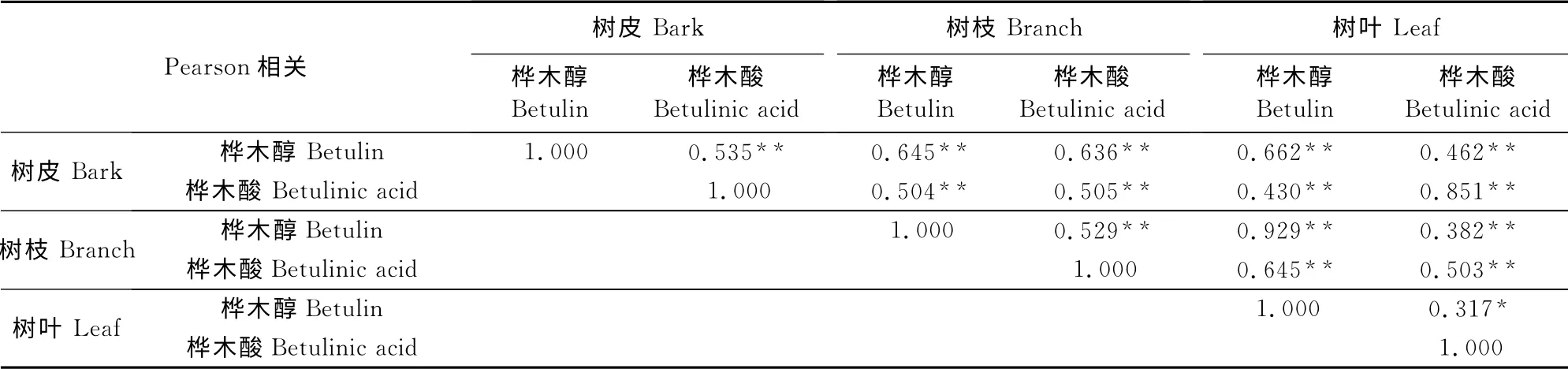
表2 白桦各器官桦木醇和桦木酸的Pearson相关Table 2 The related Pearson of betulin and betulinic acid in different organs of Betula platyphylla
3 讨 论
植物次生代谢是植物在长期繁衍进化过程中与环境相互作用的结果,本研究中,阴坡生境下白桦各器官桦木醇、桦木酸含量显著高于其他3种生境,这可能与水分、光照、温度、养分等环境因素有关,尤其是在干旱的陕北黄土高原,水分可能是影响桦木醇与桦木酸积累的重要因素,而阴坡生境能减少水分蒸发,有利于涵养水源,相比其他生境会水分含量高,因此有利于桦木醇与桦木酸的积累。
研究发现,植物次生代谢产物的积累与地理种源(基因型)有关,不同种源的同种植物,自身生物遗传特性不同,可能影响次生代谢产物的积累[13]。桦木醇与桦木酸及其衍生物作为最有潜力的新型药物制剂,具有广阔的应用前景。范桂芝等[20]以13种8年生白桦种源作为研究对象,指出东北林业大学实验林场的2 个白桦种源白桦树皮桦木醇含量可达257.11和240.36mg/g,王倩[21]也以东北林业大学哈尔滨实验林场白桦为研究对象,指出桦木酸含量在9.32mg~10.57mg,而本实验研究的黄龙山林场白桦树皮中桦木醇含量最高可达85 mg/g,桦木酸为0.8~1.7mg/g,明显比王倩与范桂芝的研究含量少,这可能与不同地区白桦种源不同有关。黄龙山白桦属于天然林,与东北地区白桦地理种源差异大,遗传差异也较大。因此,需要进一步对黄龙山地区白桦和东北地区白桦种源(基因型)加以研究,以期明确较易积累桦木醇与桦木酸的白桦基因型,为白桦资源的合理利用提供依据。
环境因子对次生代谢产物积累也有很大影响,如光照强度、温度、水分、养分等都会对其积累产生影响,研究表明,严重干旱会使产生的光合产物和其他原料非常有限,进而影响次生代谢产物[22-23],范桂芝从东北帽儿山、小北湖、凉水及新疆、内蒙古、宁夏等13个地区取样,所测桦木醇含量基本为严重干旱地区比东北的半湿润地区含量少[20]。温度也是调节植物代谢水平的主要环境因子[23],王倩研究的东北林业大学实验林场所在的黑龙江省年平均气温在4℃~5 ℃之间[24],而黄龙山林区年均温度为8.6℃[15],温度差异较大,这可能也是造成其含量差异的原因。
也有研究表明,土壤养分供应对植物次生代谢产物也有一定的影响,如氮素营养会影响萜类的积累等[25],东北地区土壤有机质含量丰富,陕北黄土高原含量土壤有机质含量较低,这也可能是东北地区白桦生长好,更易积累更多桦木醇与桦木酸的原因。研究还发现,适宜的光照强度也能促进植物同化产物的积累,进而有利于次生代谢产物的合成,东北地区的光照强度与陕北地区差异大可能也是造成两个地区的白桦积累桦木醇与桦木酸含量差异的原因,但目前有关光强对萜类物质影响的研究结果并不一致[13]。
植物次生代谢产物积累受多种因素的综合影响,白桦是东北地区多种地带性植被的先锋类型,东北地区白桦桦木醇、桦木酸含量高可能由于东北地区立地条件更适宜白桦生长[26],此外,植物次生代谢产物积累是一个非常复杂的过程,可能还会受到CO2浓度、环境污染等因素的影响[23-27],因此,造成东北地区白桦与陕北黄土高原白桦各器官桦木醇、桦木酸含量差异的原因还有待进一步研究,以便更高效利用白桦资源。
[1] 任宪威.树木学[M].北京:中国林业出版社,1997:196-197.
[2] YANG D H(杨德浩),YANG M SH(杨敏生),WANG J M(王进茂).Current status of the study on seeds resource and propagation of Betula platyphylla Suk[J].Journal of Agricultural University of Hebei(河北农业大学学报),2003,(26):101-104(in Chinese).
[3] GUO Q Q(郭其强),ZHANG W H(张文辉).Structural characteristics of different Betula platyphyllacommunities in Huanglong Mountain[J].Acta Botanica Boreali-Occidentalia Sinica(西北植物学报),2007,27(1):132-138(in Chinese).
[4] PAVLOVANI,SAVINOVAOV,NIKOLAEVA SN,et al.Antiviral activity of betulin,betulinic and betulinic acids against some enveloped and non-enveloped viruses[J].Fitoterapia,2003,74(5):489-492.
[5] HOU L(侯琳),LEI R D(雷瑞德),WANG D X(王得祥).Niche characteristics of community population of natural Pinus tabulaeformis forests tended by closing in Huanglongshan Mountain[J].Acta Botanica Boreali-Occidentalia Sinica(西北植物学报),2006,26(3):585-591(in Chinese).
[6] ZHANG Y H,YU T,WANG Y.Extraction of betulin from bark of Betula platyphylla Suk by supercritical carbon dioxide extraction[J].Journal of Forestry Research,2003,14(3):202-204.
[7] 李时珍.本草纲目[M].北京:人民卫生出版社,1978:204.
[8] FULDA S,JEREMIAS I,STEINER H H,et al.Betulinic acid:a new cytotoxic agent against malignant brain-tumor cells[J].International Journal of Cancer,1999,82(3):435-441.
[9] OH S H,CHOI J E,LM SC.Protection of betulinic against cadmium-induced apoptosis in hepatma cells[J].Toxicology,2006,220(1):1-12.
[10] FLEKHTER OB,BOREKO EI,NIGMATULLINA LR,et al.Synthesis and antiviral activity of ureides and caramates of betulinic acid and its derivatives[J].Russian J Bioorganic Chem.,2003,29:594-600.
[11] ZUCO V,SUPINO R,RIGHETTI SC,et al.Selective cytotoxicity of betulinic acid on tumor cell lines,but not on normal cells[J].Cancer Lett,2002,175(1):17-25.
[12] SUN I C,CHEN Ch,KASHIWADA Y,WU J H.Anti-AIDS agents 49.synthesis,anti-HIV,and anti-fusion activities of IC9564analogues based on betulinic acid[J].J.Med.Chem.,2002,45(19):4 271-4 275.
[13] LI Y(李 彦),ZHOU X D(周晓东),LOU ZH H(楼浙辉).Review of plant secondary metabolites and the factors that influence its accumulation.[J].Jiangxi Forestry Science and Technology(江西林业科技),2012,3:54-60(in Chinese).
[14] XU J(徐 军),WANG J P(王晋萍),QIAN CH X(钱辰旭),et al.Progress of study on betulinic acid[J].Chinese Bulletin of Life Sciences(生命科学),2011,23(5):503-509(in Chinese).
[15] 张仰渠.陕西森林[M].西安:陕西科学技术出版社,1986:66-67.
[16] WANG SH F(王石发),ZHANG M G(张明光),LI Y P(李艳苹).Study on extraction and purification of betulin from birch bark[J].Chemistry and Industry of Forest Products(林产化学与工业),2007,27(6):16-22(in Chinese).
[17] ZHANG Z(张 泽),SUN H(孙 宏).Determination of betulin content from bark of Betula platyphylla Suk.by HPLC[J].Chemistry and Industry of Forest Products(林产化学与工业),2004,24(1):61-63(in Chinese).
[18] 丁为民,白桦树皮中生物活性物质的提取与利用技术研究[D].哈尔滨:东北林业大学,2010.
[19] LI CH X(李春雪),HUANG Y T(黄雅婷),FAN G ZH(范桂芝).Variation analysis on triterpenoid content in barks of trunk and branch in Betula platyphylla[J].Nonwood Forest Research(经济林研究法),2013,31(1):44-47(in Chinese).
[20] FAN G ZH(范桂芝),ZHAN Y G(詹亚光),WANG B(王 博),et al.Research on difference of betulin content in different parts and provenances of birch(Betula platyphyllasuk.)[J].Chemistry and Industry of Forest Products(林产化学与工业),2007,27(4):103-106(in Chinese).
[21] 王 倩.白桦树皮三萜类物质的分布规律[D].哈尔滨:东北林业大学,2008.
[22] 赵国玲.白桦树皮中活性成分的提取分离及其衍生物的制取研究[D].杭州:浙江大学,2007.
[23] YAN X F(闫秀峰),WANG Y(王 洋),LI Y M(李一蒙),Plant secondary metabolism and its response to environment[J].Acta Ecologica Sinica(生态学报),2007,27(6):2 554-1 562(in Chinese).
[24] 张新颖.黑龙江年鉴[M].哈尔滨:黑龙江年鉴社,2013:66.
[25] COPLEY R R,LETUNIC I,BORK P,et al.Genome and protein evolution in eukaryotes[J].Current Opinion in Chemical Biology,2001,6(1):39-45.
[26] 郑万钧.中国树木志[M].北京:中国林业出版社,1998:2 024-2 026.
[27] SUDHA G,RAVISHANKAR G A.Involvement and interaction of various signaling compounds on the plant metabolic events during defense response,resistance to stress factors formation of secondary metabolites and their molecular aspects[J].Plant Cell Tissue Organ Cult.,2002,71:181-212.
