中频脉冲电流经皮刺激肝区对运动性疲劳大鼠大脑皮质自由基及尼氏体的影响
2015-06-28张佳黄昌林
张佳,黄昌林
中频脉冲电流经皮刺激肝区对运动性疲劳大鼠大脑皮质自由基及尼氏体的影响
张佳,黄昌林
目的 研究中频脉冲电流经皮刺激肝区对大鼠抗运动性疲劳能力及大脑皮质自由基和尼氏体的影响。方法 8周龄Wistar雄性大鼠72只,随机分为安静对照组(CG组)、疲劳训练组(FG组)、运动前刺激组(SBF组)、运动后刺激组(SAF组),每组18只。除CG组外各组均进行游泳训练,建立运动疲劳模型,SBF组和SAF组大鼠分别在游泳前和力竭后进行肝区中频脉冲电流刺激(频率1024Hz,电流强度10mA,间动周期1s,时间20min)。于第1、3、5周末测定各组大鼠的游泳力竭时间,检测大脑皮质中自由基脂质过氧化相关指标,包括总超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、SOD/MDA比值,并观察神经元尼氏体的病理改变。结果 第1周末各组各指标比较差异均无统计学意义。第3周末SAF组大鼠游泳力竭时间明显长于FG组,第5周末SAF组大鼠游泳力竭时间明显长于FG组和SBF组(P<0.05)。第5周末FG组、SBF组SOD、GSH-Px、SOD/MDA明显低于CG组和SAF组,MDA明显高于CG组和SAF组(P<0.05)。神经元尼氏体染色显示,第5周末SAF组大鼠尼氏体数目/相应面积的比值明显高于FG组和SBF组(P<0.01)。结论 中频脉冲电流经皮刺激肝区可有效降低疲劳大鼠大脑皮质的自由基脂质过氧化损伤,减少尼氏体溶解、消失,提高游泳力竭时间,延缓疲劳的发生。
中频脉冲电流;运动性疲劳;大脑皮质;自由基;虎斑小体
延缓疲劳的发生和促进疲劳恢复一直是军事训练医学、运动医学及航天航海医学的研究重点。目前,抗疲劳多采用中药治疗、针灸、艾灸等,在效果上各有不尽如人意之处。本课题组前期研究发现,中频脉冲电流经皮刺激肝区可缓解外周疲劳[1],本研究在此基础上探讨了脉冲电流经皮刺激肝区对大脑皮质自由基和尼氏体的影响,旨在进一步深入了解脉冲电流经皮刺激肝区的抗疲劳作用机制。
1 材料与方法
1.1 实验动物 清洁级8周龄雄性Wistar大鼠72只,体重204±15g,由河南省实验动物中心提供,饲养室温度23±2℃,湿度41%±15%,自然光照,分笼饲养,自由进食水。
1.2 实验方法
1.2.1 动物模型建立及分组 将实验动物随机分为4组:安静对照组(CG组)、疲劳训练组(FG组)、运动前刺激组(SBF组)、运动后刺激组(SAF组),每组18只。CG组不进行任何训练。FG组、SBF组及SAF组大鼠连续5周进行游泳训练,水深60cm,水温31±2℃,每周训练6d,休息1d,游泳2次/d,每次均达到力竭,当大鼠浮在水面不运动时用玻璃棒驱赶,维持其运动状态,力竭标准为大鼠下沉后10s不能游回水面[2]。SBF组大鼠在游泳前、SAF组大鼠在游泳力竭后腹腔注射盐酸氯胺酮0.25g/kg麻醉,然后行经皮肝区中频脉冲电流刺激,脉冲电流刺激频率为1024Hz,电流强度为10mA,间动周期为1s,时间为20min,2次/d。
1.2.2 标本制备及指标检测 分别在第1、3、5周训练的最后1d测定FG组、SBF组和SAF组大鼠的游泳力竭时间。在第1、3、5周的休息日各组大鼠采取氯胺酮0.25g/kg腹腔注射麻醉后分批断头处死,立即开颅,在冰盘上迅速剥取大脑皮质,用冰冷的生理盐水漂洗,滤纸吸干,一部分–80℃冰箱中保存,一部分用甲醛溶液固定,石蜡包埋。测试前用剪刀剪下0.6~0.9g大脑皮质组织,按1:9(质量分数)加入4℃生理盐水,眼科小剪剪碎组织块,超声匀浆,制成质量分数为10%的脑组织匀浆液,3000r/min低温离心10min,取上清液于样品管中,用于测定相关指标。总超氧化物歧化酶(SOD)采用黄嘌呤氧化酶法测定,丙二醛(MDA)采用硫代巴比妥酸(TBA)法测定,谷胱甘肽过氧化物酶(GSH-Px)采用化学比色法测定,所用试剂盒均由南京建成生物工程研究所提供,具体操作严格按说明书进行。
1.2.3 尼氏体焦油紫染色 取大鼠大脑皮质组织,常规石蜡包埋、切片、脱蜡,双蒸水水化3min,焦油紫室温避光染色30min,水洗,95%乙醇分化,二甲苯透明,中性树胶封固,光镜下观察,并采用Image-Pro Plus图像分析软件对尼氏体数目/相应面积的比值进行分析。
1.3 统计学处理 采用SPSS 18.0进行统计分析,数据结果以±s表示,组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
表1 各组大鼠游泳力竭时间的比较(min,±s,n=6)Tab. 1 Exhausted swimming time of rat in every group (min,±s, n=6)
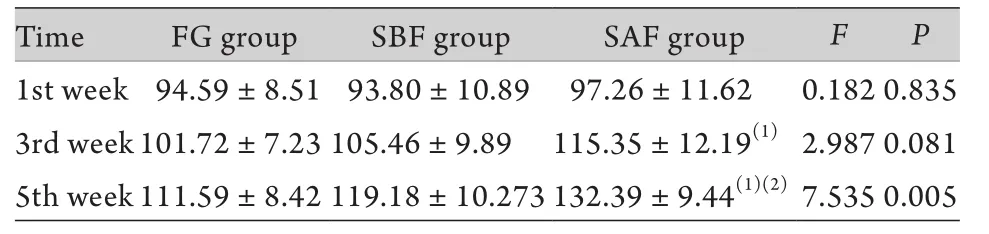
表1 各组大鼠游泳力竭时间的比较(min,±s,n=6)Tab. 1 Exhausted swimming time of rat in every group (min,±s, n=6)
(1)P<0.05 compared with FG group; (2)P<0.05 compared with SBF group
?
2.2 中频脉冲电流经皮刺激肝区对大鼠大脑皮质自由基脂质过氧化的影响 第1周末各组SOD、MDA、GSH-Px及SOD/MDA比值差异无统计学意义(P>0.05)。第3周末FG组、SBF组、SAF组SOD 及SOD/MDA比值明显低于CG组,FG组MDA明显高于CG组,FG组和SBF组GSH-Px明显低于CG组(P<0.05,P<0.01),其余各组间比较差异无统计学意义(P>0.05)。第5周末FG组和SBF组的SOD、GSH-Px及SOD/MDA比值明显低于CG组和SAF组(P<0.01),而FG组与SBF组比较、CG组与SAF组比较差异无统计学意义(P>0.05),FG组和SBF组的MDA明显高于CG组(P<0.05,P<0.01),且SAF组的MDA明显低于FG组(P<0.05),其余各组间比较差异无统计学意义(P>0.05,表2)。
2.3 尼氏体染色后光镜下观察结果及定量分析CG组、SAF组可见许多形态结构较规则的块状(形如虎斑)或颗粒状尼氏小体;FG组、SBF组神经元胞质内尼氏体逐渐溶解或消失,数目减少,细胞排列紊乱、极不规则,部分神经元缺失,胞核和胞质分界不明显,以第5周末较为明显(图1)。
表2 各组大鼠SOD、MDA、GSH-Px、SOD/MDA比较(±s,n=6)Tab. 2 Comparison of SOD, MDA, GSH-Px and SOD/MDA of rats in each group (±s, n=6)
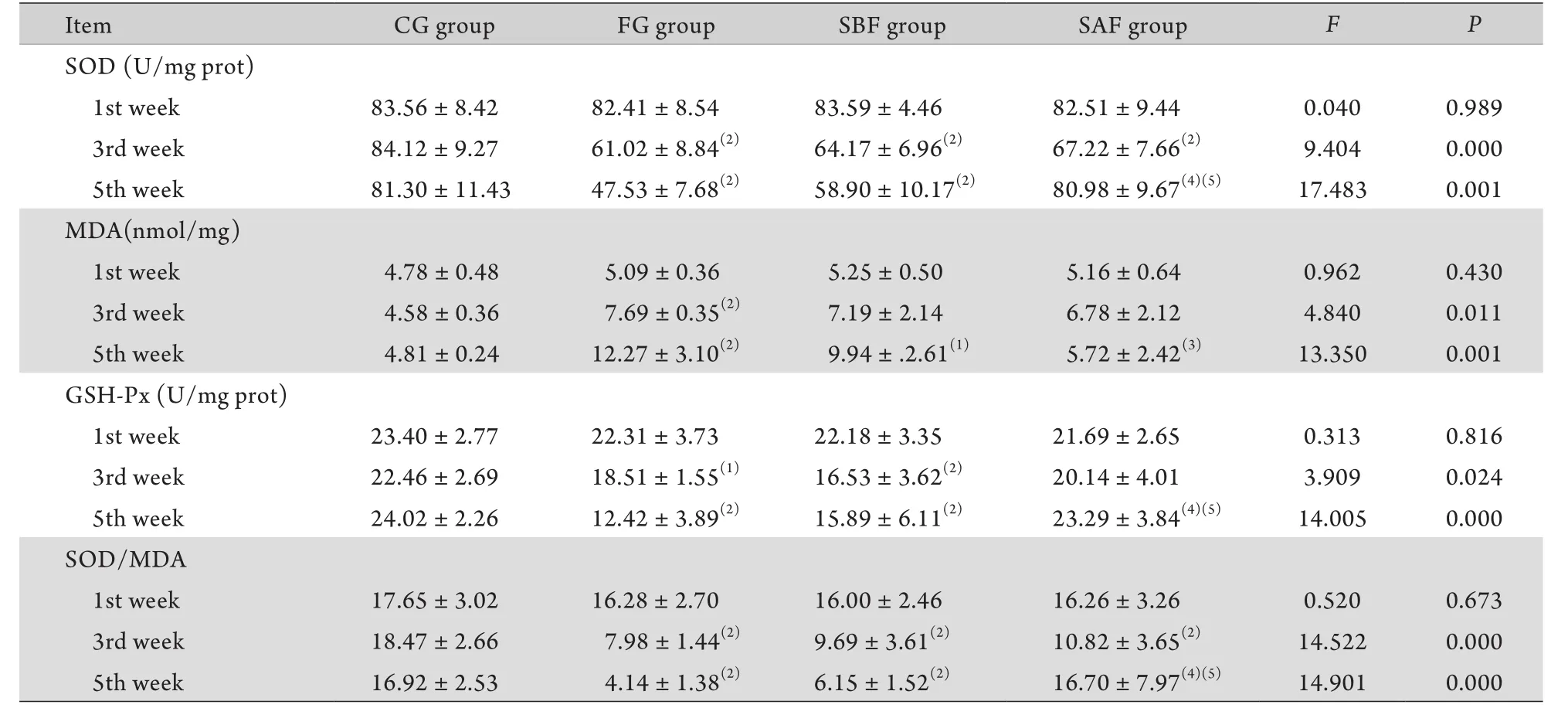
表2 各组大鼠SOD、MDA、GSH-Px、SOD/MDA比较(±s,n=6)Tab. 2 Comparison of SOD, MDA, GSH-Px and SOD/MDA of rats in each group (±s, n=6)
(1)P<0.05, (2)P<0.01 compared with CG group; (3)P<0.05, (4)P<0.01 compared with FG group; (5)P<0.01 compared with SBF group
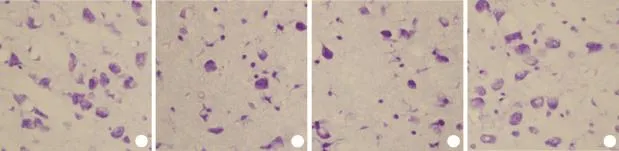
图1 第5周末各组大鼠大脑皮质神经元尼氏体焦油紫染色观察(×400)Fig. 1 The cortical neuron Nissl body at the fifth weekend (Cresyl viollet stainning ×400)
采用Image-Pro Plus软件进行分析显示,FG组、SBF组尼氏体数目/相应面积的比值于第3周末开始减少,到第5周末更为明显,与CG组及SAF组比较差异有统计学意义(P<0.01,图2)。
3 讨 论
长期或剧烈运动可导致中枢神经系统稳态失调,损伤脑动力,引发中枢性疲劳[3]。中枢性疲劳不能仅用肌肉本身的功能紊乱来解释,同时还与中枢神经系统特异性的功能改变有关[4]。
力竭时间是机体抗应激、抗疲劳等多种能力的综合体现,是衡量机体运动能力的重要直接指标,目前研究中多用大鼠开始游泳至力竭所用时间反映大鼠的力竭运动能力[5]。杨东升等[6]研究发现力竭运动所致外周持续低血糖可能是中枢能量代谢紊乱的原因之一。McKonna等[7]发现中枢神经系统电生理功能的实现依赖于脑的能量代谢,中枢能量物质葡萄糖和乳酸是保证神经元正常电生理活动的物质基础,对于维持神经元的膜电位、复合动作电位及突触功能的完整性均起重要作用。此外在运动时血液的重新分布会导致肝脏等内脏器官血供减少,影响肝脏组织的结构和功能,导致运动性疲劳的发生。本研究结果表明,疲劳后中频脉冲电刺激肝区有助于延长大鼠的力竭时间,延缓疲劳的发生,其作用机制可能为:①脉冲电流刺激肝区促进肝脏糖异生,使外周血糖升高;②脉冲电流刺激肝区导致肝血流量相对增加,延缓了疲劳的发生。
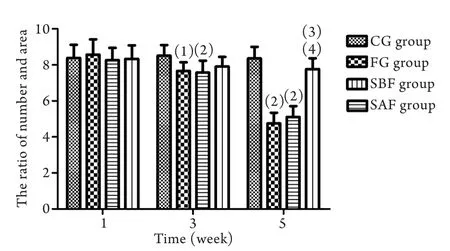
图2 各组大鼠大脑皮质神经元尼氏体数目/相应面积比值分析Fig. 2 A ratio of number/corresponding area of the cortical neuron Nissl body of rats
在正常情况下体内自由基的产生和清除处于一个动态平衡状态[8]。SOD、GSH-Px是机体清除氧自由基的重要抗氧化酶,对机体的氧化与抗氧化平衡起着至关重要的作用,其活力的高低间接反映了机体清除氧自由基的能力。MDA是细胞脂质过氧化的一种主要产物,其浓度是膜脂质过氧化损害程度的标志,大量MDA可使神经元变性坏死,对脑组织有直接的损害作用,测定MDA浓度可间接反映氧自由基的水平及氧自由基对细胞的损伤程度[9-10]。SOD/MDA比值是反映机体组织细胞潜在抗氧化能力的重要参数,该比值升高表示组织细胞抗氧化能力相对增强或MDA生成量相对减少,降低则表示组织细胞抗氧化能力相对减弱或MDA生成量相对增多。力竭运动时,氧自由基大量产生,同时机体内的自由基防御系统如SOD、GSH-Px等酶活力下降[11],不足以清除过量的自由基,大量的氧自由基广泛攻击富含不饱和脂肪酸的神经元膜和微血管,引起脂质过氧化“瀑布状”的连锁反应和微循环障碍,致使大量神经元受损[12]。脑是机体氧消耗最多的器官之一,氧代谢过程中可产生少量的氧自由基,同时脑组织富含脂质,氧自由基对不饱和共价键有一种特殊的亲和力,最容易攻击生物膜磷脂中的不饱和脂肪酸,引发生物膜的脂质过氧化反应[13-14],破坏生物膜的完整性和流动性,导致胞内Ca2+严重超负荷,线粒体和三磷腺苷含量明显减少,进而使运动冲动发放减弱,大脑分析、综合能力下降,并产生各种感觉障碍,还可导致心理应激增强、不良情绪增多,阻碍运动成绩的发挥。Metin等[15]研究发现递增负荷运动可使脂质过氧化产物大量增加,进而使膜的流动性、通透性和兴奋性降低,引起细胞肿胀和组织炎症,从而导致疲劳。本研究结果表明,中频脉冲电流经皮刺激肝区可提高疲劳大鼠大脑皮质的SOD、GSH-Px酶活力及SOD/MDA比值,同时降低MDA含量。其作用机制可能为:①激活机体内源性的抗氧化防御系统;②加速体内不饱和脂肪酸的氧化;③提高肝脏氧化呼吸链酶复合物活性水平;④脉冲电流刺激具有兴奋中枢神经元细胞的作用[16]。
尼氏体特异性地分布于神经元胞体和树突,电镜观察显示其由粗面内质网、游离核糖体和多核糖体构成,是神经元合成蛋白质最活跃的部位,尼氏体溶解或消失是神经元受损的表现[17]。本研究结果显示,力竭运动大鼠大脑皮质尼氏体溶解或消失,提示尼氏体是对疲劳所致自由基损伤较为敏感的细胞器,而疲劳后中频脉冲电流经皮刺激肝区可以减轻大鼠大脑皮质尼氏体的减少,对中枢神经细胞具有保护作用。
小任务的实施随课文讲解的进度进行,教师不会专门留出时间进行。如在进行课文导入时,领取了导入任务的两组学生分别进行展示,负责资料查询的两位学生分别将搜集好的钱学森和乔布斯的生平、成就、贡献等进行汇报,另一组同学分别提出一些与主题相关的问题并组织全班进行讨论,如他们是如何实现梦想的?经历了哪些困难?给我们带来哪些启发?
综上所述,中频脉冲电流经皮刺激肝区可提高疲劳大鼠的力竭时间,促进自由基清除,减少自由基及其引发的脂质过氧化对大脑皮质的氧化损伤和对神经元尼氏体的破坏,具有抗中枢性疲劳的作用。
[1]Huang CL, Zhu LG. Anti-fatigue effect of percutaneous stimulation with different frequency pulse current on hepatic region: an experimental study with rats[J]. Med J Chin PLA, 2009, 34(6): 740-742.[黄昌林, 朱履刚. 不同频率脉冲电流经皮刺激大鼠肝区增强抗疲劳能力的实验研究[J]. 解放军医学杂志, 2009, 34(6): 740-742.]
[2]Kanter MM. Free radicals exercise and antioxidant supplementation[J]. Int J Sport Nutr, 1994, 4(3): 205-206.
[3]Nybo L, Secher NH. Cerebtal perturbations provoked by prolonged exercise[J]. Prog Neurobiol, 2004, 72(4): 223-261.
[4]Davis JM, Bailey SP. Possible mechanism of central nervous system fatigue during exercise[J]. Med Sci Sports Exerc, 1997, 29(1): 45-57.
[5]Voces J, Alvarez AI, Vila L, et al. Effects of administration of the standardized Panax ginseng extract G115 on hepatie antioxidant function after exhaustive exercise[J]. Comp Biochem Physiol C Pharmacol Toxicol Endocrinol, 1999, 123(2): 175-184.
[6]Yang DS, Liu XL, Qiao DC. Exhaustion movement process of glucose/lactic acid metabolism in rat striatum real-time observation[J]. Chin J Sports Med, 2009, 28(4): 384-387.[杨东升, 刘晓莉, 乔德才. 力竭运动过程中大鼠纹状体葡萄糖/乳酸代谢的实时观察[J]. 中国运动医学杂志, 2009, 28(4): 384-387.]
[7]McKenna MC, Hopkins IB, Carey A. Alpha-cyano-4-hydroxycionamate decreasesboth glucose and lactate metabolism in neurons and astrocytes: implication for lactate as all energysubstrate for neurons[J]. J Neurosci Res, 2001, 66(5): 747-754.
[8]Husain K, Somani SM. Response of cardiac antioxidant system to alcohol and exercise training in the rat[J]. Alcohol, 1997, 14(3): 301-307.
[9]Fan LH, Wang KZ, Cheng B, et al. Anti-apoptotic and neuroprotective effects of Tetramethylpyrazine following spinal cord ischemia in rabbits[J]. BMC Neurosci, 2006, 7: 48.
[10] Abd-Elghaffar SKh, El-Sokkary GH, Sharkawy AA. Aluminuminduced neurotoxicity and oxidative damage in rabbits:protective effect of melatonin[J]. Neuro Endocrinol Lett, 2005, 26(5): 609-616.
[11] Dai PY, Huang CL. Influence of percutaneous stimulation of hepatic region with mid-frequency pulse current on the activity of serum GSH-PX, SOD, T-AOC and the content of malondialdehyde in exercise-induced fatigued soldiers[J]. Med J Chin PLA, 2014, 39(3): 245-248. [代朋乙, 黄昌林. 中频脉冲电流经皮刺激运动性疲劳士兵肝区对血清GSH-PX、SOD、T-AOC活性及MDA含量的影响[J]. 解放军医学杂志, 2014, 39(3): 245-248.]
[12] Yoshiha S, Abe K, Basto R, et al. Influence of transient ischemia on lipidsoluble antioxidants, free fatty acid and energy metabolites in rat brain[J]. Brain Res,1982, 2(5): 245-307.
[13] Selamoglu Talas Z, Ozdemir I, Yilmaz I, et al. The investigation of the antioxidative properties of the novel synthetic organoselenium compounds in some rat tissues[J]. Exp Biol Med (Maywood), 2008, 233(5): 575-579.
[14] Devrim E, Cetin M, Namuslu M, et al. Oxidant stress due to non ionic low osmolar contrast medium in rat kidney[J]. Indian Med Res, 2009, 130(4): 433-436.
[15] Metin G, Atukeren P, Alturfan AA, et al. Lipid peroxidation, erythrocyte superoxide-dismutase activity and trace metals in young male footballers[J]. Yonsei Med J, 2003, 44(6): 979-986.
[16] Zheng Yu, Cai D, Wang JH, et al. Effect of pulse magnetic field on distribution of neuronal action potential[J]. Acta Physiologica Sinica, 2014, 66(4): 438-448.[郑羽, 蔡迪, 王金海, 等. 脉冲磁场对神经元动作电位发放的影响[J]. 生理学报, 2014, 66(4): 438-448.]
[17] Paul CA, Beltz B, Berger-Sweeney J. The nissl stain: a stain for cell bodies in brain sections[J]. CSH Protoc, 2008, 2008: pdb. prot4805.
Effects of percutaneous midband pulse current stimulation in hepatic region on free radical and nissl bodies in cerebral cortex of rats with exercise-induced fatigue
ZHANG Jia1, HUANG Chang-lin2*1Institute of Traumatic Orthopedics, Xijing Hospital, Fourth Military Medical University, Xi'an 710032, China
2Institute of Military Training Related Medical Sciences, 150 Hospital of PLA, Henan, Luoyang 471031, China
*
, E-mail: huangchanglin1945@263.net
This work was supported by the Health and Disease Prevention and Control Applied Research Program of Military Program (13BJYZ14)
ObjectiveTo investigate the effects of percutaneous midband pulse current stimulation in hepatic region on anti-exercise fatigue ability and the free radicals and nissl bodies in cerebral cortex tissue of rats with exercise-induced fatigue.MethodsSeventy-two 8-week old male Wistar rats were randomly divided into 4 groups (18 each): control group (CG), fatigue group (FG), stimulation before fatigue group (SBF) and stimulation after fatigue group (SAF). Animals in FG, SBF and SAF group were used to reproduce the swimming-exhaustion models. Midband current stimulation (1024Hz, 10mA, current cycle 1sec) for 20 minutes was given to the rats of group SBF before swimming, and to those in group SAF after exhaustion. At the weekend of the 1st, 3rd and 5th week after modeling, the exhaustive swimming time of rats in all but CG group was observed. Cerebral cortex tissue was harvested for the estimation of the level of lipid peroxidation, including SOD, MDA, GSH-Px and SOD/MDA, and the histopathological changes in nissl bodies in neurons were observed.ResultsAt the 1st weekend after modeling, no significant difference was found in all the indexes among the 4 groups, while at the 3rd weekend, the exhaustive time was obviously longer in SAF group than in FG group, and also in SAF group than in FG and SBF group at the 5th weekend (P<0.05). At the 5th weekend, the SOD and GSH-Px levels and SOD/MDA contents were obviously lower in FG and SBF group than in CG and SAF group, andthe MDA content was obviously higher in FG and SBF group than in CG and SAF group (P<0.05). As regarding the nissl bodies in neurons, it is observed that the ratio of number/area was obviously higher in SAF group than in FG and SBF group at the 5th weekend (P<0.01).ConclusionPercutaneous stimulation of hepatic region with midband pulse current can effectively reduce the lipid peroxidation damage of cerebral cortex tissue and decrease the dissolution and loss of nissl bodies in fatigued rats, prolong the exhausting exercise time, and postpone the development of fatigue.
mid-frequency pulse current; exercise-induced fatigue; cerebral cortex; free radicals; Nissl bodies
R333.4;R972.7
A
0577-7402(2015)04-0331-05
10.11855/j.issn.0577-7402.2015.04.16
2014-09-22;
2015-03-05)
(责任编辑:胡全兵)
2013年度部队卫生和疾病防控应用性研究课题计划(13BJYZ14)
张佳,硕士研究生。主要从事骨科及军事训练损伤的基础与临床研究
710032 西安 第四军医大学西京医院全军创伤骨科研究所(张佳);471031 河南洛阳 解放军150医院全军军事训练医学研究所(黄昌林)
黄昌林,E-mail:huangchanglin1945@263.net
