CD25siRNA纳米粒抑制大鼠高危角膜移植免疫排斥的实验研究
2015-06-28石韵洁秦琴赵敏
石韵洁,秦琴,赵敏
CD25siRNA纳米粒抑制大鼠高危角膜移植免疫排斥的实验研究
石韵洁,秦琴,赵敏
目的 探讨EntransterTM-CD25siRNA纳米粒对大鼠高危角膜移植术后免疫排斥反应的抑制及延长角膜植片存活时间的作用。方法 以SD大鼠为受体(n=96),Wistar大鼠为供体(n=48)。受体右眼碱烧伤后14d行穿透性角膜移植手术。术后将大鼠随机分为阴性对照组(A组)、对照siRNA治疗组(B组)、治疗1组(C组,术后2h给予EntransterTMCD25siRNA复合物点眼)、治疗2组(D组,术后2h和术后第7天给予EntransterTM-CD25siRNA复合物点眼),每组24只。裂隙灯下观察大鼠角膜情况并对其排斥反应进行评分,HE染色检测角膜组织病理学变化,透射电镜观察植片超微结构改变,免疫组化和荧光定量PCR法检测角膜CD25的表达。结果 与A、B组比较,C、D两组角膜植片存活时间明显延长,差异有统计学意义(P<0.05)。HE染色显示A、B组角膜植片增厚、水肿,胶原纤维排列紊乱,大量炎性细胞浸润;C、D组植片排斥程度较A、B组明显减轻。免疫组化染色显示各组角膜上皮层、基质层、内皮层均有CD25表达,且在A、B组中的表达明显多于C、D组。透射电镜观察显示C、D组角膜植片基质层成纤维细胞凋亡及坏死较A、B组减轻,超微结构改变具有明显差异。荧光定量PCR检测显示A、B两组角膜植片中CD25 mRNA的表达明显高于C、D组,差异有统计学意义(P<0.05)。结论 CD25siRNA纳米粒可减轻角膜移植术后的免疫排斥反应并有效延长角膜植片存活时间。
角膜移植;移植物排斥;纳米结构;白细胞介素2受体α亚单位
角膜移植是成功率最高的器官移植术[1],也是目前角膜盲患者复明的唯一手段,但高危角膜移植术后仍可发生免疫排斥反应,是角膜移植术失败的主要原因[2]。角膜移植免疫排斥反应是一个多因素参与的调节过程,T淋巴细胞激活是其中心环节,而作为T淋巴细胞的主要膜蛋白,白细胞介素2受体α (CD25)的表达则是T 细胞活化的关键环节[3]。为了解CD25可否减轻高危角膜移植术后的免疫排斥反应,本研究制备了CD25siRNA,并与新型纳米载体EntransterTM相连接,对实验大鼠高危角膜移植术后的植片进行观察,旨在为高危角膜移植术后免疫排斥反应的临床治疗提供依据。
1 材料与方法
1.1 实验动物及分组 以健康SPF级SD大鼠96只作为受体,Wistar大鼠48只作为供体。供、受体均为雌性,8~10周龄,体重160~180g,裂隙灯检查未见异常,由重庆医科大学动物实验中心提供。实验方法符合动物伦理学要求。
碱烧伤模型的制备[4]:受体大鼠用1%戊巴比妥钠(40mg/kg)腹腔注射麻醉,将直径3mm的圆形滤纸在1mol/L NaOH中充分浸透20s,取出滤纸,吸除滤液,贴于大鼠右眼角膜中央烧灼25s。移去滤纸后,立即用大量生理盐水冲洗结膜囊,0.25%氯霉素滴眼液点眼。2周后随机选择3个以上象限有新生血管且新生血管达到角膜中央的大鼠行穿透性角膜移植术。
高危角膜移植模型的建立:参照Williams等[5]的方法,受体选择右眼手术,供体提供双眼角膜。术前15min用复方托吡卡胺滴眼液充分散瞳,盐酸奥布卡因滴眼液表面麻醉。于显微镜下进行手术,环钻钻取角膜,植片直径3.5mm,植床直径3.0mm,以10-0尼龙线间断缝合8针,线结暴露不包埋。术中严格无菌操作。术后注入粘弹剂形成前房,结膜下注射庆大霉素0.2万单位,涂红霉素眼膏。
纳米试剂的制备:按照英格恩EntransterTM转染试剂(北京英格恩生物科技有限公司)说明书,配制EntransterTM-CD25siRNA复合物(纳米试剂Ⅰ,60μl体系)。按相同比例配制EntransterTM-control CD25siRNA复合物(纳米试剂Ⅱ)和生理盐水。CD25siRNA由上海吉玛制药技术有限公司合成,基因序列为:正义5'-GAGGUUUCCGAAGACUGAATT-3',反义5'-UUCAGUCUUCG GAAACCUCTT-3'。
实验分组:通过完全随机分组设计方案把受体大鼠分为4组,每组24只。A组为阴性对照组,术后2h给予生理盐水点眼。B组为对照siRNA治疗组,术后2h给予纳米试剂Ⅱ点眼。C组为治疗1组,术后2h给予纳米试剂Ⅰ点眼。D组为治疗2组,除了术后2h给予纳米试剂Ⅰ点眼外,术后第7天再次用纳米试剂Ⅰ点眼。术后每日用0.25%氯霉素滴眼液抗感染,每日3次,直至受试结束。
1.2 裂隙灯显微镜观察大鼠角膜情况 自术后第1天起受体大鼠每日在裂隙灯下进行临床观测,以混浊、水肿和新生血管3项指标进行评分,参照Holland等[6]的评分标准,以3项评分之和作为当日的排斥反应指数(rejection index,RI),RI≥6时视为发生排斥反应。术后5d内有严重前房出血、广泛虹膜前粘连、晶状体混浊、植片感染者剔除,并补充例数。
1.3 植片的组织病理学观察 术后第3、10、14、21天各组随机处死1只大鼠,术眼取材,4%多聚甲醛固定,常规石蜡包埋,5μm切片,HE染色后光镜下观察。
1.4 植片超微结构检查 术后第3、10、14、21天各组随机处死1只大鼠,取完整眼球,置于2.5%戊二醛固定过夜,取角膜中央切削区1mm×1mm大小的组织环氧树脂包埋后制作超薄切片,透射电子显微镜下观察。
1.5 免疫组化染色检测CD25表达 术后第3、7、14、21天各组随机处死1只大鼠,术眼取材,固定包埋,5μm切片后固定于有明胶的载玻片上。用3%H2O2灭活内源性过氧化物酶,山羊血清封闭10min后滴加兔抗大鼠CD25单克隆抗体(Abcam公司,英国),4℃过夜,阴性对照用PBS代替一抗。PBS洗涤后加生物素化山羊抗兔IgG(武汉博士德生物工程有限公司),滴加辣根过氧化物标记的链霉卵白素,二氨基联苯胺显色,苏木素复染,光镜下观察。
1.6 实时荧光定量PCR检测植片中CD25 mRNA的表达 术后第3、7、14、21天各组随机处死3只大鼠取其角膜。采用Trizol试剂盒(Invitrogen公司,美国)提取总R NA,反转录试剂盒(大连TakaR a生物工程有限公司)合成cDNA。采用 SYBR Green Ⅰ实时荧光定量PCR检测角膜中CD 2 5 m R N A的表达。所用引物由上海生工有限公司合成,序列如下:G A P D H上游5'-CAAGGTCATCCATGACAACTTTG-3',下游5'-GGGCCATCCACAGTCTTCTG-3';CD25上游5'-GAGGAAGAGCAGAAGAAC-3',下游5'-GTCTCGGGACTTCATAAC-3'。采用10μl反应体系,反应程序如下:95℃预变性10min;95℃变性30s,60℃退火及延伸45s,共40个循环。结果以2–ΔΔCt表示,以GAPDH值为内参照。
1.7 统计学处理 采用SPSS 17.0软件进行统计分析,数据结果以±s表示,组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。角膜植片生存曲线采用Kaplan-Meier法绘制。P<0.05为差异有统计学意义。
2 结 果
2.1 各组角膜移植术后植片的一般情况 因前房出血、白内障及术后植片感染导致手术失败6只眼,排除在外,同时补充相应例数。角膜移植术后4d,各组角膜植片均透明,有轻度水肿,角膜缘可见火焰状细小新生血管长入。术后5~9d,对照组(A组和B组)表现为植片高度混浊水肿、明显增厚,大量新生血管长入植片,术后10d左右植片发生免疫排斥反应(图1A、B),治疗组(C组和D组)排斥反应的发展相对缓慢,表现为进行性混浊、水肿加重,新生血管由植床逐渐长入植片(图1C、D),于术后14d左右发生排斥反应。之后植片的混浊、水肿逐渐减轻,新生血管充盈减轻。
2.2 各组植片的存活时间及生存曲线 C组和D组的角膜存活时间(分别为12.75±1.71、13.67±1.07d)均明显长于A、B组(分别为8.9 2±1.4 4、8.42±1.56d),差异有统计学意义(P=0.00),而A组和B组、C组和D组之间植片存活时间比较差异无统计学意义(P>0.05,图2)。

图1 术后第10天各组大鼠角膜裂隙灯图像Fig. 1 Rat corneas on day 10 after transplantation observed under the slim lamp microscope

图2 各组角膜植片生存曲线图Fig. 2 Survival curves of the corneal graft in 4 groups
2.3 术后14d角膜排斥反应指数比较 术后14d时A组和B组角膜水肿、混浊及新生血管比C、D组更为明显。C组和D组角膜排斥反应指数均明显低于A、B组,差异有统计学意义(P<0.01),而A组与B组、C组与D组植片角膜排斥反应指数比较差异均无统计学意义(P>0.05,表1)。
表1 各组术后14d角膜植片排斥反应指数比较(±s,n=12)Tab. 1 Corneal graft rejection index (RI) on day 14 after transplantation (±s, n=12)

表1 各组术后14d角膜植片排斥反应指数比较(±s,n=12)Tab. 1 Corneal graft rejection index (RI) on day 14 after transplantation (±s, n=12)
(1)P<0.01 compared with group A; (2)P<0.01 compared with group B
?
2.4 各组角膜植片组织病理学检查结果 HE染色显示,移植术后10d,对照组(A组和B组)角膜植片明显增厚,角膜基质水肿,胶原纤维排列紊乱,可见大量炎性细胞浸润,大量新生血管(黑色箭头示)长入,内皮细胞基本未见;治疗组(C组和D组)植片未见明显增厚,胶原纤维排列较规则,未见明显炎性细胞浸润等排斥反应改变(图3)。术后14d,治疗组均有炎性细胞浸润,新生血管长入,发生排斥反应。排斥后期,植片中的炎性细胞数量、水肿及新生血管充盈都较排斥期减轻。
2.5 各组角膜植片超微结构改变 透射电镜观察显示,术后3d各组角膜各层排列整齐,角膜表层可见短小的微绒毛,上皮、基质及内皮均未见细胞凋亡特征(图4A),B、C组内皮层有少量空泡(图4B)。术后10d,A、B组植片上皮细胞明显水肿,间隙增宽,基质层胶原纤维排列紊乱,大量炎性细胞浸润,可见新生血管,成纤维细胞核浓缩,核膜不清,内皮细胞大量坏死,可见细胞凋亡与坏死并存的特征(图4C、D);C、D组植片上皮细胞水肿,少量炎性细胞浸润,基质细胞及内皮细胞未见水肿、坏死等征象(图4E)。术后14d,A、B组胶原纤维增生较术后10d明显,排列紊乱(图4F);C组部分基质层成纤维细胞体积缩小,胞核固缩,染色质边集,细胞器超微结构不清,胶原纤维增生、排列稍紊乱(图4G);D组基质层成纤维细胞超微结构欠清晰,胶原纤维少量增生、排列稍紊乱(图4H)。

图3 术后10d角膜植片病理组织学改变(HE ×200)Fig. 3 Histopathologic image of corneal graft on day 10 after transplantation (HE ×200)
2.6 角膜植片中CD25蛋白及mRNA的表达 免疫组化染色显示,术后3d各组角膜上皮可见少量CD25阳性表达,基质层和内皮层未见CD25表达;术后7d对照组(A组和B组)角膜上皮及基质层有少量CD25表达;术后14d对照组角膜各层均可见CD25强阳性表达,较同时间点治疗组(C组和D组)表达量明显增多(图5)。实时荧光定量PCR检测结果显示,CD25 mRNA表达水平在术后逐渐升高,于14d达到高峰,然后逐渐下降。治疗组CD25 mRNA表达水平与同时间点对照组比较明显降低,差异有统计学意义(P<0.05,图6)。
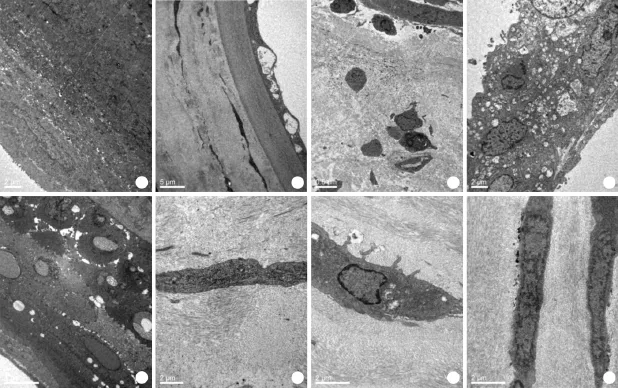
图4 各组角膜植片超微结构改变(透射电镜)Fig. 4 Ultrastructural changes of the corneal grafts (TEM)
3 讨 论
正常角膜中无血管和淋巴管,处于相对的“免疫赦免”状态。然而,碱烧伤后可诱发角膜新生血管和新生淋巴管,并在烧伤后2周达到高峰,从而破坏角膜的“免疫赦免”状态[7],导致高危角膜移植术的成功率低于35%[8]。因此,抑制免疫排斥反应是提高角膜移植成功率的关键因素。研究发现,T细胞尤其是CD4+T细胞在角膜移植排斥反应中发挥重要作用[9],IL-2和IL-2R是介导其增殖和分化的关键因素。IL-2R由α、β、γ三条链组成,静息的T细胞表面组成性表达IL-2R的β和γ链,对IL-2亲和力低,T细胞活化后,CD25快速表达,与β和γ链共同形成三聚体,对IL-2有高亲和力[10]。CD25的表达是T细胞活化和免疫反应启动的重要标志[3]。目前CD25抑制免疫排斥反应已在肝肾移植中发挥了重要作用[11],但其在防治角膜移植免疫排斥方面的报道鲜见。

图5 各组角膜植片中CD25表达(IHC ×400)Fig. 5 Expression of CD25 in the corneal graft after transplantation(IHC ×400)
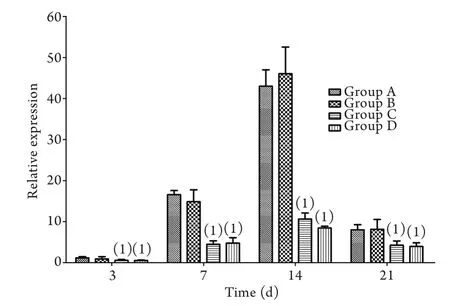
图6 各组角膜植片中CD25 mRNA的表达Fig. 6 Expression of CD25 mRNA in the corneal graft after transplantation
siRNA是RNA干扰发挥效应的关键分子,可高效、特异地抑制靶基因的表达,实现转录后的基因沉默[12]。本课题组为克服前期实验采用慢病毒载体[13]毒副作用大的弱点,改用EntransterTM纳米载体将siRNA包裹在其中,可阻止核酸酶在体内的降解,同时具有缓释作用,克服了siRNA本身易被降解和吞噬的弱点[14]。同时EntransterTM纳米载体在前期大量研究(大鼠脑缺血损伤模型[15]、CVB3感染小鼠模型[16]、小鼠哮喘模型[17])中均表现出安全高效的转染优势。
本研究发现,CD25siRNA纳米粒治疗组术后植片的存活率明显高于对照组,且CD25siRNA纳米粒能够延缓排斥反应的发生。其原因可能是CD25siRNA纳米粒降解了同源CD25 mRNA,使IL-2R无法形成高亲和力三聚体,在一定程度上阻断了T细胞的活化。组织病理学检查也发现CD25siRNA可使植片中炎性细胞的浸润程度明显减轻,提示CD25的下调可在一定程度上减轻植片的炎症反应,从而抑制排斥反应的发生。笔者认为,CD25siRNA降低CD25(Th1)表达的同时,上调了IL-10等因子(Th2)的表达,而IL-10是重要的细胞因子合成抑制因子,可抑制促炎细胞因子的分泌,减轻炎症反应和组织破坏[18]。为探讨在角膜排斥反应开始发生时,CD25siRNA再次巩固治疗是否有效,本研究在术后7d时再次给药,结果显示在植片存活时间和CD25表达水平上,术后单次给药和术后7d再次给药两组差异并无统计学意义。这不仅证实了角膜排斥反应早期干预的必要性和有效性,也揭示了CD25主要在早期参与诱导排斥反应的发生。透射电镜观察显示在C组和D组,治疗基因有一过性细胞毒性,但毒性甚小,表现为术后3d内皮细胞少量水肿,基质细胞未见水肿,之后恢复正常。大量研究表明,角膜免疫排斥高峰期有细胞凋亡与坏死并存的特征[19],炎性细胞的浸润程度也与排斥反应程度呈正相关,本实验结果也证实了这个观点。在植片存活期间,成纤维细胞增生有助于胶原纤维重塑,但胶原纤维排列紊乱会加速植片的免疫排斥。本研究结果显示,CD25siRNA纳米粒可在超微结构水平上改变胶原纤维的排列,减少成纤维细胞的凋亡与坏死,从而延长植片存活时间,术后7d再次给予基因治疗的效果更为确切。
本研究中CD25siRNA纳米粒治疗虽然可以延长角膜植片的存活时间,但不能完全抑制角膜的免疫排斥反应,其原因可能是由于IL-2R中α链缺乏,CD25通路被阻断,β和γ链的作用也被放大,β/γ二聚体能通过一些自然杀伤细胞(NK细胞)和静息的T细胞诱导免疫排斥的发生,也可能是CD25的下调在抑制Th1因子的同时也促进了Th2因子的表达所致。而有研究表明同时抑制Th1、Th2因子更能延长角膜植片的存活时间[20]。因此,如何更好地抑制角膜移植后的免疫排斥反应,尚需进一步深入研究。
[1]Li J, Jia H. Progress research on clinical application of corneal composition transplantation[J]. J Jilin Univ (Med Ed) 2014, 40(3): 695-698. [李京, 贾卉. 角膜成分移植临床应用的研究进展[J]. 吉林大学学报(医学版), 2014, 40(3): 695-698.]
[2]Price MO, Thompson RW, Price FW. Risk factors for various causes of failure in initial corneal grafts[J]. Arch Ophthalmol, 2003, 121(8): 1087-1092.
[3]He W, Gao XM, Cao XT, et al. Medical immunology[M]. Beijing: People's Medical Publishing House, 2005. 250-256. [何维, 高晓明, 曹雪涛, 等. 医学免疫学[M]. 北京: 人民卫生出版社, 2005. 250-256.]
[4]Zhao M, Chen JQ, Yang PZ. Immunologic experimental studies on the alkali burn of cornea in rats[J]. Chin J Ophthalmol, 2000, 36(1): 40-42. [赵敏, 陈家祺, 杨培增. 鼠角膜碱烧伤的免疫学研究[J]. 中华眼科杂志, 2000, 36(1): 40-42.]
[5]Williams KA, Coster DJ. Penetrating corneal transplantation in the inbred rat:a new model[J]. Invest Ophthalmol Vis Sci, 1985, 26(1): 23-30.
[6]Holland EJ, Chan CC, Wetzig RP, et al. Clinical and immunohistologic studies of corneal rejection in the rat penetrating keratoplasty model[J]. Cornea, 1991, 10(5): 374-380.
[7]Ling SQ, Li WH, Lin HT, et al. Comparison of the corneal new lymphatic vessels and new vessels in high-risk corneal transplantation immune rejection[J]. Chin J Microsurg, 2011, 34(6): 482-484. [凌士奇, 黎韦华, 林浩添, 等. 角膜新生淋巴管和新生血管在高危角膜移植免疫排斥中的作用比较[J].中国显微外科杂志, 2011, 34(6): 482-484.]
[8]Xiao H, Zhang H, Yu ZY, et al. J2 prolongs the corneal allograft survival through inhibition of the CD4+T cell-mediated response in vivo[J]. Transpl Immunol, 2007, 18(2): 130-137.
[9]Jia Z, Jiao C, Zhao S, et al. Immunomodulatory effects of mesenchymal stem cells in a rat corneal allograft rejection model[J]. Exp Eye Res, 2012, 102: 44-49.
[10] Létourneau S, Krieg C, Pantaleo G, et al. IL-2- and CD25-dependent immunoregulatory mechanisms in the homeostasis of T-cell subsets[J]. J Allergy Clin Immunol, 2009, 123(4): 758-762.
[11] Jirasiritham S, Sumethkul V, Mavichak V, et al. The role of anti-IL-2 receptor in high-risk kidney transplant patients[J]. Transplant, 2004, 36(7): 2110-2112.
[12] Deng Y, Wang CC, Choy KW, et al. Therapeutic potentials of gene silencing by RNA interference: principles, challenges, and new strategies[J]. Gene, 2014, 538(2): 217-227.
[13] Liu L, Zhao M. Effectiveness and toxicity of the transfection of lentiviral vector –mediated enhanced green fluorescent protein to rat cornea[J]. Med J Chin PLA, 2014, 39(4): 307-310. [刘立,赵敏. 慢病毒载体介导增强型绿色荧光蛋白转染大鼠角膜的效率及其毒性研究[J]. 解放军医学杂志, 2014, 39(4): 307-310.]
[14] Saengkrit N, Sanitrum P, Woramongkolchai N, et al. The PEI-introduced CS shell/PMMA core nanoparticle for silencing the expression of E6/E7 oncogenes in human cervical cells[J]. Carbohydr Polym, 2012, 90(3): 1323-1329.
[15] Jiang Z, Chen CH, Chen YY, et al. Autophagic effect of programmed cell death 5 (PDCD5) after focal cerebral ischemic reperfusion injury in rats[J]. Neurosci Lett, 2014, 566: 298-303.
[16] He F, Yao H, Xiao Z, et al. Inhibition of IL-2 inducible T-cell kinase alleviates T-cell activation and murine myocardial inflammation associated with CVB3 infection[J]. Mol Immunol, 2014, 59(1): 30-38.
[17] Zhang Y, Zhang L, Wu J, et al. Heme oxygenase-1 exerts a protective role in ovalbumin-induced neutrophilic airway inflammation by inhibiting Th17 cell-mediated immune response[J]. J Biol Chem, 2013, 288(48): 34612-34626.
[18] Cheung KW, Sze DM, Chan WK, et al. Brazilian green propolis and its constituent, Artepillin C inhibits allogeneic activated human CD4 T cells expansion and activation[J]. J Ethnopharmacol, 2011, 138(2): 463-471.
[19] Zhang YQ, Lu XH, Yuan W. Ultrastructural characteristic changes of corneal allografts in rats during acute rejection[J]. Chin J Clin Rehabilitation, 2005, 9(6): 142-143.[张永强, 陆晓和, 袁伟. 急性排斥期大鼠角膜移植物超微结构的特征性变化[J]. 中国临床康复, 2005, 9(6): 142-143.]
[20] Gong N, Pleyer U, Yang J, et al. Influence of local and systemic CTLA4Ig gene transfer on corneal allograft survival[J]. J Gene Med, 2006, 8(4): 459-467.
An experimental study on inhibiting graft rejection following high-risk penetrating keratoplasty by CD25 siRNA nanocarrier in rats
SHI Yun-jie, QIN Qin, ZHAO Min*
Department of Ophthalmology, First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China
*
, E-mail: minzhao8866@163.com
This work was supported by the National Natural Science Foundation of China (81170822)
ObjectiveTo investigate the effects of CD25 siRNA nanoparticles against immune rejection and prolongation of corneal graft survival time after high-risk corneal grafting in rats.MethodsOrthotopic corneal transplantation was performed in SD rats with alkali burned corneas to mimic high-risk rat models. Donor cornea (Wistar rats) was grafted into the right cornea of SD recipients on day 14 after alkali burn. The grafted rats were randomly divided into control group (Group A), EntransterTM-control CD25siRNA instillation treatment (Group B), EntransterTM-CD25siRNA instillation treatment (Group C) and EntransterTMCD25siRNA twice instillation treatment (Group D, first administration at 2-hour post-surgery and second on day 7 post-surgery). The recipient eyes were examined using a slit lamp microscope. Then, the mean survival time and rejection index (RI) were calculated. The morphologies of grafts were microscopically examined with HE staining, and TEM. CD25 expression after operation was determined by quantitative RT-PCR and immunohistochemistry.ResultsThe survival curves of transplanted cornea showed that the mean survival time in rats of groups C and D was significantly longer than that in groups A and B (P<0.05). No significant difference was found in survival time between group A and group B, and the same between group C and group D. The grafts in groups A and B showed obvious edema and thickening, with irregular arrangement of collagen fibers and infiltration of a large amount of inflammatory cells. Immunohistochemical results showed that expression of CD25 was found in the corneal epithelium, stroma and endothelium in all rats, and higher CD25 expression was observed in groups A and B. Transmission electron microscopy revealed that the degree of stromal fibroblast apoptosis and necrosis in corneal graft was obviously lower in groups C and D thanthat of groups A and B, with a significant statistical difference. The expression of CD25 mRNA in the experimental group was significantly lower at every single time points.ConclusionsCD25siRNA gene transfer could successfully down-regulate CD25 expression, inhibit graft rejection and prolong the survival time of allogeneic corneal graft.
corneal transplantation; graft rejection; nanostructures; interleukin-2 receptor alpha subunit
R772.2
A
0577-7402(2015)04-0297-06
10.11855/j.issn.0577-7402.2015.04.09
2014-11-12;
2015-01-05)
(责任编辑:李恩江)
国家自然科学基金(81170822)
石韵洁,硕士研究生。主要从事角膜病及眼表疾病的基础与临床研究
400016 重庆 重庆医科大学附属第一医院眼科(石韵洁、秦琴、赵敏)
赵敏,E-mail:minzhao2002@163.com
