玉兰肉质外种皮挥发性成分与功能的初步研究
2015-06-28赵芸玉李建霞赵良成
赵 武,赵芸玉,李建霞,赵良成*
(1北京林业大学自然保护区学院,北京100083;2北京林业大学生物科学与技术学院,北京100083)
玉兰肉质外种皮挥发性成分与功能的初步研究
赵 武1,赵芸玉2,李建霞1,赵良成1*
(1北京林业大学自然保护区学院,北京100083;2北京林业大学生物科学与技术学院,北京100083)
以玉兰(Magnolia denudata Desr.)发育成熟的种子为材料,采用水蒸气蒸馏法和GC-MS技术对其肉质外种皮化学成分的种类和含量进行了分析研究,并就玉兰肉质外种皮对其种子吸水和失水的影响以及化感作用进行比较研究,以探讨其相应的生态学和生物学功能。结果表明:(1)玉兰肉质外种皮占整个完整种子重量的48.25%,有无肉质外种皮对其种子自身吸水没有明显影响,但在失水过程中有肉质外种皮的种子失水较慢,具有一定的保水作用。(2)玉兰种子肉质外种皮中萜烯类和醇类的种类较多,分别有12种和11种;但酮类和酯类的相对含量较高,分别为32.84%和18.03%,其中含量较多的成分依次是甲基庚烯酮(31.95%)、乙酸丁酯(17.69%)、对伞花烃(13.64%)和芳樟醇(6.61%)。(3)玉兰肉质外种皮浸提液对豌豆、白菜种子萌发具有明显的抑制作用,且随着浸提液浓度增加,豌豆种子发芽率由86.7%下降为6.0%,白菜种子发芽率由28.0%下降为0。研究推测,玉兰种子的肉质外种皮在功能上可能是一种类似肉质果果肉的结构,具有丰富的化学成分,不仅可以吸引鸟类传播其种子,也具有一定的化感作用。
玉兰;肉质外种皮;挥发性成分;功能
木兰科(Magnoliaceae)起源古老、保存着较多原始性状,一直被认为是双子叶植物中最原始的类群[12]。该科植物不仅对研究被子植物的起源和系统发育具有重要的科学价值,而且在观赏、精油、香料、木材、药用等方面具有极大的经济价值。木兰属(Magnolia)是木兰科的代表属,具多数离心皮雌蕊,每个心皮内有2枚胚珠;果实为聚合蓇葖果,成熟时沿背缝线开裂,露出亮红色的种子。种子由种脐处的丝状木质部螺纹导管与胎座相连,悬挂于开裂的果实外,并在空中随风摆动,有吸引鸟类之效。木兰属的成熟种子由外种皮和内种皮组成。其中,外种皮极厚,约13~18层细胞,包括红色肉质的外层及黑色坚硬的内层两部分,内种皮很薄,约3层细胞,膜质[3]。肉质外种皮是由胚珠外珠被的全部或部分发育而来的一种种皮结构,其在果实成熟时往往成肉质或多汁状包被于种子最外层,颜色多为红色、橙色或蓝色。该结构已知存在于裸子植物的苏铁科(Cycadaceae)、银杏科(Ginkgoaceae)以及双子叶和单子叶植物木兰科、芍药科(Paeoniaceae)、番木瓜科(Caricaceae)、石榴科(Punicaceae)、棕榈科(Palmae)等多个科的种子中,对研究植物种子结构和功能的演化以及植物和动物的协同进化等具有重要的意义[4-5]。目前针对肉质外种皮这一特殊结构的研究还较少,主要集中于银杏(Ginkgo biloba)和番木瓜(Carica papaya)等少数经济植物种类,内容主要是关于其化学成分及其对种子萌发的影响等方面[6-9]。
种子具肉质外种皮是木兰属植物共同具有的结构特征,有些文献资料[10]常将其错误地描述为假种皮。目前,对木兰属肉质外种皮的化学组成及其功能的研究尚未见到专门的报道。本研究以玉兰(Magnolia denudata Desr.)经人工授粉后发育成熟的种子为实验材料,对其肉质外种皮化学成分的种类和含量、肉质外种皮对种子吸水和失水的影响以及对种子萌发的影响等进行了观察和比较,并对其相应的生态学(种子传播)和生物学(种子吸水、失水、萌发)功能进行了初步探讨,旨在为进一步了解木兰科这一原始被子植物类群种子结构和功能的演化提供新的资料和证据。
1 材料和方法
1.1 实验材料
2013年9月采于北京林业大学校园内人工授粉后的玉兰成熟果实。待聚合蓇葖果完全开裂后取出带红色肉质外种皮的种子,将部分种子肉质外种皮剥离备用,部分完整种子置阴凉处自然晾干备用。
1.2 实验方法
1.2.1 肉质外种皮所占重量比 每次随机取100粒种子分别对其完整种子和去除肉质外种皮后的种子进行称重,重复3次,计算平均值。按下式计算肉质外种皮重量比:

式中,W为肉质外种皮所占重量比,m1为完整种子质量,m2为去除肉质外种皮种子的质量。
1.2.2 肉质外种皮对种子吸水和失水的影响 吸水实验:采用称重法测定种子的相对吸水量、吸水速率。取自然阴干的成熟种子,分为有肉质外种皮和无肉质外种皮种子两种处理。每种处理取50粒种子准确称重后室温条件下清水浸泡。每种处理3个重复。处理后前12h每隔2h取出种子,用滤纸吸干表面浮水后迅速称重,之后每隔12h称重1次,直到种子吸水达到饱和。取3次重复平均值,按下述公式计算相对吸水量和吸水速率:

式中,M0为种子干重;Mi为种子湿重;Ri和Ri+1为两相邻测时的平均吸水系数;H为间隔时间(h);吸水速率单位为g·g-1·h-1。
失水实验:待种子吸水达到饱和后,取出吸水后的种子置于培养皿中,室温条件下自然失水。前12 h每2h称重1次,之后每12h称重1次,直到种子重量达到吸水前重量。取3次重复平均值,按下述公式计算相对失水量和失水速率:

式中,T0为初始含水量;W0为48h后种子重;Wi为每次间隔所测种子重;Ri和Ri-1为两相邻测时的平均失水系数;H为间隔时间(h);失水速率的单位为g·g-1·h-1。
1.2.3 肉质外种皮化学成分提取及分析 提取方法:取新鲜肉质外种皮,用剪刀剪碎,准确称取300 g,接水蒸气发生装置于90℃下蒸馏3次,每次蒸馏时间3h。用乙酸乙酯萃取,萃取液用无水硫酸钠脱水,旋转蒸发除去乙酸乙酯,得到具有特殊芳香气味的无色透明状液体。
分析条件:美国PE公司Perkin Elmer Clarus 600Gas Chromatograph &Mass Spectrometer气质联用仪。DB-5MS(30m×0.25mm×0.25μm)石英毛细管柱;初始温度50℃,保留2min;然后6℃/min,升至160℃,保留2min,之后15℃/min,升至270℃,保留10min;柱流量1.0mL/min;进样口温度250℃;进样量1μL;载气为高纯氦气。MS电离方式为EI;电子能量70eV;质量范围30~600m/z;采用Nist08标准谱库检索,并结合保留指数(KI)定性,峰面积归一法定量。
KI值测定:取正构烷烃混合对照品(C6-C25)按上述分析条件分析,进样量0.2μL。记录各正烷烃的保留时间,根据Van Den Dool(1963)[11]提出的线性升温公式计算各组分KI值:

式中,tx为被分析组分出峰时的保留时间;tn和tn+1为碳原子数处于n和n+1的正烷烃(tn<tx<tn+1)出峰时的保留时间。
1.2.4 肉质外种皮的化感作用 浸提液制备:准确称取2.5g研磨后的肉质外种皮粉末置于50mL离心管中,加入25mL无水乙醇,振荡器中摇匀1h后浸提,24h后取出。重复浸提3次,合并浸提原液,在温度4℃、5 000r/min条件下离心10min,取上清液,40℃水浴蒸发浓缩至体积不在减少时用蒸馏水定容至50mL,得到肉质外种皮浸提原液。
萌发实验:将浸提原液分别稀释至原浓度的50%、20%、10%、5%。将豌豆和白菜种子分别放入不同浓度的浸提原液中浸种8h。在培养皿中放置2层滤纸,加入5mL不同浓度的浸提原液。将浸种后的种子分别放于培养皿中,豌豆种子每皿30粒,白菜种子每皿50粒,每个处理重复3次,蒸馏水处理作为对照,黑暗条件下进行萌发试验,3d后对种子发芽情况进行统计。
统计分析:根据以下公式分别计算发芽率(GR)和敏感指数(RI):

式中,C为对照值;T为处理值;RI>0表示促进作用;RI<0表示抑制作用;RI绝对值大小反映化感作用的强弱。
2 结果与分析

图1 玉兰干燥种子相对吸水量曲线Fig.1 The relative water quantity curves of dry seeds in M.denudata
2.1 肉质外种皮重量比
经称重计算,新鲜状态下无肉质外种皮种子平均重22.59g,有肉质外种皮种子平均重43.58g,肉质外种皮重量占整个完整种子重量的48.25%。
2.2 肉质外种皮对种子吸水和失水的影响
2.2.1 吸水特性 由图1可见,在刚吸水的2h内,两种处理(有无肉质外种皮)的玉兰种子的相对吸水量均表现为直线快速上升,至2h时分别达到30%(有肉质外种皮)和26%(无肉质外种皮);2~8 h阶段,种子相对吸水量继续较快增加,4h时分别为35%和33%,至8h时达到42%和39%;此后二者相对吸水量缓慢增加,至12h分别达到44%和40%,24h为51%和46%,36h为53%和47%,48h达到55%和49%。
由图2可见,在刚吸水时,两种处理的玉兰种子吸水速率均直线快速增加,至2h时达到最大值,有肉质外种皮和无肉质外种皮分别为0.15和0.13 g·g-1·h-1;之后2~4h阶段,二者吸水速率又均直线快速下降至0.04和0.02g·g-1·h-1,4~12 h阶段继续缓慢减弱,至36h时,吸水速率均降为0,吸水近于饱和状态。
2.2.2 失水特性 由图3可见,在前12h内,两种处理的玉兰种子相对失水量均较快增加,至2h时有肉质外种皮和无肉质外种皮种子分别达到4%和19%,4h为13%和31%,6h为21%和38%,8h为29%和42%、10h为35%和45%、12h为39%和48%。12~24h阶段二者相对失水量继续缓慢增加,24h时分别达到50%和53%,36h时达到54%和56%,至48h时则基本趋于一致。
由图4可见,在前2h,无肉质外种皮种子失水速率开始迅速增加,呈直线上升趋势,至2h时达到最大值近0.1g·g-1·h-1;此后2~12h阶段失水速率快速下降,12h时降至0.01g·g-1·h-1,12~36h阶段失水速率继续缓慢减弱,最终至36h时趋近于0。有肉质外种皮种子在前6h失水速率增加较快,至6h时达到最大值0.05g·g-1·h-1,此后6~12h阶段失水速率下降较快,12h时降至0.02g·g-1·h-1,之后逐步缓慢减小,至36h时趋近于0。
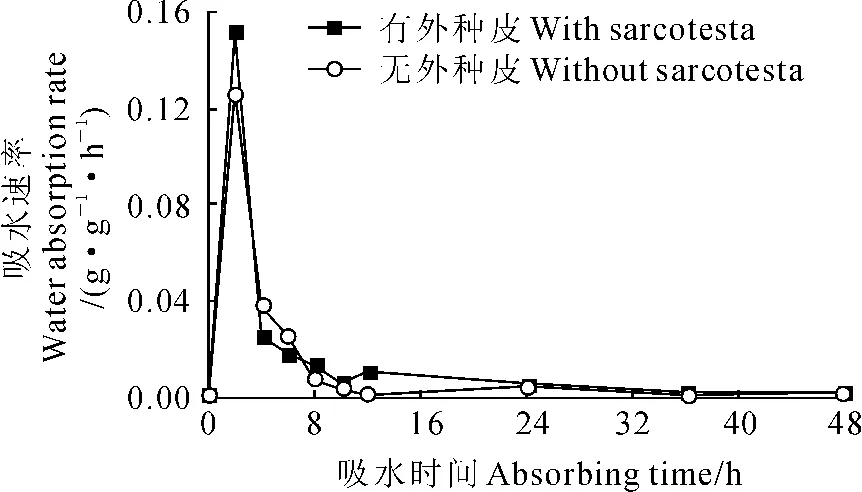
图2 玉兰干燥种子吸水速率曲线Fig.2 The water absorption rate curves of dry seeds in M.denudata

图3 玉兰种子相对失水量曲线Fig.3 The relative water loss curves of seeds in M.denudata

图4 玉兰种子失水速率曲线Fig.4 The water loss rate curves of seeds in M.denudata
2.3 肉质外种皮化学成分分析
按方法中条件对肉质外种皮进行GC-MS测试,总离子流色谱图见图5,质谱信息通过计算机在Nist08质谱信息数据库中检索,与标准图谱对照分析。选取质谱匹配度高的前3个可能物质,计算KI值,并与NIST库KI值检索结果相比较,以MS和KI值匹配度最高的化学结构为鉴定结果,共确定了35种成分,占成分总量的97.6%,结果见表1。
经归类分析,就化学成分种类而言,玉兰肉质外种皮以萜烯类、醇类为主,其中萜烯类有12种,醇类有11种。接下来烷烃类、芳香类、酮类各有3种,酯类有2种,其它1种。在相对含量上,酮类最多,为32.84%,其次是酯类18.03%,接下来依次是醇类16.46%、芳香类14.62%、萜烯类11.61%、烷烃类6.20%。
2.4 肉质外种皮的化感作用
本实验以豌豆和白菜种子作为受试对象,通过对照实验,观察玉兰肉质外种皮浸提液对这两种植物种子萌发的影响(图6,图7)。
实验结果显示(表2),对于豌豆种子,在处理浓度为5%时,其发芽率GR为86.7%,敏感指数RI为-0.02。随着处理浓度逐渐增加至20%和30%,GR值逐渐下降至83.3%和76.6%,IR值也随之降低至-0.06和-0.13。当处理浓度增至50%时,GR值显著下降到33.3%,到最大处理浓度100%时,GR值仅为6.0%,IR也相应降低至-0.62和-0.93。而对于白菜种子,在处理浓度为5%时,GR仅为28.0%,IR为-0.44。当浓度为10%时,GR进一步降低到4.0%,IR降为-0.96。更大浓度处理后GR已接近于零,IR也达到了最低-1。

图5 玉兰肉质外种皮GC-MS总离子流图Fig.5 Total GC-MS ion chromatogram(TIC)of sarcotesta in M.denudata
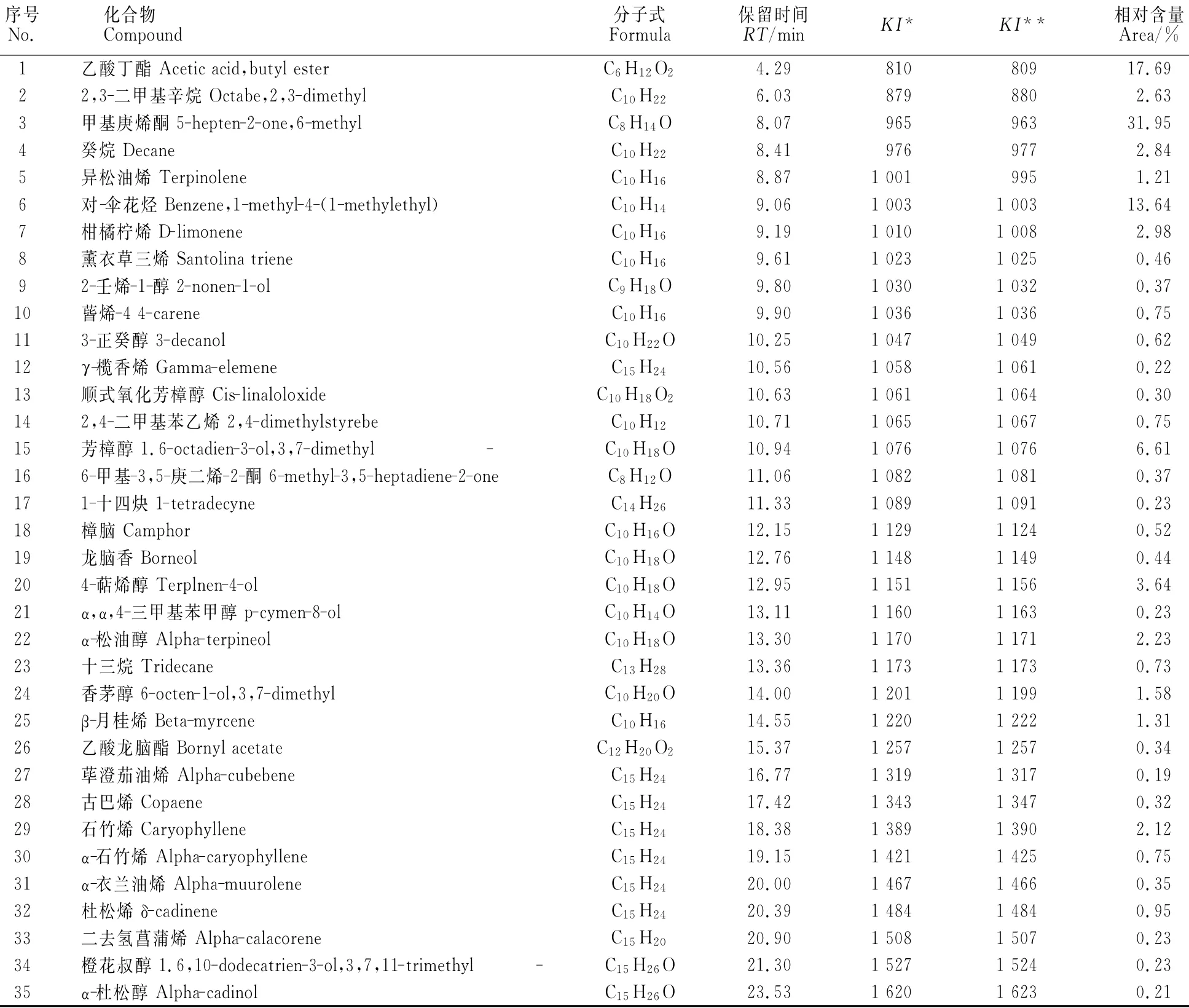
表1 玉兰肉质外种皮GC-MS分析结果Table 1 GC-MS analysis results of sarcotesta in M.denudata

图6 不同浓度处理豌豆种子发芽情况(3d后)Fig.6 The germination condition of pea seeds treated with different concentrations of sarcotesta extract for three days A.CK;B.5%;C.10%;D.20%;E.50%;F.100%
图7 不同浓度处理白菜种子发芽情况(3d后)Fig.7 The germination condition of cabbage seeds treated with different concentrations of sarcotesta extract for three days
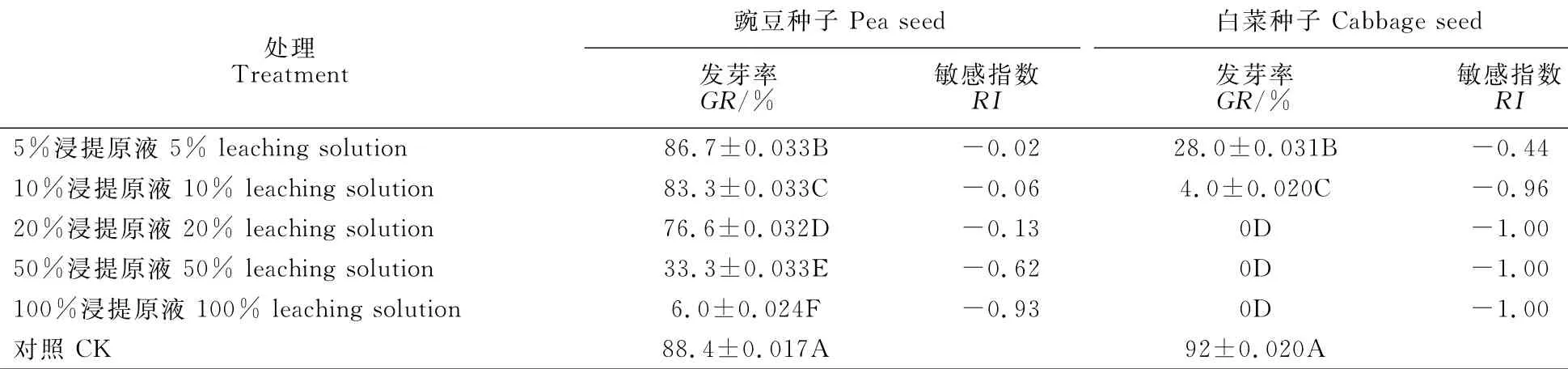
表2 玉兰肉质外种皮浸提液对豌豆和白菜种子萌发的影响Table 2 Effects of the sarcotesta extract of M.denudataon germination of pea and cabbage seeds
3 讨 论
3.1 肉质外种皮化学成分及生态学功能
种子植物鲜艳的肉质外种皮通常被认为是在长期进化过程中植物为适应动物(主要是鸟类)传播其种子而形成的结构[13-14]。本实验观察到玉兰果实在成熟开裂时,确实有几种鸟类取食其种子。这些鸟类吞食整个种子,在将其肉质外种皮消化后,剩下的具坚硬外种皮的种子有些会被呕出,更多的则是随其粪便排出。在这一过程中,玉兰为鸟类提供肉质外种皮作为回报,以此来吸引鸟类传播其种子。根据称量计算结果,玉兰肉质外种皮在新鲜状态时平均占种子总重量的为48.25%,几乎占整个种子重量的一半,显示其为种子的传播付出了较大的代价。
就化学成分种类而言,玉兰成熟种子肉质外种皮以萜烯类、醇类为主,分别有12种和11种。但就相对含量而言,萜烯类、醇类种类虽较多,相对含量却较低,二者分别为11.61%和16.46%。相反,另外2种成分酮类虽仅有3种,但相对含量最高,达到32.84%,脂类仅有2种,相对含量也达到18.03%。值得一提的是,冯立国等[15]在对玉兰花香成分进行测定分析后发现,其花香成分中萜烯类成分含量最高,达到70.29%,其次是醇类14.74%,而酯类仅有0.99%,未检出酮类物质,这与肉质外种皮中萜烯类、醇类含量低而酮类、脂类含量高正好相反。Herrera[16]对地中海地区62种依赖鸟类传播种子植物的研究表明:在夏季,成熟的种子多为含水量较大,冬季则是含类脂化合物较多,这与鸟类的需求相一致。萜烯类化合物具有呈香和呈味作用,因此推测花瓣中萜烯类、醇类含量较高可能主要是散发气味用以吸引昆虫来传粉,而肉质外种皮中成分含量较高的酮类和酯类作为类脂化合物可能主要是作为鸟类喜爱的营养物质来吸引其传播种子。关于玉兰种子肉质外种皮化学成分与其传播功能之间的关系及机制还需进一步深入研究。
3.2 肉质外种皮对种子吸水和失水的影响
为了了解肉质外种皮结构对种子吸水和失水的影响,本实验对有、无肉质外种皮两种处理下的玉兰种子进行了各自的吸水和失水实验。结果表明,在种子吸水的48h内,前2h是快速吸水阶段,2~12 h是缓慢吸水阶段,12~48h为逐步饱和阶段。而两种处理下的玉兰种子在各个阶段相对吸水量和吸水速率的变化趋势都基本一致。有肉质外种皮比无肉质外种皮的相对吸水量在各个阶段略高,差值为1%~6%;吸水速率前者比后者仅在前2h略高,后期则基本接近一致。可见肉质外种皮结构的透水性较好,其有无对玉兰种子本身的吸水过程和能力没有显著影响,有肉质外种皮种子的相对吸水量和吸水速率略高可能是由于其自身少量吸水导致的。
在失水实验中,两种处理下的玉兰种子的相对失水量和失水速率则均显示较大差异。在前12h相对失水量增加较快阶段,有肉质外种皮比没有肉质外种皮的相对失水量低9%~18%。此后至48h前者相对失水量也始终比后者低1%~3%。在失水速率上,有肉质外种皮种子在前6h增加较快,至6h时其达到最大值,而无肉质外种皮种子失水速率的迅速增加发生在前2h,呈直线上升,2h时即达到最大值,且其最大失水速率比有肉质外种皮种子高1倍。说明肉质外种皮结构对于玉兰种子具有一定的保水和储水作用,在一定时间内可以减少种子的失水量,减缓种子的失水速率。二者的失水速率达到最大值后均开始下降且下降趋势基本一致,但这一阶段无肉质外种皮种子比有肉质外种皮的失水速率略低约0.01g·g-1·h-1。这可能是由于前者前2h失水量较大,使得接下来失水速率反而较低。
3.3 肉质外种皮对种子萌发的影响
木兰科植物的种子普遍具有休眠习性,在导致种子生理休眠的诸多原因中,抑制物被认为是最重要的原因之一[17]。近年来,国内关于木兰属天女木兰(Magnolia sieboldii)以及木莲属巴东木莲(Manglietia patungensis)种子休眠与萌发特性的研究报道发现这两种植物种子的不同部位均存在萌发抑制物,其中外种皮和胚乳浸提液的抑制作用最强[1819]。是否存在抑制物质常常通过测定其浸提液对白菜种子发芽的抑制作用来确定,如番木瓜(Carica papaya)种子和文定果(Muntingia colabura L.)果实中的抑制物[20]。木兰科也常用白菜种子作为受体,测定其种子是否含有抑制物,如日本厚朴(Magnolia obovata)种子中的抑制物[21]。而玉兰种子自身发芽率较低且发芽所需时间较长[22],本实验亦选择发芽率高且发芽周期短的豌豆和白菜的种子作为受体,通过观察玉兰肉质外种皮浸提液对两种植物种子萌发的影响来测定其是否含有抑制物质。结果表明,当肉质外种皮浸提液处理浓度为5%时,豌豆种子的发芽率与对照的发芽率相差不大,但随着处理浓度的逐渐增加,种子发芽率开始逐渐下降,敏感指数值也随之降低。当处理浓度大于50%时,豌豆种子发芽率显著下降。到最大处理浓度为100%时,此时种子的发芽率接近于0,敏感指数值也接近-1。说明在高浓度的肉质外种皮浸提液作用下,豌豆种子的萌发受到了严重的抑制。而对于白菜种子,浸提液处理对其萌发在低浓度5%时就表现出了强烈的抑制作用,发芽率不到对照的1/3。当浓度大于10%时,种子发芽率即降为0,敏感指数值也达到了-1。说明仅在低浓度的肉质外种皮浸提液作用下,白菜种子的萌发就已经受到了完全的抑制。由此可见,与天女木兰和巴东木莲一样,玉兰肉质外种皮中也存在种子萌发抑制物质,且其抑制作用较强。
相关研究表明,许多肉质果实在被鸟类取食消化后,能够明显提高其种子的萌发率,甚至使种子由不能萌发变为能够萌发,原因在于这些果肉中存在抑制种子萌发的物质,鸟类通过消化果肉从而消除了抑制作用[23-25]。由此推测,玉兰种子的肉质外种皮在功能上可能是一种类似肉质果果肉的结构,该结构除了对其种子传播具有重要功能外,也可能会在一定程度上抑制种子的萌发,而鸟类取食消化肉质外种皮一定程度上有助于促进玉兰种子的萌发。因此,对于肉质外种皮对其自身种子萌发的影响还需更深入的研究。
[1] CRANE P R,FRILLS E M,PEDERSEN K R.The origin and early diversifieation of angiosperms[J].Nature,1995,(347):27-33.
[2] XU F X(徐凤霞),WU Q G(吴七根).Chalazal region morphology on the endotesta of Magnoliaceous seeds and its systematic significance[J].Acta Phytotaxonomica Sinica(植物分类学报),2002,40(3):260-270(in Chinese).
[3] KAPIL R N,BHANDARI N N.Morphology and embryology of Magnolia Dill.ex Linn.[J].Proc.Nat.Inst.Sci.India,1964,30(B):245-262.
[4] CORNER E J H.The Seeds of Dicotyledons[M].Cambridge:Cambridge University Press,1976:121.
[5] PIJL L.Van der.Sarcotesta,aril,pulpa and the evolution of the angiosperm fruit[J].Proceedings Koninklijke Nederlandse Akademie Van Westenschappen,1955,58:154-161.
[6] SANGAKKARA U R.Influence of seed ripeness,sarcotesta,drying and storage on germinability of Papaya(Carica papayaL.)seed[J].Pertanika Journal of Tropical Agricultural Science,1995,18(3):193-199.
[7] OKEYO A,OUMA G.Effect of washing and media on the germination of Papayaseeds[J].Chem.Phys.Lipids,2012,165(7):731-736.
[8] CHOI J G,JEONG S I,KU C S,et al.Antibacterial activity of hydroxyalkenyl salicylic acids from sarcotesta of Ginkgo biloba against vancomycin-resistant enterococcus[J].Fitoterapia,2009,80:18-20.
[9] LI H(李 红),HE Z(何 泽),ZHANG Y M(张勇民),et al.Studies on alkylphenols and alkylphenolic acids in the sarcotesta of Ginkgo biloba L.[J].Chinese Traditional and Herbal Drugs(中草药),2004,35(1):18-20(in Chinese).
[10] 任宪威,朱伟成.中国林木种实解剖图谱[M].北京:中国林业出版社,2007:103-105.
[11] VAN DEN D H,KRATZ P D.A generalization of the retention index system including linear temperature programmed gas-liquid patition chromatography[J].J.Chromatogr,1963,11:463.
[12] WILLIAMSON G B,RICHARDSON D.Bioassays for all elopathy:measuring treatment responses with independent controls[J].J.Chem.Ecol.,1988,14(1):181-187.
[13] PIJL L.Van Der.Principles of Dispersal in Higher Plants(3rd ed)[M].Berlin:Springer-Verlag,1982:39.
[14] WERKER E.Seed Anatomy Encyclopaedia of Plant Anatomy[M].Berlin and Stuttgart:Gebrüder Borntraeger,1997:147.
[15] FENG L G(冯立国),MENG X SH(孟祥申),ZHOU L(周 力),et al.Comparative study on aromatic constituents and contents between Magnolia denudate Desr.and Magnolia biondii Pam p.[J].Journal of Shandong Agricultural University(Nat.Sci.Edi.)(山东农业大学学报·自然科学版),2009,40(3):377-380(in Chinese).
[16] HERRERA C M.Seasonal variation is the quality of fruits and diffuse coevolution between plants and dispersers[J].Ecology,1982,63:773-785.
[17] BEWLEY J D,BLACK M.Seeds:Physiology of Development and Germination[M].New York:Plenum Press,1994:199-257.
[18] LI P(李 澎),LU X J(陆秀君),YAO F(姚 飞),et al.Preliminary study on reasons of seed dormancy of Magnolia sieboldii K.Koch.[J].Seed(种子),2006,25(2):36-39(in Chinese).
[19] CHEN F J(陈发菊),LIANG H W(梁宏伟),WANG X(王 旭),et al.Seed dormancy and germination characteristics of Manglietiapatungensis,an endangered plant endemic to China[J].Biodiversity Science(生物多样性),2007,15(5):492-499(in Chinese).
[20] LANGE A D.Effect of the sarcotesta on germination of Carica papaya[J].Botanical Gazette,1961,122:305-311.
[21] FU X Y(付晓云),YU G Y(于光艳),ZHOU G ZH(周广柱).Reasons of dormancy for seeds of Magnolia obovate[J].Journal of Liaoning Forestry Science &Technology(辽宁林业科技),2008,(1):1-4(in Chinese).
[22] 国家林业局国有林场和林木种苗工作总站.木本植物种子[M].北京:中国林业出版社,2001:141-143.
[23] RAO X D(饶晓东),CHEN D X(陈德祥),WANG D P(王代平),et al.A review on the study of relationship between birds and seed dispersal[J].Journal of Anhui Agri.Sci.(安徽农业科学),2010,38(26):14 209-14 212(in Chinese).
[24] LU CH H(鲁长虎),CHANG J CH(常家传).Effect of the fleshy fruits eating birds on seed dispersal[J].Chinese Journal of Ecology(生态学杂志),1998,17(1):61-64(in Chinese).
[25] YAGIHASHI T,HAYASHIDA M,MIYAMOTO T.Effect of bird ingestion on seed germination of Sorbus commixta[J].Oecologia,1998,114:209-212.
(编辑:潘新社)
Preliminary Study of Volatile Components and Function of Sarcotesta in Magnolia denudata Desr.
ZHAO Wu1,ZHAO Yunyu2,LI Jianxia1,ZHAO Liangcheng1*
(1College of Nature Reservation,Beijing Forestry University,Beijing 100083,China;2College of Biological Sciences and Technology,Beijing Forestry University,Beijing 100083,China)
With Magnolia denudata Desr.mature seeds as material,we analyzed the volatile components type and content of the sarcotesta by steam distillation and gas chromatography-mass spectrometry.To discussion the ecology and biology function,we has carried comparative study of sarcotesta effect on seed water absorption and loss and the influence on seed germination.The results show that:(1)the sarcotesta accounted for 48.25%of the whole complete seed weight.With/without sarcotesta of M.denudata on the seed water absorption and loss was observed show that the presence of sarcotesta has no significant impact on seed water absorption,but can decrease the water loss rate,indicating it has certain water conservation function.(2)The main types of volatile constituents are terpenes(12)and alcohols(11),but the highest relative content of the components is ketones(32.84%)and the second is esters(18.03%),which include methyl heptenone(31.95%),butyl acetate(17.69%),p-cymene(13.64%)and linalool(6.61%).(3)By investigating the influence of sarcotesta leaching solution on peas and cabbage seed germination,it can be confirmed that the sarcotesta of M.denudatahas obvious inhibitory effect.With the increase of concentra-tion of leaching solution,pea seed germination rate reduced from 86.7%to 6.0%and cabbage seed germination rate from 28.0%to zero.We speculate that the sarcotesta of M.denudatain function is a kind of similar structure to pulp of fleshy fruit,which has the rich chemical compositions and plays an important role in its seed dispersal.It not only can attract birds spread their seeds,also has certain allelopathy.
Magnolia denudata;sarcotesta;volatile components;function
Q946.8;Q945.7
A
10.7606/j.issn.1000-4025.2015.06.1254
1000-4025(2015)06-1254-08
2014-11-12;修改稿收到日期:2015-03-26
国家自然科学基金(31370213);北京市自然科学基金(5133036)
赵 武(1987-),男,硕士研究生,主要从事植物发育生物学研究。E-mail:zhaowu896@163.com
*通信作者:赵良成,博士,副教授,主要从事植物系统分类及植物资源保护与利用研究。E-mail:zliangcheng@aliyun.com
