超表达拟南芥2-烯醛还原酶基因对烟草抗旱性的作用机理分析
2015-06-28王仕稳陈道钳张梅娟邓西平殷俐娜
吴 茜,王仕稳,曹 丹,陈道钳,张梅娟,邓西平,殷俐娜*
(1中国科学院水利部水土保持研究所,黄土高原土壤侵蚀与旱地农业国家重点实验室,陕西杨陵712100;2中国科学院大学,北京100049;3西北农林科技大学水土保持研究所,陕西杨陵712100;4西北农林科技大学生命科学学院,陕西杨陵712100)
超表达拟南芥2-烯醛还原酶基因对烟草抗旱性的作用机理分析
吴 茜1,2,王仕稳1,3,曹 丹1,2,陈道钳4,张梅娟4,邓西平1,3,殷俐娜1,3*
(1中国科学院水利部水土保持研究所,黄土高原土壤侵蚀与旱地农业国家重点实验室,陕西杨陵712100;2中国科学院大学,北京100049;3西北农林科技大学水土保持研究所,陕西杨陵712100;4西北农林科技大学生命科学学院,陕西杨陵712100)
为研究是否可以利用2-烯醛还原酶(AER)来清除活性氧下游的醛自由基达到提高植物的抗旱性,以超表达拟南芥AER基因烟草和野生型烟草(SR)为研究材料,利用干旱胁迫处理进行抗旱性分析,测定了干旱胁迫及复水后各个烟草株系的生物量、光合速率、叶绿素荧光参数、叶绿素含量、MDA和H2O2含量等指标。结果显示:(1)干旱胁迫下,转基因烟草株系的生物量、叶绿素含量、净光合速率、PSⅡ最大光化学效率及H2O2的清除能力均显著高于对照;(2)复水之后,烟草植株的各项生理指标都得到一定程度的恢复,而转基因株系相比于野生型恢复迅速,恢复能力更强。研究认为,超表达AER基因可以通过清除活性氧及其下游醛自由基来提高烟草的抗旱能力。
抗旱性;2-烯醛还原酶(AER);干旱胁迫;烟草;生理指标
随着近年来全球气候变暖,旱灾出现的频率和
程度都在增加,造成作物的大面积减产[1]。为保障人类的粮食安全,提高作物的抗旱能力是在未来极端气候多发的情况下提高作物产量的重要手段,而了解植物的抗旱机理是提高作物抗旱能力的基础。干旱对植物造成伤害的原因之一是造成植物体内活性氧(reactive oxygen species,ROS)的大量积累,从而引起植物的氧化伤害[2-4]。在植物细胞中,ROS的产生主要来源于线粒体、叶绿体和过氧化物体。在干旱条件下,植物体内呼吸链中的电子传递受阻、光合作用中与卡尔文循环相关酶类活性的降低等,均可造成ROS的大量积累。这些性质活泼的ROS一方面可通过直接修饰DNA、RNA、蛋白质以及碳水化合物等,给细胞造成伤害,甚至引起细胞死亡[56]。另一方面,ROS中的单线态氧和羟基自由基极易攻击细胞膜重要组分多聚不饱和脂肪酸(polyunsaturated fatty acids),产生脂质自由基,脂质自由基与O2进行耦合,进而产生更活跃的脂质过氧化自由基,其再攻击多聚不饱和脂肪酸,继而引发脂质过氧化的链式反应,产生大量的醛[7]。醛是一种在ROS下游所产生的、比ROS具有更强攻击力的一类物质,能够使膜的完整性遭到破坏,并造成细胞毒害。
有研究证明环境逆境可以引起和加剧植物体内醛的积累,而醛的过量积累也是逆境胁迫引起植物伤害的重要原因之一[8-10]。累积的活性醛类物质不仅性质活泼,寿命较长,而且非常容易扩散,可以与距它们生成部位较远处的蛋白质、核酸等发生反应[1112]。在植物中,越来越多的研究证明醛参与了各种生物和非生物逆境下的毒害作用,并成为限制植物生长的重要因素之一。例如在干旱、盐害、高温、氧化胁迫以及重金属毒害等逆境条件下,均可造成丙二醛(MDA)在植物体内的大量累积[9,13-16]。MDA是生物体内自由基作用于脂质发生过氧化反应的氧化终产物,其在醛类物质中毒性相对较低。近年,Yin等[10]和Mano等[8]的研究更有力地证明了活性醛基是造成植物铝毒害和强光伤害的直接原因之一,并且清除植物体内过量的醛可以提高植物抵抗上述逆境胁迫的能力。因此,有效清除过多的醛对维持生物体的正常生理功能至关重要。
随着人们对植物抗逆过程更深入的了解,近几年有关醛还原酶对提高植物抗逆性的贡献也逐渐被重视,对植物中醛脱氢酶的研究也逐渐增多。醛脱氢酶被认为是生物体内活性醛类物质清除过程中的重要酶类,能够清除活性醛并降低其对植物体造成的伤害。醛脱氢酶催化醛类物质氧化生成羧酸,清除有毒的醛类并减少脂类的过氧化反应,对提高植物抗干旱、抗盐碱和清除活性氧等能力具有重要作用。张海玲等[17]通过转乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)基因番茄的抗逆研究表明,在干旱、高盐和低温胁迫条件下,转基因植株较对照株的相对电导率和丙二醛含量均有所降低,转入番茄的乙醛脱氢酶基因表达后,可将逆境下诱发膜脂过氧化反应产生的有毒醛类物质分解为无毒羧酸,从而降低了活性醛类物质对植物体造成的氧化胁迫,维持了细胞膜结构的完整性;Chen等[18]发现,甜菜碱乙醛脱氢酶(BADH)能够将甜菜碱醛氧化成对生物体起渗透保护作用的细胞相溶性物质甜菜碱,使细胞在干旱和高盐等逆境胁迫下维持渗透平衡,增强植物的抗逆性。
在脂质氧化过程中经常产生一类含有α,β-不饱和双键的2-烯醛,由于2-烯醛上α位的碳原子具有较高的亲电性,可通过迈克尔(Michael)加成与细胞内的巯基物质或氨基基团发生反应,从而破坏细胞的代谢平衡,引起细胞毒害甚至造成细胞死亡[8]。1995年,Babiychuk等首次从拟南芥中克隆了ξ-晶体(ZCr)P1基因,并在酵母中证明了该基因对二甲基甲酰胺(diamine)产生的氧化伤害有抗性。随后,Mano等[8,19]证实P1-ZCr蛋白对4-羟基-2-壬烯醛(4-hydroxy-2E-nonenal,HNE)等含有α,β-不饱和双键的烯醛以及环氧乙烯具有特异的专一性。根据P1-ZCr蛋白具有的这种专一性反应,国际生物化学和分子生物学协会将此酶统一命名为2-烯醛还原酶(2-alkenal reductase,AER)。目前在植物中只有来自拟南芥的At-AER蛋白被鉴定具有AER的活性,其可以催化烯醛基中不饱和双键的加氢还原,生成饱和的醛,然后再由其它的醛还原酶作用生成二氧化碳和水,从而极大地减少这些高活性的不饱和双键与细胞内小分子物质的反应。Yin等[10]利用AER对烯醛基的专一性,并对铝胁迫下产生的醛种类进行了鉴定,同时证明醛独立参与了铝的细胞毒害作用,而转基因烟草的高抗铝性来自其对醛的有效特异性清除能力,该转基因烟草还表现出抗强光伤害的能力[8]。但是关于AER在植物抗旱中的功能和机理的研究目前还是空白。
本研究利用超表达拟南芥AER基因的烟草植株,通过比较转基因烟草和野生型烟草在干旱胁迫下的抗性,探索AER是否可以提高植物的抗旱性,明确AER在植物抗旱中的生理生化作用,验证是否可以通过清除活性氧下游的醛自由基来提高植物的抗旱能力,以期为提高作物抗旱性提供一定的理论基础和实验依据。
1 材料和方法
1.1 材料培养和处理
所选植物材料为野生型烟草SR和2个超表达拟南芥AER基因的烟草株系AER14和AER18(利用相同的表达载体转化烟草后获得的不同株系)。基因克隆、转基因植物的培育及检测见文献[10]。
烟草种子用质量分数为1%的次氯酸钠灭菌20 min后置于4℃冰箱春化,2d后播种于MS培养基上。25℃培养20d后获得无菌苗,移种在装有0.5 kg育苗基质(有机质≥25%,腐植酸≥10%,N+P2O5+K2O≥2.0%,pH 5.8~7.0)的花盆中。每个品种40盆,光照周期为16h光照/8h黑暗,20d后间苗,每盆剩1株长势一致的幼苗进行干旱处理。通过控制浇水进行自然干旱,并每天称重补水维持各盆之间土壤含水量水平一致。当野生型烟草SR最新展开叶严重萎蔫时(第10天)进行复水处理。分别于干旱处理前、干旱处理10d和复水4d后采样进行相关指标的测定。
1.2 测定指标及方法
1.2.1 生物量 取各个株系烟草植株的地上部分,装入信封中,称取鲜重,在105℃杀青30min后,于80℃下烘至恒重,称取干重,并计算植株含水量。
1.2.2 叶片含水量 剪取新鲜完全展开叶0.5g左右,称取鲜重(FW),80℃下烘至恒重,称取干重(DW),计算烟草叶片含水量[(FW-DW)/FW×100%]。
1.2.3 气体交换参数 净光合速率(Pn)、气孔导度(Gs)及蒸腾速率(Tr)用Li-6400光合仪(Li-COR Inc.,NE,USA)测定。选取最新1片完全展开叶,LED光量子设为500μm·m-2·s-1,外界CO2浓度约为360μmol·mol-1,气流速度设定为500 mmol·s-1,温度维持在25℃。于处理期间每天9:00~11:00进行测定,每处理测定6次。
1.2.4 叶绿素荧光参数 烟草暗适应30min之后,选取最新1片完全展开叶用荧光仪(Imaging-PAM,WALZ,德国)测定荧光参数。每个株系测定3~4个重复。按照公式计算出PSⅡ光化学最大量子效率Fv/Fm、实际光合量子产量YⅡ和相对电子传递速率ETR。具体公式如下:

式中,Fm为叶片最大荧光值,F0为固定荧光值,Fm′为光下执行饱和脉冲当PSⅡ反应中心都处于关闭状态时的最大荧光产量,F′为执行饱和脉冲前的实时荧光产量,PAR为光合有效辐射,ETR-Factor为吸光系数,PPS2/PPPS为PSⅡ光合色素吸收的光量子占总光合色素吸收的光量子的比例。
1.2.5 叶绿素含量 选取最上部2片完全展开叶0.5g,采用80%的丙酮溶液提取法测定[20]。
1.2.6 H2O2含量 选取最上部2片完全展开叶0.5g鲜样用液氮冷冻,然后在预冷的研钵中加入2 mL 0.1%(W/V)的TCA进行研磨。匀浆在12 000 g、4℃离心30min。取0.4mL上清液加入0.4mL 10mmol/L的磷酸钾缓冲液(pH 7.0)和0.8mL 1 mol/L的碘化钾,测定390nm波长下的吸光值变化,最后根据标准曲线计算出H2O2含量[10]。
1.2.7 MDA含量 取0.5g最上部完全展开叶鲜样放入冰浴的研钵中,加入少许石英砂和0.05 mol/L磷酸缓冲液(pH 7.0),研磨成匀浆。将匀浆转移到试管中,再用2~3mL 0.05mol/L磷酸缓冲液分2次冲洗研钵,合并提取液并在5 000g下离心10min。取2mL上清液加入5mL 0.5%硫代巴比妥酸溶液摇匀。将试管放入沸水中煮沸10min(自试管内溶液中出现小气泡开始计时)。到时间后立即将试管取出并放入冷水浴中。待试管内溶液冷却后,再于3 000g离心15min,取上清液,以0.5%硫代巴比妥酸溶液为空白测532nm、600nm和450 nm处的吸光度A532、A600和A450,然后根据以下公式计算MDA含量:

式中,Vt为提取液总体积(mL);Vs为测定用提取液体积(mL);FW为样品鲜重(g)。
1.3 数据分析
采用SPSS 19.0软件中的邓肯氏多重比较法进行数据统计分析,显著性水平设定为α=0.05。
2 结果与分析
2.1 干旱胁迫对烟草生物量和叶片含水量的影响
生物量是衡量植物抗旱的一个重要指标。如图1,A所示,正常水分条件下,转基因株系AER14生长较慢,其生物量显著低于野生型烟草;干旱胁迫处理10d后,野生型烟草和转基因株系AER14的生物量无明显差异,而转基因株系AER18的生物量显著高于野生型;复水4d后,野生型烟草的生物量是干旱处理前的2.74倍,转基因烟草株系AER14和AER18的生物量分别是处理前的5.26和4.34倍,转基因株系和对照之间的生物量差异显著。说明在干旱胁迫下,转基因烟草的生长速度明显高于野生型。
干旱处理前,各烟草株系的土壤水分均呈饱和状态,其叶片绝对含水量之间也无差异。干旱胁迫10d后,各株系叶片含水量均显著降低;复水4d后,各处理烟草的叶片含水量均略微升高,但仍显著低于干旱胁迫前,且各株系之间也无显著差异,即各时期株系间叶片含水量均无显著差异(图1,B)。
2.2 干旱胁迫下烟草的光合气体交换参数的变化
干旱胁迫下烟草净光合速率(Pn)、蒸腾速率(Tr)和气孔导度(Gs)如图2所示。在干旱处理前,转基因株系和野生型烟草的净光合速率无显著差异。随着干旱时间的延长,转基因株系和对照的净光合速率都显著降低;在干旱胁迫10d后,野生型烟草的净光合速率降低到0.5μmol·m-2·s-1,而转基因株系的净光合速率约为1μmol·m-2·s-1,是野生型烟草的2倍。复水后,烟草净光合速率快速升高,而转基因株系的净光合速率显著高于野生型(图2,A)。

图1 干旱胁迫下野生型烟草(SR)和转AER基因烟草株系(AER14、AER18)的生物量和叶片绝对含水量Ⅰ.处理前;Ⅱ.干旱胁迫后;Ⅲ.复水后;同期不同字母表示处理间在0.05水平存在显著性差异;下同Fig.1 Biomass and leaf water content of wild-type plant(SR)and transgenic plant(AER14,AER18)under drought stressⅠ.Before treatment;Ⅱ.After drought stress;Ⅲ.After rehydration;The different normal letters in the same stage indicate significant difference among treatments at 0.05level;The same as below
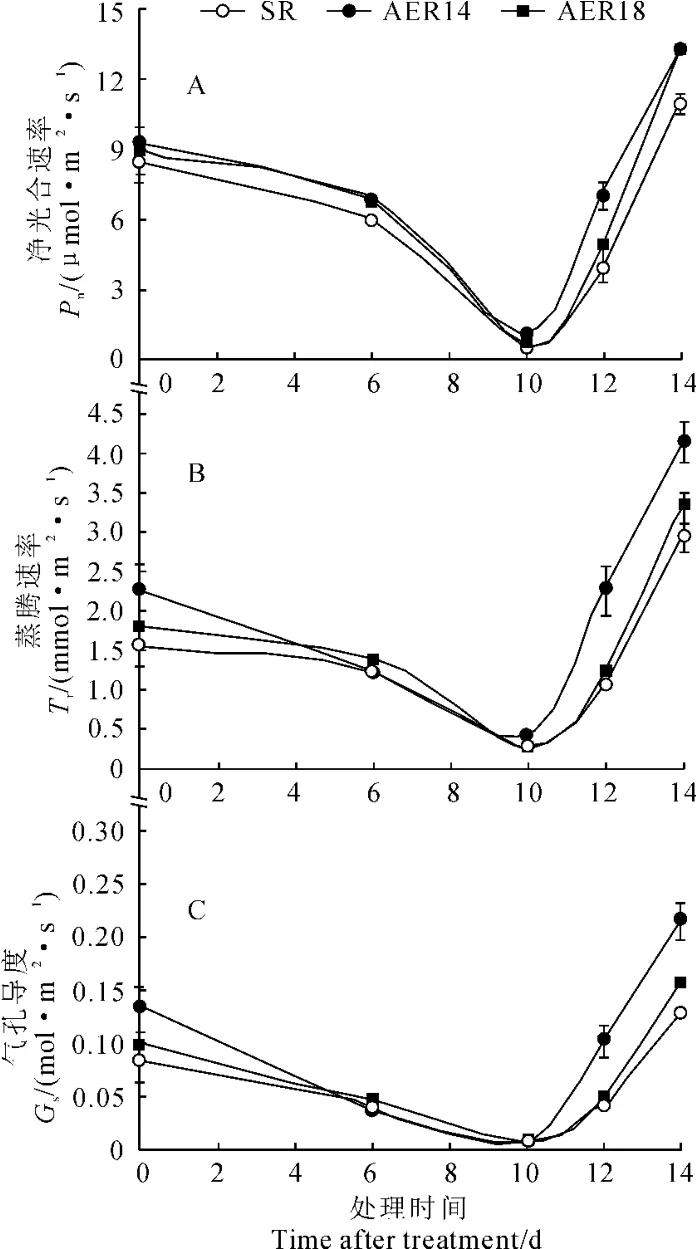
图2 干旱胁迫下野生型烟草SR和转AER基因烟草株系(AER14、AER18)的光合参数Fig.2 Photosynthetic parameters of wild-type plant(SR)and transgenic plant(AER14,AER18)during drought stress
烟草蒸腾速率和气孔导度的变化趋势与净光合速率基本一致,干旱处理前转基因株系与野生型无显著性差异(图2,B和2,C)。随着土壤含水量的降低,干旱胁迫时间的增加,蒸腾速率和气孔导度均缓慢降低,在干旱胁迫第6天,各烟草株系的蒸腾速率和气孔导度均降低,但转基因株系高于野生型。到干旱第10天,野生型烟草的蒸腾速率和气孔导度分别为0.25mmol·m-2·s-1和0.005 8mol·m-2·s-1,而转基因株系则相近,分别约为0.43mmol ·m-2·s-1和0.01mol·m-2·s-1,约是野生型烟草的2倍。复水后,烟草的蒸腾速率和气孔导度快速恢复,但转基因株系比野生型恢复得迅速,其蒸腾速率和气孔导度均显著高于野生型。抗旱性强的植株在水分胁迫下能够保持高的光合速率[21]。说明超表达AER基因烟草具有良好的抗旱能力。
2.3 干旱胁迫下烟草叶绿素荧光参数的变化
叶绿素荧光参数是一组用于描述植物光合作用机理和光合生理状况的变量,是间接评价光合活性的一种方法。Fv/Fm表示当所有反应中心开放时PSⅡ的最大光化学效率,可以衡量PSⅡ的光抑制程度[22]。如图3,A所示,在干旱处理前,各个株系的PSⅡ最大光化学效率之间无明显差异;干旱胁迫10d后,各株系Fv/Fm值均显著降低,野生型烟草的降低幅度为5.1%,而转基因株系AER14和AER18分别降低了2.7%和3.9%,转基因株系的降低幅度要显著小于野生型;复水4d后,转基因株系和对照的Fv/Fm值均迅速恢复,但其间没有显著差异。说明在干旱胁迫条件下,超表达AER基因有效减轻了烟草叶片PSⅡ受到的逆境伤害。
同时,干旱处理前,转基因株系和野生型之间的实际光合量子产量YⅡ没有显著差异(图3,B);干旱胁迫10d后,各个株系的YⅡ均大幅显著降低,野生型烟草降低为处理前的72.9%,转基因株系分别降低为处理前的87.0%和70.7%。但转基因株系AER14的YⅡ高于野生型,并呈显著性差异;复水4d后,各烟草株系的实际光合量子产量均快速恢复,且转基因株系与对照之间有明显差异,尤其是转基因株系AER18显著高于野生型烟草。
另外,正常条件下转基因株系和野生型之间的相对电子传递速率ETR无明显差异。干旱胁迫10d后,野生型烟草ETR大幅显著降低,而转基因株系的降低幅度相对较小,其值与野生型对照之间差异显著;复水4d后,各烟草株系ETR均迅速恢复,但转基因株系ETR显著高于野生型(图3,C)。
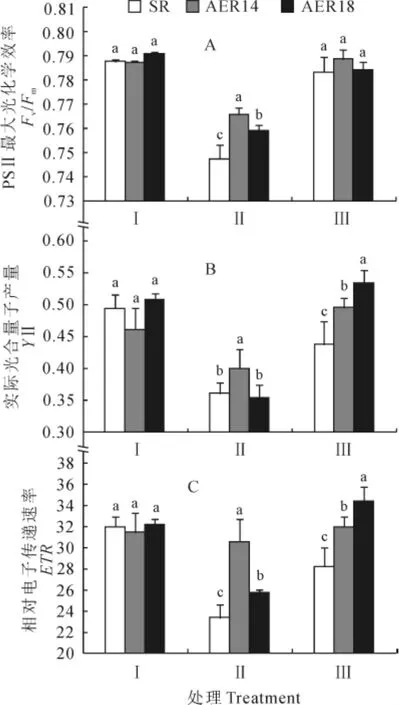
图3 干旱胁迫下野生型烟草SR和转AER基因烟草株系(AER14、AER18)的叶绿素荧光参数Fig.3 Chlorophyll fluorescence parameters of wild-type plant(SR)and transgenic plant(AER14,AER18)under drought stress

图4 干旱胁迫下野生型烟草SR和转AER基因烟草株系(AER14、AER18)的叶绿素含量Fig.4 Content of chlorophyll of wild-type plant(SR)and transgenic plant(AER14,AER18)under drought stress
2.4 干旱胁迫下烟草叶绿素含量的变化
图4显示,干旱处理之前,转基因株系与野生型烟草的叶绿素含量无显著差异;干旱胁迫10d后,野生型烟草叶绿素含量降至9.77mg·g-1,而转基因株系分别为14.52和12.84mg·g-1,比胁迫前均大幅降低,但转基因株系远高于野生型烟草;复水4d后,各株系烟草叶绿素含量均有所升高,但仍远低于干旱胁迫前水平,而转基因株系在干旱胁迫和复水后都能维持较高的叶绿素含量。表明干旱胁迫使非转基因烟草叶绿素降解严重,而转基因烟草仍能维持较高的叶绿素含量。
2.5 干旱胁迫下烟草MDA和H2O2含量的变化
MDA含量是衡量逆境对植物伤害程度的重要指标。图5,A显示,干旱处理前,转基因株系与野生型烟草的MDA含量无明显差异;干旱胁迫处理10d后,各烟草株系的MDA含量均升高约2倍,而转基因株系AER18显著低于野生型;复水4d后,烟草MDA含量降低,且转基因株系AER14和AER18的MDA含量显著低于野生型烟草。
正常生长条件下转基因株系与对照的H2O2含量无明显差异;干旱胁迫10d后,各烟草株系H2O2含量均显著升高,野生型烟草的H2O2含量为1.628μmol·g-1,而转基因株系AER14和AER18分别为1.133和1.270μmol·g-1,显著低于野生型;复水4d后,各株系烟草H2O2含量均明显降低,但转基因株系的H2O2含量显著低于野生型烟草(图5,B)。说明转基因烟草在干旱胁迫条件下能通过减少H2O2积累量来减轻逆境胁迫造成的伤害,从而提高耐旱性。

图5 干旱胁迫下野生型烟草SR和转AER基因烟草株系(AER14、AER18)的MDA和H2O2含量Fig.5 Contents of MDA and H2O2of wild-type plant(SR)and transgenic plant(AER14,AER18)under drought stress
3 讨 论
当植物处于逆境胁迫环境中时,植物体内会发生一系列生理生化变化来减轻逆境对细胞的伤害[5]。土壤水分亏缺会使植物叶绿素蛋白质的合成受到抑制,叶绿素逐渐分解,光合色素含量下降,植物光合能力受抑制。因此,叶绿素的破坏程度可以作为植物在干旱胁迫下组织受损程度的判定标准之一[23]。正常情况下,植物体内活性氧如过氧化氢、羟自由基等的产生和清除处于平衡状态,不会对细胞造成伤害。但是在盐、干旱或病害胁迫下,ROS在植物体内过量积累,与各种大分子发生反应,导致DNA、蛋白质等受到伤害,使细胞膜脂中的不饱和脂肪酸发生过氧化反应,破坏生物膜的流动性、通透性和完整性,导致细胞膜透性增大、细胞液外渗,进一步导致细胞内膜系统的破坏及诱发细胞程序性死亡[24]。一般认为,在逆境胁迫下清除体内自由基能力较强的植物,抗逆能力愈强。MDA是膜脂过氧化的最终产物之一,它的积累水平反映细胞受伤害的程度,MDA的含量与植物抗逆性呈负相关。因此,叶绿素含量的变化和MDA的累积程度可以作为衡量植物抗旱性的重要指标。
干旱胁迫10d后,本研究野生型的生物量显著低于转基因株系,说明转AER基因提高了烟草的抗旱能力。同时,干旱处理后各烟草株系的光合速率、叶绿素含量和Fv/Fm等都有所下降,但转基因烟草的下降幅度和速度明显小于野生型对照。复水4d后,各项指标均迅速恢复,而转基因烟草仍高于对照,尤其是转基因烟草的叶绿素含量显著高于对照,说明转基因烟草叶片中叶绿体膜的受损程度小于野生型植株。另外,干旱胁迫10d及复水4d后,野生型烟草的H2O2含量显著高于转基因株系。干旱胁迫首先伤害的是原生质膜[25],而MDA是膜脂过氧化的产物[26]。MDA含量会随着干旱胁迫处理时间的延长而增加,与干旱胁迫强度呈正比关系[27]。本实验中干旱胁迫10d后各烟草株系的MDA含量显著升高,复水后又降低,而转基因株系的MDA含量低于野生型烟草。表明在干旱胁迫条件下,超表达AER基因减少了膜脂过氧化产物MDA的积累量,减轻了细胞的膜脂过氧化伤害,维持了细胞相对较强的生理功能。由此说明在干旱胁迫下转AER基因烟草的抗旱性高于野生型烟草。
本研究表明超表达AER基因可能在旱后复水、促进植物恢复的过程中起着更重要的作用。在干旱胁迫下,本研究中AER18的实际光合量子产量YⅡ与野生型烟草无显著差异,但复水后,AER18的YⅡ迅速恢复,表明超表达AER使植株能够更快地修复胁迫下受损的光系统,从而使AER18在复水后表现出更高的YⅡ及ETR。超表达AER基因在复水后促进植物恢复的作用还表现在生物量和光合差异方面,复水后转基因株系与野生型的生物量、光合参数差异比在干旱胁迫过程中的更显著。
另外,从结果中可以看出,2个转基因株系均显著提高了干旱胁迫过程中和复水后的生物量、叶绿素荧光参数和叶绿素含量;显著降低了H2O2含量和MDA的积累。但是AER14株系的表现要明显优于AER18株系,可能是由于2个株系中AER基因插入位点和插入拷贝数量不同,导致AER基因的表达量不同,进而引起2个转基因株系表现差异。
综合所述,在烟草中超表达AER基因后,在干旱胁迫及复水的过程中可减轻细胞膜脂过氧化和MDA的累积,使得植物可以维持较高的光合能力和叶绿素含量,从而提高植株对干旱的耐受能力。由此可见,超表达AER基因可以通过清除醛积累来提高植物的抗旱性,即通过清除活性氧下游的醛自由基,可以有效提高植物的抗旱能力。
参考文献:
[1] WANG D L(王道龙),ZHONG X L(钟秀丽),LI M S(李茂松),et al.Impacts of main agro-meteorogical disasters on China agriculture since the 1990sand the disaster mitigation strategies[J].Journal of Catastrophology(灾害学),2006,21(1):18-22(in Chinese).
[2] HU G X(胡国霞),MA L J(马莲菊),CHEN Q(陈 强),et al.Research progress on the response of plant antioxidant system to water stress and rewatering[J].Journal of Anhui Agri.Sci.(安徽农业科学),2011,39(3):1 278-1 280(in Chinese).
[3] LI C(李 翠),LI E Y(李恩勇).The effect of oxidation-reduction system of plants under adversity stress and its physiological significance[J].Journal of Dehong Teachers College(德宏师范高等专科学校学报),2011,1(20):113-115(in Chinese).
[4] ZHAO L Y(赵丽英),DENG X P(邓西平),SHAN L(山 仑).The response mechanism of active oxygen species removing system to drought stress[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2005,25(2):413-418(in Chinese).
[5] LI C(李 聪),GUO M Y(郭梦阳),HAN L B(韩烈保).Overexpression of OjDREBgene increases tolerance to salt in transgenic tobacco[J].Acta Tabacaria Sinica(中国烟草学报),2012,18(4):72-76(in Chinese).
[6] WU SH(吴 顺),XIAO L T(萧浪涛).Metabolism and signaling conduction of the reactive oxygen species in plant[J].Journal of Hunan Agricultural University(Nat.Sci.Edi.)(湖南农业大学学报·自然科学版),2003,29(5):450-455(in Chinese).
[7] BURCHAM P C.Genotoxic lipid peroxidation products:their DNA damaging properties and role in formation of endogenous DNA adducts[J].Mutagenesis,1998,13(3):287-305.
[8] MANO J,BELLES-BOIX E,BABIYCHUK E,et al.Protection against photo oxidative injury of tobacco leaves by 2-alkenal reductase.Detoxication of lipid peroxide-derived reactive carbonyls[J].Plant Physiology,2005,139:1 773-1 783.
[9] SUNKAR R,BARTELS D,KIRCH HH.Overexpression of a stress-inducible aldehyde dehydrogrnase gene fromArabidopsis thalianain transgenic plants improves stress tolerance[J].Plant J.,2003,35:452-464.
[10] YIN L,MANO J,WANG SW,et al.The involvement of lipid peroxide-derived aldehydes in aluminum toxicity of tobacco roots[J].Plant Physiology,2010,152:1 406-1 417.
[11] CHUNG F L,CHEN H J,NATH R G.Lipid peroxidation as potential endogenous source for the formation of exocyclic DNA adducts[J].Carcinogenesis,1996,17:2 105-2 111.
[12] KOTCHONI SO,KUHNS C,DITZER A,et al.Over-expression of different aldehyde dehydrogenase genes in Arabidopsis thalianaconfers tolerance to abiotic stress and protects plants against lipid peroxidation and oxidative stress[J].Plant Cell Environ,2006,29:1 033-1 048.
[13] HODGSON R A J,RAISON J K.Lipid peroxidation and superoxide dismutase activity in relation of NAD(P)H-dependent alkkenal/one oxidoreductase[J].J.Biol.Chem.,1991,276:40 803-40 810.
[14] MISHRA R,SINGHAL GS.Function of photosynthetic apparatus of intact wheat leaves under high light amd heat stress and its relationship with peroxidation of thylakoid lipids[J].Plant Physiol.,1992,98:1-6.
[15] MORAN J F,BECANA M,ITURBE-ORMAETXE I,et al.Drought induces oxidative stress in pes plants[J].Planta,1994,194:346-352.
[16] PANAGOPOULOS I,BORNMAN JF.Response of sugar beet plants to ultraviolet-B(280-320nm)radiation and Cercospom leaf spot disease[J].Plant J.,1992,84:140-145.
[17] ZHANG H L(张海玲),SHANG CH(尚 晨),LI J K(李佶恺),et al.Studies on transformation of aldehyde dehydrogenase(ALDH)into tomato[J].Chinese Agricultural Science Bulletin(中国农学通报),2010,26(13):23-29(in Chinese).
[18] CHEN THH,MURATA N.Enhancement of tolerance of abiotic stress by metabolic engineering ofbetaines and other compatible solutes[J].Current Opinion in Plant Biology,2002,5:250-257(in Chinese).
[19] MANO J,TORII Y,HAYASHI S,et al.The NADPH:quinone oxidoreductase P1-ξ-crystallin in Arabidopsis catalyzes the a,β-hydrogen
ation of 2-alkenals:detoxication of the lipid peroxide-derived reactive aldehydes[J].Plant Cell Physiology,2002,43:1 445-1 455.
[20] 张志良,瞿伟菁.植物生理学实验指导[M].北京:高等教育出版社,2003.
[21] GUO X Y(郭新勇),CHENG CH(程 晨),WANG A Y(王爱英).Drought-tolerance analysisof tobacco plant transformed with Sasussured involucrata siCORgene[J].Chinese Bulletin of Botany(植物学报),2012,47(2):111-119(in Chinese).
[22] SUN W H(孙卫红),CHEN X Y(陈相燕),DU B(杜 斌).Tobacco seedlings overexpressing StAPXenhanced resistance to oxidative stress[J].Plant Physiology Journal(植物生理学报),2011,47(6):613-618(in Chinese).
[23] JIMENEZ M S,GONZALEZ-RODRIGUEZ A M,MORALES D,et al.Evaluation of chlorophyll fluorescenceas a tool for salt stress detection in roses[J].Photosynthetica,1997,33:291-301.
[24] LU Y(鲁 燕),XU ZH SH(徐兆师),ZHANG R Y(张瑞越).Overexpression of W6gene increases salt tolerance in transgenic tobacco
plants[J].Acta Agronomica Sinica(作物学报),2008,34(6):984-990(in Chinese).
[25] 曾群望,杨双兰.云烟生产的土壤地质背景[M],昆明:云南科技出版社,1993.
[26] YAN CH SH(阎成士),LI D Q(李德全),ZHANG J H(张建华).Plant leaf senescence and oxidative stress[J].Chinese Bulletin of Botany(植物学通报),1999,16(4):398-404(in Chinese).
[27] LI J X(李继新),DING F ZH(丁福章),YUAN Y B(袁有波).Effects of different drought stress on malondiadehyde content and cell
membrane permeability in tobacco leaves[J].Guizhou Agricultural Sciences(贵州农业科学),2008,36(4):34-35(in Chinese).
(编辑:裴阿卫)
Influence of Overexpression of 2-alkenal Reductase Gene on Drought Resistance in Tobacco
WU Xi1,2,WANG Shiwen1,3,CAO Dan1,2,CHEN Daoqian4,ZHANG Meijuan4,DENG Xiping1,3,YIN Lina1,3*
(1State Key Laboratory of Soil Erosion and Dryland Farming on the Loess Plateau,Institute of Soil and Water Conservation,Chinese Academy of Sciences,and Ministry of Water Resources,Yangling,Shaanxi 712100,China;2University of Chinese Academy of Science,Beijing 100049,China;3Institute of Soil and Water Conservation,Northwest A&F University,Yangling,Shaanxi 712100,China;4College of Life Sciences,Northwest A&F University,Yangling,Shaanxi 712100,China)
In this study,we investigated the functions of 2-alkenal reductase(AER)in improving drought tolerance.Transgenic tobacco plants overexpressing 2-alkenal reductase and wild-type tobacco plants(SR)were used to measure the biomass,photosynthetic rate,chlorophyll fluorescence parameters,contents of chlorophyll,MDA and H2O2under drought stress and rehydration.Results showed that:(1)the biomass,content of chlorophyll,photosynthetic rate,chlorophyll fluorescence parameters and the capability for scavenging H2O2of the transgenic tobacco plants were significantly higher than those of control plants under drought treatment.(2)After rehydration,the physiological indexes of tobacco recovered.The recovery capability of transgenic lines is better than that of wild-type.These results indicated that overexpression of AER gene lead to enhanced drought tolerance in transgenic tobacco plants.
drought tolerance;2-alkenal reductase(AER);drought stress;tobacco;physiological indexes
Q789
A
10.7606/j.issn.1000-4025.2015.06.1166
1000-4025(2015)06-1166-07
2014-12-07;修改稿收到日期:2015-05-24
国家自然科学基金(31200206);中央高校基本科研业务费专项资金(ZD2012023)
吴 茜(1989-),女,在读硕士研究生,主要从事植物抗逆生理研究。E-mail:wuxi0420@126.com
*通信作者:殷俐娜,副研究员,从事植物抗逆生理及分子机制方面的研究。E-mail:linayin@nwsuaf.edu.cn
